专题一化学用语与基本概念 选择题专攻1.化学用语的规范使用(共43张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题一化学用语与基本概念 选择题专攻1.化学用语的规范使用(共43张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:26:02 | ||
图片预览









文档简介
(共43张PPT)
1.化学用语的规范使用
选择题专攻
核心精讲
01
1.熟悉常考化学用语及其规范使用
(1)三种符号
①元素符号:Na、S、Cl等。
②离子符号:Mg2+、Cl-等。
(2)十种图示
①化学式:NaCl、SiO2等。
②分子式:CO2、H2O等。
③实验式(最简式):CH、CH2等。
④电子式: 等。
⑤原子(离子)结构示意图: 等。
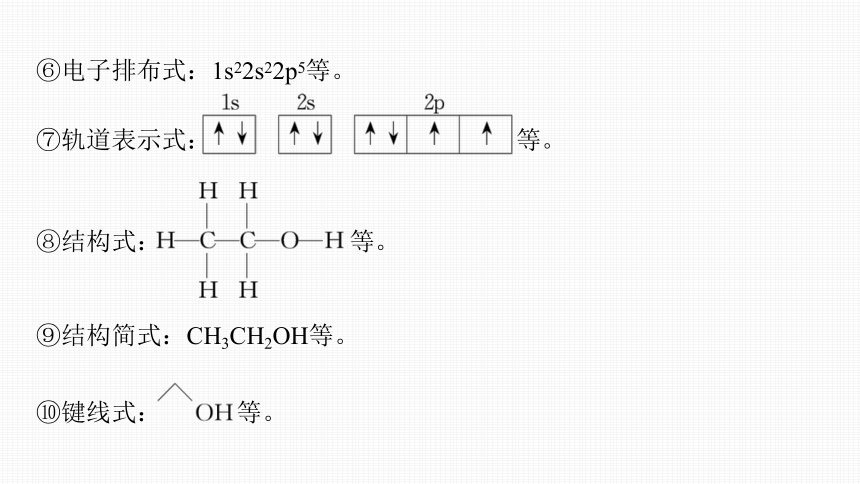
⑥电子排布式:1s22s22p5等。
⑦轨道表示式: 等。
⑧结构式: 等。
⑨结构简式:CH3CH2OH等。
⑩键线式: 等。
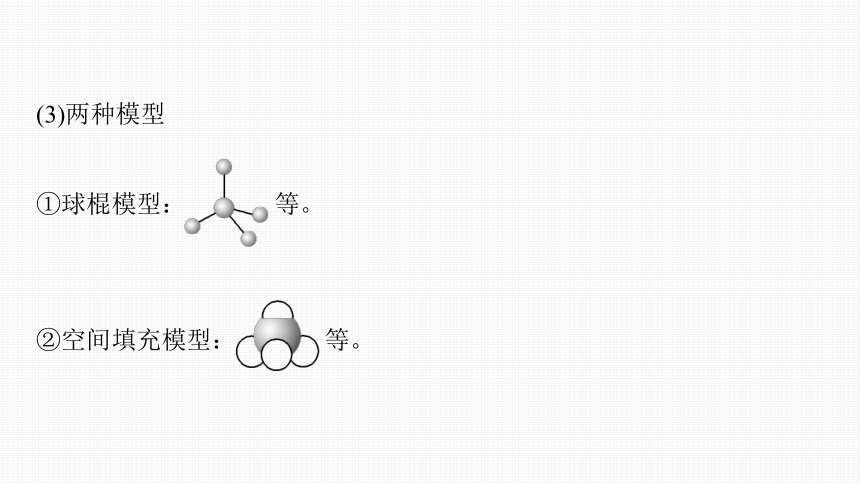
(3)两种模型
①球棍模型: 等。
②空间填充模型: 等。
2.用电子式表示两类化学键的形成过程
化学键 用电子式表示形成过程
共价键 不标出弯箭头及电子的转移,表示出共用电子对,如:
离子键 用弯箭头表示电子转移,用中括号将接受电子的原子括起来并标上电荷数,如:
1.正误判断,正确的打“√”,错误的打“×”
(1)氨分子的空间填充模型: ( )
(2)氢氰酸的结构式:H—C≡N( )
(3) CS2的空间填充模型: ( )
(4)氨基负离子( )的电子式: ( )
(5)氧原子的价层电子排布式:2s22p4( )
(6)氮原子的轨道表示式: ( )
√
√
√
×
√
×
对点训练
2.按要求书写下列微粒的电子式:
(1)H3O+____________, _______________,
_____________, _____________,
—OH________,OH-____________。
(2)HClO___________,CCl4__________,CS2_______________,
COS_______________,HCHO_________,COCl2___________,
N2H4_____________, ________________。
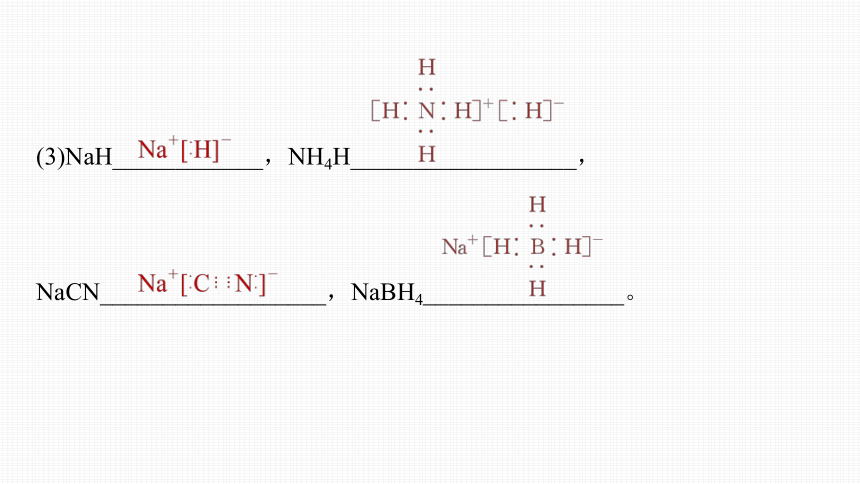
(3)NaH____________,NH4H__________________,
NaCN__________________,NaBH4________________。
(1)首先要判断是阴离子还是阳离子,是离子化合物还是共价化合物。
(2)不能漏写没有参与成键的电子对,如NH3的电子式不是 。
(3)不能错误合并离子,如Na2O2的电子式写成 是错误的。
书写电子式需要注意的5个问题
(4)不能混淆化学键的类别,如H2O2的电子式写成 是
错误的。
(5)离子(或根)带电荷,基团不显电性,如OH-的电子式为 ,
—OH的电子式为 。
返回
思维建模
真题演练
02
1.(2023·江苏,2)反应NH4Cl+NaNO2===NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是
A. 的电子式为
B. 中N元素的化合价为+5
C.N2分子中存在N≡N键
D.H2O为非极性分子
1
2
3
4
5
√
6
7
8
1
2
3
4
5
的电子式为 ,A错误;
中N元素的化合价为+3,B错误;
H2O为V形分子,分子中正负电荷中心未重合,为极性分子,D错误。
6
7
8
2.(2022·江苏,2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是
A.Na2O2的电子式为
B.H2O的空间构型为直线形
C.H2O2中O元素的化合价为-1
D.NaOH仅含离子键
√
1
2
3
4
5
6
7
8
过氧化钠是离子化合物,其电子式是 ,A错误;
H2O中氧原子的成键电子对数是2,孤电子对数是2,则价层电子对数为4,根据价层电子对互斥模型,其空间构型为V形,B错误;
H2O2中H显+1价,根据正负化合价代数和为0,可得O的化合价为-1,C正确;
NaOH中O和H之间是共价键,D错误。
1
2
3
4
5
6
7
8
3.(2021·江苏,2)反应Cl2+2NaOH===NaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
√
1
2
3
4
5
6
7
8
氯气分子结构对称,正负电荷中心重合,为非极性分子,A错误;
NaOH为离子化合物,其电子式为 ,B错误;
1
2
3
4
5
NaClO含有钠离子和次氯酸根离子形成的离子键,含有O原子和Cl原子形成的共价键,C正确;
Cl-有3层电子,Na+有2层电子,D错误。
6
7
8
4.(2020·江苏,2)反应8NH3+3Cl2===6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
√
1
2
3
4
5
6
7
8
中子数为9的氮原子应为 ,A项错误;
N2分子的电子式为 ,B项错误;
Cl-的结构示意图为 ,D项错误。
1
2
3
4
5
6
7
8
5.(2023·浙江6月选考,2)下列化学用语表示正确的是
A.H2S分子的球棍模型:
B.AlCl3的价层电子对互斥模型:
C.KI的电子式:
D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
√
1
2
3
4
5
6
7
8
1
2
3
4
5
H2S分子是V形结构,故A错误;
AlCl3中心原子价层电子对数为3+ ×(3-1×3)=3,其价层电子对互斥模型为平面三角形,故B错误;
KI是离子化合物,其电子式: ,故C错误;
CH3CH(CH2CH3)2的结构简式为 ,其名称为3-甲
基戊烷,故D正确。
6
7
8
6.(2023·北京,2)下列化学用语或图示表达正确的是
A.NaCl的电子式为
B.NH3的VSEPR模型为
C.2pz电子云图为
D.基态24Cr原子的价层电子轨道表示式为
√
1
2
3
4
5
6
7
8
1
2
3
4
氯化钠是离子化合物,其电子式是 ,A项错误;
氨分子的VSEPR模型是四面体结构,B项错误:
基态24Cr的价层电子轨道表示式为 ,D项错误。
5
6
7
8
7.(2023·湖北,5)化学用语可以表达化学过程,下列化学用语的表达错误的是
A.用电子式表示K2S的形成:
B.用离子方程式表示Al(OH)3溶于烧碱溶液:Al(OH)3+OH-===[Al(OH)4]-
C.用电子云轮廓图表示H—H的s-s σ键形成的示意图:
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂: +
1
2
3
4
+nH2O
√
5
6
7
8
1
2
3
4
用化学方程式表示尿素与甲醛制备线型脲醛树脂为 +
nHCHO +(n-1)H2O,D错误。
5
6
7
8
8.(2023·辽宁,2)下列化学用语或表述正确的是
A.BeCl2的空间结构:V形
B.P4中的共价键类型:非极性键
C.基态Ni原子价电子排布式:3d10
D.顺-2-丁烯的结构简式:
1
2
3
4
√
5
6
7
8
1
2
3
4
5
BeCl2的中心原子为Be,根据VSEPR模型可以计算,BeCl2中不含有孤电子对,因此BeCl2为直线形分子,A错误;
Ni原子的原子序数为28,其基态原子的价电子排布式为3d84s2,C错误;
顺-2-丁烯的结构中两个甲基在双键的同一侧,其结构简式为
,D错误。
6
7
8
考向预测
03
1.(2023·海安高级中学高三下学期模拟)ClO2在工业上可用于淀粉及油脂的漂白及自来水的消毒,制备ClO2的一种方法为5NaClO2+4HCl===5NaCl+4ClO2↑+2H2O,下列有关化学用语表达正确的是
A.中子数为8的氧原子:
B.Na+的结构示意图:
C.HCl的电子式:
D.ClO2的空间填充模型:
1
2
3
4
5
6
√
Na+的结构示意图: ,故B错误;
HCl为共价化合物,电子式为 ,故C错误;
ClO2的价电子对数为4,含孤电子对,不是直线形,故D错误。
1
2
3
4
5
6
2.(2023·淮阴中学高三下学期最后一模)NCl3可发生水解反应NCl3+3H2O===NH3+3HClO,下列说法正确的是
A.NCl3分子空间结构为三角锥形
B.H2O的VSEPR模型:
C.质量数为35、中子数为18的Cl原子:
D.用电子式表示H2O的形成过程:
1
2
3
4
5
6
√
NCl3中氮原子形成了3个σ键,有1对孤电子对,价电子对数为4,其空间结构为三角锥形,A正确;
H2O中氧原子形成了2个σ键,有2对孤电子对,价电子对数为4,其VSEPR模型为四面体形,B错误;
质量数为35、中子数为18的Cl原子为 ,C错误;
水为共价化合物,则用电子式表示H2O的形成过程为
,D错误。
1
2
3
4
5
6
3.(2023·江苏省决胜新高考高三4月大联考)我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种矿物Ca5(PO4)3(OH)。下列有关化学用语或图示表达正确的是
A.OH-的电子式:
B.基态P原子的外围电子的轨道表示式:
C. 的空间填充模型:
D.H2O的空间结构:V形
1
2
3
4
5
6
√
OH-的电子式为 ,A错误;
基态P原子的外围电子排布式为3s23p3,轨道表示式为 ,
B错误;
的中心原子的价电子对数为 =4,没有孤电子对,空间结构
为正四面体,空间填充模型为 ,C错误;
H2O的中心原子的价电子对数为 =4,有2对孤电子对,空间结
构为V形,D正确。
1
2
3
4
5
6
4.(2023·连云港高三下学期2月调研)反应SO2+Br2+2H2O===H2SO4+2HBr可用于海水提取溴。下列有关说法正确的是
A.SO2是直线形分子
B.基态O原子的轨道表示式为
C.HBr的电子式为
D.H2SO4分子中含有6个σ键
1
2
3
4
5
6
√
SO2的中心原子采取sp2杂化,有1对孤电子对,为V形分子,A项错误;
基态O原子的轨道表示式为 ,B项错误;
HBr是共价化合物,电子式是 ,C项错误;
H2SO4的结构式是 ,所以分子中含有4个S—O σ键,2个
O—H σ键,D项正确。
1
2
3
4
5
6
5.(2023·南京师范大学附属中学高三5月模拟)亚硝酰氟(FNO)是一种工业稳定剂,可通过反应N2O4 +CsF===FNO+CsNO3制得。下列说法正确的是
A.氧原子的结构示意图为
B.CsF的电子式为
C.FNO的空间结构为直线形
D.CsNO3中含有离子键与共价键
1
2
3
4
5
6
√
O原子的质子数和电子数都是8,核外电子分层排布,其结构示意图
为 ,故A错误;
CsF为离子化合物,电子式为 ,故B错误;
FNO中心原子N原子价电子对数为 =3,有1对孤电子对,空间结构为V形,故C错误;
CsNO3中含有Cs+与 间的离子键与N—O共价键,故D正确。
1
2
3
4
5
6
6.(2022·盐城市阜宁中学综合测试)在阳光照射下,水和氧气在浸泡过KOH溶液的三噻吩(C12H8S3)聚合物表面能高效合成过氧化氢(H2O2),下列说法不正确的是
A.H2O2的电子式为
B.H2O为极性分子
C.KOH为离子晶体
D.S2-的结构示意图为
1
2
3
4
5
6
√
A项,H2O2是共价化合物,电子式为 ,错误;
1
2
3
4
5
6
B项,水分子的空间结构为V形、分子内正负电荷中心不重合,H2O为极性分子,正确;
C项,KOH由活泼金属钾离子和氢氧根离子构成,其晶体为离子晶体,正确;
D项,S2-的质子数为16、电子数为18,硫离子结构示意图为 ,
正确。
本课结束
1.化学用语的规范使用
选择题专攻
核心精讲
01
1.熟悉常考化学用语及其规范使用
(1)三种符号
①元素符号:Na、S、Cl等。
②离子符号:Mg2+、Cl-等。
(2)十种图示
①化学式:NaCl、SiO2等。
②分子式:CO2、H2O等。
③实验式(最简式):CH、CH2等。
④电子式: 等。
⑤原子(离子)结构示意图: 等。
⑥电子排布式:1s22s22p5等。
⑦轨道表示式: 等。
⑧结构式: 等。
⑨结构简式:CH3CH2OH等。
⑩键线式: 等。
(3)两种模型
①球棍模型: 等。
②空间填充模型: 等。
2.用电子式表示两类化学键的形成过程
化学键 用电子式表示形成过程
共价键 不标出弯箭头及电子的转移,表示出共用电子对,如:
离子键 用弯箭头表示电子转移,用中括号将接受电子的原子括起来并标上电荷数,如:
1.正误判断,正确的打“√”,错误的打“×”
(1)氨分子的空间填充模型: ( )
(2)氢氰酸的结构式:H—C≡N( )
(3) CS2的空间填充模型: ( )
(4)氨基负离子( )的电子式: ( )
(5)氧原子的价层电子排布式:2s22p4( )
(6)氮原子的轨道表示式: ( )
√
√
√
×
√
×
对点训练
2.按要求书写下列微粒的电子式:
(1)H3O+____________, _______________,
_____________, _____________,
—OH________,OH-____________。
(2)HClO___________,CCl4__________,CS2_______________,
COS_______________,HCHO_________,COCl2___________,
N2H4_____________, ________________。
(3)NaH____________,NH4H__________________,
NaCN__________________,NaBH4________________。
(1)首先要判断是阴离子还是阳离子,是离子化合物还是共价化合物。
(2)不能漏写没有参与成键的电子对,如NH3的电子式不是 。
(3)不能错误合并离子,如Na2O2的电子式写成 是错误的。
书写电子式需要注意的5个问题
(4)不能混淆化学键的类别,如H2O2的电子式写成 是
错误的。
(5)离子(或根)带电荷,基团不显电性,如OH-的电子式为 ,
—OH的电子式为 。
返回
思维建模
真题演练
02
1.(2023·江苏,2)反应NH4Cl+NaNO2===NaCl+N2↑+2H2O应用于石油开采。下列说法正确的是
A. 的电子式为
B. 中N元素的化合价为+5
C.N2分子中存在N≡N键
D.H2O为非极性分子
1
2
3
4
5
√
6
7
8
1
2
3
4
5
的电子式为 ,A错误;
中N元素的化合价为+3,B错误;
H2O为V形分子,分子中正负电荷中心未重合,为极性分子,D错误。
6
7
8
2.(2022·江苏,2)少量Na2O2与H2O反应生成H2O2和NaOH。下列说法正确的是
A.Na2O2的电子式为
B.H2O的空间构型为直线形
C.H2O2中O元素的化合价为-1
D.NaOH仅含离子键
√
1
2
3
4
5
6
7
8
过氧化钠是离子化合物,其电子式是 ,A错误;
H2O中氧原子的成键电子对数是2,孤电子对数是2,则价层电子对数为4,根据价层电子对互斥模型,其空间构型为V形,B错误;
H2O2中H显+1价,根据正负化合价代数和为0,可得O的化合价为-1,C正确;
NaOH中O和H之间是共价键,D错误。
1
2
3
4
5
6
7
8
3.(2021·江苏,2)反应Cl2+2NaOH===NaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是
A.Cl2是极性分子
B.NaOH的电子式为
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
√
1
2
3
4
5
6
7
8
氯气分子结构对称,正负电荷中心重合,为非极性分子,A错误;
NaOH为离子化合物,其电子式为 ,B错误;
1
2
3
4
5
NaClO含有钠离子和次氯酸根离子形成的离子键,含有O原子和Cl原子形成的共价键,C正确;
Cl-有3层电子,Na+有2层电子,D错误。
6
7
8
4.(2020·江苏,2)反应8NH3+3Cl2===6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
√
1
2
3
4
5
6
7
8
中子数为9的氮原子应为 ,A项错误;
N2分子的电子式为 ,B项错误;
Cl-的结构示意图为 ,D项错误。
1
2
3
4
5
6
7
8
5.(2023·浙江6月选考,2)下列化学用语表示正确的是
A.H2S分子的球棍模型:
B.AlCl3的价层电子对互斥模型:
C.KI的电子式:
D.CH3CH(CH2CH3)2的名称:3-甲基戊烷
√
1
2
3
4
5
6
7
8
1
2
3
4
5
H2S分子是V形结构,故A错误;
AlCl3中心原子价层电子对数为3+ ×(3-1×3)=3,其价层电子对互斥模型为平面三角形,故B错误;
KI是离子化合物,其电子式: ,故C错误;
CH3CH(CH2CH3)2的结构简式为 ,其名称为3-甲
基戊烷,故D正确。
6
7
8
6.(2023·北京,2)下列化学用语或图示表达正确的是
A.NaCl的电子式为
B.NH3的VSEPR模型为
C.2pz电子云图为
D.基态24Cr原子的价层电子轨道表示式为
√
1
2
3
4
5
6
7
8
1
2
3
4
氯化钠是离子化合物,其电子式是 ,A项错误;
氨分子的VSEPR模型是四面体结构,B项错误:
基态24Cr的价层电子轨道表示式为 ,D项错误。
5
6
7
8
7.(2023·湖北,5)化学用语可以表达化学过程,下列化学用语的表达错误的是
A.用电子式表示K2S的形成:
B.用离子方程式表示Al(OH)3溶于烧碱溶液:Al(OH)3+OH-===[Al(OH)4]-
C.用电子云轮廓图表示H—H的s-s σ键形成的示意图:
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂: +
1
2
3
4
+nH2O
√
5
6
7
8
1
2
3
4
用化学方程式表示尿素与甲醛制备线型脲醛树脂为 +
nHCHO +(n-1)H2O,D错误。
5
6
7
8
8.(2023·辽宁,2)下列化学用语或表述正确的是
A.BeCl2的空间结构:V形
B.P4中的共价键类型:非极性键
C.基态Ni原子价电子排布式:3d10
D.顺-2-丁烯的结构简式:
1
2
3
4
√
5
6
7
8
1
2
3
4
5
BeCl2的中心原子为Be,根据VSEPR模型可以计算,BeCl2中不含有孤电子对,因此BeCl2为直线形分子,A错误;
Ni原子的原子序数为28,其基态原子的价电子排布式为3d84s2,C错误;
顺-2-丁烯的结构中两个甲基在双键的同一侧,其结构简式为
,D错误。
6
7
8
考向预测
03
1.(2023·海安高级中学高三下学期模拟)ClO2在工业上可用于淀粉及油脂的漂白及自来水的消毒,制备ClO2的一种方法为5NaClO2+4HCl===5NaCl+4ClO2↑+2H2O,下列有关化学用语表达正确的是
A.中子数为8的氧原子:
B.Na+的结构示意图:
C.HCl的电子式:
D.ClO2的空间填充模型:
1
2
3
4
5
6
√
Na+的结构示意图: ,故B错误;
HCl为共价化合物,电子式为 ,故C错误;
ClO2的价电子对数为4,含孤电子对,不是直线形,故D错误。
1
2
3
4
5
6
2.(2023·淮阴中学高三下学期最后一模)NCl3可发生水解反应NCl3+3H2O===NH3+3HClO,下列说法正确的是
A.NCl3分子空间结构为三角锥形
B.H2O的VSEPR模型:
C.质量数为35、中子数为18的Cl原子:
D.用电子式表示H2O的形成过程:
1
2
3
4
5
6
√
NCl3中氮原子形成了3个σ键,有1对孤电子对,价电子对数为4,其空间结构为三角锥形,A正确;
H2O中氧原子形成了2个σ键,有2对孤电子对,价电子对数为4,其VSEPR模型为四面体形,B错误;
质量数为35、中子数为18的Cl原子为 ,C错误;
水为共价化合物,则用电子式表示H2O的形成过程为
,D错误。
1
2
3
4
5
6
3.(2023·江苏省决胜新高考高三4月大联考)我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种矿物Ca5(PO4)3(OH)。下列有关化学用语或图示表达正确的是
A.OH-的电子式:
B.基态P原子的外围电子的轨道表示式:
C. 的空间填充模型:
D.H2O的空间结构:V形
1
2
3
4
5
6
√
OH-的电子式为 ,A错误;
基态P原子的外围电子排布式为3s23p3,轨道表示式为 ,
B错误;
的中心原子的价电子对数为 =4,没有孤电子对,空间结构
为正四面体,空间填充模型为 ,C错误;
H2O的中心原子的价电子对数为 =4,有2对孤电子对,空间结
构为V形,D正确。
1
2
3
4
5
6
4.(2023·连云港高三下学期2月调研)反应SO2+Br2+2H2O===H2SO4+2HBr可用于海水提取溴。下列有关说法正确的是
A.SO2是直线形分子
B.基态O原子的轨道表示式为
C.HBr的电子式为
D.H2SO4分子中含有6个σ键
1
2
3
4
5
6
√
SO2的中心原子采取sp2杂化,有1对孤电子对,为V形分子,A项错误;
基态O原子的轨道表示式为 ,B项错误;
HBr是共价化合物,电子式是 ,C项错误;
H2SO4的结构式是 ,所以分子中含有4个S—O σ键,2个
O—H σ键,D项正确。
1
2
3
4
5
6
5.(2023·南京师范大学附属中学高三5月模拟)亚硝酰氟(FNO)是一种工业稳定剂,可通过反应N2O4 +CsF===FNO+CsNO3制得。下列说法正确的是
A.氧原子的结构示意图为
B.CsF的电子式为
C.FNO的空间结构为直线形
D.CsNO3中含有离子键与共价键
1
2
3
4
5
6
√
O原子的质子数和电子数都是8,核外电子分层排布,其结构示意图
为 ,故A错误;
CsF为离子化合物,电子式为 ,故B错误;
FNO中心原子N原子价电子对数为 =3,有1对孤电子对,空间结构为V形,故C错误;
CsNO3中含有Cs+与 间的离子键与N—O共价键,故D正确。
1
2
3
4
5
6
6.(2022·盐城市阜宁中学综合测试)在阳光照射下,水和氧气在浸泡过KOH溶液的三噻吩(C12H8S3)聚合物表面能高效合成过氧化氢(H2O2),下列说法不正确的是
A.H2O2的电子式为
B.H2O为极性分子
C.KOH为离子晶体
D.S2-的结构示意图为
1
2
3
4
5
6
√
A项,H2O2是共价化合物,电子式为 ,错误;
1
2
3
4
5
6
B项,水分子的空间结构为V形、分子内正负电荷中心不重合,H2O为极性分子,正确;
C项,KOH由活泼金属钾离子和氢氧根离子构成,其晶体为离子晶体,正确;
D项,S2-的质子数为16、电子数为18,硫离子结构示意图为 ,
正确。
本课结束
同课章节目录
