专题二 物质结构与性质 选择题专攻 1.元素周期律、化学键与分子结构(共45张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题二 物质结构与性质 选择题专攻 1.元素周期律、化学键与分子结构(共45张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:31:10 | ||
图片预览









文档简介
(共45张PPT)
1.元素周期律、化学键与分子结构
选择题专攻
核心精讲
01
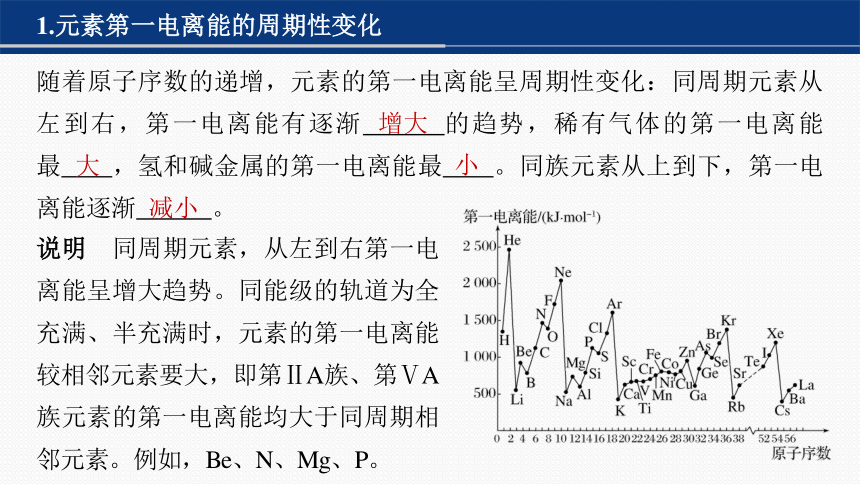
1.元素第一电离能的周期性变化
随着原子序数的递增,元素的第一电离能呈周期性变化:同周期元素从左到右,第一电离能有逐渐 的趋势,稀有气体的第一电离能最 ,氢和碱金属的第一电离能最 。同族元素从上到下,第一电离能逐渐 。
增大
大
小
减小
说明 同周期元素,从左到右第一电离能呈增大趋势。同能级的轨道为全充满、半充满时,元素的第一电离能较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能均大于同周期相邻元素。例如,Be、N、Mg、P。
2.元素的电负性
随着原子序数的递增,元素的电负性呈周期性变化:同周期元素从左到右,元素的电负性逐渐 ;同族元素从上到下,元素的电负性逐渐
。
增大
减小
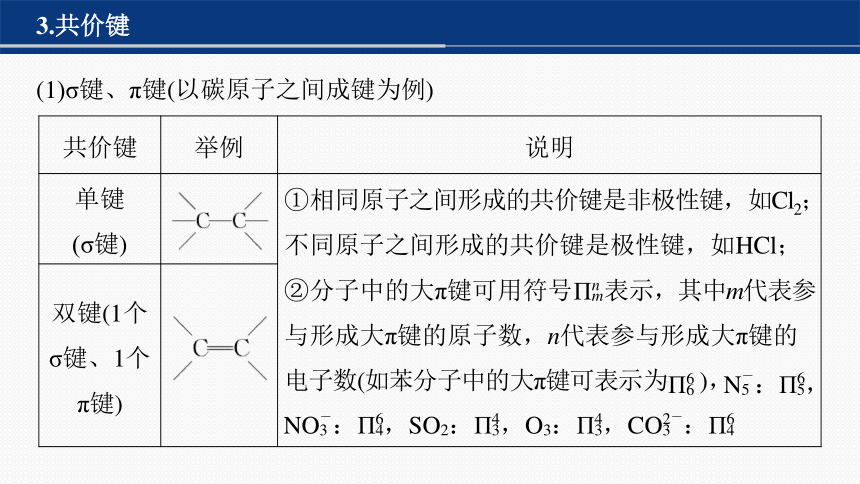
3.共价键
(1)σ键、π键(以碳原子之间成键为例)
共价键 举例 说明
单键 (σ键) ①相同原子之间形成的共价键是非极性键,如Cl2;不同原子之间形成的共价键是极性键,如HCl;
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),
双键(1个 σ键、1个 π键) 共价键 举例 说明
三键(1个 σ键、2个 π键) -C≡C- ①相同原子之间形成的共价键是非极性键,如Cl2;不同原子之间形成的共价键是极性键,如HCl;
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),
大π键 (2)配位键
①配合物的组成:以[Cu(NH3)4]SO4为例,如图1所示。
②一般来说,配合物内界与外界之间为离子键,电荷相互抵消。
③配体有多个配位原子,与中心原子形成螯合物,
如铜离子与乙二胺形成配离子(图2)。
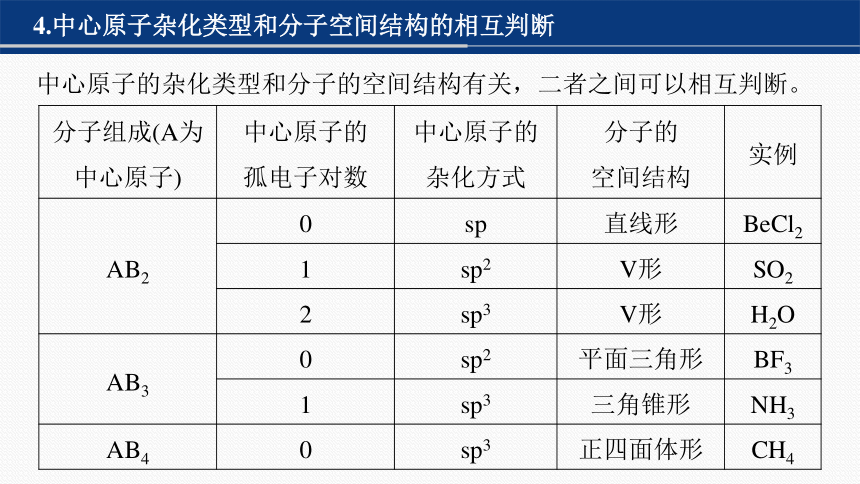
4.中心原子杂化类型和分子空间结构的相互判断
中心原子的杂化类型和分子的空间结构有关,二者之间可以相互判断。
分子组成(A为中心原子) 中心原子的 孤电子对数 中心原子的 杂化方式 分子的 空间结构 实例
AB2 0 sp 直线形 BeCl2
1 sp2 V形 SO2
2 sp3 V形 H2O
AB3 0 sp2 平面三角形 BF3
1 sp3 三角锥形 NH3
AB4 0 sp3 正四面体形 CH4
特别提醒 (1)用价层电子对互斥模型判断分子的空间结构,不仅要考虑中心原子的孤电子对所占据的空间,还要考虑孤电子对对成键电子对的排斥力大小。排斥力大小顺序为LP—LP>LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)键角大小的判断方法
①不同杂化类型
如键角:CH4②单键、双键、三键的影响(较少考查,了解)
三键、双键、单键之间的排斥力大小顺序:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键。
如乙烯分子中H—C==C的键角是121.3°;H—C—H的键角是117.4°,均接近120°。
③杂化类型相同,中心原子的孤电子对数越多,键角越小
如键角:CH4>NH3>H2O; >NH3;H3O+>H2O。
④杂化类型和孤电子对数均相同,中心原子的电负性越大,键角越大
键角:NH3>PH3>AsH3。
解释:N、P、As的电负性逐渐减小,中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对排斥力增大,键角增大。
⑤杂化类型和孤电子对数均相同,配位原子的电负性越大,键角越小
键角:NF3解释:F的电负性比H大,NF3中成键电子对偏向F,成键电子对排斥力比NH3小,且NF3的孤电子对偏向N,孤电子对对成键电子对的排斥力较大。
对于第④、⑤种类型,可以归纳为判断中心原子的电子云密度,中心原子的电子云密度越大,则该分子的成键电子对排斥力越大,则键角越大。
真题演练
02
1
2
3
4
5
1.(2023·江苏,4)元素C、Si、Ge位于周期表中第ⅣA族。下列说法正确的是
A.原子半径:r(C)>r(Si)>r(Ge)
B.第一电离能:I1(C)C.碳单质、晶体硅、SiC均为共价晶体
D.可在周期表中元素Si附近寻找新半导体材料
√
6
7
8
1
2
3
4
5
同主族元素从上往下原子半径逐渐增大,故原子半径:r(C)同主族元素,从上往下原子半径逐渐增大,更易失电子,第一电离能:I1(C)>I1(Si)>I1(Ge),B错误;
晶体硅、SiC均为共价晶体,碳单质中金刚石为共价晶体,而石墨为混合型晶体,C60为分子晶体,C错误;
周期表中元素Si附近存在许多准金属,可在其周围寻找新的半导体材料,D正确。
6
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
√
6
7
8
1
2
3
4
5
H2O2分子中的化学键既存在O—H极性共价键,也存在O—O非极性共价键,C错误;
CaH2晶体中存在Ca2+与H-之间的离子键,不存在Ca与H2之间的强烈相互作用,D错误。
6
7
8
1
2
3
4
5
3.(2022·江苏,3)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是
A.半径大小:r(Al3+)B.电负性大小:χ(F)<χ(O)
C.电离能大小:I1(O)D.碱性强弱:NaOH√
6
7
8
核外电子数相同时,核电荷数越大,离子半径越小,故半径大小为r(Al3+)同周期元素核电荷数越大电负性越大,故χ(F)>χ(O),故B错误;
同周期元素从左往右第一电离能呈增大趋势,同主族元素从上往下第一电离能呈减小趋势,故电离能大小为I1(O)>I1(Na),故C错误;
元素金属性越强,其最高价氧化物对应水化物的碱性越强,故碱性强弱为NaOH>Al(OH)3,故D错误。
1
2
3
4
5
6
7
8
1
2
3
4
5
√
6
7
8
1
2
3
4
5
硝酸根离子的空间结构为平面三角形,B错误;
[Ag(NH3)2]+中含有2个配位键,D错误。
6
7
8
1
2
3
4
5
5.(2020·江苏,9)下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n:n(Na)<n(Mg)<n(Cl)<n(Br)
√
6
7
8
1
2
3
4
5
金属性:Na>Mg,故碱性:NaOH>Mg(OH)2,A项正确;
氯和溴均属于卤族元素,同一主族元素从上到下,单质的氧化性逐渐减弱,得电子能力:Cl2>Br2,B项错误;
同一周期主族元素,从左到右原子半径依次减小,则r(Br)>r(Na)>r(Mg)>r(Cl),C项错误;
氯和溴属于同一主族,最外层电子数相等,D项错误。
6
7
8
1
2
3
4
5
6.(2023·北京,10)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A.F—F键的键能小于Cl—Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
√
6
7
8
1
2
3
4
F原子半径小,电子云密度大,两个原子间的斥力较强,F—F不稳定,因此F—F的键能小于Cl—Cl的键能,与电负性无关,A符合题意;
氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更容易电离出氢离子,酸性更强,B不符合题意;
氟的电负性大于氯的电负性,F—H的极性大于Cl—H的极性,导致HF分子极性强于HCl,C不符合题意;
氟的电负性大于氯的电负性,与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中存在(HF)2,D不符合题意。
5
6
7
8
1
2
3
4
7.(2023·湖北,9)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A.CH4和H2O的VSEPR模型均为四面体
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
√
5
6
7
8
1
2
3
4
甲烷分子的中心原子的价层电子对数为4,水分子的中心原子价层电子对数也为4,所以VSEPR模型均为四面体,A正确;
CF4为正四面体结构,为非极性分子,SF4的中心原子有孤电子对,为极性分子,C错误;
XeF2和XeO2分子中,中心原子孤电子对数不相等,所以键角不等,D错误。
5
6
7
8
1
2
3
4
8.(2023·浙江1月选考,12)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3===2Al(NH3)Cl3,下列说法不正确的是
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯
D.Al2Br6比Al2Cl6更难与NH3发生反应
√
5
6
7
8
1
2
3
4
5
由双聚氯化铝分子中所有原子均满足8电子稳定结构可知,分子的结
构式为 ,是结构对称的非极性分子,故A、B正确;
由反应方程式可知,氨分子更易与具有空轨道的铝原子形成配位键,配位能力大于氯原子,故C正确;
溴元素的电负性小于氯元素,原子的原子半径大于氯原子,则铝溴键弱于铝氯键,所以双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与氨气反应,故D错误。
6
7
8
考向预测
03
1
2
3
4
5
6
7
1.(2023·海安高级中学高三下学期3月月考)实验室可以用KMnO4和浓盐酸制Cl2。下列说法正确的是
A.半径大小:r(K+)>r(Cl-)
B.KMnO4仅含离子键
C.电负性大小:χ(O)>χ(Cl)
D.Mn元素在元素周期表的ds区
√
1
2
3
4
5
6
7
K+与Cl-的电子层结构相同,但K+的核电荷数比Cl-大,所以半径大小:r(K+)<r(Cl-),A不正确;
氧和氯形成的化合物ClO2中Cl显正价,则电负性大小:χ(O)>χ(Cl),C正确;
Mn元素的价电子排布式为3d54s2,在元素周期表的d区,D不正确。
1
2
3
4
5
6
7
2.(2023·连云港高级中学高三5月模拟)黑火药爆炸时发生反应2KNO3+S+3C===K2S+N2↑+3CO2↑。下列说法正确的是
A.半径:r(S2-)<r(K+)
B.熔点:K2S<S
C.第一电离能:I1(N)<I1(O)
D.电负性:χ(S)<χ(O)
√
1
2
3
4
5
6
7
硫离子和钾离子具有相同的电子层数,核电荷数越大半径越小,即半径:r(S2-)>r(K+),A错误;
K2S是离子晶体,S为分子晶体,一般情况下,离子晶体的熔点大于分子晶体的熔点,B错误;
同一主族元素的电负性从上到下逐渐减小,即电负性:χ(S)<χ(O),D正确。
1
2
3
4
5
6
7
3.(2023·连云港市高三下学期2月调研)祖母绿(主要成分Be3Al2Si6O18)被称为宝石之王,与其相似的天然绿色宝石有萤石[主要成分CaF2]、磷灰石[主要成分Ca5(PO4)3F]。下列说法正确的是
A.半径:r(Al3+)>r(O2-)
B.电负性:x(P)>x(Si)
C.第一电离能:I1(F)<I1(O)
D.碱性:Ca(OH)2<Al(OH)3
√
1
2
3
4
5
6
7
电子层结构相同的离子,核电荷数越大,离子半径越小,则铝离子的半径小于氧离子,故A错误;
同周期元素,从左到右元素的非金属性依次增强,电负性依次增大,则磷元素的电负性大于硅元素,故B正确;
同周期元素,从左到右第一电离能呈增大趋势,故C错误;
金属性:Ca>Al,则氢氧化钙的碱性强于氢氧化铝,故D错误。
1
2
3
4
5
6
7
4.下列关于BeF2和SF2的说法错误的是
A.BeF2分子中,中心原子Be的价层电子对数等于2,成键电子对数也等
于2
B.BeF2分子的孤电子对数为0
C.SF2分子中,中心原子S的价层电子对数等于4,其空间结构为四面体
形,成键电子对数等于2,没有孤电子对
D.在气相中,BeF2是直线形而SF2是V形
√
1
2
3
4
5
6
7
5.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是
A.配位体是Cl-和H2O,配位数是8
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中Cl-的数目比是1∶2
D.在1 mol该配合物中加入足量AgNO3溶液,可以得到3 mol AgCl沉淀
√
1
2
3
4
5
6
7
配合物[TiCl(H2O)5]Cl2·H2O中配位体是Cl-和H2O,配位数是6,故A错误;
中心离子是Ti3+,故B错误;
加入足量AgNO3溶液,外界中Cl-与Ag+反应,内界中Cl-不与Ag+反应,1 mol该配合物只能生成2 mol AgCl沉淀,故D错误。
1
2
3
4
5
6
7
6.铝离子电池常用离子液体AlCl3/[EMIM]Cl作电解质,其中阴离子有
,阳离子为EMIM+( ),EMIM+以单个形
式存在时可以获得良好的溶解性能。下列说法错误的是
C.1 mol EMIM+中所含σ键为17 mol
D.为使EMIM+获得良好的溶解性,不能将与N原子相连的—CH3、—C2H5
替换为H原子
√
1
2
3
4
5
6
7
中环上由5个原子参与成键,与乙基相连的N原子提供
2个电子,每个碳原子提供1个电子,与甲基相连的N原子提供1个电子,故该大π键应表示为 ,A正确;
中每个Al原子周围形成4对共用电子对,则其结构式为
,各原子最外层均达到8电子稳定结构,B正确;
1
2
3
4
5
6
7
一个单键为一个σ键,一个双键中含有一个σ键和一个π键,1个EMIM+中所含σ键有19个,1 mol EMIM+中所含σ键为19 mol,C错误;
氮原子上连H原子形成分子间氢键,使该离子不易以单个形式存在,所以与N原子相连的—CH3、—C2H5不能被氢原子替换,D正确。
1
2
3
4
5
6
7
7.检验Ni2+反应的一种生成物为丁二酮肟镍,是一种鲜红色沉淀,其分子结构如图所示。下列说法正确的是
A.Ni2+核外有14种运动状态不同的电子
B.该分子内微粒之间存在的作用力有共价键、
配位键、离子键、氢键
C.基态N原子的价层电子轨道表示式为
D.H2O中有2个由s轨道与sp3杂化轨道形成的σ键
√
1
2
3
4
5
6
7
Ni2+的价层电子排布式为3d8,能级、轨道中的电子运动状态各不相同,则Ni2+核外有26种运动状态不同的电子,A说法错误;
该分子不是离子化合物,不含离子键,B说法错误;
基态N原子的价层电子排布式为2s22p3,价层电子轨道表示式为
,C说法错误。
本课结束
1.元素周期律、化学键与分子结构
选择题专攻
核心精讲
01
1.元素第一电离能的周期性变化
随着原子序数的递增,元素的第一电离能呈周期性变化:同周期元素从左到右,第一电离能有逐渐 的趋势,稀有气体的第一电离能最 ,氢和碱金属的第一电离能最 。同族元素从上到下,第一电离能逐渐 。
增大
大
小
减小
说明 同周期元素,从左到右第一电离能呈增大趋势。同能级的轨道为全充满、半充满时,元素的第一电离能较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能均大于同周期相邻元素。例如,Be、N、Mg、P。
2.元素的电负性
随着原子序数的递增,元素的电负性呈周期性变化:同周期元素从左到右,元素的电负性逐渐 ;同族元素从上到下,元素的电负性逐渐
。
增大
减小
3.共价键
(1)σ键、π键(以碳原子之间成键为例)
共价键 举例 说明
单键 (σ键) ①相同原子之间形成的共价键是非极性键,如Cl2;不同原子之间形成的共价键是极性键,如HCl;
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),
双键(1个 σ键、1个 π键) 共价键 举例 说明
三键(1个 σ键、2个 π键) -C≡C- ①相同原子之间形成的共价键是非极性键,如Cl2;不同原子之间形成的共价键是极性键,如HCl;
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),
大π键 (2)配位键
①配合物的组成:以[Cu(NH3)4]SO4为例,如图1所示。
②一般来说,配合物内界与外界之间为离子键,电荷相互抵消。
③配体有多个配位原子,与中心原子形成螯合物,
如铜离子与乙二胺形成配离子(图2)。
4.中心原子杂化类型和分子空间结构的相互判断
中心原子的杂化类型和分子的空间结构有关,二者之间可以相互判断。
分子组成(A为中心原子) 中心原子的 孤电子对数 中心原子的 杂化方式 分子的 空间结构 实例
AB2 0 sp 直线形 BeCl2
1 sp2 V形 SO2
2 sp3 V形 H2O
AB3 0 sp2 平面三角形 BF3
1 sp3 三角锥形 NH3
AB4 0 sp3 正四面体形 CH4
特别提醒 (1)用价层电子对互斥模型判断分子的空间结构,不仅要考虑中心原子的孤电子对所占据的空间,还要考虑孤电子对对成键电子对的排斥力大小。排斥力大小顺序为LP—LP>LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)键角大小的判断方法
①不同杂化类型
如键角:CH4
三键、双键、单键之间的排斥力大小顺序:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键。
如乙烯分子中H—C==C的键角是121.3°;H—C—H的键角是117.4°,均接近120°。
③杂化类型相同,中心原子的孤电子对数越多,键角越小
如键角:CH4>NH3>H2O; >NH3;H3O+>H2O。
④杂化类型和孤电子对数均相同,中心原子的电负性越大,键角越大
键角:NH3>PH3>AsH3。
解释:N、P、As的电负性逐渐减小,中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对排斥力增大,键角增大。
⑤杂化类型和孤电子对数均相同,配位原子的电负性越大,键角越小
键角:NF3
对于第④、⑤种类型,可以归纳为判断中心原子的电子云密度,中心原子的电子云密度越大,则该分子的成键电子对排斥力越大,则键角越大。
真题演练
02
1
2
3
4
5
1.(2023·江苏,4)元素C、Si、Ge位于周期表中第ⅣA族。下列说法正确的是
A.原子半径:r(C)>r(Si)>r(Ge)
B.第一电离能:I1(C)
D.可在周期表中元素Si附近寻找新半导体材料
√
6
7
8
1
2
3
4
5
同主族元素从上往下原子半径逐渐增大,故原子半径:r(C)
晶体硅、SiC均为共价晶体,碳单质中金刚石为共价晶体,而石墨为混合型晶体,C60为分子晶体,C错误;
周期表中元素Si附近存在许多准金属,可在其周围寻找新的半导体材料,D正确。
6
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
√
6
7
8
1
2
3
4
5
H2O2分子中的化学键既存在O—H极性共价键,也存在O—O非极性共价键,C错误;
CaH2晶体中存在Ca2+与H-之间的离子键,不存在Ca与H2之间的强烈相互作用,D错误。
6
7
8
1
2
3
4
5
3.(2022·江苏,3)工业上电解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得铝。下列说法正确的是
A.半径大小:r(Al3+)
C.电离能大小:I1(O)
6
7
8
核外电子数相同时,核电荷数越大,离子半径越小,故半径大小为r(Al3+)
同周期元素从左往右第一电离能呈增大趋势,同主族元素从上往下第一电离能呈减小趋势,故电离能大小为I1(O)>I1(Na),故C错误;
元素金属性越强,其最高价氧化物对应水化物的碱性越强,故碱性强弱为NaOH>Al(OH)3,故D错误。
1
2
3
4
5
6
7
8
1
2
3
4
5
√
6
7
8
1
2
3
4
5
硝酸根离子的空间结构为平面三角形,B错误;
[Ag(NH3)2]+中含有2个配位键,D错误。
6
7
8
1
2
3
4
5
5.(2020·江苏,9)下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n:n(Na)<n(Mg)<n(Cl)<n(Br)
√
6
7
8
1
2
3
4
5
金属性:Na>Mg,故碱性:NaOH>Mg(OH)2,A项正确;
氯和溴均属于卤族元素,同一主族元素从上到下,单质的氧化性逐渐减弱,得电子能力:Cl2>Br2,B项错误;
同一周期主族元素,从左到右原子半径依次减小,则r(Br)>r(Na)>r(Mg)>r(Cl),C项错误;
氯和溴属于同一主族,最外层电子数相等,D项错误。
6
7
8
1
2
3
4
5
6.(2023·北京,10)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A.F—F键的键能小于Cl—Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
√
6
7
8
1
2
3
4
F原子半径小,电子云密度大,两个原子间的斥力较强,F—F不稳定,因此F—F的键能小于Cl—Cl的键能,与电负性无关,A符合题意;
氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更容易电离出氢离子,酸性更强,B不符合题意;
氟的电负性大于氯的电负性,F—H的极性大于Cl—H的极性,导致HF分子极性强于HCl,C不符合题意;
氟的电负性大于氯的电负性,与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中存在(HF)2,D不符合题意。
5
6
7
8
1
2
3
4
7.(2023·湖北,9)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A.CH4和H2O的VSEPR模型均为四面体
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
√
5
6
7
8
1
2
3
4
甲烷分子的中心原子的价层电子对数为4,水分子的中心原子价层电子对数也为4,所以VSEPR模型均为四面体,A正确;
CF4为正四面体结构,为非极性分子,SF4的中心原子有孤电子对,为极性分子,C错误;
XeF2和XeO2分子中,中心原子孤电子对数不相等,所以键角不等,D错误。
5
6
7
8
1
2
3
4
8.(2023·浙江1月选考,12)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3===2Al(NH3)Cl3,下列说法不正确的是
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯
D.Al2Br6比Al2Cl6更难与NH3发生反应
√
5
6
7
8
1
2
3
4
5
由双聚氯化铝分子中所有原子均满足8电子稳定结构可知,分子的结
构式为 ,是结构对称的非极性分子,故A、B正确;
由反应方程式可知,氨分子更易与具有空轨道的铝原子形成配位键,配位能力大于氯原子,故C正确;
溴元素的电负性小于氯元素,原子的原子半径大于氯原子,则铝溴键弱于铝氯键,所以双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与氨气反应,故D错误。
6
7
8
考向预测
03
1
2
3
4
5
6
7
1.(2023·海安高级中学高三下学期3月月考)实验室可以用KMnO4和浓盐酸制Cl2。下列说法正确的是
A.半径大小:r(K+)>r(Cl-)
B.KMnO4仅含离子键
C.电负性大小:χ(O)>χ(Cl)
D.Mn元素在元素周期表的ds区
√
1
2
3
4
5
6
7
K+与Cl-的电子层结构相同,但K+的核电荷数比Cl-大,所以半径大小:r(K+)<r(Cl-),A不正确;
氧和氯形成的化合物ClO2中Cl显正价,则电负性大小:χ(O)>χ(Cl),C正确;
Mn元素的价电子排布式为3d54s2,在元素周期表的d区,D不正确。
1
2
3
4
5
6
7
2.(2023·连云港高级中学高三5月模拟)黑火药爆炸时发生反应2KNO3+S+3C===K2S+N2↑+3CO2↑。下列说法正确的是
A.半径:r(S2-)<r(K+)
B.熔点:K2S<S
C.第一电离能:I1(N)<I1(O)
D.电负性:χ(S)<χ(O)
√
1
2
3
4
5
6
7
硫离子和钾离子具有相同的电子层数,核电荷数越大半径越小,即半径:r(S2-)>r(K+),A错误;
K2S是离子晶体,S为分子晶体,一般情况下,离子晶体的熔点大于分子晶体的熔点,B错误;
同一主族元素的电负性从上到下逐渐减小,即电负性:χ(S)<χ(O),D正确。
1
2
3
4
5
6
7
3.(2023·连云港市高三下学期2月调研)祖母绿(主要成分Be3Al2Si6O18)被称为宝石之王,与其相似的天然绿色宝石有萤石[主要成分CaF2]、磷灰石[主要成分Ca5(PO4)3F]。下列说法正确的是
A.半径:r(Al3+)>r(O2-)
B.电负性:x(P)>x(Si)
C.第一电离能:I1(F)<I1(O)
D.碱性:Ca(OH)2<Al(OH)3
√
1
2
3
4
5
6
7
电子层结构相同的离子,核电荷数越大,离子半径越小,则铝离子的半径小于氧离子,故A错误;
同周期元素,从左到右元素的非金属性依次增强,电负性依次增大,则磷元素的电负性大于硅元素,故B正确;
同周期元素,从左到右第一电离能呈增大趋势,故C错误;
金属性:Ca>Al,则氢氧化钙的碱性强于氢氧化铝,故D错误。
1
2
3
4
5
6
7
4.下列关于BeF2和SF2的说法错误的是
A.BeF2分子中,中心原子Be的价层电子对数等于2,成键电子对数也等
于2
B.BeF2分子的孤电子对数为0
C.SF2分子中,中心原子S的价层电子对数等于4,其空间结构为四面体
形,成键电子对数等于2,没有孤电子对
D.在气相中,BeF2是直线形而SF2是V形
√
1
2
3
4
5
6
7
5.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是
A.配位体是Cl-和H2O,配位数是8
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中Cl-的数目比是1∶2
D.在1 mol该配合物中加入足量AgNO3溶液,可以得到3 mol AgCl沉淀
√
1
2
3
4
5
6
7
配合物[TiCl(H2O)5]Cl2·H2O中配位体是Cl-和H2O,配位数是6,故A错误;
中心离子是Ti3+,故B错误;
加入足量AgNO3溶液,外界中Cl-与Ag+反应,内界中Cl-不与Ag+反应,1 mol该配合物只能生成2 mol AgCl沉淀,故D错误。
1
2
3
4
5
6
7
6.铝离子电池常用离子液体AlCl3/[EMIM]Cl作电解质,其中阴离子有
,阳离子为EMIM+( ),EMIM+以单个形
式存在时可以获得良好的溶解性能。下列说法错误的是
C.1 mol EMIM+中所含σ键为17 mol
D.为使EMIM+获得良好的溶解性,不能将与N原子相连的—CH3、—C2H5
替换为H原子
√
1
2
3
4
5
6
7
中环上由5个原子参与成键,与乙基相连的N原子提供
2个电子,每个碳原子提供1个电子,与甲基相连的N原子提供1个电子,故该大π键应表示为 ,A正确;
中每个Al原子周围形成4对共用电子对,则其结构式为
,各原子最外层均达到8电子稳定结构,B正确;
1
2
3
4
5
6
7
一个单键为一个σ键,一个双键中含有一个σ键和一个π键,1个EMIM+中所含σ键有19个,1 mol EMIM+中所含σ键为19 mol,C错误;
氮原子上连H原子形成分子间氢键,使该离子不易以单个形式存在,所以与N原子相连的—CH3、—C2H5不能被氢原子替换,D正确。
1
2
3
4
5
6
7
7.检验Ni2+反应的一种生成物为丁二酮肟镍,是一种鲜红色沉淀,其分子结构如图所示。下列说法正确的是
A.Ni2+核外有14种运动状态不同的电子
B.该分子内微粒之间存在的作用力有共价键、
配位键、离子键、氢键
C.基态N原子的价层电子轨道表示式为
D.H2O中有2个由s轨道与sp3杂化轨道形成的σ键
√
1
2
3
4
5
6
7
Ni2+的价层电子排布式为3d8,能级、轨道中的电子运动状态各不相同,则Ni2+核外有26种运动状态不同的电子,A说法错误;
该分子不是离子化合物,不含离子键,B说法错误;
基态N原子的价层电子排布式为2s22p3,价层电子轨道表示式为
,C说法错误。
本课结束
同课章节目录
