专题二 物质结构与性质 选择题专攻 3.晶体结构(共38张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题二 物质结构与性质 选择题专攻 3.晶体结构(共38张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:36:06 | ||
图片预览






文档简介
(共38张PPT)
3.晶体结构
选择题专攻
核心精讲
01
1.常见共价晶体结构分析
(1)金刚石
①每个C与相邻4个C以共价键结合,形成正四面体结构;
②键角均为109°28′;
③最小碳环由6个C组成且6个C不在同一平面内;
④每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2。
(2)SiO2
①每个Si与4个O以共价键结合,形成正四面体结构;
②每个正四面体占有1个Si,4个“ O”,因此二氧化硅晶
体中Si与O的个数之比为1∶2;
③最小环上有12个原子,即6个O、6个Si。
(3)SiC、BP、AlN
每个原子与另外4个不同种类的原子形成正四面体结构。
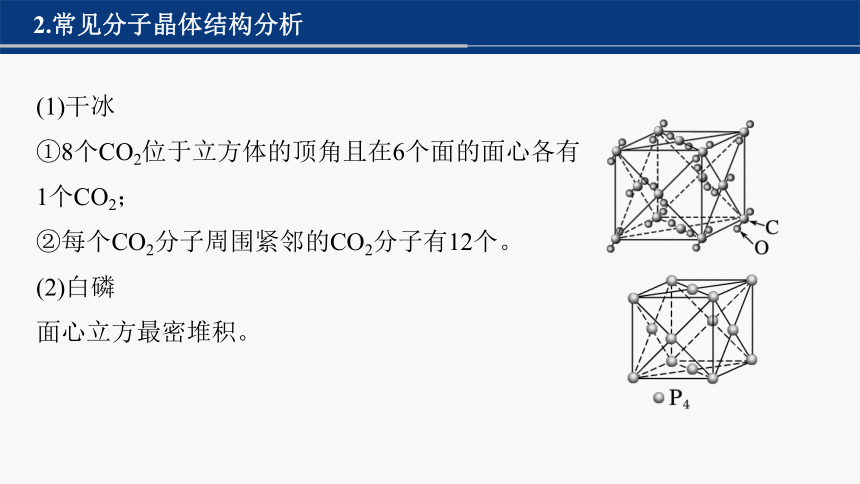
2.常见分子晶体结构分析
(1)干冰
①8个CO2位于立方体的顶角且在6个面的面心各有
1个CO2;
②每个CO2分子周围紧邻的CO2分子有12个。
(2)白磷
面心立方最密堆积。
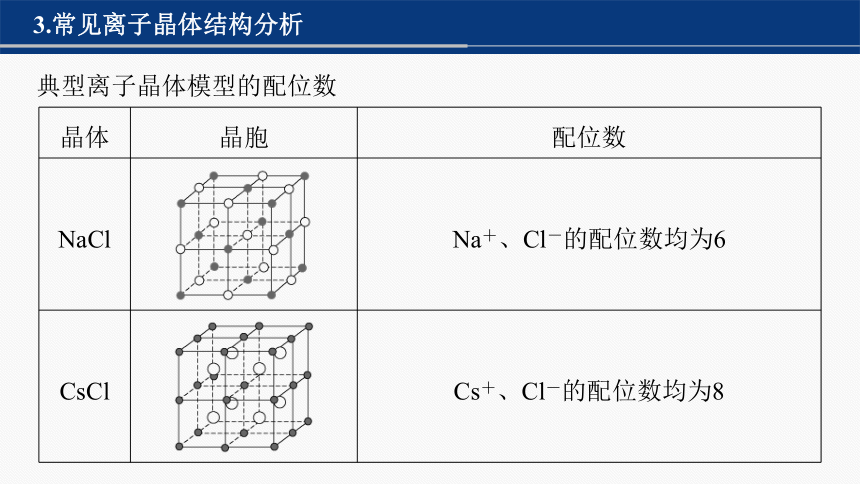
3.常见离子晶体结构分析
典型离子晶体模型的配位数
晶体 晶胞 配位数
NaCl Na+、Cl-的配位数均为6
CsCl Cs+、Cl-的配位数均为8
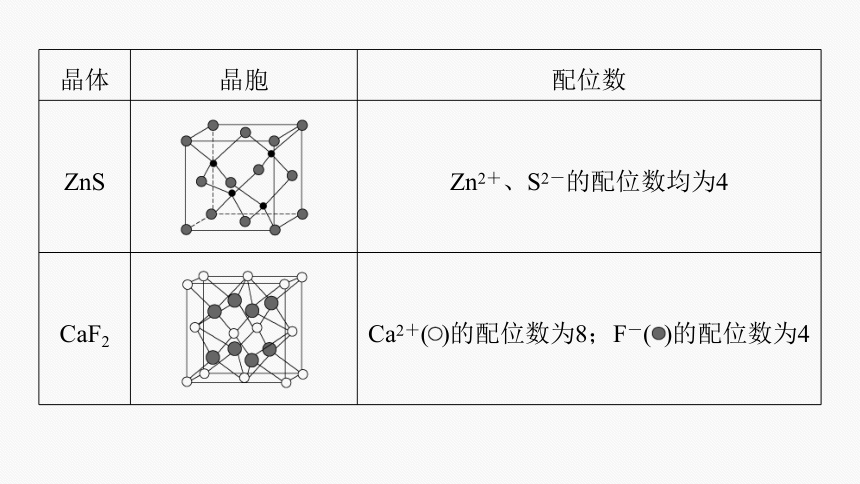
晶体 晶胞 配位数
ZnS Zn2+、S2-的配位数均为4
CaF2 Ca2+( )的配位数为8;F-( )的配位数为4
[知识拓展] 晶格能
(1)定义:气态离子形成1摩离子晶体释放的能量。晶格能是反映离子晶体稳定性的数据,可以用来衡量离子键的强弱,晶格能越大,离子键越强。
(2)影响因素:晶格能的大小与阴阳离子所带电荷数、阴阳离子间的距离、离子晶体的结构类型有关。离子所带电荷数越多,半径越小,晶格能越大。
(3)对离子晶体性质的影响:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
真题演练
02
1
2
3
4
5
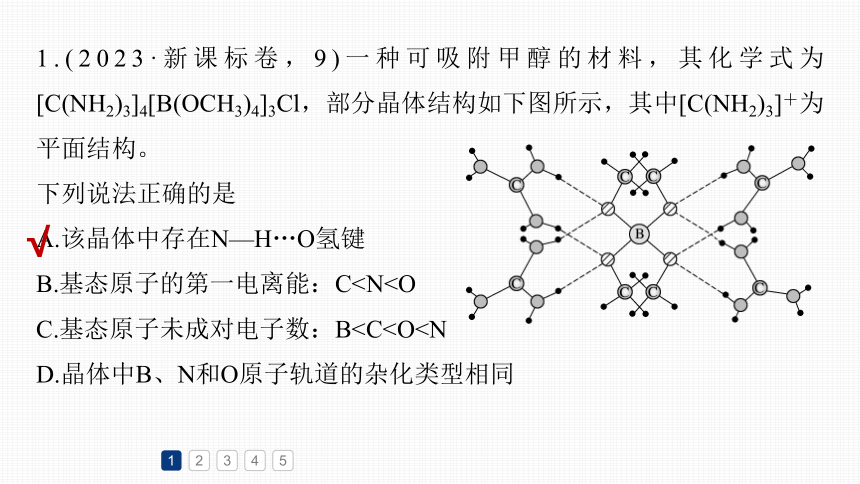
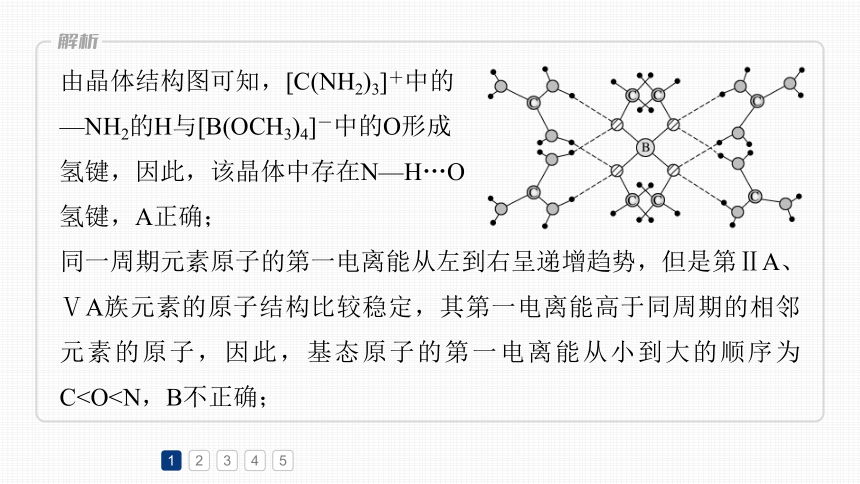
1.(2023·新课标卷,9)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:CC.基态原子未成对电子数:BD.晶体中B、N和O原子轨道的杂化类型相同
√
1
2
3
4
5
由晶体结构图可知,[C(NH2)3]+中的
—NH2的H与[B(OCH3)4]-中的O形成
氢键,因此,该晶体中存在N—H…O
氢键,A正确;
同一周期元素原子的第一电离能从左到右呈递增趋势,但是第ⅡA、ⅤA族元素的原子结构比较稳定,其第一电离能高于同周期的相邻元素的原子,因此,基态原子的第一电离能从小到大的顺序为C1
2
3
4
5
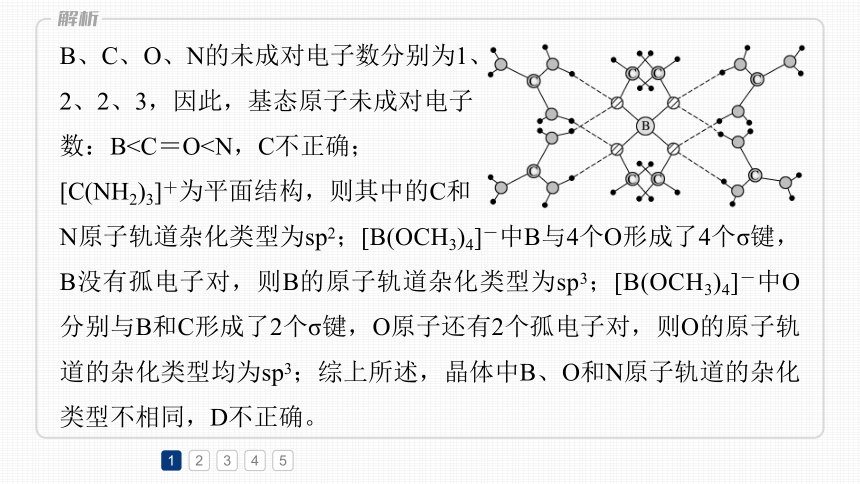
B、C、O、N的未成对电子数分别为1、
2、2、3,因此,基态原子未成对电子
数:B[C(NH2)3]+为平面结构,则其中的C和
N原子轨道杂化类型为sp2;[B(OCH3)4]-中B与4个O形成了4个σ键,B没有孤电子对,则B的原子轨道杂化类型为sp3;[B(OCH3)4]-中O分别与B和C形成了2个σ键,O原子还有2个孤电子对,则O的原子轨道的杂化类型均为sp3;综上所述,晶体中B、О和N原子轨道的杂化类型不相同,D不正确。
1
2
3
4
5
2.(2023·北京,1)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说
法正确的是
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
√
1
2
3
4
5
金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;
金刚石为共价晶体,石墨为混合
型晶体,石墨炔为分子晶体,C
项错误;
金刚石不能导电,D项错误。
1
2
3
4
5
3.(2023·湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
√
K+位于晶胞顶角,Ca2+位于体心,则晶体中与K+最近且距离相等的Ca2+有8个,B正确;
根据晶胞结构可知,晶胞中B和C原子构成的多面体有14个面,C错误;
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
4.(2023·山东,5)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1 mol (CF)x中含有2x mol共价单键
√
1
2
3
4
5
石墨晶体中每个碳原子上未参与杂化的1个2p
轨道上电子在层内离域运动,故石墨晶体能
导电,而(CF)x中没有未参与杂化的2p轨道上
的电子,故与石墨相比,(CF)x导电性减弱,
A错误;
石墨层间插入F后形成的C—F键长短,键能极大,分子结构稳定性增强,抗氧化性增强,B正确;
1
2
3
4
5
已知C的原子半径比F的大,故可知(CF)x中
C—C的键长比C—F的长,C错误;
由题干结构示意图可知,在(CF)x中每个C与
周围的3个碳原子、1个F原子形成共价键,
每个C—C被2个碳原子共用,即1 mol (CF)x中含有2.5x mol共价单键,D错误。
1
2
3
4
5
5.(2022·湖北,9)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是
A.Ca2+的配位数为6
B.与F-距离最近的是K+
C.该物质的化学式为KCaF3
D.若F-换为Cl-,则晶胞棱长将改变
√
1
2
3
4
5
Ca2+的配位数为与其距离最近且等距离的F-的个数,如图所示,Ca2+位于体心,F-位于面心,所以Ca2+的配位数为6,A正确;
F-与Cl-半径不同,替换后晶胞棱长将改变,D正确。
考向预测
03
1
2
3
4
5
6
1.根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示,下列有关氮化碳的说法不正确的是
A.氮化碳属于共价晶体
B.氮化碳的化学式为C3N4
C.该晶体的熔点比金刚石的熔点低
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
√
1
2
3
4
5
6
根据晶体硬度超过金刚石,具有网状结构这些特点确定该物质为共价晶体,A项正确;
该晶体与金刚石晶体均为共价晶体,r(N)1
2
3
4
5
6
2.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是
√
1
2
3
4
5
6
1
2
3
4
5
6
3.砷化镓(GaAs)作为第二代半导体材料的代表,是目前研究最成熟、生产量最大的半导体材料。GaAs晶胞结构如图所示,晶胞边长为a pm,下列说法正确的是
A.GaAs属于离子晶体
B.基态砷原子价层电子轨道表示式为
C.As的配位数为4
√
1
2
3
4
5
6
由GaAs晶胞结构图可知,该晶胞含有Ga原子和As
原子,微粒间的作用力是共价键,属于共价晶体,
A错误;
基态砷原子价层电子轨道表示式为 ,B错误;
与砷原子距离最近的镓原子的个数为4,则As的配位数为4,C正确;
1
2
3
4
5
6
4.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是
A.Z表示的微粒为H2
B.每个X周围最近且等距离的X有6个
C.若A的原子分数坐标为(0,0.5,0.5),B的原子分数
坐标为(0.75,0.75,0),则C的原子分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
√
1
2
3
4
5
6
从图中可以看出,每个X周围最近且等距离的X在顶角,数目为6,B正确;
若A的原子分数坐标为(0,0.5,0.5),B的原子分数坐标为(0.75,0.75,0),则坐标原点为底面左下角的X,晶胞参数为1,所以C的原子分数坐标为(1,0.5,1),C正确;
1
2
3
4
5
6
1
2
3
4
5
6
5.几种常见的晶胞或结构(CaF2、NH4Cl、AlCl3)如图,下列说法错误的是
A.图1所示晶胞中阳、阴离子的配位数分别为8和4
B.熔点:图2所示物质<图1所示物质
C.图3所示晶胞中与体心原子等距离且最近的顶点原子有8个
D.NH4Cl可与H-反应生成NH4H,NH4Cl和NH4H均是共价化合物
√
1
2
3
4
5
6
由题意判断图1为CaF2的晶胞,图2为AlCl3的结构,图3为NH4Cl的晶胞。图1中顶角和面心是Ca2+,体内较大的小球表示F-,距离Ca2+最近且等距离的F-有8个,则Ca2+的配位数为8,距离F-最近且等距离的Ca2+有4个,则F-的配位数为4,故A正确;
1
2
3
4
5
6
图1为CaF2的晶胞,CaF2是离子化合物,图2为AlCl3的结构,AlCl3是共价化合物,离子化合物的熔点一般高于共价化合物,则CaF2的熔点高于AlCl3,故B正确;
由图3可看出,与体心原子等距离且最近的顶点原子有8个,故C正确;
NH4H、NH4Cl均为离子化合物,故D错误。
1
2
3
4
5
6
6.有关晶体的结构如图所示,下列说法不正确的是
A.在NaCl晶体(图甲)中,距Na+最近的Cl-
围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或
FE
C.在CO2晶体(图丙)中,一个CO2分子周围
有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非
极性键和范德华力
√
1
2
3
4
5
6
在NaCl晶体中,距Na+最近的Cl-有6个,分别位于Na+的上、下、左、右、前、后,围成正八面体,A正确;
乙是一个分子,不是晶胞,所以分子式为E4F4或F4E4,B错误;
碘晶体中,有碘分子内部的碘原子间的非极性共价键,还有碘分子间的范德华力,D正确。
本课结束
3.晶体结构
选择题专攻
核心精讲
01
1.常见共价晶体结构分析
(1)金刚石
①每个C与相邻4个C以共价键结合,形成正四面体结构;
②键角均为109°28′;
③最小碳环由6个C组成且6个C不在同一平面内;
④每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2。
(2)SiO2
①每个Si与4个O以共价键结合,形成正四面体结构;
②每个正四面体占有1个Si,4个“ O”,因此二氧化硅晶
体中Si与O的个数之比为1∶2;
③最小环上有12个原子,即6个O、6个Si。
(3)SiC、BP、AlN
每个原子与另外4个不同种类的原子形成正四面体结构。
2.常见分子晶体结构分析
(1)干冰
①8个CO2位于立方体的顶角且在6个面的面心各有
1个CO2;
②每个CO2分子周围紧邻的CO2分子有12个。
(2)白磷
面心立方最密堆积。
3.常见离子晶体结构分析
典型离子晶体模型的配位数
晶体 晶胞 配位数
NaCl Na+、Cl-的配位数均为6
CsCl Cs+、Cl-的配位数均为8
晶体 晶胞 配位数
ZnS Zn2+、S2-的配位数均为4
CaF2 Ca2+( )的配位数为8;F-( )的配位数为4
[知识拓展] 晶格能
(1)定义:气态离子形成1摩离子晶体释放的能量。晶格能是反映离子晶体稳定性的数据,可以用来衡量离子键的强弱,晶格能越大,离子键越强。
(2)影响因素:晶格能的大小与阴阳离子所带电荷数、阴阳离子间的距离、离子晶体的结构类型有关。离子所带电荷数越多,半径越小,晶格能越大。
(3)对离子晶体性质的影响:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
真题演练
02
1
2
3
4
5
1.(2023·新课标卷,9)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:C
√
1
2
3
4
5
由晶体结构图可知,[C(NH2)3]+中的
—NH2的H与[B(OCH3)4]-中的O形成
氢键,因此,该晶体中存在N—H…O
氢键,A正确;
同一周期元素原子的第一电离能从左到右呈递增趋势,但是第ⅡA、ⅤA族元素的原子结构比较稳定,其第一电离能高于同周期的相邻元素的原子,因此,基态原子的第一电离能从小到大的顺序为C
2
3
4
5
B、C、O、N的未成对电子数分别为1、
2、2、3,因此,基态原子未成对电子
数:B
N原子轨道杂化类型为sp2;[B(OCH3)4]-中B与4个O形成了4个σ键,B没有孤电子对,则B的原子轨道杂化类型为sp3;[B(OCH3)4]-中O分别与B和C形成了2个σ键,O原子还有2个孤电子对,则O的原子轨道的杂化类型均为sp3;综上所述,晶体中B、О和N原子轨道的杂化类型不相同,D不正确。
1
2
3
4
5
2.(2023·北京,1)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说
法正确的是
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
√
1
2
3
4
5
金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;
金刚石为共价晶体,石墨为混合
型晶体,石墨炔为分子晶体,C
项错误;
金刚石不能导电,D项错误。
1
2
3
4
5
3.(2023·湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
√
K+位于晶胞顶角,Ca2+位于体心,则晶体中与K+最近且距离相等的Ca2+有8个,B正确;
根据晶胞结构可知,晶胞中B和C原子构成的多面体有14个面,C错误;
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
4.(2023·山东,5)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是
A.与石墨相比,(CF)x导电性增强
B.与石墨相比,(CF)x抗氧化性增强
C.(CF)x中C—C的键长比C—F短
D.1 mol (CF)x中含有2x mol共价单键
√
1
2
3
4
5
石墨晶体中每个碳原子上未参与杂化的1个2p
轨道上电子在层内离域运动,故石墨晶体能
导电,而(CF)x中没有未参与杂化的2p轨道上
的电子,故与石墨相比,(CF)x导电性减弱,
A错误;
石墨层间插入F后形成的C—F键长短,键能极大,分子结构稳定性增强,抗氧化性增强,B正确;
1
2
3
4
5
已知C的原子半径比F的大,故可知(CF)x中
C—C的键长比C—F的长,C错误;
由题干结构示意图可知,在(CF)x中每个C与
周围的3个碳原子、1个F原子形成共价键,
每个C—C被2个碳原子共用,即1 mol (CF)x中含有2.5x mol共价单键,D错误。
1
2
3
4
5
5.(2022·湖北,9)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是
A.Ca2+的配位数为6
B.与F-距离最近的是K+
C.该物质的化学式为KCaF3
D.若F-换为Cl-,则晶胞棱长将改变
√
1
2
3
4
5
Ca2+的配位数为与其距离最近且等距离的F-的个数,如图所示,Ca2+位于体心,F-位于面心,所以Ca2+的配位数为6,A正确;
F-与Cl-半径不同,替换后晶胞棱长将改变,D正确。
考向预测
03
1
2
3
4
5
6
1.根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示,下列有关氮化碳的说法不正确的是
A.氮化碳属于共价晶体
B.氮化碳的化学式为C3N4
C.该晶体的熔点比金刚石的熔点低
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
√
1
2
3
4
5
6
根据晶体硬度超过金刚石,具有网状结构这些特点确定该物质为共价晶体,A项正确;
该晶体与金刚石晶体均为共价晶体,r(N)
2
3
4
5
6
2.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是
√
1
2
3
4
5
6
1
2
3
4
5
6
3.砷化镓(GaAs)作为第二代半导体材料的代表,是目前研究最成熟、生产量最大的半导体材料。GaAs晶胞结构如图所示,晶胞边长为a pm,下列说法正确的是
A.GaAs属于离子晶体
B.基态砷原子价层电子轨道表示式为
C.As的配位数为4
√
1
2
3
4
5
6
由GaAs晶胞结构图可知,该晶胞含有Ga原子和As
原子,微粒间的作用力是共价键,属于共价晶体,
A错误;
基态砷原子价层电子轨道表示式为 ,B错误;
与砷原子距离最近的镓原子的个数为4,则As的配位数为4,C正确;
1
2
3
4
5
6
4.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是
A.Z表示的微粒为H2
B.每个X周围最近且等距离的X有6个
C.若A的原子分数坐标为(0,0.5,0.5),B的原子分数
坐标为(0.75,0.75,0),则C的原子分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
√
1
2
3
4
5
6
从图中可以看出,每个X周围最近且等距离的X在顶角,数目为6,B正确;
若A的原子分数坐标为(0,0.5,0.5),B的原子分数坐标为(0.75,0.75,0),则坐标原点为底面左下角的X,晶胞参数为1,所以C的原子分数坐标为(1,0.5,1),C正确;
1
2
3
4
5
6
1
2
3
4
5
6
5.几种常见的晶胞或结构(CaF2、NH4Cl、AlCl3)如图,下列说法错误的是
A.图1所示晶胞中阳、阴离子的配位数分别为8和4
B.熔点:图2所示物质<图1所示物质
C.图3所示晶胞中与体心原子等距离且最近的顶点原子有8个
D.NH4Cl可与H-反应生成NH4H,NH4Cl和NH4H均是共价化合物
√
1
2
3
4
5
6
由题意判断图1为CaF2的晶胞,图2为AlCl3的结构,图3为NH4Cl的晶胞。图1中顶角和面心是Ca2+,体内较大的小球表示F-,距离Ca2+最近且等距离的F-有8个,则Ca2+的配位数为8,距离F-最近且等距离的Ca2+有4个,则F-的配位数为4,故A正确;
1
2
3
4
5
6
图1为CaF2的晶胞,CaF2是离子化合物,图2为AlCl3的结构,AlCl3是共价化合物,离子化合物的熔点一般高于共价化合物,则CaF2的熔点高于AlCl3,故B正确;
由图3可看出,与体心原子等距离且最近的顶点原子有8个,故C正确;
NH4H、NH4Cl均为离子化合物,故D错误。
1
2
3
4
5
6
6.有关晶体的结构如图所示,下列说法不正确的是
A.在NaCl晶体(图甲)中,距Na+最近的Cl-
围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或
FE
C.在CO2晶体(图丙)中,一个CO2分子周围
有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非
极性键和范德华力
√
1
2
3
4
5
6
在NaCl晶体中,距Na+最近的Cl-有6个,分别位于Na+的上、下、左、右、前、后,围成正八面体,A正确;
乙是一个分子,不是晶胞,所以分子式为E4F4或F4E4,B错误;
碘晶体中,有碘分子内部的碘原子间的非极性共价键,还有碘分子间的范德华力,D正确。
本课结束
同课章节目录
