专题二 物质结构与性质 主观题突破 1.原子(或离子)核外电子排布及规范解答(共36张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题二 物质结构与性质 主观题突破 1.原子(或离子)核外电子排布及规范解答(共36张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:35:39 | ||
图片预览









文档简介
(共36张PPT)
1.原子(或离子)核外电子排布及规范解答
主观题突破
核心精讲
01
1.排布规律
(1)能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,如Ge:1s22s22p63s23p63d104s24p2。
(2)泡利原理:每个原子轨道上最多只能容纳2个自旋相反的电子。
(3)洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
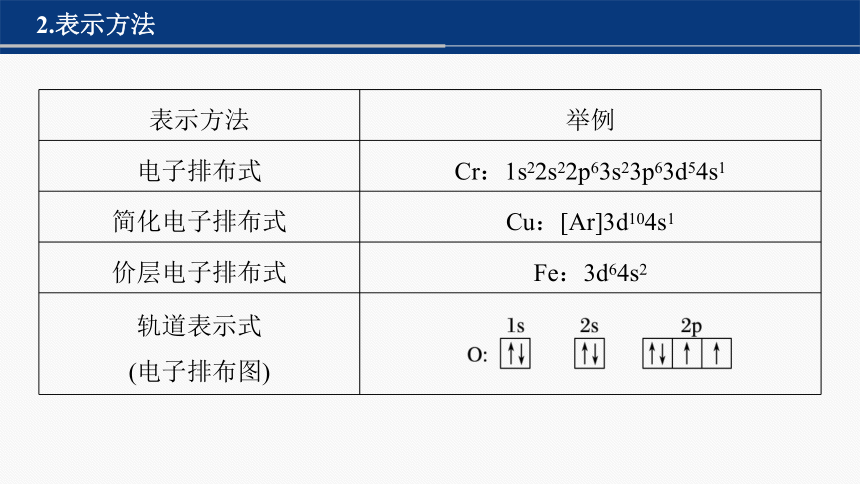
2.表示方法
表示方法 举例
电子排布式 Cr:1s22s22p63s23p63d54s1
简化电子排布式 Cu:[Ar]3d104s1
价层电子排布式 Fe:3d64s2
轨道表示式 (电子排布图)
3.特殊原子的核外电子排布式
(1)Cr的核外电子排布
先按能量从低到高排列:1s22s22p63s23p64s23d4,因3d5为半充满状态,比较稳定,故需要将4s轨道的一个电子调整到3d轨道,得到1s22s22p63s23p64s13d5,再将同一能层的排到一起,得到该原子的电子排布式:1s22s22p63s23p63d54s1。
(2)Cu的核外电子排布
先按能量从低到高排列:1s22s22p63s23p64s23d9,因3d10为全充满状态,比较稳定,故需要将4s轨道的一个电子调整到3d轨道,得到1s22s22p63s23p64s13d10,再将同一能层的排到一起,得到该原子的电子排布式:1s22s22p63s23p63d104s1。
注意元素原子电子排布式、简化电子排布式、价电子排布式的区别与联系。如Ga的电子排布式:1s22s22p63s23p63d104s24p1;简化电子排布式:[Ar]3d104s24p1;价层电子排布式:4s24p1。
4.原子核外电子排布的周期性
随着原子序数的增加,主族元素原子的最外层电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的最外层电子排布重复出现从
到 的周期性变化(第一周期除外)。
ns1
ns2np6
应用示例
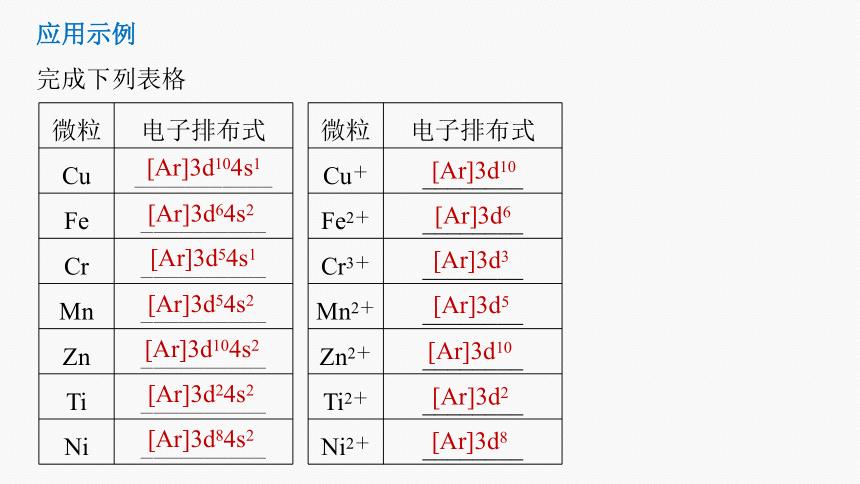
完成下列表格
微粒 电子排布式
Cu ___________
Fe __________
Cr __________
Mn __________
Zn __________
Ti __________
Ni __________
微粒 电子排布式
Cu+ ________
Fe2+ ________
Cr3+ ________
Mn2+ ________
Zn2+ ________
Ti2+ ________
Ni2+ ________
[Ar]3d104s1
[Ar]3d64s2
[Ar]3d54s1
[Ar]3d54s2
[Ar]3d104s2
[Ar]3d24s2
[Ar]3d84s2
[Ar]3d10
[Ar]3d6
[Ar]3d3
[Ar]3d5
[Ar]3d10
[Ar]3d2
[Ar]3d8
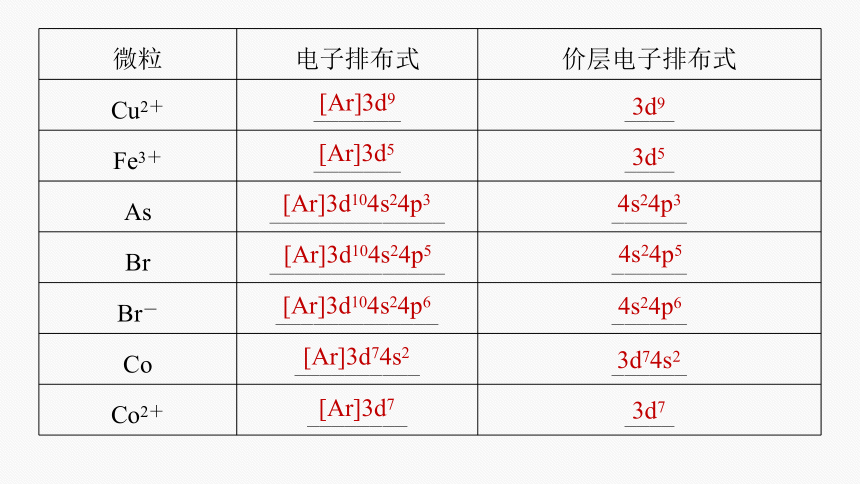
微粒 电子排布式 价层电子排布式
Cu2+ _______ ____
Fe3+ _______ ____
As ______________ ______
Br ______________ ______
Br- _____________ ______
Co __________ ______
Co2+ ________ ____
[Ar]3d9
3d9
[Ar]3d5
3d5
[Ar]3d104s24p3
4s24p3
[Ar]3d104s24p5
4s24p5
[Ar]3d104s24p6
4s24p6
[Ar]3d74s2
3d74s2
[Ar]3d7
3d7
真题演练
02
1
2
3
4
5
1.[2021·全国乙卷,35(1)]对于基态Cr原子,下列叙述正确的是______ (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
AC
6
7
8
9
10
1
2
3
4
5
2.[2021·广东,20(1)]基态硫原子的价电子排布式为__________。
3s23p4
6
7
8
9
10
1
2
3
4
5
3.[2021·全国甲卷,35(1)节选]Si的价电子层的电子排布式为_________。
3s23p2
6
7
8
9
10
1
2
3
4
5
4.[2021·湖南,18(1)]基态硅原子最外层的电子排布图为______________。
6
7
8
9
10
1
2
3
4
5
5.[2021·山东,16(1)]基态F原子核外电子的运动状态有________种。
9
基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种。
6
7
8
9
10
1
2
3
4
5
6.[2021·河北,17(1)(2)]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__________(填离子符号)。
K+和P3-
KH2PO4的四种组成元素各自所能形成的简单离子分别为H+(或H-)、O2-、K+和P3-,其中核外电子排布相同的是K+和P3-。
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
1
2
3
4
7.[2019·全国卷Ⅰ,35(1)]下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。
A.[Ne] B.[Ne]
C.[Ne] D.[Ne]
A
5
6
7
8
9
10
1
2
3
4
由题给信息知,A项和D项代表Mg+,B项和C项代表Mg。A项,Mg+再失去一个电子较难,即第二电离能大于第一电离能,所以电离最外层一个电子所需能量A大于B;
3p能级的能量高于3s,3p能级上电子较3s上易失去,故电离最外层一个电子所需能量:A>C、A>D,选A。
5
6
7
8
9
10
1
2
3
4
8.[2019·全国卷Ⅱ,35(2)(3)](2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
4s
4f5
Fe的价层电子排布式为3d64s2,其阳离子Fe2+、Fe3+的价层电子排布式分别是3d6、3d5,二者均首先失去4s轨道上的电子;
Sm失去3个电子成为Sm3+时,首先失去6s轨道上的电子,然后再失去1个4f轨道上的电子,故Sm3+的价层电子排布式为4f5。
5
6
7
8
9
10
1
2
3
4
(3)比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。
小于
F-与O2-核外电子层结构相同,核电荷数越大,原子核对核外电子的吸引力越大,离子半径越小,故离子半径:F-5
6
7
8
9
10
1
2
3
4
9.[2018·全国卷Ⅰ,35(1)(2)](1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
A. B.
C. D.
D
C
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是__________________。
Li+核电荷数较大
5
6
7
8
9
10
1
2
3
4
10.[2018·全国卷Ⅱ,35(1)]基态Fe原子价层电子的电子排布图(轨道表达
式)为__________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
哑铃
5
6
7
8
9
10
考向预测
03
1
2
3
4
5
6
7
1.基态Ga原子的价层电子排布式为________。
4s24p1
8
9
10
1
2
3
4
5
6
7
2.基态硫原子核外电子的空间运动状态有______种。
9
8
9
10
1
2
3
4
5
6
7
3.基态Mn原子的价层电子轨道表示式为_______________________。
8
9
10
1
2
3
4
5
6
7
4.钨元素位于第六周期第ⅥB族,价层电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式:________。
5d46s2
钨元素位于周期表的第六周期第ⅥB族,价层电子排布在5d、6s能级,与Cr位于同一副族,但排布方式与Cr有所不同,Cr的价层电子排布式为3d54s1,而钨的价层电子排布式为5d46s2。
8
9
10
1
2
3
4
5
6
7
5.某些过渡金属(如钛、铜)及其化合物,以其高导电性和丰富的物理化学性质在材料领域大放异彩。
(1)钛比钢轻、比铝硬。基态钛原子的价层电子排布式为________,钛原子核外电子占据的轨道数为_______。
3d24s2
12
Ti是22号元素,基态Ti原子的价层电子排布式为3d24s2;基态Ti原子的核外电子排布为1s22s22p63s23p63d24s2,电子占据12个轨道。
8
9
10
1
2
3
4
5
6
7
(2)铜的下列状态中,失去最外层一个电子所需能量最小的是_______(填字母)。
A.[Ar]3d104p1 B.[Ar]3d10
C.[Ar]3d94s1 D.[Ar]3d104s1
A
A为激发态铜原子,B为失去一个电子的+1价铜离子,C为失去一个电子且是激发态的+1价铜离子,D为基态铜原子,则失去最外层一个电子所需能量最小的是A。
8
9
10
1
2
3
4
5
6
7
6.与Fe最外层电子数相同且同周期的过渡元素有_____种。
7
Fe为26号元素,电子排布式为1s22s22p63s23p63d64s2,最外层电子数为2,与Fe最外层电子数相同且同周期的过渡元素有Sc、Ti、V、Mn、Co、Ni、Zn,共7种。
8
9
10
1
2
3
4
5
6
7
7.从原子结构角度分析Fe2+和Fe3+稳定性的相对强弱:_______________
_________________________________________________________________________。
Fe2+:[Ar]3d6,
Fe3+:[Ar]3d5,Fe3+的3d能级电子为半充满的稳定结构,故稳定性:Fe3+>Fe2+
8
9
10
1
2
3
4
5
6
7
8.检验K元素的方法是焰色试验,请用原子结构的知识解释产生此现象的原因:______________________________________________________
_____________________________________________________________________________________________。
当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量
8
9
10
1
2
3
4
5
6
9.下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是_______(填字母)。
A.1s22s22p43s1 B.1s22s22p43d2
C.1s22s22p5 D.1s22s22p6
AB
氟为9号元素,基态原子核外电子排布为1s22s22p5;
若处于激发态的电子跃迁到较低轨道会得到发射光谱,根据构造原理1s22s22p43s1、1s22s22p43d2中有电子处于激发态,故用光谱仪可捕捉到发射光谱的是1s22s22p43s1、1s22s22p43d2。
7
8
9
10
1
2
3
4
5
6
10.基态铬原子的价层电子排布式为________,属于周期表的_____区。同周期的基态原子中,与Cr最高能层电子数相同的还有__________(写元素符号)。
3d54s1
d
K和Cu
7
8
9
10
本课结束
1.原子(或离子)核外电子排布及规范解答
主观题突破
核心精讲
01
1.排布规律
(1)能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,如Ge:1s22s22p63s23p63d104s24p2。
(2)泡利原理:每个原子轨道上最多只能容纳2个自旋相反的电子。
(3)洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
2.表示方法
表示方法 举例
电子排布式 Cr:1s22s22p63s23p63d54s1
简化电子排布式 Cu:[Ar]3d104s1
价层电子排布式 Fe:3d64s2
轨道表示式 (电子排布图)
3.特殊原子的核外电子排布式
(1)Cr的核外电子排布
先按能量从低到高排列:1s22s22p63s23p64s23d4,因3d5为半充满状态,比较稳定,故需要将4s轨道的一个电子调整到3d轨道,得到1s22s22p63s23p64s13d5,再将同一能层的排到一起,得到该原子的电子排布式:1s22s22p63s23p63d54s1。
(2)Cu的核外电子排布
先按能量从低到高排列:1s22s22p63s23p64s23d9,因3d10为全充满状态,比较稳定,故需要将4s轨道的一个电子调整到3d轨道,得到1s22s22p63s23p64s13d10,再将同一能层的排到一起,得到该原子的电子排布式:1s22s22p63s23p63d104s1。
注意元素原子电子排布式、简化电子排布式、价电子排布式的区别与联系。如Ga的电子排布式:1s22s22p63s23p63d104s24p1;简化电子排布式:[Ar]3d104s24p1;价层电子排布式:4s24p1。
4.原子核外电子排布的周期性
随着原子序数的增加,主族元素原子的最外层电子排布呈现周期性的变化:每隔一定数目的元素,主族元素原子的最外层电子排布重复出现从
到 的周期性变化(第一周期除外)。
ns1
ns2np6
应用示例
完成下列表格
微粒 电子排布式
Cu ___________
Fe __________
Cr __________
Mn __________
Zn __________
Ti __________
Ni __________
微粒 电子排布式
Cu+ ________
Fe2+ ________
Cr3+ ________
Mn2+ ________
Zn2+ ________
Ti2+ ________
Ni2+ ________
[Ar]3d104s1
[Ar]3d64s2
[Ar]3d54s1
[Ar]3d54s2
[Ar]3d104s2
[Ar]3d24s2
[Ar]3d84s2
[Ar]3d10
[Ar]3d6
[Ar]3d3
[Ar]3d5
[Ar]3d10
[Ar]3d2
[Ar]3d8
微粒 电子排布式 价层电子排布式
Cu2+ _______ ____
Fe3+ _______ ____
As ______________ ______
Br ______________ ______
Br- _____________ ______
Co __________ ______
Co2+ ________ ____
[Ar]3d9
3d9
[Ar]3d5
3d5
[Ar]3d104s24p3
4s24p3
[Ar]3d104s24p5
4s24p5
[Ar]3d104s24p6
4s24p6
[Ar]3d74s2
3d74s2
[Ar]3d7
3d7
真题演练
02
1
2
3
4
5
1.[2021·全国乙卷,35(1)]对于基态Cr原子,下列叙述正确的是______ (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
AC
6
7
8
9
10
1
2
3
4
5
2.[2021·广东,20(1)]基态硫原子的价电子排布式为__________。
3s23p4
6
7
8
9
10
1
2
3
4
5
3.[2021·全国甲卷,35(1)节选]Si的价电子层的电子排布式为_________。
3s23p2
6
7
8
9
10
1
2
3
4
5
4.[2021·湖南,18(1)]基态硅原子最外层的电子排布图为______________。
6
7
8
9
10
1
2
3
4
5
5.[2021·山东,16(1)]基态F原子核外电子的运动状态有________种。
9
基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种。
6
7
8
9
10
1
2
3
4
5
6.[2021·河北,17(1)(2)]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__________(填离子符号)。
K+和P3-
KH2PO4的四种组成元素各自所能形成的简单离子分别为H+(或H-)、O2-、K+和P3-,其中核外电子排布相同的是K+和P3-。
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
1
2
3
4
7.[2019·全国卷Ⅰ,35(1)]下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。
A.[Ne] B.[Ne]
C.[Ne] D.[Ne]
A
5
6
7
8
9
10
1
2
3
4
由题给信息知,A项和D项代表Mg+,B项和C项代表Mg。A项,Mg+再失去一个电子较难,即第二电离能大于第一电离能,所以电离最外层一个电子所需能量A大于B;
3p能级的能量高于3s,3p能级上电子较3s上易失去,故电离最外层一个电子所需能量:A>C、A>D,选A。
5
6
7
8
9
10
1
2
3
4
8.[2019·全国卷Ⅱ,35(2)(3)](2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为________。
4s
4f5
Fe的价层电子排布式为3d64s2,其阳离子Fe2+、Fe3+的价层电子排布式分别是3d6、3d5,二者均首先失去4s轨道上的电子;
Sm失去3个电子成为Sm3+时,首先失去6s轨道上的电子,然后再失去1个4f轨道上的电子,故Sm3+的价层电子排布式为4f5。
5
6
7
8
9
10
1
2
3
4
(3)比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。
小于
F-与O2-核外电子层结构相同,核电荷数越大,原子核对核外电子的吸引力越大,离子半径越小,故离子半径:F-
6
7
8
9
10
1
2
3
4
9.[2018·全国卷Ⅰ,35(1)(2)](1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
A. B.
C. D.
D
C
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是__________________。
Li+核电荷数较大
5
6
7
8
9
10
1
2
3
4
10.[2018·全国卷Ⅱ,35(1)]基态Fe原子价层电子的电子排布图(轨道表达
式)为__________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
哑铃
5
6
7
8
9
10
考向预测
03
1
2
3
4
5
6
7
1.基态Ga原子的价层电子排布式为________。
4s24p1
8
9
10
1
2
3
4
5
6
7
2.基态硫原子核外电子的空间运动状态有______种。
9
8
9
10
1
2
3
4
5
6
7
3.基态Mn原子的价层电子轨道表示式为_______________________。
8
9
10
1
2
3
4
5
6
7
4.钨元素位于第六周期第ⅥB族,价层电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式:________。
5d46s2
钨元素位于周期表的第六周期第ⅥB族,价层电子排布在5d、6s能级,与Cr位于同一副族,但排布方式与Cr有所不同,Cr的价层电子排布式为3d54s1,而钨的价层电子排布式为5d46s2。
8
9
10
1
2
3
4
5
6
7
5.某些过渡金属(如钛、铜)及其化合物,以其高导电性和丰富的物理化学性质在材料领域大放异彩。
(1)钛比钢轻、比铝硬。基态钛原子的价层电子排布式为________,钛原子核外电子占据的轨道数为_______。
3d24s2
12
Ti是22号元素,基态Ti原子的价层电子排布式为3d24s2;基态Ti原子的核外电子排布为1s22s22p63s23p63d24s2,电子占据12个轨道。
8
9
10
1
2
3
4
5
6
7
(2)铜的下列状态中,失去最外层一个电子所需能量最小的是_______(填字母)。
A.[Ar]3d104p1 B.[Ar]3d10
C.[Ar]3d94s1 D.[Ar]3d104s1
A
A为激发态铜原子,B为失去一个电子的+1价铜离子,C为失去一个电子且是激发态的+1价铜离子,D为基态铜原子,则失去最外层一个电子所需能量最小的是A。
8
9
10
1
2
3
4
5
6
7
6.与Fe最外层电子数相同且同周期的过渡元素有_____种。
7
Fe为26号元素,电子排布式为1s22s22p63s23p63d64s2,最外层电子数为2,与Fe最外层电子数相同且同周期的过渡元素有Sc、Ti、V、Mn、Co、Ni、Zn,共7种。
8
9
10
1
2
3
4
5
6
7
7.从原子结构角度分析Fe2+和Fe3+稳定性的相对强弱:_______________
_________________________________________________________________________。
Fe2+:[Ar]3d6,
Fe3+:[Ar]3d5,Fe3+的3d能级电子为半充满的稳定结构,故稳定性:Fe3+>Fe2+
8
9
10
1
2
3
4
5
6
7
8.检验K元素的方法是焰色试验,请用原子结构的知识解释产生此现象的原因:______________________________________________________
_____________________________________________________________________________________________。
当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量
8
9
10
1
2
3
4
5
6
9.下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是_______(填字母)。
A.1s22s22p43s1 B.1s22s22p43d2
C.1s22s22p5 D.1s22s22p6
AB
氟为9号元素,基态原子核外电子排布为1s22s22p5;
若处于激发态的电子跃迁到较低轨道会得到发射光谱,根据构造原理1s22s22p43s1、1s22s22p43d2中有电子处于激发态,故用光谱仪可捕捉到发射光谱的是1s22s22p43s1、1s22s22p43d2。
7
8
9
10
1
2
3
4
5
6
10.基态铬原子的价层电子排布式为________,属于周期表的_____区。同周期的基态原子中,与Cr最高能层电子数相同的还有__________(写元素符号)。
3d54s1
d
K和Cu
7
8
9
10
本课结束
同课章节目录
