专题二 物质结构与性质 主观题突破 2.电离能、电负性、化学键、空间结构原因解释(共31张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题二 物质结构与性质 主观题突破 2.电离能、电负性、化学键、空间结构原因解释(共31张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:37:56 | ||
图片预览










文档简介
(共31张PPT)
2.电离能、电负性、化学键、空间结构原因解释
主观题突破
真题演练
01
1
2
3
4
1.[2021·山东,16(2)节选]O、F、Cl电负性由大到小的顺序为_________。
F>O>Cl
1
2
3
4
2.[2020·全国卷Ⅰ,35(1)(2)]Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_______。
4∶5
基态Fe2+的价层电子排布式为3d6,未成对电子数为4,基态Fe3+的价层电子排布式为3d5,未成对电子数为5,所以两者之比为4∶5。
1
2
3
4
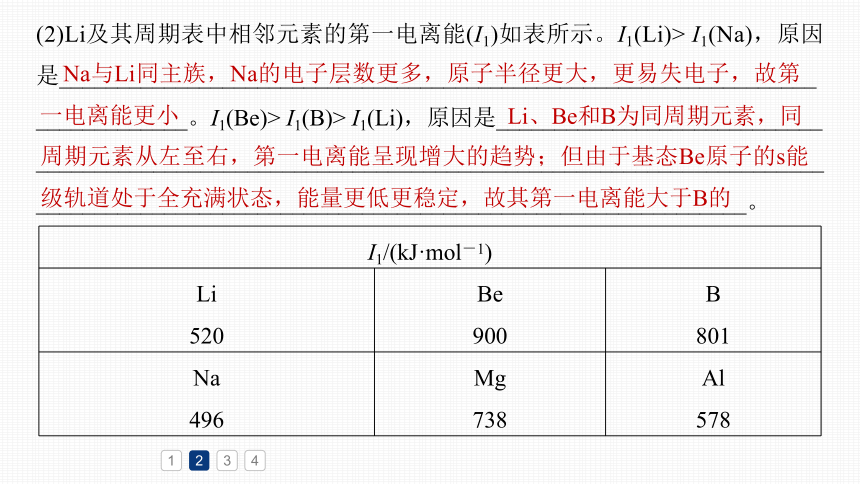
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________________________________________________________________
_____________。I1(Be)> I1(B)> I1(Li),原因是____________________________
________________________________________________________________________________________________________________________________。
Na与Li同主族,Na的电子层数更多,原子半径更大,更易失电子,故第一电离能更小
I1/(kJ·mol-1) Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
Li、Be和B为同周期元素,同
周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的
1
2
3
4
3.[2020·全国卷Ⅱ,35(3)]钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是
____________;金属离子与氧离子间的作用力为_______,
Ca2+的配位数是_____。
O>Ti>Ca
离子键
12
三种元素中O的电负性最大,Ca的电负性最小,因此三种元素电负性的大小顺序为O>Ti>Ca。氧离子与金属离子之间形成的是离子键。由图可知,每个Ca2+周围与之等距离的O2-的个数为12,即配位数为12。
1
2
3
4
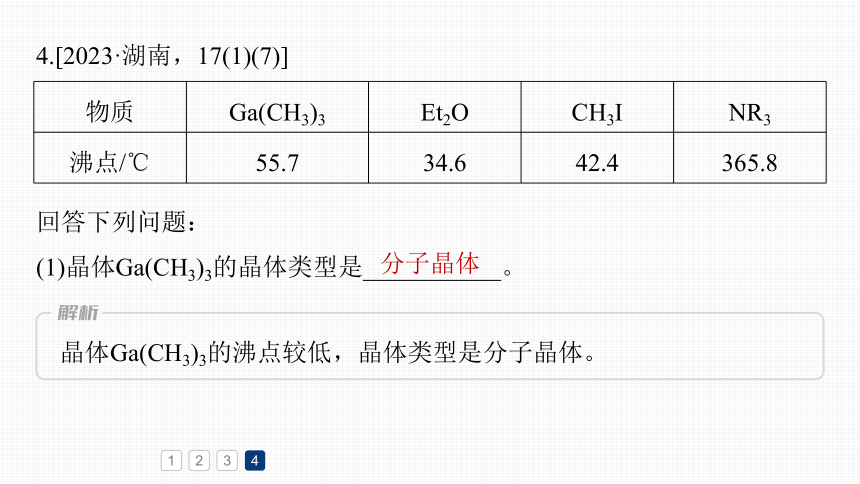
4.[2023·湖南,17(1)(7)]
回答下列问题:
(1)晶体Ga(CH3)3的晶体类型是___________。
分子晶体
晶体Ga(CH3)3的沸点较低,晶体类型是分子晶体。
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
1
2
3
4
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
(7)比较分子中的C—Ga—C键角大小:Ga(CH3)3_____Ga(CH3)3(Et2O)(填“>”“<”或“=”),其原因是_________________________________
____________________________________________________________________。
>
Ga(CH3)3中Ga为sp2杂化,而
Ga(CH3)3(Et2O)中Ga为sp3杂化,故Ga(CH3)3(Et2O)中C—Ga—C的键角较小
考向预测
02
1
2
3
4
5
6
7
1.比较O、C电负性大小,并从原子结构角度解释两元素电负性差异的原因是__________________________________________________________
___________________。
8
9
10
11
12
13
14
15
16
17
18
O原子的原子半径小于C原子的原子半径,对电子的吸引能力更
强,电负性:O>C
1
2
3
4
5
6
7
2.尿素[CO(NH2)2]分子中N、O元素的第一电离能:N>O,原因是______
____________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
N元素
的2p能级为半充满状态,是较稳定的结构,失去1个电子需要的能量更多
1
2
3
4
5
6
7
3.氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为______。
8
9
10
11
12
13
14
15
16
17
18
KF
1
2
3
4
5
6
7
4.Na+和Ne互为等电子体,电离能:I2(Na)>I1(Ne),原因是____________
______________________________________________________________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
Na+和Ne电
子排布结构相同,而Na+比Ne的核电荷数大,因此Na+原子核对核外电子的吸引力大于Ne原子核对核外电子的吸引力,所以Na+更难失去电子,电离能更大
1
2
3
4
5
6
7
5.已知电负性:H 2.1;C 2.5;F 4.0;P 2.1;I 2.5。
CH3I是一种甲基化试剂,CF3I可用作制冷剂,CH3I和CF3I发生水解时的主要反应分别是CH3I+H2O―→CH3OH+HI和CF3I+H2O―→CF3H+HIO。CF3I的水解产物是HIO,结合电负性解释原因:_____________________
_________________________________________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
因为电负性:F>I=C,
所以在CF3I中,受3个F原子吸引电子能力强的影响,I与C之间的共用电子对偏向于C,I显+1价,则CF3I发生水解时,生成CF3H和HIO
1
2
3
4
5
6
7
6.下表是两者的键能(单位:kJ·mol-1)数据:
8
9
10
11
12
13
14
15
16
17
18
结合数据说明CO比N2活泼的原因:_______________________________
________________________________________________________________________________________________________。
CO中第一个π键的键能是326.9 kJ·
mol-1,N2中第一个π键的键能是528 kJ·mol-1,所以CO的第一个π键比N2中第一个π键更容易断裂,所以CO比N2活泼
A-B A==B A≡B
CO 351 745 1 071.9
N2 139 418 946
1
2
3
4
5
6
7
7.两种三角锥形气态氢化物PH3和NH3的键角分别为93°6′和107°,试分析PH3的键角小于NH3的原因:__________________________________
_________________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
电负性:N>P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的排斥力增大,键角变大
1
2
3
4
5
6
7
8.NF3的键角______NH3的键角(填“>”“<”或“=”),理由是______________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
<
F的电负性比H大,NF3中N原子周围电子云的密度减小,成键电子对之间的排斥力较小,因而键角较小
1
2
3
4
5
6
9.H3O+中H—O—H的键角比H2O中H—O—H的键角大,原因是________
____________________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
H2O中
的氧原子有2个孤电子对,H3O+中的氧原子有1个孤电子对,排斥力较小
1
2
3
4
5
6
10.CH4、NH3、H2O的VSEPR模型都是_________,键角分别是________、______、______;分析它们键角差异的原因:______________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
四面体形
109°28′
107°
105°
CH4中键与键之间的排斥
力一样,是正四面体形,键角为109°28′;而其他两个分子均有未成键的孤电子对,孤电子对间的排斥力>孤电子对与σ键电子对间的排斥力>σ键电子对间的排斥力。由于孤电子对对成键电子的排斥作用,使得成键电子间夹角变小,H2O中有两个孤电子对,NH3中有一个孤电子对,故H2O中键角比NH3更小
1
2
3
4
5
6
11.H2S键角比H2Se大的原因:_____________________________________
____________________。
7
8
9
10
11
12
13
14
15
16
17
18
电负性:S>Se,共用电子对离S近,共用
电子对间的排斥力大
1
2
3
4
5
6
12. 的键角小于 的原因是__________________________________
______________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
13.顺铂有抗癌作用。机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl与DNA结合,破坏DNA的结构,阻止癌细胞增殖。如:
7
8
9
10
11
12
13
14
15
16
17
18
(1)鸟嘌呤与Pt(NH3)2(OH)Cl反应的产物中包含的化学键有_______(填字母)。
A氢键 B.离子键 C.共价键 D.配位键
BCD
1
2
3
4
5
6
根据题中产物结构可知化学键包括离子键、共价键和配位键,故选B、C、D。
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(2)在Pt(NH3)2Cl2,配体与铂(Ⅱ)的结合能力:Cl-______NH3(填“>”或“<”)。
<
与Cl相比,N给出孤电子对的能力更强。
1
2
3
4
5
6
14.Cu2O与NH3·H2O反应能形成较稳定的[Cu(NH3)2]+的原因是_________
_________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
NH3·H2O
中的N原子提供孤电子对,与Cu+形成配位键
1
2
3
4
5
6
15.Co3+在水中易被还原成 Co2+,而在氨水中可稳定存在,其原因为________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
Co3+可与 NH3形成较稳定的配合物
1
2
3
4
5
6
16.一种钴的配合物乙二胺四乙酸合钴的结构为 ,1 mol
该配合物形成的配位键有_____ mol,配位原子是________。
7
8
9
10
11
12
13
14
15
16
17
18
6
N、O
1
2
3
4
5
6
17.邻二氮菲( )中N原子可与Fe2+通过配位键形成橙红色邻二
氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因:______________________________
__________________________________________________________________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
当H+浓度较高时,邻二氮菲中的
N优先与H+形成配位键,导致与Fe2+配位的能力减弱;若OH-浓度较高时,OH-与Fe2+反应,也会影响与邻二氮菲配位
1
2
3
4
5
6
18.Cu2+能与NH3形成具有对称空间结构的[Cu(NH3)4]2+。
(1)[Cu(NH3)4]2+的H—N—H键角_____(填“>”“=”或“<”)NH3的H—N—H键角。
7
8
9
10
11
12
13
14
15
16
17
18
>
[Cu(NH3)4]2+中N原子无孤电子对,所以[Cu(NH3)4]2+中H—N—H键角>NH3中H—N—H键角。
1
2
3
4
5
6
(2)NF3与NH3具有相同的空间结构,但NF3不易与Cu2+形成配离子,理由是____________________________________________________________
_______________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
F的电负性比N大,N—F的成键电子偏向于F,导致NF3中N原子对其
孤电子对的吸引能力增强,难以形成配位键
本课结束
2.电离能、电负性、化学键、空间结构原因解释
主观题突破
真题演练
01
1
2
3
4
1.[2021·山东,16(2)节选]O、F、Cl电负性由大到小的顺序为_________。
F>O>Cl
1
2
3
4
2.[2020·全国卷Ⅰ,35(1)(2)]Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_______。
4∶5
基态Fe2+的价层电子排布式为3d6,未成对电子数为4,基态Fe3+的价层电子排布式为3d5,未成对电子数为5,所以两者之比为4∶5。
1
2
3
4
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________________________________________________________________
_____________。I1(Be)> I1(B)> I1(Li),原因是____________________________
________________________________________________________________________________________________________________________________。
Na与Li同主族,Na的电子层数更多,原子半径更大,更易失电子,故第一电离能更小
I1/(kJ·mol-1) Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
Li、Be和B为同周期元素,同
周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的
1
2
3
4
3.[2020·全国卷Ⅱ,35(3)]钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是
____________;金属离子与氧离子间的作用力为_______,
Ca2+的配位数是_____。
O>Ti>Ca
离子键
12
三种元素中O的电负性最大,Ca的电负性最小,因此三种元素电负性的大小顺序为O>Ti>Ca。氧离子与金属离子之间形成的是离子键。由图可知,每个Ca2+周围与之等距离的O2-的个数为12,即配位数为12。
1
2
3
4
4.[2023·湖南,17(1)(7)]
回答下列问题:
(1)晶体Ga(CH3)3的晶体类型是___________。
分子晶体
晶体Ga(CH3)3的沸点较低,晶体类型是分子晶体。
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
1
2
3
4
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
(7)比较分子中的C—Ga—C键角大小:Ga(CH3)3_____Ga(CH3)3(Et2O)(填“>”“<”或“=”),其原因是_________________________________
____________________________________________________________________。
>
Ga(CH3)3中Ga为sp2杂化,而
Ga(CH3)3(Et2O)中Ga为sp3杂化,故Ga(CH3)3(Et2O)中C—Ga—C的键角较小
考向预测
02
1
2
3
4
5
6
7
1.比较O、C电负性大小,并从原子结构角度解释两元素电负性差异的原因是__________________________________________________________
___________________。
8
9
10
11
12
13
14
15
16
17
18
O原子的原子半径小于C原子的原子半径,对电子的吸引能力更
强,电负性:O>C
1
2
3
4
5
6
7
2.尿素[CO(NH2)2]分子中N、O元素的第一电离能:N>O,原因是______
____________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
N元素
的2p能级为半充满状态,是较稳定的结构,失去1个电子需要的能量更多
1
2
3
4
5
6
7
3.氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为______。
8
9
10
11
12
13
14
15
16
17
18
KF
1
2
3
4
5
6
7
4.Na+和Ne互为等电子体,电离能:I2(Na)>I1(Ne),原因是____________
______________________________________________________________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
Na+和Ne电
子排布结构相同,而Na+比Ne的核电荷数大,因此Na+原子核对核外电子的吸引力大于Ne原子核对核外电子的吸引力,所以Na+更难失去电子,电离能更大
1
2
3
4
5
6
7
5.已知电负性:H 2.1;C 2.5;F 4.0;P 2.1;I 2.5。
CH3I是一种甲基化试剂,CF3I可用作制冷剂,CH3I和CF3I发生水解时的主要反应分别是CH3I+H2O―→CH3OH+HI和CF3I+H2O―→CF3H+HIO。CF3I的水解产物是HIO,结合电负性解释原因:_____________________
_________________________________________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
因为电负性:F>I=C,
所以在CF3I中,受3个F原子吸引电子能力强的影响,I与C之间的共用电子对偏向于C,I显+1价,则CF3I发生水解时,生成CF3H和HIO
1
2
3
4
5
6
7
6.下表是两者的键能(单位:kJ·mol-1)数据:
8
9
10
11
12
13
14
15
16
17
18
结合数据说明CO比N2活泼的原因:_______________________________
________________________________________________________________________________________________________。
CO中第一个π键的键能是326.9 kJ·
mol-1,N2中第一个π键的键能是528 kJ·mol-1,所以CO的第一个π键比N2中第一个π键更容易断裂,所以CO比N2活泼
A-B A==B A≡B
CO 351 745 1 071.9
N2 139 418 946
1
2
3
4
5
6
7
7.两种三角锥形气态氢化物PH3和NH3的键角分别为93°6′和107°,试分析PH3的键角小于NH3的原因:__________________________________
_________________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
电负性:N>P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的排斥力增大,键角变大
1
2
3
4
5
6
7
8.NF3的键角______NH3的键角(填“>”“<”或“=”),理由是______________________________________________________________________________________________。
8
9
10
11
12
13
14
15
16
17
18
<
F的电负性比H大,NF3中N原子周围电子云的密度减小,成键电子对之间的排斥力较小,因而键角较小
1
2
3
4
5
6
9.H3O+中H—O—H的键角比H2O中H—O—H的键角大,原因是________
____________________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
H2O中
的氧原子有2个孤电子对,H3O+中的氧原子有1个孤电子对,排斥力较小
1
2
3
4
5
6
10.CH4、NH3、H2O的VSEPR模型都是_________,键角分别是________、______、______;分析它们键角差异的原因:______________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
四面体形
109°28′
107°
105°
CH4中键与键之间的排斥
力一样,是正四面体形,键角为109°28′;而其他两个分子均有未成键的孤电子对,孤电子对间的排斥力>孤电子对与σ键电子对间的排斥力>σ键电子对间的排斥力。由于孤电子对对成键电子的排斥作用,使得成键电子间夹角变小,H2O中有两个孤电子对,NH3中有一个孤电子对,故H2O中键角比NH3更小
1
2
3
4
5
6
11.H2S键角比H2Se大的原因:_____________________________________
____________________。
7
8
9
10
11
12
13
14
15
16
17
18
电负性:S>Se,共用电子对离S近,共用
电子对间的排斥力大
1
2
3
4
5
6
12. 的键角小于 的原因是__________________________________
______________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
13.顺铂有抗癌作用。机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl与DNA结合,破坏DNA的结构,阻止癌细胞增殖。如:
7
8
9
10
11
12
13
14
15
16
17
18
(1)鸟嘌呤与Pt(NH3)2(OH)Cl反应的产物中包含的化学键有_______(填字母)。
A氢键 B.离子键 C.共价键 D.配位键
BCD
1
2
3
4
5
6
根据题中产物结构可知化学键包括离子键、共价键和配位键,故选B、C、D。
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(2)在Pt(NH3)2Cl2,配体与铂(Ⅱ)的结合能力:Cl-______NH3(填“>”或“<”)。
<
与Cl相比,N给出孤电子对的能力更强。
1
2
3
4
5
6
14.Cu2O与NH3·H2O反应能形成较稳定的[Cu(NH3)2]+的原因是_________
_________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
NH3·H2O
中的N原子提供孤电子对,与Cu+形成配位键
1
2
3
4
5
6
15.Co3+在水中易被还原成 Co2+,而在氨水中可稳定存在,其原因为________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
Co3+可与 NH3形成较稳定的配合物
1
2
3
4
5
6
16.一种钴的配合物乙二胺四乙酸合钴的结构为 ,1 mol
该配合物形成的配位键有_____ mol,配位原子是________。
7
8
9
10
11
12
13
14
15
16
17
18
6
N、O
1
2
3
4
5
6
17.邻二氮菲( )中N原子可与Fe2+通过配位键形成橙红色邻二
氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因:______________________________
__________________________________________________________________________________________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
当H+浓度较高时,邻二氮菲中的
N优先与H+形成配位键,导致与Fe2+配位的能力减弱;若OH-浓度较高时,OH-与Fe2+反应,也会影响与邻二氮菲配位
1
2
3
4
5
6
18.Cu2+能与NH3形成具有对称空间结构的[Cu(NH3)4]2+。
(1)[Cu(NH3)4]2+的H—N—H键角_____(填“>”“=”或“<”)NH3的H—N—H键角。
7
8
9
10
11
12
13
14
15
16
17
18
>
[Cu(NH3)4]2+中N原子无孤电子对,所以[Cu(NH3)4]2+中H—N—H键角>NH3中H—N—H键角。
1
2
3
4
5
6
(2)NF3与NH3具有相同的空间结构,但NF3不易与Cu2+形成配离子,理由是____________________________________________________________
_______________________________________。
7
8
9
10
11
12
13
14
15
16
17
18
F的电负性比N大,N—F的成键电子偏向于F,导致NF3中N原子对其
孤电子对的吸引能力增强,难以形成配位键
本课结束
同课章节目录
