专题二 物质结构与性质 主观题突破 4.晶体类型与微粒间作用力原因解释(共30张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题二 物质结构与性质 主观题突破 4.晶体类型与微粒间作用力原因解释(共30张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:42:12 | ||
图片预览











文档简介
(共30张PPT)
4.晶体类型与微粒间作用力原因解释
主观题突破
核心精讲
01
1.不同晶体的特点比较
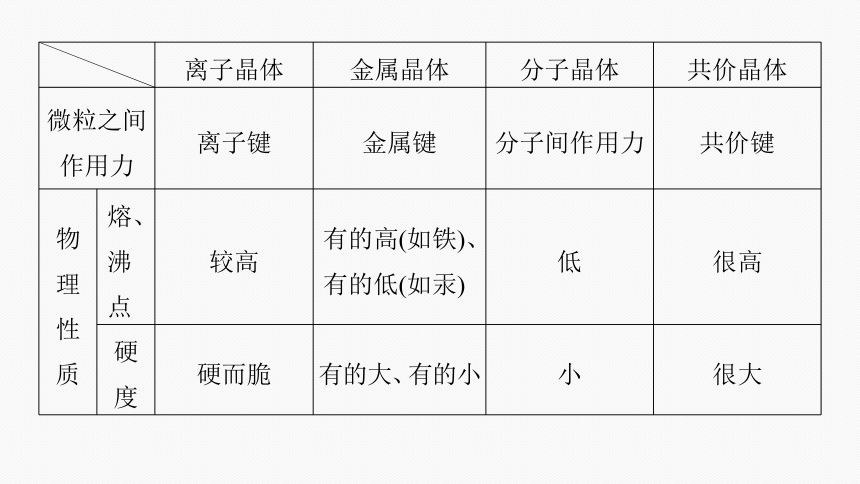
离子晶体 金属晶体 分子晶体 共价晶体
概念 阳离子和阴离子通过离子键结合而形成的晶体 通过金属离子与自由电子之间的较强作用形成的晶体 分子间以分子间作用力相结合的晶体 相邻原子间以共价键相结合而形成空间网状结构的晶体
晶体微粒 阴、阳离子 金属阳离子、自由电子 分子 原子
离子晶体 金属晶体 分子晶体 共价晶体
微粒之间 作用力 离子键 金属键 分子间作用力 共价键
物 理 性 质 熔、 沸点 较高 有的高(如铁)、有的低(如汞) 低 很高
硬度 硬而脆 有的大、有的小 小 很大
离子晶体 金属晶体 分子晶体 共价晶体
物 理 性 质 溶解性 一般情况下,易溶于极性溶剂(如水),难溶于有机溶剂 钠等可与水、醇类、酸类反应 极性分子易溶于极性溶剂;非极性分子易溶于非极性溶剂 不溶于任何溶剂
2.晶体类别的判断方法
(1)依据构成晶体的微粒和微粒间作用力判断
由阴、阳离子形成的离子键构成的晶体为离子晶体;由原子形成的共价键构成的晶体为共价晶体;由分子依靠分子间作用力形成的晶体为分子晶体;由金属阳离子、自由电子以金属键构成的晶体为金属晶体。
(2)依据物质的分类判断
①活泼金属氧化物和过氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)、绝大多数的盐是离子晶体。
②部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体是分子晶体。
③常见的单质类共价晶体有金刚石、晶体硅、晶体硼等,常见的化合物类共价晶体有SiC、SiO2、AlN、BP、GaAs等。
④金属单质、合金是金属晶体。
(3)依据晶体的熔点判断
不同类型晶体熔点大小的一般规律:共价晶体>离子晶体>分子晶体。金属晶体的熔点差别很大,如钨、铂等熔点很高,铯等熔点很低。
(4)依据导电性判断
①离子晶体溶于水和熔融状态时均能导电。
②共价晶体一般为非导体。
③分子晶体为非导体,但分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水时,分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(5)依据硬度和机械性能判断
一般情况下,硬度:共价晶体>离子晶体>分子晶体。金属晶体多数硬度大,但也有较小的,且具有较好的延展性。
3.晶体熔、沸点的比较
(1)共价晶体
如熔点:金刚石>碳化硅>晶体硅。
(2)离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,离子间的作用力就越强,离子晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
(3)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有分子间氢键的分子晶体熔、沸点反常的高,如沸点:H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点:CO>N2。
④在同分异构体中,一般支链越多,熔、沸点越低,如熔、沸点:正戊烷>异戊烷。
(4)金属晶体
金属离子半径越小,所带电荷数越多,其金属键越强,熔、沸点就越高,如熔、沸点:Na真题演练
02
1
2
3
4
5
1.[2015·全国卷Ⅰ,37(4)]CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于________晶体。
6
7
8
9
10
分子
1
2
3
4
5
2.[2015·全国卷Ⅱ,37(2)改编]氧和钠的氢化物所属的晶体类型分别为__________和__________。
6
7
8
9
10
分子晶体
离子晶体
1
2
3
4
5
3.[2018·全国卷Ⅰ,35(3)改编]LiAlH4中,存在的微粒间作用力有______________。
6
7
8
9
10
离子键、σ键
1
2
3
4
5
4.[2018·全国卷Ⅲ,35(3)节选]ZnF2具有较高的熔点(872 ℃),其化学键类型是____________。
6
7
8
9
10
离子键
1
2
3
4
5
5.[2016·全国卷Ⅰ,37(5)改编]Ge单晶具有金刚石型结构,其微粒之间存在的作用力是__________。
6
7
8
9
10
共价键
1
2
3
4
5
6.[2016·全国卷Ⅱ,37(3)节选]单质铜及镍都是由______键形成的晶体。
6
7
8
9
10
金属
1
2
3
4
7.[2017·全国卷Ⅰ,35(2)节选]K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________
__________________________________。
5
6
7
8
9
10
K原子半径
较大且价层电子数较少,金属键较弱
1
2
3
4
8.[2017·全国卷Ⅲ,35(3)改编]在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)所涉及的4种物质中,沸点从高到低的顺序为
_____________________,原因是_________________________________
______________________________________________________________________________。
5
6
7
8
9
10
H2O>CH3OH>CO2>H2
H2O与CH3OH均为极性分子,H2O中
氢键数目比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大
1
2
3
4
9.[2016·全国卷Ⅲ,37(4)]GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________________________________。
5
6
7
8
9
10
GaF3为离子晶体,GaCl3为分子晶体
1
2
3
4
10.[2015·全国卷Ⅱ,37(2)改编]单质氧有两种同素异形体,其中沸点高的是_____(填分子式),原因是____________________________________
____________。
5
6
7
8
9
10
O3
O3相对分子质量较大且是极性分子,范
德华力较大
考向预测
03
1
2
3
4
5
1.Cu2O与Cu2S比较,熔点较高的是_______,原因是_________________
______________________________________________________________________________________。
Cu2O
两物质均为离子化
合物,且离子带电荷数相同,O2-的半径小于S2-的半径,所以Cu2O的离子键强度大,熔点更高
1
2
3
4
5
2.钛比钢轻,比铝硬,是一种新兴的结构材料。钛的硬度比铝大的原因是____________________________________________。
Ti原子的价层电子数比Al原子的多,金属键更强
1
2
3
4
5
3.已知Ba、Mo的氯化物沸点信息如表所示。二者沸点差异的原因是_________________________________________________________________________________________________________________________________________________________。
氯化物 沸点
BaCl2 1 560 ℃
MoCl5 268 ℃
BaCl2属于离子晶体,MoCl5属于分子晶体,离子晶体的沸点主要取决于离子键,分子晶体的沸点主要取决于分子间作用力,离子键通常强于分子间作用力(答案合理即可)
1
2
3
4
5
4.[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为 ,IMI
的某种衍生物与甘氨酸形成的离子化合物 ,
常温下为液态而非固态,原因是__________________________________
______________________。
阴、阳离子半径大,电荷数小,形成
的离子键较弱,熔点低
1
2
3
4
5
5.研究晶体性质对工业流程的探究十分重要,某化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
熔点/℃ 硬度 水溶性 导电性 水溶液与Ag+反应
A 811 较大 易溶 水溶液或熔融时导电 白色沉淀
B 3 550 很大 不溶 不导电 不反应
C -114.2 很小 易溶 液态不导电 白色沉淀
1
2
3
4
5
根据以上实验数据,填写表格:
化学式 晶体类型 微粒间作用力
A
B
C
NaCl
离子晶体
离子键
C(金刚石)
共价晶体
共价键
HCl
分子晶体
分子间作用力
本课结束
4.晶体类型与微粒间作用力原因解释
主观题突破
核心精讲
01
1.不同晶体的特点比较
离子晶体 金属晶体 分子晶体 共价晶体
概念 阳离子和阴离子通过离子键结合而形成的晶体 通过金属离子与自由电子之间的较强作用形成的晶体 分子间以分子间作用力相结合的晶体 相邻原子间以共价键相结合而形成空间网状结构的晶体
晶体微粒 阴、阳离子 金属阳离子、自由电子 分子 原子
离子晶体 金属晶体 分子晶体 共价晶体
微粒之间 作用力 离子键 金属键 分子间作用力 共价键
物 理 性 质 熔、 沸点 较高 有的高(如铁)、有的低(如汞) 低 很高
硬度 硬而脆 有的大、有的小 小 很大
离子晶体 金属晶体 分子晶体 共价晶体
物 理 性 质 溶解性 一般情况下,易溶于极性溶剂(如水),难溶于有机溶剂 钠等可与水、醇类、酸类反应 极性分子易溶于极性溶剂;非极性分子易溶于非极性溶剂 不溶于任何溶剂
2.晶体类别的判断方法
(1)依据构成晶体的微粒和微粒间作用力判断
由阴、阳离子形成的离子键构成的晶体为离子晶体;由原子形成的共价键构成的晶体为共价晶体;由分子依靠分子间作用力形成的晶体为分子晶体;由金属阳离子、自由电子以金属键构成的晶体为金属晶体。
(2)依据物质的分类判断
①活泼金属氧化物和过氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)、绝大多数的盐是离子晶体。
②部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体是分子晶体。
③常见的单质类共价晶体有金刚石、晶体硅、晶体硼等,常见的化合物类共价晶体有SiC、SiO2、AlN、BP、GaAs等。
④金属单质、合金是金属晶体。
(3)依据晶体的熔点判断
不同类型晶体熔点大小的一般规律:共价晶体>离子晶体>分子晶体。金属晶体的熔点差别很大,如钨、铂等熔点很高,铯等熔点很低。
(4)依据导电性判断
①离子晶体溶于水和熔融状态时均能导电。
②共价晶体一般为非导体。
③分子晶体为非导体,但分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水时,分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(5)依据硬度和机械性能判断
一般情况下,硬度:共价晶体>离子晶体>分子晶体。金属晶体多数硬度大,但也有较小的,且具有较好的延展性。
3.晶体熔、沸点的比较
(1)共价晶体
如熔点:金刚石>碳化硅>晶体硅。
(2)离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,离子间的作用力就越强,离子晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
(3)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有分子间氢键的分子晶体熔、沸点反常的高,如沸点:H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如熔、沸点:SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如熔、沸点:CO>N2。
④在同分异构体中,一般支链越多,熔、沸点越低,如熔、沸点:正戊烷>异戊烷。
(4)金属晶体
金属离子半径越小,所带电荷数越多,其金属键越强,熔、沸点就越高,如熔、沸点:Na
02
1
2
3
4
5
1.[2015·全国卷Ⅰ,37(4)]CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于________晶体。
6
7
8
9
10
分子
1
2
3
4
5
2.[2015·全国卷Ⅱ,37(2)改编]氧和钠的氢化物所属的晶体类型分别为__________和__________。
6
7
8
9
10
分子晶体
离子晶体
1
2
3
4
5
3.[2018·全国卷Ⅰ,35(3)改编]LiAlH4中,存在的微粒间作用力有______________。
6
7
8
9
10
离子键、σ键
1
2
3
4
5
4.[2018·全国卷Ⅲ,35(3)节选]ZnF2具有较高的熔点(872 ℃),其化学键类型是____________。
6
7
8
9
10
离子键
1
2
3
4
5
5.[2016·全国卷Ⅰ,37(5)改编]Ge单晶具有金刚石型结构,其微粒之间存在的作用力是__________。
6
7
8
9
10
共价键
1
2
3
4
5
6.[2016·全国卷Ⅱ,37(3)节选]单质铜及镍都是由______键形成的晶体。
6
7
8
9
10
金属
1
2
3
4
7.[2017·全国卷Ⅰ,35(2)节选]K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________
__________________________________。
5
6
7
8
9
10
K原子半径
较大且价层电子数较少,金属键较弱
1
2
3
4
8.[2017·全国卷Ⅲ,35(3)改编]在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)所涉及的4种物质中,沸点从高到低的顺序为
_____________________,原因是_________________________________
______________________________________________________________________________。
5
6
7
8
9
10
H2O>CH3OH>CO2>H2
H2O与CH3OH均为极性分子,H2O中
氢键数目比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大
1
2
3
4
9.[2016·全国卷Ⅲ,37(4)]GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________________________________。
5
6
7
8
9
10
GaF3为离子晶体,GaCl3为分子晶体
1
2
3
4
10.[2015·全国卷Ⅱ,37(2)改编]单质氧有两种同素异形体,其中沸点高的是_____(填分子式),原因是____________________________________
____________。
5
6
7
8
9
10
O3
O3相对分子质量较大且是极性分子,范
德华力较大
考向预测
03
1
2
3
4
5
1.Cu2O与Cu2S比较,熔点较高的是_______,原因是_________________
______________________________________________________________________________________。
Cu2O
两物质均为离子化
合物,且离子带电荷数相同,O2-的半径小于S2-的半径,所以Cu2O的离子键强度大,熔点更高
1
2
3
4
5
2.钛比钢轻,比铝硬,是一种新兴的结构材料。钛的硬度比铝大的原因是____________________________________________。
Ti原子的价层电子数比Al原子的多,金属键更强
1
2
3
4
5
3.已知Ba、Mo的氯化物沸点信息如表所示。二者沸点差异的原因是_________________________________________________________________________________________________________________________________________________________。
氯化物 沸点
BaCl2 1 560 ℃
MoCl5 268 ℃
BaCl2属于离子晶体,MoCl5属于分子晶体,离子晶体的沸点主要取决于离子键,分子晶体的沸点主要取决于分子间作用力,离子键通常强于分子间作用力(答案合理即可)
1
2
3
4
5
4.[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为 ,IMI
的某种衍生物与甘氨酸形成的离子化合物 ,
常温下为液态而非固态,原因是__________________________________
______________________。
阴、阳离子半径大,电荷数小,形成
的离子键较弱,熔点低
1
2
3
4
5
5.研究晶体性质对工业流程的探究十分重要,某化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
熔点/℃ 硬度 水溶性 导电性 水溶液与Ag+反应
A 811 较大 易溶 水溶液或熔融时导电 白色沉淀
B 3 550 很大 不溶 不导电 不反应
C -114.2 很小 易溶 液态不导电 白色沉淀
1
2
3
4
5
根据以上实验数据,填写表格:
化学式 晶体类型 微粒间作用力
A
B
C
NaCl
离子晶体
离子键
C(金刚石)
共价晶体
共价键
HCl
分子晶体
分子间作用力
本课结束
同课章节目录
