专题三 元素及其化合物 选择题专攻 4.无机化工微流程分析(共44张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题三 元素及其化合物 选择题专攻 4.无机化工微流程分析(共44张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:49:51 | ||
图片预览










文档简介
(共44张PPT)
4.无机化工微流程分析
选择题专攻
核心精讲
01
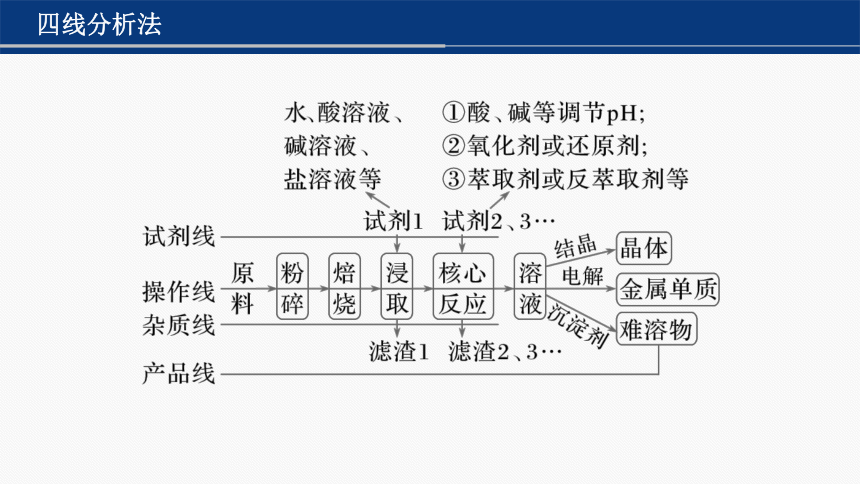
四线分析法
(1)试剂线:分清各步加入试剂的作用,一般是为了除去杂质或进行目标元素及其化合物间的转化等。
(2)操作线:分离杂质和产品需要进行的分离、提纯操作等。
(3)杂质线:分清各步去除杂质的种类,杂质的去除顺序、方法及条件等。
(4)产品线:工艺流程主线,关注目标元素及其化合物在各步发生的反应或进行分离、提纯的操作方法,实质是目标元素及其化合物的转化。
典例剖析
某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl,工艺流程如图所示。焙烧时过量的MnO2分解为Mn2O3,金属活动性:Fe>(H)>Bi>Cu。下列说法错误的是
A.通过“联合焙烧”Bi2S3和FeS2分
别转化为Bi2O3、Fe2O3
B.“水浸”所得滤液的主要溶质是
MnSO4
C.“酸浸”所得滤渣的主要成分是SiO2,气体A为Cl2
D.向“酸浸”所得滤液中加入金属Bi的目的是消耗H+,促进Bi3+水解
思路分析
常考原料预处理阶段各操作的目的
规律总结
研磨、粉碎等 增大反应物的接触面积,增大反应速率,提高原料转化率、利用率、浸取率
灼烧(煅烧、焙烧) 除去有机物;使无机物分解为金属氧化物等,便于后续浸取、溶解
浸取 水浸:分离水溶性和非水溶性的物质
酸浸:溶解金属、金属氧化物、调节pH促进某离子的水解而转化为沉淀
碱浸:除去油污、溶解酸性氧化物、溶解铝及其化合物、调节pH等
真题演练
02
1
2
3
4
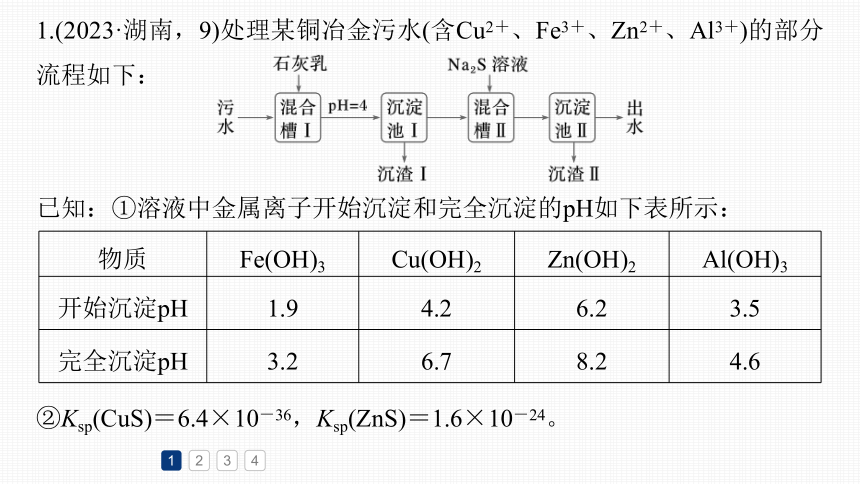
1.(2023·湖南,9)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2 Al(OH)3
开始沉淀pH 1.9 4.2 6.2 3.5
完全沉淀pH 3.2 6.7 8.2 4.6
②Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24。
1
2
3
4
下列说法错误的是
A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3
B.Na2S溶液呈碱性,其主要原因是S2-+H2O HS-+OH-
C.“沉淀池Ⅱ”中,当Cu2+和Zn2+完全沉淀时,溶液中 =
4.0×10-12
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
√
1
2
3
4
当pH=1.9时氢氧化铁开始沉淀,当pH=3.5时氢氧化铝开始沉淀,当pH=4时,则会生成氢氧化铝和氢氧化铁,即“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3,A正确;
硫化钠溶液中的硫离子可以水解,产生氢氧根离子,使溶液显碱性,其第一步水解的方程式为S2-+H2O HS-+OH-,B正确;
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2 Al(OH)3
开始沉淀pH 1.9 4.2 6.2 3.5
完全沉淀pH 3.2 6.7 8.2 4.6
1
2
3
4
“出水”中除含有阴离子外,还含有大量的Na+、Ca2+等,故只经阴离子交换树脂软化处理后,不可用作工业冷却循环用水,D错误。
1
2
3
4
2.(2023·辽宁,10)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是
A.“焙烧”中产生CO2
B.滤渣的主要成分为Fe(OH)2
C.滤液①中Cr元素的主要存
在形式为
D.淀粉水解液中的葡萄糖起还原作用
√
1
2
3
4
3.(2022·山东,12)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
Fe(OH)3 Cu(OH)2 Zn(OH)2
开始沉淀pH 1.9 4.2 6.2
沉淀完全pH 3.2 6.7 8.2
1
2
3
4
下列说法错误的是
A.固体X主要成分是Fe(OH)3和S;金属M为Zn
B.浸取时,增大O2压强可促进金属离子浸出
C.中和调pH的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
√
CuS精矿(含Zn、Fe元素的杂质)在高压O2作用下,用硫酸溶液浸取,与CuS反应生成CuSO4、S、H2O,Fe2+被氧化为Fe3+,然后加入NH3调节溶液pH,使Fe3+形成Fe(OH)3沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,过滤得到的滤渣中含有S、Fe(OH)3;
滤液中含有Cu2+、Zn2+;
1
2
3
4
然后向滤液中通入高压H2,根据元素活动性:Zn>H>Cu,Cu2+被还原为Cu单质,通过过滤分离出来;
而Zn2+仍然以离子形式存在于溶液中,再经一系列处理可得到Zn单质。经过上述分析可知,固体X的主要成分是S、Fe(OH)3,金属M为Zn,A正确;
1
2
3
4
CuS难溶于硫酸溶液,在溶液中存在沉淀溶解平衡:CuS(s) Cu2+(aq)
+S2-(aq),增大O2的浓度,可以消耗S2-,使之转化为S,从而使沉淀溶解平衡正向移动,从而可促进金属离子的浸出,B正确;
根据流程图可知,用NH3调节溶液pH时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在
于溶液中,结合离子沉淀的pH
范围,可知中和时应该调节溶
液pH的范围为3.2~4.2,C正确;
1
2
3
4
用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,若还原时增大溶液的酸度,c(H+)增大,不利于H2失去电子还原Cu单质,因此不利于Cu的生成,D错误。
1
2
3
4
1
2
3
4
4.(2022·湖南,7)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
√
1
2
3
4
烟气(含HF)通入吸收塔,加入过量的碳酸钠,发生反应:Na2CO3+HF===NaF+NaHCO3,向合成槽中通入NaAlO2,发生反应:6NaF+NaAlO2+4NaHCO3===Na3AlF6↓+4Na2CO3+2H2O,过滤得到Na3AlF6和含有Na2CO3的滤液。陶瓷的成分中含有SiO2,SiO2能与HF发生反应,因此不宜用陶瓷作吸收塔内衬材料,故A正确;
1
2
3
4
采用溶液喷淋法可增大反应物的接触面积,提高吸收塔内烟气吸收效率,故B正确;
由上述分析知,合成槽内产物主要有Na3AlF6、Na2CO3、H2O,故C错误;
滤液的主要成分为Na2CO3,可进入吸收塔循环利用,故D正确。
考向预测
03
1
2
3
4
5
6
1.(2023·南京高三下学期考前模拟)实验室以含锌废液(主要成分为ZnSO4,还含有少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如下:
下列说法正确的是
A.过二硫酸钠(Na2S2O8)中硫元
素的化合价为+7价
B.氧化除锰后的溶液中存在:
Na+、Zn2+、Fe2+、
C.调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D.沉锌时的离子方程式为3Zn2++ ===ZnCO3·2Zn(OH)2↓+
5CO2↑+H2O
√
1
2
3
4
5
6
Na2S2O8中含有过氧键,其中2个O为-1价,6个O为-2价,Na为+1价,S为+6价,A错误;
Fe2+具有还原性,易被氧化,不可能存在于氧化后的溶液中,B错误;
1
2
3
4
5
6
加入X的目的是调节pH,使Fe3+转化成Fe(OH)3,且不引入杂质,Fe3+水解显酸性:Fe3++3H2O Fe(OH)3+3H+,加入ZnO、ZnCO3均可以与H+反应,促进Fe3+的水解,从而生成Fe(OH)3沉淀,由于Fe3+的氧化性强于H+,当加入Zn时,Fe3+会被Zn还原为Fe2+,影响除杂,所以不能用Zn来调节溶液pH,C错误。
1
2
3
4
5
6
2.(2023·南京师范大学附属中学高三模拟)硫酸钾是一种重要的无氯优质钾肥,利用某高钾明矾石制备硫酸钾的工艺流程如下:
已知:高钾明矾石的主要成分为K2SO4·
Al2(SO4)3·2Al2O3·H2O和少量Fe2O3。下
列说法正确的是
A.焙烧时Al2(SO4)3发生反应的化学方程
式为2Al2(SO4)3+3S===2Al2O3+9SO3
B.调节pH的目的是使Fe3+和Al3+完全沉淀
C.化合物Y可制成铝热剂用于焊接铁轨
D.SO3可回收利用后应用于本流程
√
1
2
3
4
5
6
高钾明矾石经粉碎增大接触面积,加入硫粉进行焙烧得到SO2、SO3,加入KOH溶液发生反应的离子方程式为Al2O3+2OH-=== +H2O,
1
2
3
4
5
6
1
2
3
4
5
6
3.(2023·江苏省决胜新高考高三大联考)NiSO4·nH2O易溶于水,其水溶液显酸性。从电镀污泥[含Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等]中回收制备NiSO4·nH2O和其他金属的工艺流程如图所示。
下列叙述不正确的是
A.“酸浸”时,为加快浸出速率,应
加入相同体积、稍高浓度的硫酸
B.用惰性电极“电解”后的电解液中主要存在的阳离子有H+、Ni2+等
C.“除Fe、Cr”时通入O2更有利于生成Fe(OH)3沉淀
D.NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作可得到
NiSO4·nH2O
1
2
3
4
5
6
√
1
2
3
4
5
6
电镀污泥加入的稀硫酸酸浸除去二氧化硅滤渣,滤液电解分离出铜后,加入碳酸钠、通入氧气除去铁、铬,滤液加入萃取剂萃取后得到硫酸镍溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作可制得硫酸镍晶体。“酸浸”时,加入相同体积、稍高浓度的硫酸,硫酸的用量增加,且电解产生硫酸,会增加后续碳酸钠的用量,A错误;
1
2
3
4
5
6
惰性电极“电解”时铜离子被还原为铜、水被氧化为氧气和氢离子,则电解液中主要存在的阳离子有H+、Ni2+等,B正确;
电解过程中铜会和铁离子生成亚铁离子,“除Fe、Cr”时通入O2可以将Fe2+转化为Fe3+有利于生成Fe(OH)3沉淀,C正确。
1
2
3
4
5
6
4.(2023·连云港高级中学高三5月模拟)氧化钪(Sc2O3)广泛应用于航天、激光等科学领域。利用钛白酸性废水(含H+、Sc3+、Fe2+等)制备氧化钪的工艺具有较高的经济价值,其流程如图所示。
已知:Sc3+、Fe2+均能与P504(用HR表示)发生络合反应,且机理均为Mn++nHR MRn+nH+。
1
2
3
4
5
6
下列说法不正确的是
A.Sc3+、Fe2+与P504的络合能
力:Sc3+>Fe2+
B.萃取、反萃取后均可使用分
液漏斗分离,有机相均从分
液漏斗下口放出
C.“反萃取”时加入NaOH溶液
将Sc3+转化为Sc(OH)3
D.沉钪时能得到Sc2(C2O4)3·6H2O,则焙烧时的化学方程式:2Sc2(C2O4)3·
6H2O+3O2 2Sc2O3+12CO2+12H2O
√
1
2
3
4
5
6
由向有机相中加入稀硫酸后Fe2+先被洗出可知,与P504的络合能力:Sc3+>Fe2+,A正确;
煤油的密度小于水的密度,“萃取”时,有机相应从分液漏斗上口倒出,B错误;
1
2
3
4
5
6
沉钪时能得到Sc2(C2O4)3·
6H2O,则焙烧时与氧气发生氧化还原反应,根据得失电子守恒、原子守恒得2Sc2(C2O4)3·6H2O+3O2
2Sc2O3+12CO2+12H2O,D正确。
1
2
3
4
5
6
5.(2023·连云港高三下学期2月调研)以废弃锌锰干电池(主要成分是Zn和MnO2,还含有少量炭黑)为原料制取ZnSO4、MnSO4溶液,进而得到复合微肥的流程如下:
下列说法正确的是
A.浸取时,MnO2与FeS(不溶于水)反应
的离子方程式:8MnO2+2FeS+16H+
===8Mn2++ +2Fe2++8H2O
B.浸取液中主要存在的离子有H+、Fe3+、Zn2+、S2-、Mn2+、
C.过滤Ⅱ所得的滤渣为ZnCO3
D.过滤所得ZnSO4、MnSO4溶液中:c(Zn2+)+c(Mn2+)<
√
1
2
3
4
5
6
Zn和MnO2在浸取步骤中发生氧化还原反应,锌和硫酸反应生成硫酸锌和氢气、二氧化锰和硫化亚铁反应生成硫酸铁和硫酸锰,炭黑不反应,过滤除去,加碳酸锌调节pH使铁离子转化为氢氧化铁沉淀过滤除去,最终得到硫酸锌和硫
酸锰溶液。由分析知二者反应的
离子方程式为9MnO2+2FeS+
20H+===9Mn2++ +2Fe3++10H2O,A错误;
1
2
3
4
5
6
浸取液中主要存在的离子有H+、Fe3+、Zn2+、Mn2+、 ,B错误;
1
2
3
4
5
6
6.(2023·江苏南通统考一模)无水FeCl3常用作芳烃氯代反应的催化剂。以废铁屑(主要成分Fe,还有少量Fe2O3、C和SiO2)制取无水FeCl3的流程如下,下列说法正确的是
A.“过滤”所得滤液中大量存
在的离子有Fe3+、Fe2+、
H+、Cl-
B.“氧化”时可使用新制氯水作氧化剂
C.将“氧化”后的溶液蒸干可获得FeCl3·6H2O
D.“脱水”时加入SOCl2能抑制FeCl3的水解,原因是SOCl2与水反应生成
H2SO4和HCl
√
1
2
3
4
5
6
废铁屑加入盐酸酸溶,碳、二氧化硅不反应,铁转化为盐溶液,过滤,滤液加入氧化剂将亚铁离子氧化为铁离子,处理得到FeCl3·6H2O,加入SOCl2脱水得到FeCl3。铁屑主要成分为Fe,铁和铁离子反应生成亚铁离子,故“过滤”所得滤液中大量存在的离子有Fe2+、H+、Cl-,A错误;
1
2
3
4
5
6
氯气具有氧化性,且不引入新杂质,故“氧化”时可使用新制氯水作氧化剂,B正确;
铁离子水解生成氢氧化铁,故不能将“氧化”后的溶液蒸干来获得FeCl3·6H2O,C错误;
SOCl2与水反应生成SO2和HCl,D错误。
本课结束
4.无机化工微流程分析
选择题专攻
核心精讲
01
四线分析法
(1)试剂线:分清各步加入试剂的作用,一般是为了除去杂质或进行目标元素及其化合物间的转化等。
(2)操作线:分离杂质和产品需要进行的分离、提纯操作等。
(3)杂质线:分清各步去除杂质的种类,杂质的去除顺序、方法及条件等。
(4)产品线:工艺流程主线,关注目标元素及其化合物在各步发生的反应或进行分离、提纯的操作方法,实质是目标元素及其化合物的转化。
典例剖析
某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl,工艺流程如图所示。焙烧时过量的MnO2分解为Mn2O3,金属活动性:Fe>(H)>Bi>Cu。下列说法错误的是
A.通过“联合焙烧”Bi2S3和FeS2分
别转化为Bi2O3、Fe2O3
B.“水浸”所得滤液的主要溶质是
MnSO4
C.“酸浸”所得滤渣的主要成分是SiO2,气体A为Cl2
D.向“酸浸”所得滤液中加入金属Bi的目的是消耗H+,促进Bi3+水解
思路分析
常考原料预处理阶段各操作的目的
规律总结
研磨、粉碎等 增大反应物的接触面积,增大反应速率,提高原料转化率、利用率、浸取率
灼烧(煅烧、焙烧) 除去有机物;使无机物分解为金属氧化物等,便于后续浸取、溶解
浸取 水浸:分离水溶性和非水溶性的物质
酸浸:溶解金属、金属氧化物、调节pH促进某离子的水解而转化为沉淀
碱浸:除去油污、溶解酸性氧化物、溶解铝及其化合物、调节pH等
真题演练
02
1
2
3
4
1.(2023·湖南,9)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2 Al(OH)3
开始沉淀pH 1.9 4.2 6.2 3.5
完全沉淀pH 3.2 6.7 8.2 4.6
②Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24。
1
2
3
4
下列说法错误的是
A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3
B.Na2S溶液呈碱性,其主要原因是S2-+H2O HS-+OH-
C.“沉淀池Ⅱ”中,当Cu2+和Zn2+完全沉淀时,溶液中 =
4.0×10-12
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
√
1
2
3
4
当pH=1.9时氢氧化铁开始沉淀,当pH=3.5时氢氧化铝开始沉淀,当pH=4时,则会生成氢氧化铝和氢氧化铁,即“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3,A正确;
硫化钠溶液中的硫离子可以水解,产生氢氧根离子,使溶液显碱性,其第一步水解的方程式为S2-+H2O HS-+OH-,B正确;
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2 Al(OH)3
开始沉淀pH 1.9 4.2 6.2 3.5
完全沉淀pH 3.2 6.7 8.2 4.6
1
2
3
4
“出水”中除含有阴离子外,还含有大量的Na+、Ca2+等,故只经阴离子交换树脂软化处理后,不可用作工业冷却循环用水,D错误。
1
2
3
4
2.(2023·辽宁,10)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是
A.“焙烧”中产生CO2
B.滤渣的主要成分为Fe(OH)2
C.滤液①中Cr元素的主要存
在形式为
D.淀粉水解液中的葡萄糖起还原作用
√
1
2
3
4
3.(2022·山东,12)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
Fe(OH)3 Cu(OH)2 Zn(OH)2
开始沉淀pH 1.9 4.2 6.2
沉淀完全pH 3.2 6.7 8.2
1
2
3
4
下列说法错误的是
A.固体X主要成分是Fe(OH)3和S;金属M为Zn
B.浸取时,增大O2压强可促进金属离子浸出
C.中和调pH的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
√
CuS精矿(含Zn、Fe元素的杂质)在高压O2作用下,用硫酸溶液浸取,与CuS反应生成CuSO4、S、H2O,Fe2+被氧化为Fe3+,然后加入NH3调节溶液pH,使Fe3+形成Fe(OH)3沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,过滤得到的滤渣中含有S、Fe(OH)3;
滤液中含有Cu2+、Zn2+;
1
2
3
4
然后向滤液中通入高压H2,根据元素活动性:Zn>H>Cu,Cu2+被还原为Cu单质,通过过滤分离出来;
而Zn2+仍然以离子形式存在于溶液中,再经一系列处理可得到Zn单质。经过上述分析可知,固体X的主要成分是S、Fe(OH)3,金属M为Zn,A正确;
1
2
3
4
CuS难溶于硫酸溶液,在溶液中存在沉淀溶解平衡:CuS(s) Cu2+(aq)
+S2-(aq),增大O2的浓度,可以消耗S2-,使之转化为S,从而使沉淀溶解平衡正向移动,从而可促进金属离子的浸出,B正确;
根据流程图可知,用NH3调节溶液pH时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在
于溶液中,结合离子沉淀的pH
范围,可知中和时应该调节溶
液pH的范围为3.2~4.2,C正确;
1
2
3
4
用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,若还原时增大溶液的酸度,c(H+)增大,不利于H2失去电子还原Cu单质,因此不利于Cu的生成,D错误。
1
2
3
4
1
2
3
4
4.(2022·湖南,7)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
√
1
2
3
4
烟气(含HF)通入吸收塔,加入过量的碳酸钠,发生反应:Na2CO3+HF===NaF+NaHCO3,向合成槽中通入NaAlO2,发生反应:6NaF+NaAlO2+4NaHCO3===Na3AlF6↓+4Na2CO3+2H2O,过滤得到Na3AlF6和含有Na2CO3的滤液。陶瓷的成分中含有SiO2,SiO2能与HF发生反应,因此不宜用陶瓷作吸收塔内衬材料,故A正确;
1
2
3
4
采用溶液喷淋法可增大反应物的接触面积,提高吸收塔内烟气吸收效率,故B正确;
由上述分析知,合成槽内产物主要有Na3AlF6、Na2CO3、H2O,故C错误;
滤液的主要成分为Na2CO3,可进入吸收塔循环利用,故D正确。
考向预测
03
1
2
3
4
5
6
1.(2023·南京高三下学期考前模拟)实验室以含锌废液(主要成分为ZnSO4,还含有少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如下:
下列说法正确的是
A.过二硫酸钠(Na2S2O8)中硫元
素的化合价为+7价
B.氧化除锰后的溶液中存在:
Na+、Zn2+、Fe2+、
C.调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D.沉锌时的离子方程式为3Zn2++ ===ZnCO3·2Zn(OH)2↓+
5CO2↑+H2O
√
1
2
3
4
5
6
Na2S2O8中含有过氧键,其中2个O为-1价,6个O为-2价,Na为+1价,S为+6价,A错误;
Fe2+具有还原性,易被氧化,不可能存在于氧化后的溶液中,B错误;
1
2
3
4
5
6
加入X的目的是调节pH,使Fe3+转化成Fe(OH)3,且不引入杂质,Fe3+水解显酸性:Fe3++3H2O Fe(OH)3+3H+,加入ZnO、ZnCO3均可以与H+反应,促进Fe3+的水解,从而生成Fe(OH)3沉淀,由于Fe3+的氧化性强于H+,当加入Zn时,Fe3+会被Zn还原为Fe2+,影响除杂,所以不能用Zn来调节溶液pH,C错误。
1
2
3
4
5
6
2.(2023·南京师范大学附属中学高三模拟)硫酸钾是一种重要的无氯优质钾肥,利用某高钾明矾石制备硫酸钾的工艺流程如下:
已知:高钾明矾石的主要成分为K2SO4·
Al2(SO4)3·2Al2O3·H2O和少量Fe2O3。下
列说法正确的是
A.焙烧时Al2(SO4)3发生反应的化学方程
式为2Al2(SO4)3+3S===2Al2O3+9SO3
B.调节pH的目的是使Fe3+和Al3+完全沉淀
C.化合物Y可制成铝热剂用于焊接铁轨
D.SO3可回收利用后应用于本流程
√
1
2
3
4
5
6
高钾明矾石经粉碎增大接触面积,加入硫粉进行焙烧得到SO2、SO3,加入KOH溶液发生反应的离子方程式为Al2O3+2OH-=== +H2O,
1
2
3
4
5
6
1
2
3
4
5
6
3.(2023·江苏省决胜新高考高三大联考)NiSO4·nH2O易溶于水,其水溶液显酸性。从电镀污泥[含Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等]中回收制备NiSO4·nH2O和其他金属的工艺流程如图所示。
下列叙述不正确的是
A.“酸浸”时,为加快浸出速率,应
加入相同体积、稍高浓度的硫酸
B.用惰性电极“电解”后的电解液中主要存在的阳离子有H+、Ni2+等
C.“除Fe、Cr”时通入O2更有利于生成Fe(OH)3沉淀
D.NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作可得到
NiSO4·nH2O
1
2
3
4
5
6
√
1
2
3
4
5
6
电镀污泥加入的稀硫酸酸浸除去二氧化硅滤渣,滤液电解分离出铜后,加入碳酸钠、通入氧气除去铁、铬,滤液加入萃取剂萃取后得到硫酸镍溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作可制得硫酸镍晶体。“酸浸”时,加入相同体积、稍高浓度的硫酸,硫酸的用量增加,且电解产生硫酸,会增加后续碳酸钠的用量,A错误;
1
2
3
4
5
6
惰性电极“电解”时铜离子被还原为铜、水被氧化为氧气和氢离子,则电解液中主要存在的阳离子有H+、Ni2+等,B正确;
电解过程中铜会和铁离子生成亚铁离子,“除Fe、Cr”时通入O2可以将Fe2+转化为Fe3+有利于生成Fe(OH)3沉淀,C正确。
1
2
3
4
5
6
4.(2023·连云港高级中学高三5月模拟)氧化钪(Sc2O3)广泛应用于航天、激光等科学领域。利用钛白酸性废水(含H+、Sc3+、Fe2+等)制备氧化钪的工艺具有较高的经济价值,其流程如图所示。
已知:Sc3+、Fe2+均能与P504(用HR表示)发生络合反应,且机理均为Mn++nHR MRn+nH+。
1
2
3
4
5
6
下列说法不正确的是
A.Sc3+、Fe2+与P504的络合能
力:Sc3+>Fe2+
B.萃取、反萃取后均可使用分
液漏斗分离,有机相均从分
液漏斗下口放出
C.“反萃取”时加入NaOH溶液
将Sc3+转化为Sc(OH)3
D.沉钪时能得到Sc2(C2O4)3·6H2O,则焙烧时的化学方程式:2Sc2(C2O4)3·
6H2O+3O2 2Sc2O3+12CO2+12H2O
√
1
2
3
4
5
6
由向有机相中加入稀硫酸后Fe2+先被洗出可知,与P504的络合能力:Sc3+>Fe2+,A正确;
煤油的密度小于水的密度,“萃取”时,有机相应从分液漏斗上口倒出,B错误;
1
2
3
4
5
6
沉钪时能得到Sc2(C2O4)3·
6H2O,则焙烧时与氧气发生氧化还原反应,根据得失电子守恒、原子守恒得2Sc2(C2O4)3·6H2O+3O2
2Sc2O3+12CO2+12H2O,D正确。
1
2
3
4
5
6
5.(2023·连云港高三下学期2月调研)以废弃锌锰干电池(主要成分是Zn和MnO2,还含有少量炭黑)为原料制取ZnSO4、MnSO4溶液,进而得到复合微肥的流程如下:
下列说法正确的是
A.浸取时,MnO2与FeS(不溶于水)反应
的离子方程式:8MnO2+2FeS+16H+
===8Mn2++ +2Fe2++8H2O
B.浸取液中主要存在的离子有H+、Fe3+、Zn2+、S2-、Mn2+、
C.过滤Ⅱ所得的滤渣为ZnCO3
D.过滤所得ZnSO4、MnSO4溶液中:c(Zn2+)+c(Mn2+)<
√
1
2
3
4
5
6
Zn和MnO2在浸取步骤中发生氧化还原反应,锌和硫酸反应生成硫酸锌和氢气、二氧化锰和硫化亚铁反应生成硫酸铁和硫酸锰,炭黑不反应,过滤除去,加碳酸锌调节pH使铁离子转化为氢氧化铁沉淀过滤除去,最终得到硫酸锌和硫
酸锰溶液。由分析知二者反应的
离子方程式为9MnO2+2FeS+
20H+===9Mn2++ +2Fe3++10H2O,A错误;
1
2
3
4
5
6
浸取液中主要存在的离子有H+、Fe3+、Zn2+、Mn2+、 ,B错误;
1
2
3
4
5
6
6.(2023·江苏南通统考一模)无水FeCl3常用作芳烃氯代反应的催化剂。以废铁屑(主要成分Fe,还有少量Fe2O3、C和SiO2)制取无水FeCl3的流程如下,下列说法正确的是
A.“过滤”所得滤液中大量存
在的离子有Fe3+、Fe2+、
H+、Cl-
B.“氧化”时可使用新制氯水作氧化剂
C.将“氧化”后的溶液蒸干可获得FeCl3·6H2O
D.“脱水”时加入SOCl2能抑制FeCl3的水解,原因是SOCl2与水反应生成
H2SO4和HCl
√
1
2
3
4
5
6
废铁屑加入盐酸酸溶,碳、二氧化硅不反应,铁转化为盐溶液,过滤,滤液加入氧化剂将亚铁离子氧化为铁离子,处理得到FeCl3·6H2O,加入SOCl2脱水得到FeCl3。铁屑主要成分为Fe,铁和铁离子反应生成亚铁离子,故“过滤”所得滤液中大量存在的离子有Fe2+、H+、Cl-,A错误;
1
2
3
4
5
6
氯气具有氧化性,且不引入新杂质,故“氧化”时可使用新制氯水作氧化剂,B正确;
铁离子水解生成氢氧化铁,故不能将“氧化”后的溶液蒸干来获得FeCl3·6H2O,C错误;
SOCl2与水反应生成SO2和HCl,D错误。
本课结束
同课章节目录
