专题四 电化学 选择题专攻 1.新型燃料电池(共27张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题四 电化学 选择题专攻 1.新型燃料电池(共27张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:54:51 | ||
图片预览








文档简介
(共27张PPT)
1.新型燃料电池
选择题专攻
核心精讲
01
1.氢氧燃料电池
负极反应式 正极反应式
酸性 介质 2H2-4e-===4H+ O2+4e-+4H+===2H2O
碱性 介质 2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH-
2.有机物燃料电池
(1)在酸性电池中,电极反应式用H+平衡电荷,不能出现OH-。负极生成H+,正极消耗H+。
以CH4燃料电池为例(电解液为H2SO4溶液),写出电极反应式。
负极: 。
正极: 。
电池总反应式: 。
CH4+2H2O-8e-===CO2+8H+
O2+4e-+4H+===2H2O
CH4+2O2===CO2+2H2O
(2)在碱性电池中,电极反应式用OH-平衡电荷,不能出现H+、CO2(应为 )。负极消耗OH-,正极生成OH-。
以CH4燃料电池为例(电解液为KOH溶液),写出电极反应式。
负极: 。
正极: 。
电池总反应式: 。
O2+4e-+2H2O===4OH-
CH4+2O2+2KOH===K2CO3+3H2O
(3)熔融碳酸盐燃料电池( 平衡电荷)。
负极:燃料失去电子,生成CO2。
正极:氧气得到电子,生成 。
以CH4燃料电池为例,写出电极反应式。
负极: 。
正极: 。
(4)固态氧化物燃料电池(O2-平衡电荷)。
以CH4燃料电池为例,写出电极反应式。
负极: 。
正极: 。
CH4+4O2--8e-===CO2+2H2O
O2+4e-===2O2-
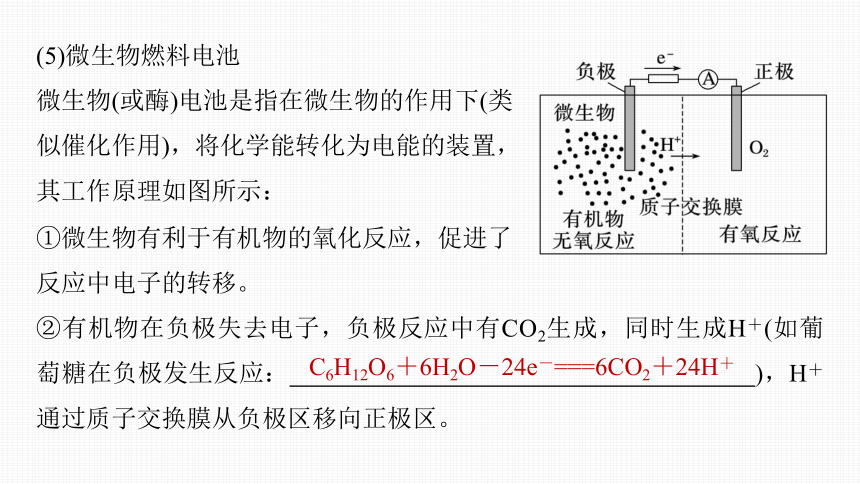
(5)微生物燃料电池
微生物(或酶)电池是指在微生物的作用下(类似催化作用),将化学能转化为电能的装置,其工作原理如图所示:
①微生物有利于有机物的氧化反应,促进了
反应中电子的转移。
②有机物在负极失去电子,负极反应中有CO2生成,同时生成H+(如葡萄糖在负极发生反应: ),H+通过质子交换膜从负极区移向正极区。
C6H12O6+6H2O-24e-===6CO2+24H+
真题演练
02
1
2
1.(2021·山东,10)以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况
下为11.2 L
√
1
2
放电过程为原电池工作原理,所以钾离子均向正极移动,A错误;
碱性环境下,N2H4-O2清洁燃料电池总反应为N2H4+O2===N2+2H2O,其总反应中未消耗KOH,所以KOH的物质的量不变,其他两种燃料电池根据总反应可知,KOH的物质的量均减小,B错误;
1
2
根据转移电子数守恒和总反应式可知,消耗1 mol O2生成的氮气的物质的量为1 mol,在标准状况下为22.4 L,D错误。
1
2
2.(2019·全国卷Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,
同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
√
1
2
相比现有工业合成氨,该方法选用酶作催
化剂,条件温和,同时利用MV+和MV2+
的相互转化,化学能转化为电能,故可提
供电能,故A正确;
左室为负极区,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+-e-===MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+===2H++2MV+,故B错误;
1
2
右室为正极区,MV2+在正极得电子发生还
原反应生成MV+,电极反应式为MV2++e-
===MV+,放电生成的MV+与N2在固氮酶
的作用下反应生成NH3和MV2+,故C正确;
电池工作时,氢离子(即质子)通过交换膜由负极向正极移动。
考向预测
03
1
2
3
1.研究发现,在肼(N2H4)酸性燃料电池中添加少量Fe2(SO4)3能持续大电流放电,工作原理如图所示。
下列说法错误的是
A.交换膜M为质子交换膜
B.Fe3+能够降低正极区反应的活化能
C.放电时正极区溶液的pH下降
D.负极反应式为N2H4-4e-===N2↑+4H+
√
1
2
3
由图可知,N2H4失去电子发生氧化反应为负极,反应为N2H4-4e-===N2↑+4H+,铁离子得到电子发生还原反应生成亚铁离子,亚铁离子和氧气反应的离子方程
式为4Fe2++4H++O2===4Fe3+
+2H2O,反应中氢离子向正极
移动,交换膜M为质子交换膜,
A、D正确;
1
2
3
由图可知,铁离子参与反应后又生成,即作催化剂,Fe3+能够降低正极区反应的活化能,B正确;
由A项分析,放电时正极区溶液的酸性减弱,pH升高,C错误。
1
2
3
2.沉积物微生物燃料电池(SMFC)可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,用SMFC处理含硫废水的工作原理如图所示,酸性增强不利于菌落存活。下列说法错误的是
A.碳棒b电势比碳棒a电势低
B.碳棒a附近酸性增强
C.碳棒b存在电极反应:S-6e-+4H2O
=== +8H+
D.工作一段时间后,电池效率降低
√
1
2
3
光合菌产生的O2得电子结合H+生成H2O,碳棒a为正极,FeSx在硫氧化菌的作用下被氧化为S,S在硫氧化菌的作用下被氧化为硫酸根离子,碳棒b为负极,正极的电势高于负极,A正确;
a为正极,电极反应为O2+4e-+4H+===2H2O,酸性减弱,B错误;
1
2
3
根据图示,碳棒b存在电极反应:S-6e-+4H2O=== +8H+,C正确;
酸性增强不利于菌落存活,负极失电子发生的氧化反应会减慢,故工作一段时间后,电池效率降低,D正确。
1
2
3
3.一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,其中硝化过程中 被O2氧化。下列叙述正确的是
A.电池工作时,“厌氧阳极”为正
极,“缺氧阴极”和“好氧阴极”
为负极
B.电池工作时,“缺氧阴极”电极
附近溶液的pH减小
D.“厌氧阳极”区质量减少28.8 g时,该电极输出电子2.4 mol
√
1
2
3
该装置为原电池,“厌氧阳极”
上C6H12O6转化为CO2,C由0价变
为+4价,则“厌氧阳极”为负极;
“缺氧阴极”上 转化为NO2,
再转化为N2,N由+5价变为+4价,
最后变为0价,则“缺氧阴极”为正极;“好氧阴极”上O2转化为H2O,O由0价变为-2价,则“好氧阴极”为正极,A项错误;
1
2
3
“缺氧阴极”上电极反应式分别为
+e-+2H+===NO2↑+H2O,
2NO2+8e-+8H+===N2+4H2O,
电池工作时,“缺氧阴极”上消耗
H+,其附近溶液的pH增大,B错误;
1
2
3
“厌氧阳极”的电极反应式为
C6H12O6+6H2O-24e-===6CO2↑
+24H+,1 mol C6H12O6反应消耗
6 mol H2O,转移24 mol电子,
“厌氧阳极”区质量减少288 g,故
“厌氧阳极”区质量减少28.8 g时,该电极输出电子2.4 mol,D正确。
本课结束
1.新型燃料电池
选择题专攻
核心精讲
01
1.氢氧燃料电池
负极反应式 正极反应式
酸性 介质 2H2-4e-===4H+ O2+4e-+4H+===2H2O
碱性 介质 2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH-
2.有机物燃料电池
(1)在酸性电池中,电极反应式用H+平衡电荷,不能出现OH-。负极生成H+,正极消耗H+。
以CH4燃料电池为例(电解液为H2SO4溶液),写出电极反应式。
负极: 。
正极: 。
电池总反应式: 。
CH4+2H2O-8e-===CO2+8H+
O2+4e-+4H+===2H2O
CH4+2O2===CO2+2H2O
(2)在碱性电池中,电极反应式用OH-平衡电荷,不能出现H+、CO2(应为 )。负极消耗OH-,正极生成OH-。
以CH4燃料电池为例(电解液为KOH溶液),写出电极反应式。
负极: 。
正极: 。
电池总反应式: 。
O2+4e-+2H2O===4OH-
CH4+2O2+2KOH===K2CO3+3H2O
(3)熔融碳酸盐燃料电池( 平衡电荷)。
负极:燃料失去电子,生成CO2。
正极:氧气得到电子,生成 。
以CH4燃料电池为例,写出电极反应式。
负极: 。
正极: 。
(4)固态氧化物燃料电池(O2-平衡电荷)。
以CH4燃料电池为例,写出电极反应式。
负极: 。
正极: 。
CH4+4O2--8e-===CO2+2H2O
O2+4e-===2O2-
(5)微生物燃料电池
微生物(或酶)电池是指在微生物的作用下(类似催化作用),将化学能转化为电能的装置,其工作原理如图所示:
①微生物有利于有机物的氧化反应,促进了
反应中电子的转移。
②有机物在负极失去电子,负极反应中有CO2生成,同时生成H+(如葡萄糖在负极发生反应: ),H+通过质子交换膜从负极区移向正极区。
C6H12O6+6H2O-24e-===6CO2+24H+
真题演练
02
1
2
1.(2021·山东,10)以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况
下为11.2 L
√
1
2
放电过程为原电池工作原理,所以钾离子均向正极移动,A错误;
碱性环境下,N2H4-O2清洁燃料电池总反应为N2H4+O2===N2+2H2O,其总反应中未消耗KOH,所以KOH的物质的量不变,其他两种燃料电池根据总反应可知,KOH的物质的量均减小,B错误;
1
2
根据转移电子数守恒和总反应式可知,消耗1 mol O2生成的氮气的物质的量为1 mol,在标准状况下为22.4 L,D错误。
1
2
2.(2019·全国卷Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,
同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
√
1
2
相比现有工业合成氨,该方法选用酶作催
化剂,条件温和,同时利用MV+和MV2+
的相互转化,化学能转化为电能,故可提
供电能,故A正确;
左室为负极区,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+-e-===MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+===2H++2MV+,故B错误;
1
2
右室为正极区,MV2+在正极得电子发生还
原反应生成MV+,电极反应式为MV2++e-
===MV+,放电生成的MV+与N2在固氮酶
的作用下反应生成NH3和MV2+,故C正确;
电池工作时,氢离子(即质子)通过交换膜由负极向正极移动。
考向预测
03
1
2
3
1.研究发现,在肼(N2H4)酸性燃料电池中添加少量Fe2(SO4)3能持续大电流放电,工作原理如图所示。
下列说法错误的是
A.交换膜M为质子交换膜
B.Fe3+能够降低正极区反应的活化能
C.放电时正极区溶液的pH下降
D.负极反应式为N2H4-4e-===N2↑+4H+
√
1
2
3
由图可知,N2H4失去电子发生氧化反应为负极,反应为N2H4-4e-===N2↑+4H+,铁离子得到电子发生还原反应生成亚铁离子,亚铁离子和氧气反应的离子方程
式为4Fe2++4H++O2===4Fe3+
+2H2O,反应中氢离子向正极
移动,交换膜M为质子交换膜,
A、D正确;
1
2
3
由图可知,铁离子参与反应后又生成,即作催化剂,Fe3+能够降低正极区反应的活化能,B正确;
由A项分析,放电时正极区溶液的酸性减弱,pH升高,C错误。
1
2
3
2.沉积物微生物燃料电池(SMFC)可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,用SMFC处理含硫废水的工作原理如图所示,酸性增强不利于菌落存活。下列说法错误的是
A.碳棒b电势比碳棒a电势低
B.碳棒a附近酸性增强
C.碳棒b存在电极反应:S-6e-+4H2O
=== +8H+
D.工作一段时间后,电池效率降低
√
1
2
3
光合菌产生的O2得电子结合H+生成H2O,碳棒a为正极,FeSx在硫氧化菌的作用下被氧化为S,S在硫氧化菌的作用下被氧化为硫酸根离子,碳棒b为负极,正极的电势高于负极,A正确;
a为正极,电极反应为O2+4e-+4H+===2H2O,酸性减弱,B错误;
1
2
3
根据图示,碳棒b存在电极反应:S-6e-+4H2O=== +8H+,C正确;
酸性增强不利于菌落存活,负极失电子发生的氧化反应会减慢,故工作一段时间后,电池效率降低,D正确。
1
2
3
3.一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,其中硝化过程中 被O2氧化。下列叙述正确的是
A.电池工作时,“厌氧阳极”为正
极,“缺氧阴极”和“好氧阴极”
为负极
B.电池工作时,“缺氧阴极”电极
附近溶液的pH减小
D.“厌氧阳极”区质量减少28.8 g时,该电极输出电子2.4 mol
√
1
2
3
该装置为原电池,“厌氧阳极”
上C6H12O6转化为CO2,C由0价变
为+4价,则“厌氧阳极”为负极;
“缺氧阴极”上 转化为NO2,
再转化为N2,N由+5价变为+4价,
最后变为0价,则“缺氧阴极”为正极;“好氧阴极”上O2转化为H2O,O由0价变为-2价,则“好氧阴极”为正极,A项错误;
1
2
3
“缺氧阴极”上电极反应式分别为
+e-+2H+===NO2↑+H2O,
2NO2+8e-+8H+===N2+4H2O,
电池工作时,“缺氧阴极”上消耗
H+,其附近溶液的pH增大,B错误;
1
2
3
“厌氧阳极”的电极反应式为
C6H12O6+6H2O-24e-===6CO2↑
+24H+,1 mol C6H12O6反应消耗
6 mol H2O,转移24 mol电子,
“厌氧阳极”区质量减少288 g,故
“厌氧阳极”区质量减少28.8 g时,该电极输出电子2.4 mol,D正确。
本课结束
同课章节目录
