专题四 电化学 选择题专攻 3.电解原理的多方面应用(共38张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题四 电化学 选择题专攻 3.电解原理的多方面应用(共38张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 21:59:57 | ||
图片预览





文档简介
(共38张PPT)
3.电解原理的多方面应用
选择题专攻
核心精讲
01
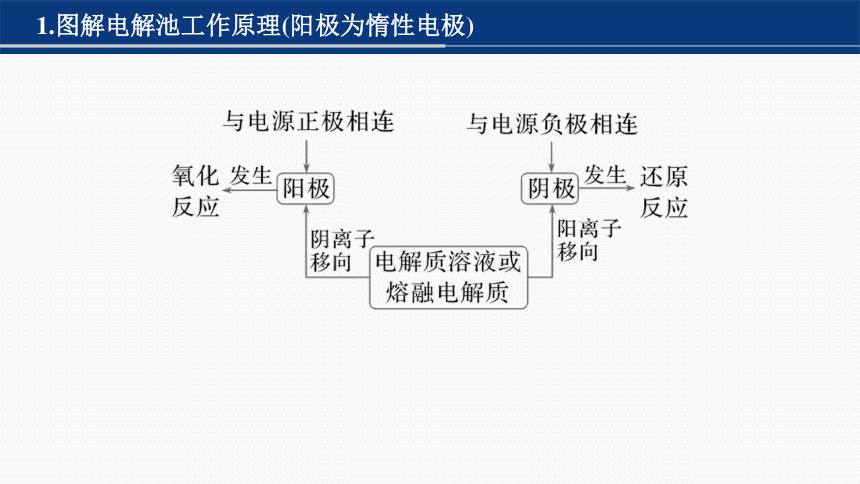
1.图解电解池工作原理(阳极为惰性电极)
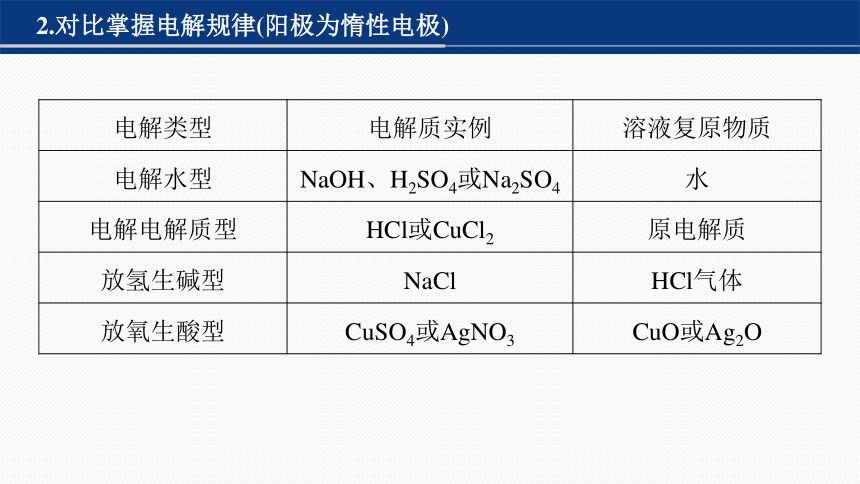
2.对比掌握电解规律(阳极为惰性电极)
电解类型 电解质实例 溶液复原物质
电解水型 NaOH、H2SO4或Na2SO4 水
电解电解质型 HCl或CuCl2 原电解质
放氢生碱型 NaCl HCl气体
放氧生酸型 CuSO4或AgNO3 CuO或Ag2O
注意 电解后有关电解质溶液恢复原态的问题应该用质量守恒法分析。一般是加入阳极产物和阴极产物的化合物,但也有特殊情况,如用惰性电极电解CuSO4溶液,Cu2+完全放电之前,可加入CuO或CuCO3复原,而Cu2+完全放电之后,溶液中H+继续放电,应加入Cu(OH)2或Cu2(OH)2CO3复原。
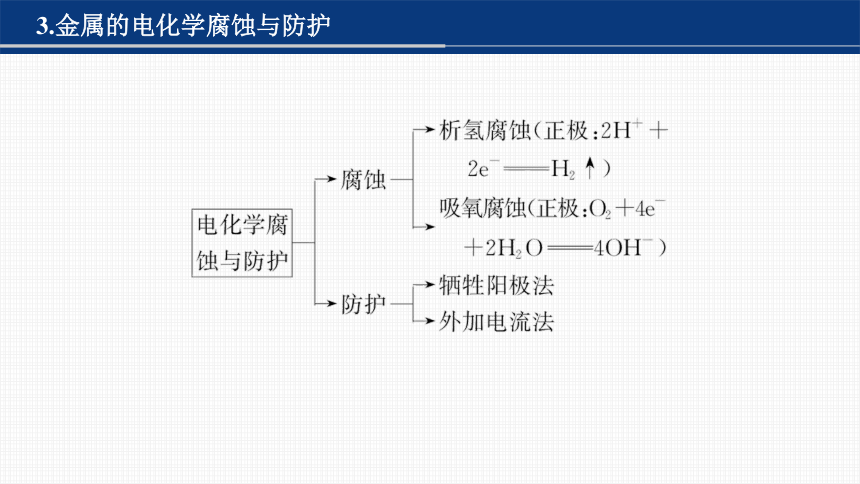
3.金属的电化学腐蚀与防护
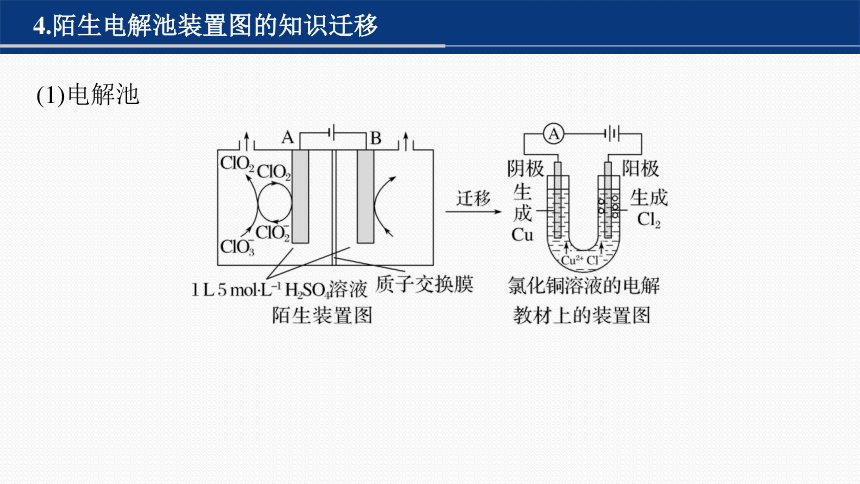
4.陌生电解池装置图的知识迁移
(1)电解池
(2)金属腐蚀
真题演练
02
1
2
3
4
5
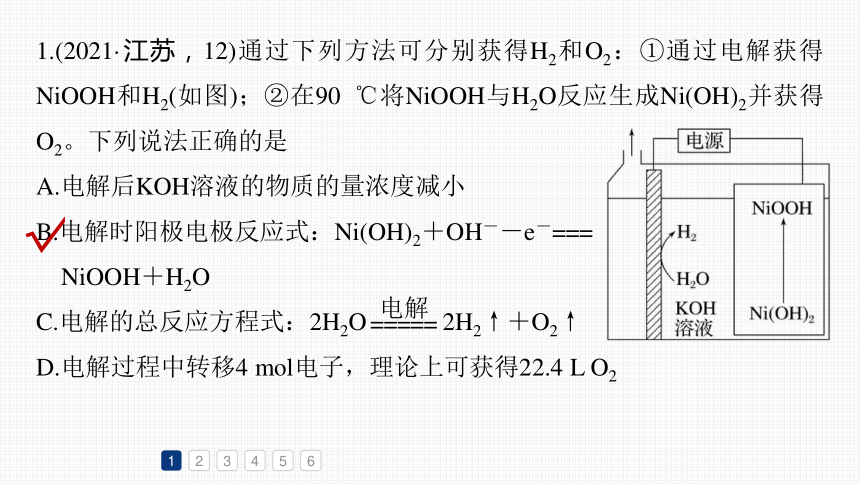
1.(2021·江苏,12)通过下列方法可分别获得H2和O2:①通过电解获得NiOOH和H2(如图);②在90 ℃将NiOOH与H2O反应生成Ni(OH)2并获得O2。下列说法正确的是
A.电解后KOH溶液的物质的量浓度减小
B.电解时阳极电极反应式:Ni(OH)2+OH--e-===
NiOOH+H2O
C.电解的总反应方程式:2H2O 2H2↑+O2↑
D.电解过程中转移4 mol电子,理论上可获得22.4 L O2
6
√
1
2
3
4
5
阴极水电离的氢离子得电子生成氢气,阳极
Ni(OH)2失电子生成NiOOH,电解过程总反应为
2Ni(OH)2 2NiOOH+H2↑,电解后KOH溶
液的物质的量浓度不变,故A、C错误;
电解时阳极Ni(OH)2失电子生成NiOOH,电极反应式为Ni(OH)2+OH--e-===NiOOH+H2O,故B正确;
电解过程中转移4 mol电子,生成1 mol氧气,非标准状况下的体积不一定是22.4 L,故D错误。
6
1
2
3
4
5
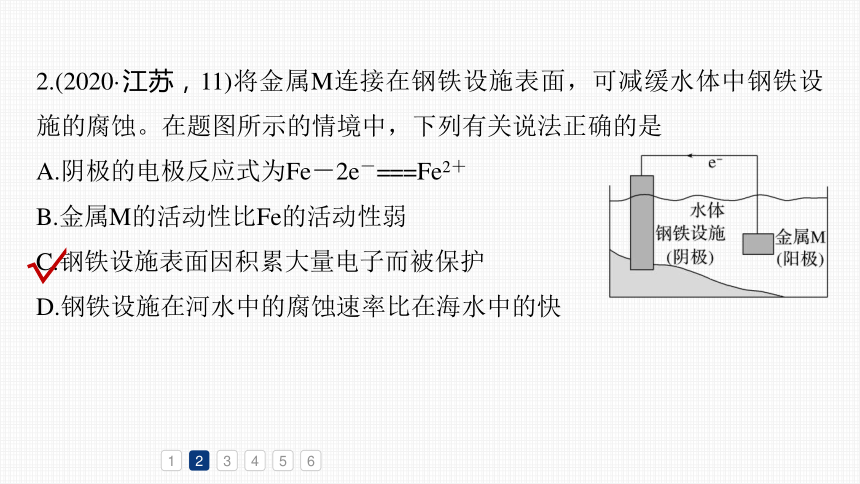
2.(2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
6
1
2
3
4
5
阴极得电子,A错误;
金属M失电子,其活动性应比铁强,B错误;
M失去的电子流入钢铁设施表面,因积累大量
电子而被保护,C正确;
海水中所含电解质的浓度远大于河水中的,因此钢铁设施在海水中腐蚀的速率快,D错误。
6
1
2
3
4
5
3.(2023·浙江6月选考,13)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为:2H2O+2e-===
H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少
能耗
√
6
电极A是氯离子变为氯气,化合价升高,
失去电子,是电解池阳极,因此电极A接
电源正极,发生氧化反应,故A正确;
电极B为阴极,通入的氧气得到电子,其
电极反应式为2H2O+4e-+O2===4OH-,故B错误;
右室生成氢氧根离子,应选用阳离子交换膜,左室的钠离子进入右室,在右室获得浓度较高的NaOH溶液,故C正确;
改进设计中增大了氧气的量,提高了电极B处的氧化性,从而降低电解电压,减少能耗,故D正确。
1
2
3
4
5
6
1
2
3
4
5
4.(2023·北京,5)回收利用工业废气中的CO2和SO2,实验原理示意图如下。
下列说法不正确的是
A.废气中SO2排放到大气中会形成
酸雨
C.装置a中溶液的作用是吸收废气中的CO2和SO2
6
√
1
2
3
4
5
SO2是酸性氧化物,废气中SO2排
放到大气中会形成硫酸型酸雨,
故A正确;
装置a中溶液的溶质为NaHCO3,
溶液显碱性,说明 的水解程度大于其电离程度,故B正确;
装置a中NaHCO3溶液的作用是吸收SO2气体,NaHCO3溶液不能吸收CO2,故C错误。
6
1
2
3
4
5
5.(2023·广东,16)用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利于电解反应顺利进行。下列说法不正确的是
A.电解总反应:KNO3+3H2O===
NH3·H2O+2O2↑+KOH
B.每生成1 mol NH3·H2O,双极膜处
有9 mol的H2O解离
C.电解过程中,阳极室中KOH的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
6
√
1
2
3
4
5
由大电流催化电解KNO3溶液制氨可知,在电极a处KNO3放电生成NH3,发生还原反应,故电极a为阴极,电极反应式为 +8e-+9H+===NH3·H2O+2H2O,电极
b为阳极,电极反应式为4OH-
-4e-===O2↑+2H2O,电解总
反应为KNO3+3H2O===NH3·H2O
+2O2↑+KOH,故A正确;
6
1
2
3
4
5
每生成1 mol NH3·H2O,阴极得
8 mol e-,同时双极膜处有8 mol
H+进入阴极室,即有8 mol的H2O
解离,故B错误;
电解过程中,阳极室每消耗4 mol OH-,同时有4 mol OH-通过双极膜进入阳极室,KOH的物质的量不因反应而改变,故C正确;
相比于平面结构双极膜,“卯榫”结构具有更大的膜面积,有利于H2O被催化解离成H+和OH-,可提高氨生成速率,故D正确。
6
1
2
3
4
5
6.(2023·辽宁,7)某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是
A.b端电势高于a端电势
B.理论上转移2 mol e-生成4 g H2
C.电解后海水pH下降
D.阳极发生:Cl-+H2O-2e-===HClO+H+
√
6
1
2
3
4
由题图分析可知,a为正极,b为负极,
则a端电势高于b端电势,A错误;
右侧电极上产生氢气的电极方程式为2H+
+2e-===H2↑,则理论上转移2 mol e-生
成2 g H2,B错误;
电解总反应为Cl-+H2O ClO-+H2↑,ClO-水解使溶液呈碱性,海水pH上升,C错误。
5
6
考向预测
03
1
2
3
4
5
1.(2023·南京师范大学附属中学高三模拟)科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图1所示,电源电压改变与生成NH3速率的关系如图2所示,下列说法不正确的是
A.Pt-C是该合成氨装置的阳极
B.Pt-C3N4电极上发生的反应为N2+6H+
+6e-===2NH3
C.若H2的进出口流量差为22.4 L·min-1,则固体质子导体中H+的流速为
2 mol·min-1
D.当电压高于1.2 V时,混合气体中N2和NH3的体积分数之和小于100%
√
1
2
3
4
5
图1可知,Pt-C电极是电解池的阳极,
氢气在阳极失去电子发生氧化反应生
成氢离子,电极反应式为H2-2e-===
2H+,Pt-C3N4电极为阴极,酸性条件
下氮气在阴极得到电子发生还原反应生成氨气,电极反应式为N2+6H++6e-===2NH3,故A、B正确;
未说明标准状况下,无法计算22.4 L氢气的物质的量和反应生成氢离子的物质的量,则无法计算固体质子导体中氢离子的流速,故C错误;
1
2
3
4
5
由图2可知,当电压高于1.2 V时,生成氨气速率变慢,说明氢离子在阴极得到电子生成氢气,导致混合气体中氮气和氨气的体积分数之和小于100%,故D正确。
1
2
3
4
5
2.(2023·连云港高级中学高三5月模拟)为实现氮氧化物脱除和再利用,工业上可以通过电解NO制备NH4NO3,其工作原理如图所示(图中a、b电极均为石墨电极)。下列有关说法不正确的是
A.b电极发生氧化反应
B.a电极上发生的反应:NO+5e-+6H+===
+H2O
C.若两极共通入标准状况下22.4 L NO,理论
上可以得到30 g NH4NO3
D.为使电解产物全部转化为NH4NO3,需补充的物质A是HNO3
√
1
2
3
4
5
由图可知,a电极NO得到电子发生还原反应生成铵根离子,a电极为阴极,则b电极为阳极,发生氧化反应,A、B正确;
1
2
3
4
5
结合C分析可知,反应后生成的硝酸过量,故为使电解产物全部转化为NH4NO3,需补充的物质A是氨气,D错误。
1
2
3
4
5
3.双极膜是一种离子交换复合膜,在直流电场作用下能将中间层的水分子解离成H+和OH-,并分别向两极迁移。用双极膜电解制备金属钴,工作原理如图所示。下列说法错误的是
A.电极a接电源的正极
B.电解过程中溶液中的 透过阴离子交换
膜向左移动
C.当电路中转移2 mol电子时,阳极产生22.4 L
H2(标准状况)
D.电解池工作时,阴离子交换膜与双极膜之间的溶液的pH减小
√
1
2
3
4
5
电解池中阳离子向阴极移动,则电极b是
阴极,电极a是阳极,电极a接电源的正极,
故A正确;
电解池中阴离子向阳极移动,电解过程中
溶液中的 透过阴离子交换膜向左移
动,故B正确;
当电路中转移2 mol电子时,阳极氢氧根离子失电子生成0.5 mol O2,故C错误;
1
2
3
4
5
电解池工作时, 通过阴离子交换膜向左移动与氢离子结合生成硫酸,阴离子交换膜与双极膜之间的溶液的pH减小,故D正确。
1
2
3
4
5
4.八钼酸铵[(NH4)4Mo8O26]可用于染料、催化剂、防火剂等。该化合物可通过电渗析法获得,工作原理如图。下列说法错误的是
A.a连接电源正极
C.电解一段时间后,b极附近氨水的浓度减小
D.双极膜附近的OH-移向左侧
√
1
2
3
4
5
由图可知,b为阴极,水放电生成氢气和氢氧根离子,a为阳极,连接电源正极,水放电生成氧气和氢离子,A正确;
电解一段时间后,b极附近生成的氢氧根离子和左侧迁移过来的铵根离子结合生成一水合氨,氨水的浓度增大,C错误;
阴离子向阳极迁移,双极膜附近的OH-移向左侧,D正确。
1
2
3
4
5
5.电解法处理含有Cl-、 的酸性废水,其工作原理及电极b中铁的化合物的催化机理如图所示,H表示氢原子。下列说法错误的是
A.电极b接电源负极
B.处理1 mol ,电路中转移5 mol e-
C.HClO在阳极生成:Cl-+H2O-2e-===HClO+H+
√
1
2
3
4
5
由图知,电极b上硝酸根离子转变为铵根离子,
被还原,则电极b为阴极,接电源负极,A正确;
硝酸根离子转变为铵根离子,N元素化合价从
+5价降低到-3价,则处理1 mol ,电路中
转移8 mol e-,B不正确;
阳极氯离子失去电子被氧化,生成HClO:Cl-+
H2O-2e-===HClO+H+,C正确;
1
2
3
4
5
本课结束
3.电解原理的多方面应用
选择题专攻
核心精讲
01
1.图解电解池工作原理(阳极为惰性电极)
2.对比掌握电解规律(阳极为惰性电极)
电解类型 电解质实例 溶液复原物质
电解水型 NaOH、H2SO4或Na2SO4 水
电解电解质型 HCl或CuCl2 原电解质
放氢生碱型 NaCl HCl气体
放氧生酸型 CuSO4或AgNO3 CuO或Ag2O
注意 电解后有关电解质溶液恢复原态的问题应该用质量守恒法分析。一般是加入阳极产物和阴极产物的化合物,但也有特殊情况,如用惰性电极电解CuSO4溶液,Cu2+完全放电之前,可加入CuO或CuCO3复原,而Cu2+完全放电之后,溶液中H+继续放电,应加入Cu(OH)2或Cu2(OH)2CO3复原。
3.金属的电化学腐蚀与防护
4.陌生电解池装置图的知识迁移
(1)电解池
(2)金属腐蚀
真题演练
02
1
2
3
4
5
1.(2021·江苏,12)通过下列方法可分别获得H2和O2:①通过电解获得NiOOH和H2(如图);②在90 ℃将NiOOH与H2O反应生成Ni(OH)2并获得O2。下列说法正确的是
A.电解后KOH溶液的物质的量浓度减小
B.电解时阳极电极反应式:Ni(OH)2+OH--e-===
NiOOH+H2O
C.电解的总反应方程式:2H2O 2H2↑+O2↑
D.电解过程中转移4 mol电子,理论上可获得22.4 L O2
6
√
1
2
3
4
5
阴极水电离的氢离子得电子生成氢气,阳极
Ni(OH)2失电子生成NiOOH,电解过程总反应为
2Ni(OH)2 2NiOOH+H2↑,电解后KOH溶
液的物质的量浓度不变,故A、C错误;
电解时阳极Ni(OH)2失电子生成NiOOH,电极反应式为Ni(OH)2+OH--e-===NiOOH+H2O,故B正确;
电解过程中转移4 mol电子,生成1 mol氧气,非标准状况下的体积不一定是22.4 L,故D错误。
6
1
2
3
4
5
2.(2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
6
1
2
3
4
5
阴极得电子,A错误;
金属M失电子,其活动性应比铁强,B错误;
M失去的电子流入钢铁设施表面,因积累大量
电子而被保护,C正确;
海水中所含电解质的浓度远大于河水中的,因此钢铁设施在海水中腐蚀的速率快,D错误。
6
1
2
3
4
5
3.(2023·浙江6月选考,13)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为:2H2O+2e-===
H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少
能耗
√
6
电极A是氯离子变为氯气,化合价升高,
失去电子,是电解池阳极,因此电极A接
电源正极,发生氧化反应,故A正确;
电极B为阴极,通入的氧气得到电子,其
电极反应式为2H2O+4e-+O2===4OH-,故B错误;
右室生成氢氧根离子,应选用阳离子交换膜,左室的钠离子进入右室,在右室获得浓度较高的NaOH溶液,故C正确;
改进设计中增大了氧气的量,提高了电极B处的氧化性,从而降低电解电压,减少能耗,故D正确。
1
2
3
4
5
6
1
2
3
4
5
4.(2023·北京,5)回收利用工业废气中的CO2和SO2,实验原理示意图如下。
下列说法不正确的是
A.废气中SO2排放到大气中会形成
酸雨
C.装置a中溶液的作用是吸收废气中的CO2和SO2
6
√
1
2
3
4
5
SO2是酸性氧化物,废气中SO2排
放到大气中会形成硫酸型酸雨,
故A正确;
装置a中溶液的溶质为NaHCO3,
溶液显碱性,说明 的水解程度大于其电离程度,故B正确;
装置a中NaHCO3溶液的作用是吸收SO2气体,NaHCO3溶液不能吸收CO2,故C错误。
6
1
2
3
4
5
5.(2023·广东,16)用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利于电解反应顺利进行。下列说法不正确的是
A.电解总反应:KNO3+3H2O===
NH3·H2O+2O2↑+KOH
B.每生成1 mol NH3·H2O,双极膜处
有9 mol的H2O解离
C.电解过程中,阳极室中KOH的物质的量不因反应而改变
D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
6
√
1
2
3
4
5
由大电流催化电解KNO3溶液制氨可知,在电极a处KNO3放电生成NH3,发生还原反应,故电极a为阴极,电极反应式为 +8e-+9H+===NH3·H2O+2H2O,电极
b为阳极,电极反应式为4OH-
-4e-===O2↑+2H2O,电解总
反应为KNO3+3H2O===NH3·H2O
+2O2↑+KOH,故A正确;
6
1
2
3
4
5
每生成1 mol NH3·H2O,阴极得
8 mol e-,同时双极膜处有8 mol
H+进入阴极室,即有8 mol的H2O
解离,故B错误;
电解过程中,阳极室每消耗4 mol OH-,同时有4 mol OH-通过双极膜进入阳极室,KOH的物质的量不因反应而改变,故C正确;
相比于平面结构双极膜,“卯榫”结构具有更大的膜面积,有利于H2O被催化解离成H+和OH-,可提高氨生成速率,故D正确。
6
1
2
3
4
5
6.(2023·辽宁,7)某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是
A.b端电势高于a端电势
B.理论上转移2 mol e-生成4 g H2
C.电解后海水pH下降
D.阳极发生:Cl-+H2O-2e-===HClO+H+
√
6
1
2
3
4
由题图分析可知,a为正极,b为负极,
则a端电势高于b端电势,A错误;
右侧电极上产生氢气的电极方程式为2H+
+2e-===H2↑,则理论上转移2 mol e-生
成2 g H2,B错误;
电解总反应为Cl-+H2O ClO-+H2↑,ClO-水解使溶液呈碱性,海水pH上升,C错误。
5
6
考向预测
03
1
2
3
4
5
1.(2023·南京师范大学附属中学高三模拟)科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图1所示,电源电压改变与生成NH3速率的关系如图2所示,下列说法不正确的是
A.Pt-C是该合成氨装置的阳极
B.Pt-C3N4电极上发生的反应为N2+6H+
+6e-===2NH3
C.若H2的进出口流量差为22.4 L·min-1,则固体质子导体中H+的流速为
2 mol·min-1
D.当电压高于1.2 V时,混合气体中N2和NH3的体积分数之和小于100%
√
1
2
3
4
5
图1可知,Pt-C电极是电解池的阳极,
氢气在阳极失去电子发生氧化反应生
成氢离子,电极反应式为H2-2e-===
2H+,Pt-C3N4电极为阴极,酸性条件
下氮气在阴极得到电子发生还原反应生成氨气,电极反应式为N2+6H++6e-===2NH3,故A、B正确;
未说明标准状况下,无法计算22.4 L氢气的物质的量和反应生成氢离子的物质的量,则无法计算固体质子导体中氢离子的流速,故C错误;
1
2
3
4
5
由图2可知,当电压高于1.2 V时,生成氨气速率变慢,说明氢离子在阴极得到电子生成氢气,导致混合气体中氮气和氨气的体积分数之和小于100%,故D正确。
1
2
3
4
5
2.(2023·连云港高级中学高三5月模拟)为实现氮氧化物脱除和再利用,工业上可以通过电解NO制备NH4NO3,其工作原理如图所示(图中a、b电极均为石墨电极)。下列有关说法不正确的是
A.b电极发生氧化反应
B.a电极上发生的反应:NO+5e-+6H+===
+H2O
C.若两极共通入标准状况下22.4 L NO,理论
上可以得到30 g NH4NO3
D.为使电解产物全部转化为NH4NO3,需补充的物质A是HNO3
√
1
2
3
4
5
由图可知,a电极NO得到电子发生还原反应生成铵根离子,a电极为阴极,则b电极为阳极,发生氧化反应,A、B正确;
1
2
3
4
5
结合C分析可知,反应后生成的硝酸过量,故为使电解产物全部转化为NH4NO3,需补充的物质A是氨气,D错误。
1
2
3
4
5
3.双极膜是一种离子交换复合膜,在直流电场作用下能将中间层的水分子解离成H+和OH-,并分别向两极迁移。用双极膜电解制备金属钴,工作原理如图所示。下列说法错误的是
A.电极a接电源的正极
B.电解过程中溶液中的 透过阴离子交换
膜向左移动
C.当电路中转移2 mol电子时,阳极产生22.4 L
H2(标准状况)
D.电解池工作时,阴离子交换膜与双极膜之间的溶液的pH减小
√
1
2
3
4
5
电解池中阳离子向阴极移动,则电极b是
阴极,电极a是阳极,电极a接电源的正极,
故A正确;
电解池中阴离子向阳极移动,电解过程中
溶液中的 透过阴离子交换膜向左移
动,故B正确;
当电路中转移2 mol电子时,阳极氢氧根离子失电子生成0.5 mol O2,故C错误;
1
2
3
4
5
电解池工作时, 通过阴离子交换膜向左移动与氢离子结合生成硫酸,阴离子交换膜与双极膜之间的溶液的pH减小,故D正确。
1
2
3
4
5
4.八钼酸铵[(NH4)4Mo8O26]可用于染料、催化剂、防火剂等。该化合物可通过电渗析法获得,工作原理如图。下列说法错误的是
A.a连接电源正极
C.电解一段时间后,b极附近氨水的浓度减小
D.双极膜附近的OH-移向左侧
√
1
2
3
4
5
由图可知,b为阴极,水放电生成氢气和氢氧根离子,a为阳极,连接电源正极,水放电生成氧气和氢离子,A正确;
电解一段时间后,b极附近生成的氢氧根离子和左侧迁移过来的铵根离子结合生成一水合氨,氨水的浓度增大,C错误;
阴离子向阳极迁移,双极膜附近的OH-移向左侧,D正确。
1
2
3
4
5
5.电解法处理含有Cl-、 的酸性废水,其工作原理及电极b中铁的化合物的催化机理如图所示,H表示氢原子。下列说法错误的是
A.电极b接电源负极
B.处理1 mol ,电路中转移5 mol e-
C.HClO在阳极生成:Cl-+H2O-2e-===HClO+H+
√
1
2
3
4
5
由图知,电极b上硝酸根离子转变为铵根离子,
被还原,则电极b为阴极,接电源负极,A正确;
硝酸根离子转变为铵根离子,N元素化合价从
+5价降低到-3价,则处理1 mol ,电路中
转移8 mol e-,B不正确;
阳极氯离子失去电子被氧化,生成HClO:Cl-+
H2O-2e-===HClO+H+,C正确;
1
2
3
4
5
本课结束
同课章节目录
