5.1化学反应中的质量守恒课件(共21张PPT)---2023--2024学年九年级化学鲁教版上册
文档属性
| 名称 | 5.1化学反应中的质量守恒课件(共21张PPT)---2023--2024学年九年级化学鲁教版上册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
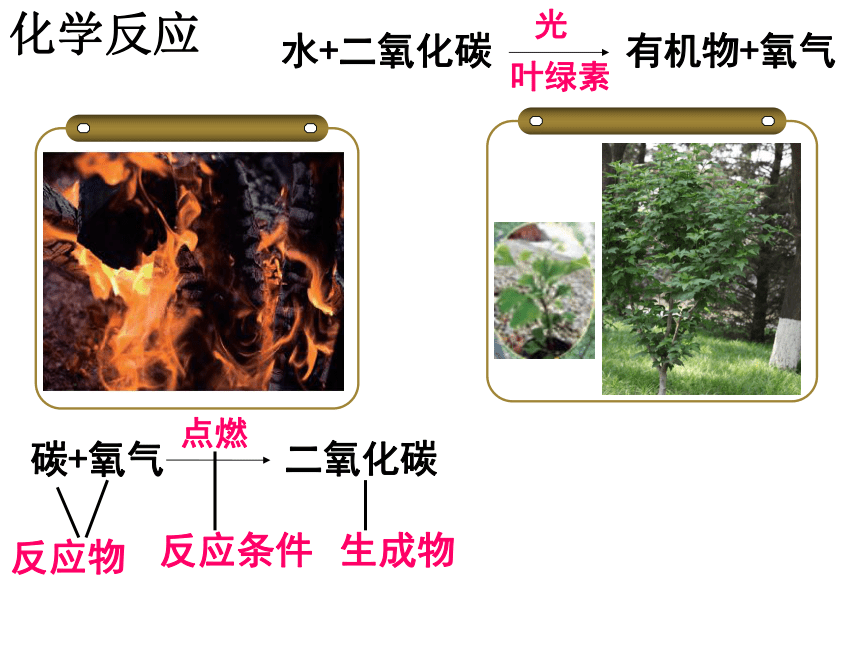
化学反应
碳+氧气
点燃
二氧化碳
水+二氧化碳
光
有机物+氧气
叶绿素
反应物
生成物
反应条件
化学反应中的质量守恒
第五单元第一节
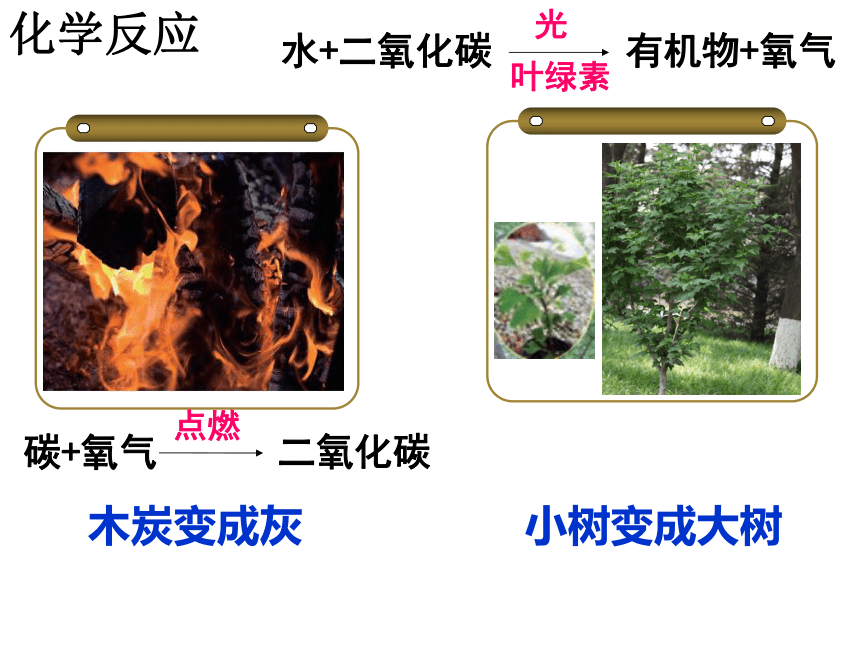
化学反应
碳+氧气
点燃
二氧化碳
水+二氧化碳
光
有机物+氧气
叶绿素
小树变成大树
木炭变成灰
提出问题:
化学反应前后物质的质量如何变化?
作出假设:
化学反应前后物质的质量相等
化学反应前后物质的质量不相等
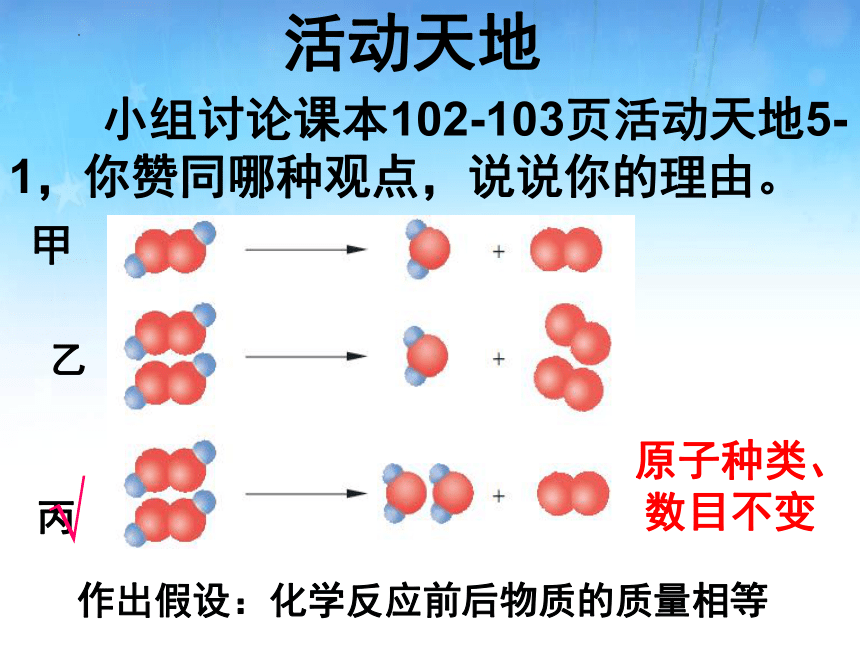
活动天地
小组讨论课本102-103页活动天地5-1,你赞同哪种观点,说说你的理由。
乙
甲
丙
√
作出假设:化学反应前后物质的质量相等
原子种类、
数目不变
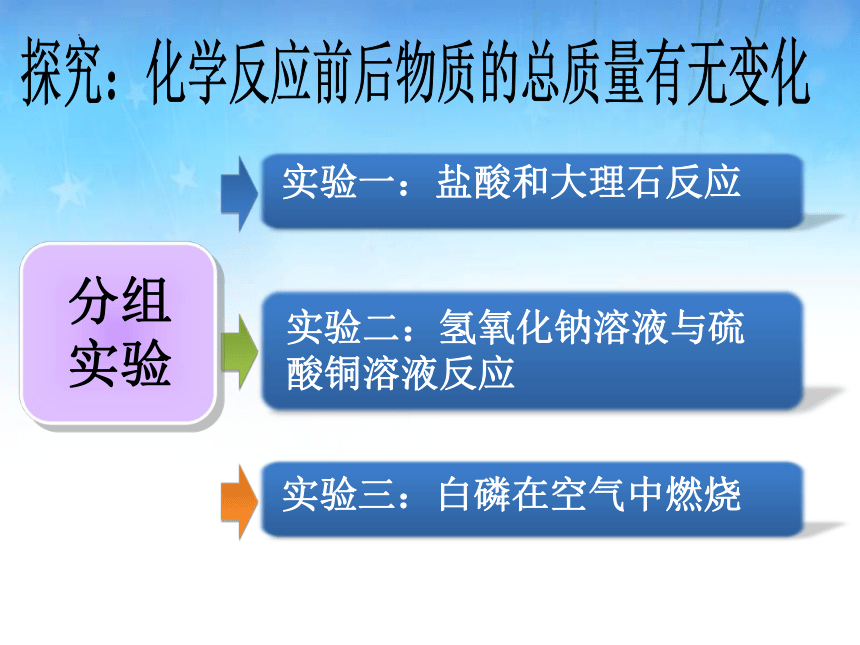
实验二:氢氧化钠溶液与硫酸铜溶液反应
实验一:盐酸和大理石反应
实验三:白磷在空气中燃烧
探究:化学反应前后物质的总质量有无变化
分组
实验
碳酸钙+氯化氢
氯化钙+二氧化碳+水
现象:产生大量气泡,气球胀大
氢氧化钠+硫酸铜
硫酸钠+氢氧化铜
现象:产生蓝色沉淀。
锥形瓶、橡皮塞、玻璃棒、细沙、白磷、氧气、空气的其他成分
锥形瓶、橡皮塞、玻璃棒、细沙、五氧化二磷、空气的其他成分
白磷、氧气
的质量总和
五氧化二磷
的质量总和
参加反应的各物质
的质量总和
反应后生成的各物质
的质量总和
推导求证
参加化学反应的各物质质量总和等于反应后生成的各物质的质量总和.
质量守恒定律
1
判断:10g冰加热熔化后得到10g水,这一变化遵循质量守恒定律 。
2
判断:10ml水通电分解得到2ml氢气和8ml氧气,这一变化遵循质量守恒定律.
理解与应用
参加化学反应的各物质质量总和等于反应后生成的各物质的质量总和.
适用于化学变化、而不是物理变化
守恒的是质量、而不是体积等
参加反应的各反应物的总质量
=生成物的总质量
理解与应用
18克
2克
16克
参加反应的各反应物的总质量
=生成物的总质量
4-1克
2克
5克
理解与应用
把握质量守恒定律应注意几点:
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”,而不是体积、能量、分子个数等。
如有沉淀、气体等都应考虑进去。
3、“参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
为什么在化学反应前后,物质发生了变化,而物质的总质量却不变呢?
化学反应前后,原子的
种类、数目、质量没有改变。
没有改变
没有改变
宏观
微观
元素种类
元素质量
原子种类
原子数目
原子质量
物质的总质量没有改变
1、某物质在空气中燃烧,生成水和二氧化碳,则该物质中一定包含有 元素,可能含有_____元素。
元素种类
不变
实战演练
O
C、H
用质量守恒定律解释
碳+氧气
点燃
二氧化碳
根据质量守恒定律,
M 碳+M氧气= M二氧化碳
CO2扩散到空气中,
因此质量减少。
为什么木炭燃烧成灰质量减少?
1.某同学做了两个试验①氧化汞受热分解生成汞和氧气②镁在氧气中燃烧生成氧化镁。他认真的收集其反应的生成物,并准确的称量了反应物和生成物的质量,得到如下数据:
他看了这些数据后认为:实验(1)中生成物的质量减少了,实验(2)中生成物的质量增加了,所以都不遵守质量守恒定律了。他的说法正确吗?为什么?
不正确。因为氧化汞受热分解有氧气生成,镁条燃烧需要氧气 ,而这些数据都忽略了氧气的存在,导致固体质量增多或者减少,所以遵循质量守恒定律。
实验(1) 氧化汞1.083克 金属汞1.003克
实验(2) 金属镁0.486克 氧化镁0.806克
5
原子的种类
1
元素的种类
4
物质的种类
2
原子的数目
6
化学反应前后物质的状态
3
分子的种类
7
化学反应前后各物质的总质量
2、化学反应前后,肯定没有变的是:
实战演练
√
√
√
√
A层:
1. 熟记质量守恒定律内容和实质。
2.用质量守恒定律解释:
(1)铁丝燃烧后质量增加。
(2)蜡烛燃烧后质量变小。
B层:
探究:蜡烛燃烧前后物质
的总质量有没有变化?
推荐作业
化学反应
碳+氧气
点燃
二氧化碳
水+二氧化碳
光
有机物+氧气
叶绿素
反应物
生成物
反应条件
化学反应中的质量守恒
第五单元第一节
化学反应
碳+氧气
点燃
二氧化碳
水+二氧化碳
光
有机物+氧气
叶绿素
小树变成大树
木炭变成灰
提出问题:
化学反应前后物质的质量如何变化?
作出假设:
化学反应前后物质的质量相等
化学反应前后物质的质量不相等
活动天地
小组讨论课本102-103页活动天地5-1,你赞同哪种观点,说说你的理由。
乙
甲
丙
√
作出假设:化学反应前后物质的质量相等
原子种类、
数目不变
实验二:氢氧化钠溶液与硫酸铜溶液反应
实验一:盐酸和大理石反应
实验三:白磷在空气中燃烧
探究:化学反应前后物质的总质量有无变化
分组
实验
碳酸钙+氯化氢
氯化钙+二氧化碳+水
现象:产生大量气泡,气球胀大
氢氧化钠+硫酸铜
硫酸钠+氢氧化铜
现象:产生蓝色沉淀。
锥形瓶、橡皮塞、玻璃棒、细沙、白磷、氧气、空气的其他成分
锥形瓶、橡皮塞、玻璃棒、细沙、五氧化二磷、空气的其他成分
白磷、氧气
的质量总和
五氧化二磷
的质量总和
参加反应的各物质
的质量总和
反应后生成的各物质
的质量总和
推导求证
参加化学反应的各物质质量总和等于反应后生成的各物质的质量总和.
质量守恒定律
1
判断:10g冰加热熔化后得到10g水,这一变化遵循质量守恒定律 。
2
判断:10ml水通电分解得到2ml氢气和8ml氧气,这一变化遵循质量守恒定律.
理解与应用
参加化学反应的各物质质量总和等于反应后生成的各物质的质量总和.
适用于化学变化、而不是物理变化
守恒的是质量、而不是体积等
参加反应的各反应物的总质量
=生成物的总质量
理解与应用
18克
2克
16克
参加反应的各反应物的总质量
=生成物的总质量
4-1克
2克
5克
理解与应用
把握质量守恒定律应注意几点:
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”,而不是体积、能量、分子个数等。
如有沉淀、气体等都应考虑进去。
3、“参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
为什么在化学反应前后,物质发生了变化,而物质的总质量却不变呢?
化学反应前后,原子的
种类、数目、质量没有改变。
没有改变
没有改变
宏观
微观
元素种类
元素质量
原子种类
原子数目
原子质量
物质的总质量没有改变
1、某物质在空气中燃烧,生成水和二氧化碳,则该物质中一定包含有 元素,可能含有_____元素。
元素种类
不变
实战演练
O
C、H
用质量守恒定律解释
碳+氧气
点燃
二氧化碳
根据质量守恒定律,
M 碳+M氧气= M二氧化碳
CO2扩散到空气中,
因此质量减少。
为什么木炭燃烧成灰质量减少?
1.某同学做了两个试验①氧化汞受热分解生成汞和氧气②镁在氧气中燃烧生成氧化镁。他认真的收集其反应的生成物,并准确的称量了反应物和生成物的质量,得到如下数据:
他看了这些数据后认为:实验(1)中生成物的质量减少了,实验(2)中生成物的质量增加了,所以都不遵守质量守恒定律了。他的说法正确吗?为什么?
不正确。因为氧化汞受热分解有氧气生成,镁条燃烧需要氧气 ,而这些数据都忽略了氧气的存在,导致固体质量增多或者减少,所以遵循质量守恒定律。
实验(1) 氧化汞1.083克 金属汞1.003克
实验(2) 金属镁0.486克 氧化镁0.806克
5
原子的种类
1
元素的种类
4
物质的种类
2
原子的数目
6
化学反应前后物质的状态
3
分子的种类
7
化学反应前后各物质的总质量
2、化学反应前后,肯定没有变的是:
实战演练
√
√
√
√
A层:
1. 熟记质量守恒定律内容和实质。
2.用质量守恒定律解释:
(1)铁丝燃烧后质量增加。
(2)蜡烛燃烧后质量变小。
B层:
探究:蜡烛燃烧前后物质
的总质量有没有变化?
推荐作业
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
