3.1 铁的多样性 课时练习(含解析) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1 铁的多样性 课时练习(含解析) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 96.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 14:47:53 | ||
图片预览




文档简介
3.1 铁的多样性 课时练习
一、单选题
1.下列溶液中,常温下可以用铁制容器装运的是( )
A.浓硝酸 B.浓盐酸 C.硫酸铜溶液 D.稀硫酸
2.要除去FeCl2溶液中的少量氯化铁,可行的办法是( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉
3.将少量铁粉加入到下列溶液中,铁粉溶解,但不产生气体和沉淀的是( )
A.稀H2SO4溶液 B.FeCl3溶液 C.CuSO4溶液 D.NaCl溶液
4.下列有关试剂保存的说法中,错误的是( )
A.金属钠保存在煤油中
B.保存氯化亚铁溶液时加入少量铁粉
C.过氧化钠应密封保存
D.用棕色广口试剂瓶存放氯水
5.检验KCl溶液中是否混有Fe3+时,可选择的试剂是( )
A.硫氰化钾溶液 B.硝酸
C.盐酸 D.硫酸
6.现要除去 溶液中的少量 和 ,可行的方法是( )
A.通入氯气 B.加入铁粉
C.加入铜粉 D.滴入 溶液
7.下列有关铁及其化合物的说法中错误的是( )
A.为了防止氯化亚铁溶液久置变质,常在其溶液中加入少许铁钉
B.将饱和FeCl3溶液滴入沸水中,能形成胶体
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加铁粉,然后过滤
8.物质之间反应,一定不产生H2的是( )
A.过氧化钠和水 B.金属钠和冷水
C.铁和热浓硫酸 D.炽热铁和水蒸气
9.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.浓硫酸
C.氢氧化钠溶液 D.硫酸铜溶液
10.向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
11.Fe与下列物质反应的产物,能使KSCN溶液显红色的是( )
A.H2O B.O2 C.S D.足量稀HNO3
12.向Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色变化应该是( )
A.无变化 B.颜色变浅 C.变为棕黄色 D.变为红褐色
13.下列实验或现象能证明某硫酸铝溶液中含的杂质一定为Fe3+的是( )
A.加入足量氢氧化钠溶液后产生的浑浊不溶解
B.用pH试纸检验呈弱酸性
C.滴入KSCN溶液后溶液变血红色
D.溶液显浅黄色
14.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CaCl2(aq) CaCO3 CaO
B.Na Na2O NaOH
C.(C6H10O5)n(淀粉) C6H12O6(葡萄糖) C2H5OH
D.Cu2S Cu CuSO4
15.下列化学方程式书写正确的是
A.往碳酸钠溶液中加入少量稀盐酸:
B.往硫酸亚铁溶液中加入少量铜粉:
C.往氯化铁溶液中加入少量金属钠:
D.往氯化钙溶液中通入少量二氧化碳:
16.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe→Fe2O3→Fe(OH)3→Fe B.Si→SiO2→H2SiO3→CaSiO3
C.NaOH→NaCl→Na2CO3→NaOH D.HCl→CuCl2→BaCl2→HCl
二、综合题
17.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeSO4,其流程如下:
(1)“酸溶”时,提高反应速率的措施有 (写一条)。
(2)加入Fe粉还原后,检验Fe3+是否反应完全的试剂为 。
(3)写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式: 。
18.一个体重50kg的健康人含铁元素2g,这2g铁元素以Fe2+和Fe3+形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+.在过程A中,Fe2+作 剂;
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有 性;
(3)某同学要检验Fe3+,向溶液中加入 (写化学式)溶液变成红色.要除去FeCl3溶液中少量的氯化亚铁,可行的办法是 (填字母).
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 ;
(4)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 .
19.FeCl3蚀刻液由FeCl3和盐酸等组成,可用于蚀刻铜及铜合金等。
(1)加入盐酸可抑制Fe3+及生成的Cu2+的水解, Fe3+水解的离子方程式为 。
(2)FeCl3溶液蚀刻铜的化学方程式为 。
(3)测定某废蚀刻液中Cu2+含量的实验步骤如下:量取25.00mL废蚀刻液,加入足量的NH4HF2(掩蔽Fe3+,消除干扰),加入稍过量KI溶液(2Cu2++4I-=2CuI↓+ I2),在暗处静置5min,然后用0.02000mol·L-1Na2S2O3标准溶液滴定(I2+2S2O =2I-+S4O ),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①不加NH4HF2会导致测得的铜的含量 (填:“偏高”“偏低”或“不变”)。
②通过计算确定该废蚀刻液中铜的含量(单位g·L-1,写出计算过程) 。
20.现有以下物质:①Na2O2固体、②液氨、③NaOH、④熔融KHSO4、⑤Fe(OH)3胶体、⑥铜、⑦CO2、⑧CH3COOH、⑨蔗糖。
(1)以上物质中属于电解质的是 (填序号,下同);属于单质的是 。
(2)制备⑤时,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 ,继续煮沸至液体呈透明的红褐色,停止加热;然后向其中逐滴滴入过量盐酸,实验现象为 。
(3)写出①和⑦反应的化学方程式 。
(4)③的溶液不能装在带磨口玻璃塞的试剂瓶中,用离子方程式说明其原因 。
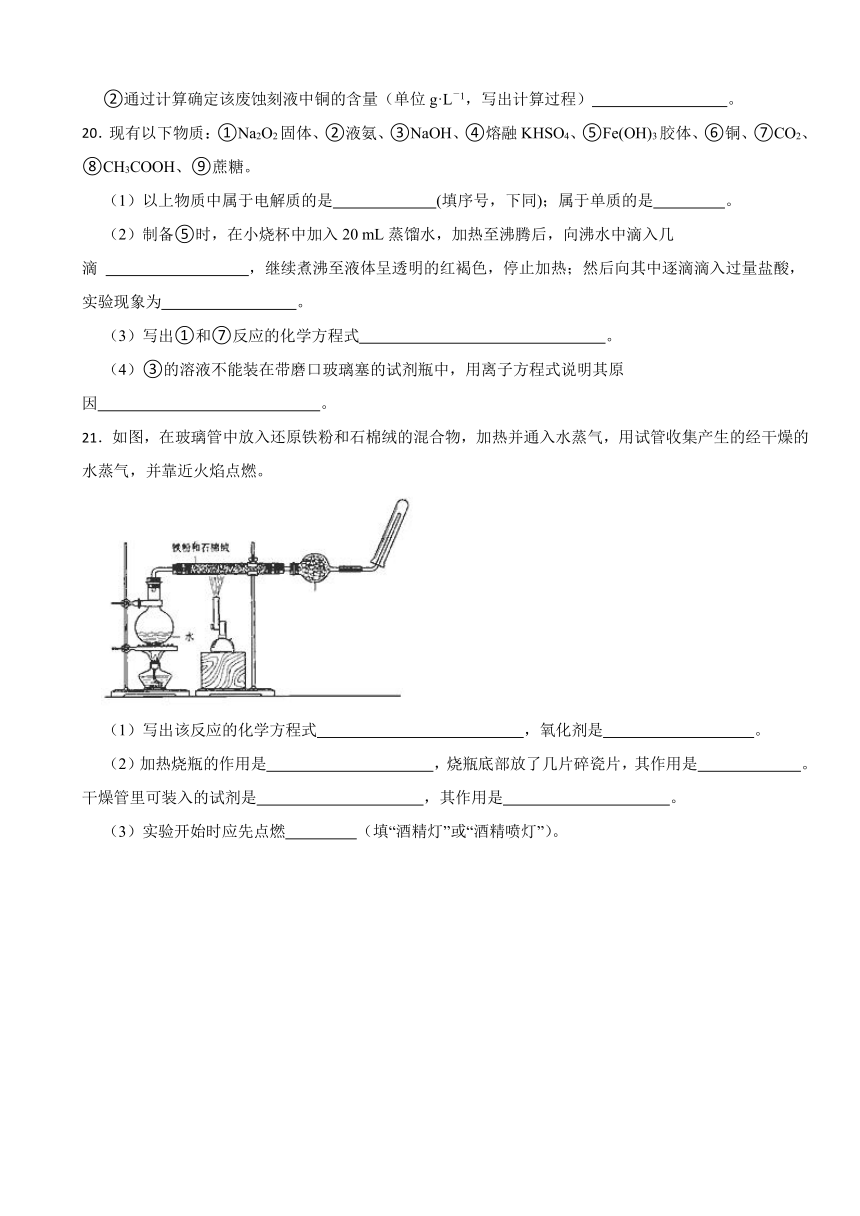
21.如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。
(1)写出该反应的化学方程式 ,氧化剂是 。
(2)加热烧瓶的作用是 ,烧瓶底部放了几片碎瓷片,其作用是 。干燥管里可装入的试剂是 ,其作用是 。
(3)实验开始时应先点燃 (填“酒精灯”或“酒精喷灯”)。
答案解析部分
1.【答案】A
【解析】【解答】A、常温下,铁遇浓硫酸发生钝化,则可用铁罐装运浓硫酸,故A符合题意;
B、铁与浓盐酸反应生成氯化亚铁和氢气,不能用铁罐装运,故B不符合题意;
C、铁与硫酸铜反应生成硫酸亚铁和Cu,则不能用铁罐装运,故C不符合题意;
D、铁与稀硫酸反应生成硫酸亚铁和氢气,不能用铁罐装运用,故D不符合题意。
故答案为:A。
【分析】A、浓硫酸、浓硝酸可以使铁、铝钝化;
B、浓盐酸不能使铁钝化,可以和铁反应;
C、铁和铜离子可以发生置换反应;
D、稀硫酸可以和铁反应。
2.【答案】D
【解析】【解答】A. 滴入KSCN溶液可以检验铁离子,不能除去氯化铁,A不符合题意;
B. 通入氯气把氯化亚铁氧化为氯化铁,B不符合题意;
C. 加入铜粉与氯化铁反应生成氯化亚铁和氯化铜,引入新杂质,C不符合题意;
D. 加入铁粉与氯化铁反应生成氯化亚铁,可以除去氯化铁杂质,D符合题意,
故答案为:D。
【分析】铁离子具有氧化性,能与铁发生反应生成亚铁离子,除去铁离子时不能带入新的杂质,据此解答即可。
3.【答案】B
【解析】【解答】A.铁与稀硫酸反应生成硫酸亚铁和氢气,故不选A;
B.铁氯化铁溶液反应生成氯化亚铁,铁粉溶解,但不产生气体和沉淀,
C.铁与硫酸铜溶液反应生成硫酸亚铁和铜,故不选C;
D.铁与氯化钠溶液不反应,故不选D;
故答案选B。
【分析】铁与稀硫酸反应生成氢气、与硫酸铜溶液发生置换反应、与NaCl溶液不反应,铁与氯化铁溶液反应发生氧化还原反应生成氯化亚铁,据此解答即可。
4.【答案】D
【解析】【解答】A、金属钠还原性强,暴露在空气中会被氧化,金属钠的密度大于煤油小于水,因此少量金属钠可保存在煤油中,隔绝空气。不符合题意;
B、亚铁离子容易被空气中的氧气氧化成三价铁离子,因此保存氯化亚铁溶液时加入少量铁粉,防止氧化。不符合题意;
C、过氧化钠易于和空气中的水和二氧化碳反应,所以应在干燥环境下密封保存。不符合题意;
D、氯水见光其中的次氯酸易分解,并属于液体,应盛放在棕色细口试剂瓶中。符合题意;
故答案为:D。
【分析】一般固体药品存放在广口瓶中,液体药品存放在细口瓶中。
5.【答案】A
【解析】【解答】Fe3+硫氰化钾溶液反应,溶液呈红色,故A符合题意。
【分析】检验Fe3+只有一种方法,那就是遇硫氰化钾显血红色,记住即可
6.【答案】B
【解析】【解答】
A.氯气与亚铁离子反应,故A不符合题意;
B.铁与三价铁离子和铜离子反应生成亚铁离子,然后过滤即可,故B符合题意;
C.加入铜粉无法除去氯化铜,故C不符合题意;
D.加入 溶液只能检验三价铁离子,无法除去,故D不符合题意;
故答案为:B.
【分析】
除杂原则:不能引入新的杂质,要保证产物易于分离,原物质不反应而杂质完全反应。
7.【答案】D
【解析】【解答】A. 亚铁离子在空气中易被氧化为三价铁离子,加铁钉可以防止氯化亚铁溶液的变质,故A不符合题意;
B. 制备氢氧化铁胶体的方法是将饱和FeCl3溶液滴入沸水中,搅拌到红褐色即可,故B不符合题意;
C. 新制的氢氧化亚铁沉淀露置在空气中迅速变成灰绿色,最终会变为红褐色的氢氧化铁,故C不符合题意;
D. 除去FeCl3溶液中的FeCl2杂质可以向溶液中滴加氯水,将氯化亚铁氧化为氯化铁,故D符合题意。
【分析】A.氯化铁可与铁反应生成氯化亚铁;
B.饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,是利用氯化铁水解加热促进生成;
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色的氢氧化铁;
D. 氯化铁可与铁反应生成氯化亚铁。
8.【答案】A
【解析】【解答】A. 过氧化钠和水反应生成氧气和氢氧化钠,A符合题意;
B. 金属钠和冷水反应生成氢气和氢氧化钠,B不符合题意;
C. 铁和热浓硫酸反应,随着反应的进行,浓硫酸变为稀硫酸,稀硫酸与铁反应生成氢气,C不符合题意;
D. 炽热铁和水蒸气生成反应生成四氧化三铁和氢气,D不符合题意;
故答案为:A
【分析】A.Na2O2与H2O反应生成O2;
B.Na与H2O反应生成H2;
C.铁与热的浓硫酸反应生成SO2,与稀硫酸反应生成H2;
D.铁与水蒸气反应生成H2;
9.【答案】C
【解析】【解答】A.铁与稀硫酸反应:Fe+H2SO4=FeSO4+H2 ,不符合题意;
B.常温下,铁与浓硫酸会发生氧化还原反应生成致密的氧化膜导致铁钝化,不符合题意;
C.铁与氢氧化钠溶液不发生反应,符合题意;
D.铁与硫酸铜发生置换反应:Fe+CuSO4=FeSO4+Cu,不符合题意;
故答案为:C。
【分析】需注意,常温下,铝和铁与浓硫酸或浓硝酸会发生钝化,并不是铁和铝不与浓硫酸或浓硝酸反应。
10.【答案】B
【解析】【解答】盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)= n(HCl)= ×0.1L×2mol/L=0.1mol;用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.1mol,质量为0.1mol×56g/mol=5.6g,
故答案为:B。
【分析】由题意可得,铁完全转化为氯化亚铁,则物质的量之比Fe:Cl=1:2,又n(Cl-)=0.2mol
故n(Fe)=0.1mol
11.【答案】D
【解析】【解答】A. Fe与H
2O蒸汽反应生成四氧化三铁固体,不与KSCN 溶液反应,故A不符合题意;
B.Fe与O2点燃反应生成四氧化三铁固体,不与KSCN 溶液反应,故B不符合题意;
C.Fe与S加热反应生成硫化亚铁固体,不与KSCN 溶液反应,故C不符合题意;
D. Fe与足量稀HNO3生成硝酸铁,滴入KSCN 溶液,显红色,故D符合题意;
故答案为:D。
【分析】+3价铁离子能使KSCN溶液显红色。强氧化剂如硝酸、氯气能将铁氧化到+3价,而S或碘单质等弱氧化剂只能将铁氧化到+2价,铁与水蒸气反应 3Fe + 4H2O(g)
Fe3O4 + 4H2。
12.【答案】C
【解析】【解答】解:往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3﹣+4H+═3Fe3++NO↑+2H20,三价铁离子为棕黄色,
故选C.
【分析】酸性条件下硝酸根离子具有强氧化性,能将亚铁离子氧化为三价,二价铁浅绿色,三价铁为棕黄色,以此解答.
13.【答案】C
【解析】【解答】解:A、能和足量的氢氧化钠溶液产生沉淀不溶解的除了Fe3+,还有Cu2+、Mg2+等,故A不能说说明Fe3+的存在,故A错误;
B、硫酸铝是强酸弱碱盐,其溶液本身显弱酸性,故不能说明Fe3+的存在,故B错误;
C、Fe3+遇KSCN溶液时溶液为血红色,能说明Fe3+的存在,故C正确;
D、溶液显浅黄色的不只Fe3+,还有氯水等,故D错误.
故选C.
【分析】根据Fe3+的检验方法可知,Fe3+遇KSCN溶液时溶液为血红色,以此来检验.
14.【答案】C
【解析】【解答】A.二氧化碳与氯化钙溶液不反应,碳酸钙受热分解生成氧化钙和二氧化碳,其中第一步不能实现转化,选项A不符合题意;
B.钠在氧气中点燃反应生成过氧化钠而不是生成氧化钠,氧化钠与水反应生成氢氧化钠,其中第一步不能实现转化,选项B不符合题意;
C.淀粉在稀硫酸催化下水解最终生成葡萄糖,葡萄糖在酒化酶的催化下反应生成乙醇和二氧化碳,两步转化均能实现,选项C符合题意;
D.高温条件下硫化亚铜与氧气反应生成铜和二氧化硫(火法炼铜),铜与稀硫酸不反应无法得到硫酸铜,第一步转化不能实现,选项D不符合题意;
故答案为:C。
【分析】A、二氧化碳和氯化钙不能制得碳酸钙
B、钠和氧气在高温下的产物是过氧化钠
D、铜与稀硫酸不反应
15.【答案】C
【解析】【解答】A.往碳酸钠溶液中加入少量稀盐酸,生成碳酸氢钠无气泡产生,A不符合题意 ;
B.金属活动性:Fe>Cu,加入少量铜粉不和亚铁离子反应,B不符合题意 ;
C.钠先与水反应生成氢氧化钠和氢气,氯化铁再与氢氧化钠反应会生成氢氧化铁与氯化钠,C符合题意 ;
D.氯化钙和二氧化碳不会发生反应,无沉淀生成,D不符合题意 ;
故答案为:C 。
【分析】A.往碳酸钠溶液中加入少量稀盐酸,生成碳酸氢钠 ;
B.铜粉不和亚铁离子反应 ;
C.钠先与水反应生成氢氧化钠和氢气,氯化铁再与氢氧化钠反应会生成氢氧化铁与氯化钠 ;
D.氯化钙和二氧化碳不会发生反应。
16.【答案】D
【解析】【解答】A.铁燃烧能直接转化为四氧化三铁,不能生成三氧化二铁,故A错误;
B.二氧化硅不溶于水,也不能直接和水反应生成硅酸,故B错误;
C.氯化钠不能直接反应生成碳酸钠,故C错误;
D.HCl可以与CuO反应生成CuCl2,CuCl2可以与Ba(OH)2反应生成BaCl2,BaCl2可以和硫酸反应生成HCl,故D正确;
故选D。
【分析】A.铁燃烧生成四氧化三铁;
B.二氧化硅不溶于水;
C.氯化钠不能直接反应生成碳酸钠;
D.HCl可以与CuO反应生成CuCl2,CuCl2可以与Ba(OH)2反应生成BaCl2,BaCl2可以和硫酸反应生成HCl。
17.【答案】(1)适当加热升温等
(2)KSCN溶液
(3)2Fe3+ + Fe = 3Fe2+
【解析】【解答】(1)要提高反应速率,可以通过加热、增加硫酸的浓度、固体粉碎及搅拌等措施,故答案为加热(或增加硫酸的浓度或将烧渣粉碎或搅拌);
(2)Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反应未完全,若溶液无明显现象,说明反应完全,故答案为KSCN溶液;
(3)“还原”步骤中,Fe粉和Fe3+反应的离子方程式为2Fe3+ + Fe = 3Fe2+,故答案为2Fe3+ + Fe = 3Fe2+。
【分析】烧渣中加入硫酸酸溶, Fe2O3和FeO溶于硫酸,二氧化硅不溶,则滤渣为二氧化硅,加入铁将铁离子还原为亚铁离子,过滤除去过量铁得到硫酸亚铁。
(1)升高温度,增大反应物浓度,固体粉碎及搅拌等均可提高反应速率;
(2)检验铁离子常用KSCN溶液;
(3)铁离子和铁反应生成亚铁离子。
18.【答案】(1)还原
(2)还原
(3)KSCN;c;2Fe2++Cl2═2Fe3++2Cl
(4)2Fe3++Cu2+═2Fe2++Cu2+
【解析】【解答】解:(1)由Fe2+ Fe3+可知,在过程A中Fe元素的化合价升高,则Fe2+为还原剂,故答案为:还原;(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C为还原剂,具有还原性,故答案为:还原;(3)检验Fe3+,利用KSCN溶液,除去FeCl3溶液中少量的氯化亚铁,可加入铁粉,不会引入新的杂质,发生的离子反应为2Fe2++Cl2═2Fe3++2Cl ,故答案为:KSCN;c;2Fe2++Cl2═2Fe3++2Cl ;(4)FeCl3与金属铜反应生成氯化铜和氯化亚铁,离子反应为2Fe3++Cu2+═2Fe2++Cu2+,故答案为:2Fe3++Cu2+═2Fe2++Cu2+;
【分析】(1)由Fe2+ Fe3+可知,在过程A中Fe元素的化合价升高;(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;(3)检验Fe3+,利用KSCN溶液,除去FeCl3溶液中少量的氯化亚铁,可加入铁粉;(4)FeCl3与金属铜反应生成氯化铜和氯化亚铁;
19.【答案】(1)Fe3++3H2O Fe(OH)3+3H+
(2)2FeCl3 + Cu = 2FeCl2 + CuCl2
(3)偏高;1.024g·L-1
【解析】【解答】(1)FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解方程式为Fe3++3H2O Fe(OH)3+3H+;
(2)FeCl3溶液蚀刻铜生成氯化铜和氯化亚铁,反应的化学方程式为2FeCl3 + Cu = 2FeCl2 + CuCl2;
(3)①加入足量的NH4HF2掩蔽Fe3+,消除干扰,若不加,则Fe3+会氧化部分I-,使滴定消耗的Na2S2O3标准溶液偏多,导致测得的铜的含量偏高;②根据反应2Cu2++4I-=2CuI↓+ I2、I2+2S2 =2I-+S4 ,可得2Cu2+~~~~~ I2~~~~~ 2S2 ,故有 =1.024g·L-1。
【分析】(1)铁盐属于强酸弱碱盐,水解是溶液呈酸性;
(2)氯化铁与铜反应生成氯化亚铁和氯化铜;
(3)根据关系式法计算铜的含量。
20.【答案】(1)①③④⑧;⑥
(2)饱和FeCl3溶液;先沉淀后溶解
(3)2 Na2O2+2 CO2=2 Na2CO3+ O2
(4)2OH-+SiO2═+H2O
【解析】【解答】(1)电解质是在水溶液或熔融状态下能够导电的化合物,满足条件的为:①Na2O2固体、③NaOH、④熔融KHSO4、⑧CH3COOH;
单质是由一种元素组成的纯净物,满足条件的有:⑥铜;
故答案为:①③④⑧;⑥;
(2)制备⑤Fe(OH)3胶体时,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色,停止加热;
向制得Fe(OH)3 胶体中加入盐酸,胶体会发生聚沉,Fe(OH)3能溶于盐酸,所以沉淀又消失,故实验现象为先沉淀后溶解;
(3)①和⑦反应是过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2 Na2O2+2 CO2=2 Na2CO3+ O2;
(4)氢氧化钠呈强碱性,能和二氧化硅反应2NaOH+SiO2═Na2SiO3+H2O,生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以NaOH溶液不能用磨口玻璃塞的试剂瓶盛装,故答案为:2OH-+SiO2═+H2O;
【分析】(1)电解质是在溶液中或者熔融状态在能导电的化合物;
(2)制备氢氧化铁胶体是操作为: 在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液 , 继续煮沸至液体呈透明的红褐色,停止加热;加入盐酸,胶体会发生聚沉,Fe(OH)3能溶于盐酸;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(4)NaOH和二氧化硅反应生成硅酸钠和水。
21.【答案】(1)3Fe+4H2O(g) Fe3O4+4H2;水蒸气(或水)
(2)为实验提供水蒸气;防止暴沸;碱石灰(合理即可);干燥反应产生的H2
(3)酒精灯
【解析】【解答】由图可知,烧瓶中加热水得到水蒸气,在硬质玻璃管中Fe与水蒸气反应生成四氧化三铁和氢气,
(1)该反应的化学方程式3Fe+4H2O(g) Fe3O4+4H2 ;水中氢元素化合价降低,水作氧化剂;
(2)加热烧瓶的作用是:为实验提供水蒸气;烧瓶底部放了几片碎瓷片,其作用是:防止暴沸;干燥管里可装入的试剂是:干燥管内可装入的试剂是碱石灰(或无水CaCl2硅胶等)(合理即可) ,干燥反应产生的H2;
(3)点燃加热仪器时,本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯A,排掉硬质玻璃管内空气,为Fe与水蒸气的反应实验提供持续不断的水蒸气。
【分析】(1)铁与水蒸气反应生成四氧化三铁和氢气,水是氧化剂;
(2)根据反应判断水蒸汽的来源、实验安全以及氢气的干燥等进行分析即可;
(3)实验开始需要用水蒸气将装置中的空气排净.
一、单选题
1.下列溶液中,常温下可以用铁制容器装运的是( )
A.浓硝酸 B.浓盐酸 C.硫酸铜溶液 D.稀硫酸
2.要除去FeCl2溶液中的少量氯化铁,可行的办法是( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉
3.将少量铁粉加入到下列溶液中,铁粉溶解,但不产生气体和沉淀的是( )
A.稀H2SO4溶液 B.FeCl3溶液 C.CuSO4溶液 D.NaCl溶液
4.下列有关试剂保存的说法中,错误的是( )
A.金属钠保存在煤油中
B.保存氯化亚铁溶液时加入少量铁粉
C.过氧化钠应密封保存
D.用棕色广口试剂瓶存放氯水
5.检验KCl溶液中是否混有Fe3+时,可选择的试剂是( )
A.硫氰化钾溶液 B.硝酸
C.盐酸 D.硫酸
6.现要除去 溶液中的少量 和 ,可行的方法是( )
A.通入氯气 B.加入铁粉
C.加入铜粉 D.滴入 溶液
7.下列有关铁及其化合物的说法中错误的是( )
A.为了防止氯化亚铁溶液久置变质,常在其溶液中加入少许铁钉
B.将饱和FeCl3溶液滴入沸水中,能形成胶体
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加铁粉,然后过滤
8.物质之间反应,一定不产生H2的是( )
A.过氧化钠和水 B.金属钠和冷水
C.铁和热浓硫酸 D.炽热铁和水蒸气
9.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.浓硫酸
C.氢氧化钠溶液 D.硫酸铜溶液
10.向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
11.Fe与下列物质反应的产物,能使KSCN溶液显红色的是( )
A.H2O B.O2 C.S D.足量稀HNO3
12.向Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色变化应该是( )
A.无变化 B.颜色变浅 C.变为棕黄色 D.变为红褐色
13.下列实验或现象能证明某硫酸铝溶液中含的杂质一定为Fe3+的是( )
A.加入足量氢氧化钠溶液后产生的浑浊不溶解
B.用pH试纸检验呈弱酸性
C.滴入KSCN溶液后溶液变血红色
D.溶液显浅黄色
14.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CaCl2(aq) CaCO3 CaO
B.Na Na2O NaOH
C.(C6H10O5)n(淀粉) C6H12O6(葡萄糖) C2H5OH
D.Cu2S Cu CuSO4
15.下列化学方程式书写正确的是
A.往碳酸钠溶液中加入少量稀盐酸:
B.往硫酸亚铁溶液中加入少量铜粉:
C.往氯化铁溶液中加入少量金属钠:
D.往氯化钙溶液中通入少量二氧化碳:
16.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe→Fe2O3→Fe(OH)3→Fe B.Si→SiO2→H2SiO3→CaSiO3
C.NaOH→NaCl→Na2CO3→NaOH D.HCl→CuCl2→BaCl2→HCl
二、综合题
17.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeSO4,其流程如下:
(1)“酸溶”时,提高反应速率的措施有 (写一条)。
(2)加入Fe粉还原后,检验Fe3+是否反应完全的试剂为 。
(3)写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式: 。
18.一个体重50kg的健康人含铁元素2g,这2g铁元素以Fe2+和Fe3+形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+.在过程A中,Fe2+作 剂;
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有 性;
(3)某同学要检验Fe3+,向溶液中加入 (写化学式)溶液变成红色.要除去FeCl3溶液中少量的氯化亚铁,可行的办法是 (填字母).
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 ;
(4)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 .
19.FeCl3蚀刻液由FeCl3和盐酸等组成,可用于蚀刻铜及铜合金等。
(1)加入盐酸可抑制Fe3+及生成的Cu2+的水解, Fe3+水解的离子方程式为 。
(2)FeCl3溶液蚀刻铜的化学方程式为 。
(3)测定某废蚀刻液中Cu2+含量的实验步骤如下:量取25.00mL废蚀刻液,加入足量的NH4HF2(掩蔽Fe3+,消除干扰),加入稍过量KI溶液(2Cu2++4I-=2CuI↓+ I2),在暗处静置5min,然后用0.02000mol·L-1Na2S2O3标准溶液滴定(I2+2S2O =2I-+S4O ),接近终点时,加入淀粉和10mL10%NH4SCN溶液(CuI可吸附少量I2, CuSCN不吸附I2),继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①不加NH4HF2会导致测得的铜的含量 (填:“偏高”“偏低”或“不变”)。
②通过计算确定该废蚀刻液中铜的含量(单位g·L-1,写出计算过程) 。
20.现有以下物质:①Na2O2固体、②液氨、③NaOH、④熔融KHSO4、⑤Fe(OH)3胶体、⑥铜、⑦CO2、⑧CH3COOH、⑨蔗糖。
(1)以上物质中属于电解质的是 (填序号,下同);属于单质的是 。
(2)制备⑤时,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 ,继续煮沸至液体呈透明的红褐色,停止加热;然后向其中逐滴滴入过量盐酸,实验现象为 。
(3)写出①和⑦反应的化学方程式 。
(4)③的溶液不能装在带磨口玻璃塞的试剂瓶中,用离子方程式说明其原因 。
21.如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。
(1)写出该反应的化学方程式 ,氧化剂是 。
(2)加热烧瓶的作用是 ,烧瓶底部放了几片碎瓷片,其作用是 。干燥管里可装入的试剂是 ,其作用是 。
(3)实验开始时应先点燃 (填“酒精灯”或“酒精喷灯”)。
答案解析部分
1.【答案】A
【解析】【解答】A、常温下,铁遇浓硫酸发生钝化,则可用铁罐装运浓硫酸,故A符合题意;
B、铁与浓盐酸反应生成氯化亚铁和氢气,不能用铁罐装运,故B不符合题意;
C、铁与硫酸铜反应生成硫酸亚铁和Cu,则不能用铁罐装运,故C不符合题意;
D、铁与稀硫酸反应生成硫酸亚铁和氢气,不能用铁罐装运用,故D不符合题意。
故答案为:A。
【分析】A、浓硫酸、浓硝酸可以使铁、铝钝化;
B、浓盐酸不能使铁钝化,可以和铁反应;
C、铁和铜离子可以发生置换反应;
D、稀硫酸可以和铁反应。
2.【答案】D
【解析】【解答】A. 滴入KSCN溶液可以检验铁离子,不能除去氯化铁,A不符合题意;
B. 通入氯气把氯化亚铁氧化为氯化铁,B不符合题意;
C. 加入铜粉与氯化铁反应生成氯化亚铁和氯化铜,引入新杂质,C不符合题意;
D. 加入铁粉与氯化铁反应生成氯化亚铁,可以除去氯化铁杂质,D符合题意,
故答案为:D。
【分析】铁离子具有氧化性,能与铁发生反应生成亚铁离子,除去铁离子时不能带入新的杂质,据此解答即可。
3.【答案】B
【解析】【解答】A.铁与稀硫酸反应生成硫酸亚铁和氢气,故不选A;
B.铁氯化铁溶液反应生成氯化亚铁,铁粉溶解,但不产生气体和沉淀,
C.铁与硫酸铜溶液反应生成硫酸亚铁和铜,故不选C;
D.铁与氯化钠溶液不反应,故不选D;
故答案选B。
【分析】铁与稀硫酸反应生成氢气、与硫酸铜溶液发生置换反应、与NaCl溶液不反应,铁与氯化铁溶液反应发生氧化还原反应生成氯化亚铁,据此解答即可。
4.【答案】D
【解析】【解答】A、金属钠还原性强,暴露在空气中会被氧化,金属钠的密度大于煤油小于水,因此少量金属钠可保存在煤油中,隔绝空气。不符合题意;
B、亚铁离子容易被空气中的氧气氧化成三价铁离子,因此保存氯化亚铁溶液时加入少量铁粉,防止氧化。不符合题意;
C、过氧化钠易于和空气中的水和二氧化碳反应,所以应在干燥环境下密封保存。不符合题意;
D、氯水见光其中的次氯酸易分解,并属于液体,应盛放在棕色细口试剂瓶中。符合题意;
故答案为:D。
【分析】一般固体药品存放在广口瓶中,液体药品存放在细口瓶中。
5.【答案】A
【解析】【解答】Fe3+硫氰化钾溶液反应,溶液呈红色,故A符合题意。
【分析】检验Fe3+只有一种方法,那就是遇硫氰化钾显血红色,记住即可
6.【答案】B
【解析】【解答】
A.氯气与亚铁离子反应,故A不符合题意;
B.铁与三价铁离子和铜离子反应生成亚铁离子,然后过滤即可,故B符合题意;
C.加入铜粉无法除去氯化铜,故C不符合题意;
D.加入 溶液只能检验三价铁离子,无法除去,故D不符合题意;
故答案为:B.
【分析】
除杂原则:不能引入新的杂质,要保证产物易于分离,原物质不反应而杂质完全反应。
7.【答案】D
【解析】【解答】A. 亚铁离子在空气中易被氧化为三价铁离子,加铁钉可以防止氯化亚铁溶液的变质,故A不符合题意;
B. 制备氢氧化铁胶体的方法是将饱和FeCl3溶液滴入沸水中,搅拌到红褐色即可,故B不符合题意;
C. 新制的氢氧化亚铁沉淀露置在空气中迅速变成灰绿色,最终会变为红褐色的氢氧化铁,故C不符合题意;
D. 除去FeCl3溶液中的FeCl2杂质可以向溶液中滴加氯水,将氯化亚铁氧化为氯化铁,故D符合题意。
【分析】A.氯化铁可与铁反应生成氯化亚铁;
B.饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,是利用氯化铁水解加热促进生成;
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色的氢氧化铁;
D. 氯化铁可与铁反应生成氯化亚铁。
8.【答案】A
【解析】【解答】A. 过氧化钠和水反应生成氧气和氢氧化钠,A符合题意;
B. 金属钠和冷水反应生成氢气和氢氧化钠,B不符合题意;
C. 铁和热浓硫酸反应,随着反应的进行,浓硫酸变为稀硫酸,稀硫酸与铁反应生成氢气,C不符合题意;
D. 炽热铁和水蒸气生成反应生成四氧化三铁和氢气,D不符合题意;
故答案为:A
【分析】A.Na2O2与H2O反应生成O2;
B.Na与H2O反应生成H2;
C.铁与热的浓硫酸反应生成SO2,与稀硫酸反应生成H2;
D.铁与水蒸气反应生成H2;
9.【答案】C
【解析】【解答】A.铁与稀硫酸反应:Fe+H2SO4=FeSO4+H2 ,不符合题意;
B.常温下,铁与浓硫酸会发生氧化还原反应生成致密的氧化膜导致铁钝化,不符合题意;
C.铁与氢氧化钠溶液不发生反应,符合题意;
D.铁与硫酸铜发生置换反应:Fe+CuSO4=FeSO4+Cu,不符合题意;
故答案为:C。
【分析】需注意,常温下,铝和铁与浓硫酸或浓硝酸会发生钝化,并不是铁和铝不与浓硫酸或浓硝酸反应。
10.【答案】B
【解析】【解答】盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)= n(HCl)= ×0.1L×2mol/L=0.1mol;用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.1mol,质量为0.1mol×56g/mol=5.6g,
故答案为:B。
【分析】由题意可得,铁完全转化为氯化亚铁,则物质的量之比Fe:Cl=1:2,又n(Cl-)=0.2mol
故n(Fe)=0.1mol
11.【答案】D
【解析】【解答】A. Fe与H
2O蒸汽反应生成四氧化三铁固体,不与KSCN 溶液反应,故A不符合题意;
B.Fe与O2点燃反应生成四氧化三铁固体,不与KSCN 溶液反应,故B不符合题意;
C.Fe与S加热反应生成硫化亚铁固体,不与KSCN 溶液反应,故C不符合题意;
D. Fe与足量稀HNO3生成硝酸铁,滴入KSCN 溶液,显红色,故D符合题意;
故答案为:D。
【分析】+3价铁离子能使KSCN溶液显红色。强氧化剂如硝酸、氯气能将铁氧化到+3价,而S或碘单质等弱氧化剂只能将铁氧化到+2价,铁与水蒸气反应 3Fe + 4H2O(g)
Fe3O4 + 4H2。
12.【答案】C
【解析】【解答】解:往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3﹣+4H+═3Fe3++NO↑+2H20,三价铁离子为棕黄色,
故选C.
【分析】酸性条件下硝酸根离子具有强氧化性,能将亚铁离子氧化为三价,二价铁浅绿色,三价铁为棕黄色,以此解答.
13.【答案】C
【解析】【解答】解:A、能和足量的氢氧化钠溶液产生沉淀不溶解的除了Fe3+,还有Cu2+、Mg2+等,故A不能说说明Fe3+的存在,故A错误;
B、硫酸铝是强酸弱碱盐,其溶液本身显弱酸性,故不能说明Fe3+的存在,故B错误;
C、Fe3+遇KSCN溶液时溶液为血红色,能说明Fe3+的存在,故C正确;
D、溶液显浅黄色的不只Fe3+,还有氯水等,故D错误.
故选C.
【分析】根据Fe3+的检验方法可知,Fe3+遇KSCN溶液时溶液为血红色,以此来检验.
14.【答案】C
【解析】【解答】A.二氧化碳与氯化钙溶液不反应,碳酸钙受热分解生成氧化钙和二氧化碳,其中第一步不能实现转化,选项A不符合题意;
B.钠在氧气中点燃反应生成过氧化钠而不是生成氧化钠,氧化钠与水反应生成氢氧化钠,其中第一步不能实现转化,选项B不符合题意;
C.淀粉在稀硫酸催化下水解最终生成葡萄糖,葡萄糖在酒化酶的催化下反应生成乙醇和二氧化碳,两步转化均能实现,选项C符合题意;
D.高温条件下硫化亚铜与氧气反应生成铜和二氧化硫(火法炼铜),铜与稀硫酸不反应无法得到硫酸铜,第一步转化不能实现,选项D不符合题意;
故答案为:C。
【分析】A、二氧化碳和氯化钙不能制得碳酸钙
B、钠和氧气在高温下的产物是过氧化钠
D、铜与稀硫酸不反应
15.【答案】C
【解析】【解答】A.往碳酸钠溶液中加入少量稀盐酸,生成碳酸氢钠无气泡产生,A不符合题意 ;
B.金属活动性:Fe>Cu,加入少量铜粉不和亚铁离子反应,B不符合题意 ;
C.钠先与水反应生成氢氧化钠和氢气,氯化铁再与氢氧化钠反应会生成氢氧化铁与氯化钠,C符合题意 ;
D.氯化钙和二氧化碳不会发生反应,无沉淀生成,D不符合题意 ;
故答案为:C 。
【分析】A.往碳酸钠溶液中加入少量稀盐酸,生成碳酸氢钠 ;
B.铜粉不和亚铁离子反应 ;
C.钠先与水反应生成氢氧化钠和氢气,氯化铁再与氢氧化钠反应会生成氢氧化铁与氯化钠 ;
D.氯化钙和二氧化碳不会发生反应。
16.【答案】D
【解析】【解答】A.铁燃烧能直接转化为四氧化三铁,不能生成三氧化二铁,故A错误;
B.二氧化硅不溶于水,也不能直接和水反应生成硅酸,故B错误;
C.氯化钠不能直接反应生成碳酸钠,故C错误;
D.HCl可以与CuO反应生成CuCl2,CuCl2可以与Ba(OH)2反应生成BaCl2,BaCl2可以和硫酸反应生成HCl,故D正确;
故选D。
【分析】A.铁燃烧生成四氧化三铁;
B.二氧化硅不溶于水;
C.氯化钠不能直接反应生成碳酸钠;
D.HCl可以与CuO反应生成CuCl2,CuCl2可以与Ba(OH)2反应生成BaCl2,BaCl2可以和硫酸反应生成HCl。
17.【答案】(1)适当加热升温等
(2)KSCN溶液
(3)2Fe3+ + Fe = 3Fe2+
【解析】【解答】(1)要提高反应速率,可以通过加热、增加硫酸的浓度、固体粉碎及搅拌等措施,故答案为加热(或增加硫酸的浓度或将烧渣粉碎或搅拌);
(2)Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反应未完全,若溶液无明显现象,说明反应完全,故答案为KSCN溶液;
(3)“还原”步骤中,Fe粉和Fe3+反应的离子方程式为2Fe3+ + Fe = 3Fe2+,故答案为2Fe3+ + Fe = 3Fe2+。
【分析】烧渣中加入硫酸酸溶, Fe2O3和FeO溶于硫酸,二氧化硅不溶,则滤渣为二氧化硅,加入铁将铁离子还原为亚铁离子,过滤除去过量铁得到硫酸亚铁。
(1)升高温度,增大反应物浓度,固体粉碎及搅拌等均可提高反应速率;
(2)检验铁离子常用KSCN溶液;
(3)铁离子和铁反应生成亚铁离子。
18.【答案】(1)还原
(2)还原
(3)KSCN;c;2Fe2++Cl2═2Fe3++2Cl
(4)2Fe3++Cu2+═2Fe2++Cu2+
【解析】【解答】解:(1)由Fe2+ Fe3+可知,在过程A中Fe元素的化合价升高,则Fe2+为还原剂,故答案为:还原;(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C为还原剂,具有还原性,故答案为:还原;(3)检验Fe3+,利用KSCN溶液,除去FeCl3溶液中少量的氯化亚铁,可加入铁粉,不会引入新的杂质,发生的离子反应为2Fe2++Cl2═2Fe3++2Cl ,故答案为:KSCN;c;2Fe2++Cl2═2Fe3++2Cl ;(4)FeCl3与金属铜反应生成氯化铜和氯化亚铁,离子反应为2Fe3++Cu2+═2Fe2++Cu2+,故答案为:2Fe3++Cu2+═2Fe2++Cu2+;
【分析】(1)由Fe2+ Fe3+可知,在过程A中Fe元素的化合价升高;(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;(3)检验Fe3+,利用KSCN溶液,除去FeCl3溶液中少量的氯化亚铁,可加入铁粉;(4)FeCl3与金属铜反应生成氯化铜和氯化亚铁;
19.【答案】(1)Fe3++3H2O Fe(OH)3+3H+
(2)2FeCl3 + Cu = 2FeCl2 + CuCl2
(3)偏高;1.024g·L-1
【解析】【解答】(1)FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解方程式为Fe3++3H2O Fe(OH)3+3H+;
(2)FeCl3溶液蚀刻铜生成氯化铜和氯化亚铁,反应的化学方程式为2FeCl3 + Cu = 2FeCl2 + CuCl2;
(3)①加入足量的NH4HF2掩蔽Fe3+,消除干扰,若不加,则Fe3+会氧化部分I-,使滴定消耗的Na2S2O3标准溶液偏多,导致测得的铜的含量偏高;②根据反应2Cu2++4I-=2CuI↓+ I2、I2+2S2 =2I-+S4 ,可得2Cu2+~~~~~ I2~~~~~ 2S2 ,故有 =1.024g·L-1。
【分析】(1)铁盐属于强酸弱碱盐,水解是溶液呈酸性;
(2)氯化铁与铜反应生成氯化亚铁和氯化铜;
(3)根据关系式法计算铜的含量。
20.【答案】(1)①③④⑧;⑥
(2)饱和FeCl3溶液;先沉淀后溶解
(3)2 Na2O2+2 CO2=2 Na2CO3+ O2
(4)2OH-+SiO2═+H2O
【解析】【解答】(1)电解质是在水溶液或熔融状态下能够导电的化合物,满足条件的为:①Na2O2固体、③NaOH、④熔融KHSO4、⑧CH3COOH;
单质是由一种元素组成的纯净物,满足条件的有:⑥铜;
故答案为:①③④⑧;⑥;
(2)制备⑤Fe(OH)3胶体时,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色,停止加热;
向制得Fe(OH)3 胶体中加入盐酸,胶体会发生聚沉,Fe(OH)3能溶于盐酸,所以沉淀又消失,故实验现象为先沉淀后溶解;
(3)①和⑦反应是过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2 Na2O2+2 CO2=2 Na2CO3+ O2;
(4)氢氧化钠呈强碱性,能和二氧化硅反应2NaOH+SiO2═Na2SiO3+H2O,生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以NaOH溶液不能用磨口玻璃塞的试剂瓶盛装,故答案为:2OH-+SiO2═+H2O;
【分析】(1)电解质是在溶液中或者熔融状态在能导电的化合物;
(2)制备氢氧化铁胶体是操作为: 在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液 , 继续煮沸至液体呈透明的红褐色,停止加热;加入盐酸,胶体会发生聚沉,Fe(OH)3能溶于盐酸;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气;
(4)NaOH和二氧化硅反应生成硅酸钠和水。
21.【答案】(1)3Fe+4H2O(g) Fe3O4+4H2;水蒸气(或水)
(2)为实验提供水蒸气;防止暴沸;碱石灰(合理即可);干燥反应产生的H2
(3)酒精灯
【解析】【解答】由图可知,烧瓶中加热水得到水蒸气,在硬质玻璃管中Fe与水蒸气反应生成四氧化三铁和氢气,
(1)该反应的化学方程式3Fe+4H2O(g) Fe3O4+4H2 ;水中氢元素化合价降低,水作氧化剂;
(2)加热烧瓶的作用是:为实验提供水蒸气;烧瓶底部放了几片碎瓷片,其作用是:防止暴沸;干燥管里可装入的试剂是:干燥管内可装入的试剂是碱石灰(或无水CaCl2硅胶等)(合理即可) ,干燥反应产生的H2;
(3)点燃加热仪器时,本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯A,排掉硬质玻璃管内空气,为Fe与水蒸气的反应实验提供持续不断的水蒸气。
【分析】(1)铁与水蒸气反应生成四氧化三铁和氢气,水是氧化剂;
(2)根据反应判断水蒸汽的来源、实验安全以及氢气的干燥等进行分析即可;
(3)实验开始需要用水蒸气将装置中的空气排净.
