第三章铁金属材料 单元同步练习题(含解析)-2023--2024学年高一化学人教版必修1
文档属性
| 名称 | 第三章铁金属材料 单元同步练习题(含解析)-2023--2024学年高一化学人教版必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 634.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 18:42:43 | ||
图片预览



文档简介
第三章 铁 金属材料 单元同步练习题
一、单选题
1.下列相关反应的离子方程式书写错误的是
A.盐酸除铁锈:
B.硫酸铜溶液与氢氧化钡溶液反应:
C.向硝酸银溶液中加盐酸:
D.向NaCl溶液中加入盐酸除去含有的杂质
2.水溶液中的可以用除去,反应的离子方程式为,下列说法正确的是
A.是氧化剂,发生还原反应 B.还原性:
C.与浓盐酸混合加热才可以生成 D.每生成,反应中转移电子的物质的量为12mol
3.黄铁矿(主要成分)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,氧化过程如图所示。
下列有关说法不正确的是
A.d步反应生成胶体可以作消毒剂
B.氧化过程会产生较多酸性废水破坏矿区生态环境
C.a步反应中完全被氧化时大约消耗标准状况下的空气39L
D.检验a步反应中是否生成,方法是先向溶液中加入KSCN溶液,无明显变化,然后通入氯气,若溶液变红,则说明产物是
4.下列离子方程式书写正确的是
A.向水中通入氯气:
B.向硫酸铜溶液中加入小块钠:
C.磁性氧化铁与盐酸反应:
D.用烧碱溶液除去铁粉中的铝粉:
5.阿伏加德罗常数的值为,下列说法正确的是
A.常温常压下,0.1mol铁与足量浓硫酸反应生成的分子数为1.5
B.20g 中含有电子数为10
C.标准状况下,11.2L 含氧原子数为1.5
D.标准状况下,5.6L NO和5.6L 混合后分子总数为0.5
6.绿矾()可作还原剂、着色剂、制药等,在不同温度下易分解成各种铁的氧化物和硫的氧化物。已知是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。下列说法正确的是
A.若装置A试管内固体粉末由绿色变棕黄色,由此得出绿矾的分解产物中一定含有
B.若装置B中可观察到的现象是品红溶液褪色,由此得出绿矾的分解产物中一定含有
C.装置C用于吸收多余的尾气,最终生成,以防止有毒气体排放,污染环境
D.若装置C中有无色气体逸出且使带火星的木条复燃,由此得出绿矾分解产物中含
7.在给定条件下,下列选项所示的物质间转化无法实现的是
A.
B.
C.
D.
8.下列有关物质的性质与用途具有对应关系的是
A.不稳定,可用于医学上作补血剂
B.熔融的氯化镁能被电解,氯化镁可用作冶炼镁的原料
C.铝的金属活泼性强,可用于制作铝金属制品
D.呈碱性,可用于鉴别葡萄糖和蔗糖
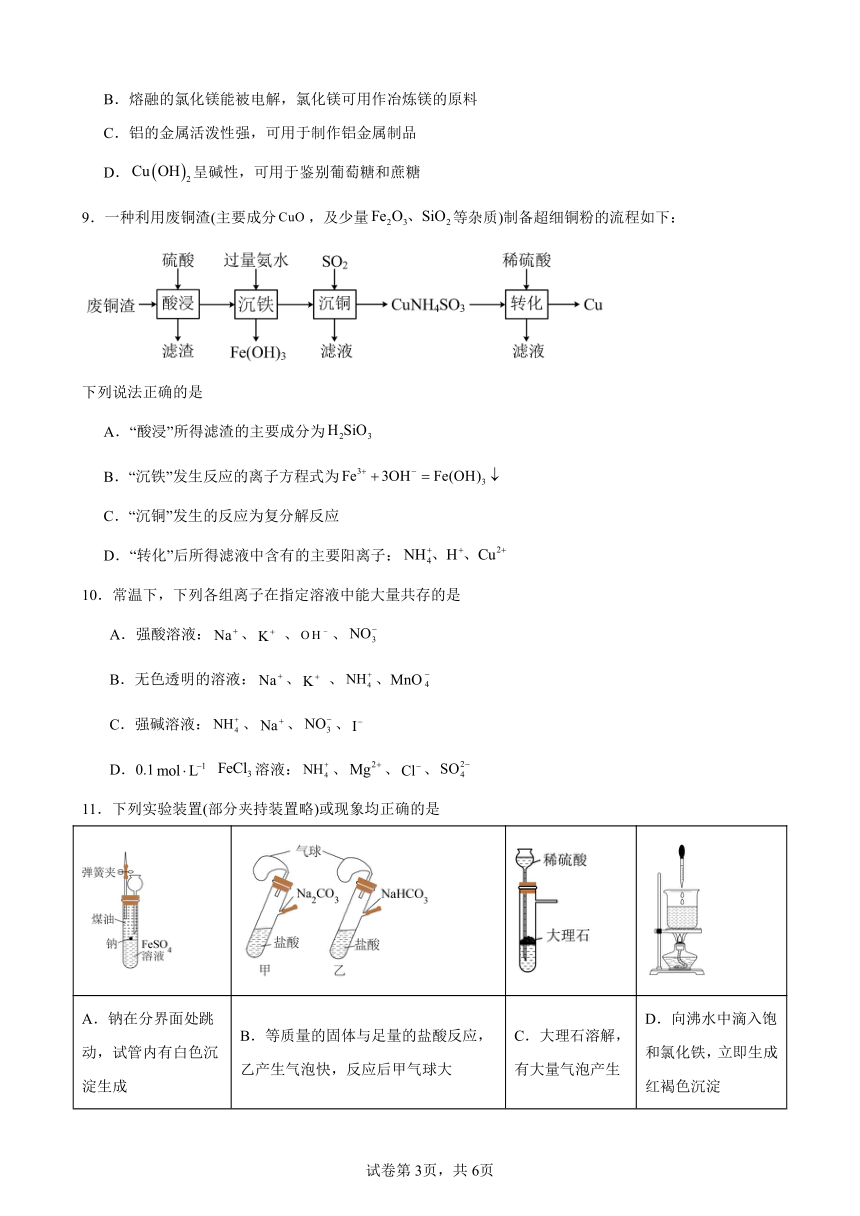
9.一种利用废铜渣(主要成分,及少量等杂质)制备超细铜粉的流程如下:
下列说法正确的是
A.“酸浸”所得滤渣的主要成分为
B.“沉铁”发生反应的离子方程式为
C.“沉铜”发生的反应为复分解反应
D.“转化”后所得滤液中含有的主要阳离子:
10.常温下,下列各组离子在指定溶液中能大量共存的是
A.强酸溶液:、、、
B.无色透明的溶液:、、、MnO
C.强碱溶液:、、、
D.0.1 溶液:、、、
11.下列实验装置(部分夹持装置略)或现象均正确的是
A.钠在分界面处跳动,试管内有白色沉淀生成 B.等质量的固体与足量的盐酸反应,乙产生气泡快,反应后甲气球大 C.大理石溶解,有大量气泡产生 D.向沸水中滴入饱和氯化铁,立即生成红褐色沉淀
A.A B.B C.C D.D
12.含氰废水中氰化物的主要形态是HCN和CN-,CN-具有较强的配位能力,能与Cu+形成一种无限长链离子,其片段为≡≡N—…;CN-结合H+能力弱于C。氰化物浓度较低时,可在碱性条件下用H2O2或Cl2将其转化为N2;浓度较高时,可加入HCN、Fe和K2CO3溶液反应生成K4[Fe(CN)6]溶液。下列物质性质与用途具有对应关系的是
A.H2O2具有还原性,可用于处理含氰废水
B.维生素C具有还原性,可用作食品抗氧化剂
C.FeCl3溶液显酸性,可用于刻蚀铜板
D.NaHCO3受热易分解,可用于治疗胃酸过多
13.下列关于铁及其化合物之间转化反应的方程式书写正确的是
A.FeSO4溶液中加入酸性KMnO4溶液:5Fe2++MnO+8H+=5Fe3++Mn2++4H2O
B.过量铁粉加入稀硝酸中:Fe+4H++NO=Fe3++NO↑+2H2O
C.氢氧化铁中加入氢碘酸:Fe(OH)3+3HI=FeI3+3H2O
D.H2O(g)通过灼热铁粉:2Fe+3H2O(g)Fe2O3+3H2
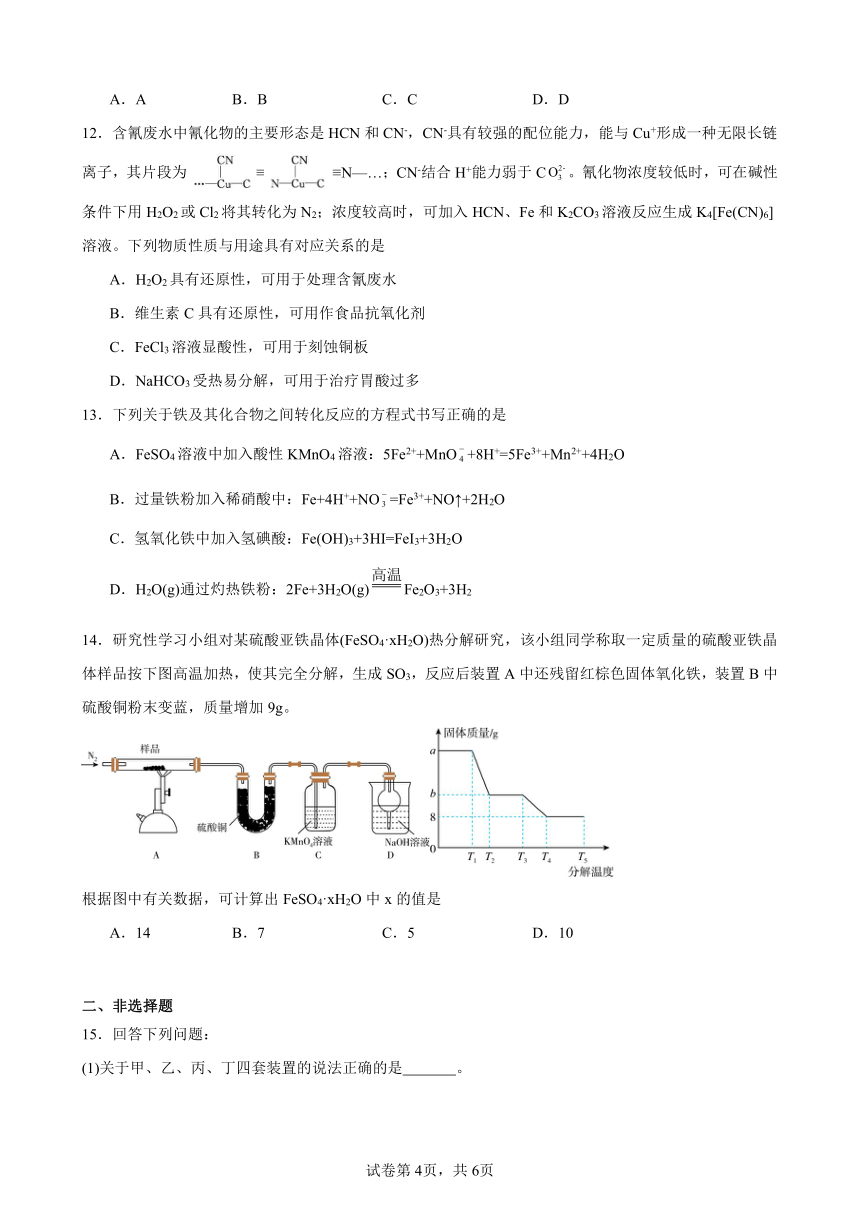
14.研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取一定质量的硫酸亚铁晶体样品按下图高温加热,使其完全分解,生成SO3,反应后装置A中还残留红棕色固体氧化铁,装置B中硫酸铜粉末变蓝,质量增加9g。
根据图中有关数据,可计算出FeSO4·xH2O中x的值是
A.14 B.7 C.5 D.10
二、非选择题
15.回答下列问题:
(1)关于甲、乙、丙、丁四套装置的说法正确的是 。
A.用装置甲制取氯气 B.用丙装置可以较长时间看到白色Fe(OH)2白色沉淀
C.用丁装置证明碳酸氢钠受热易分解 D.用装置乙除去氢气中的少量氯化氢
(2)以下物质(或粒子)与其用途之间关联正确的是 。
A.硬铝——制导线 B.14C——测定文物年代
C.锗——作半导体材料 D.Ti-Fe合金——作不锈钢材料
(3)实验室制取Cl2的化学方程式: 。浓盐酸表现的性质是 。
(4)已知:在稀硫酸中,MnO与H2O2也能发生以下反应:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。由上述反应得出物质氧化性强弱的结论是_______>_______(填化学式)。
16.铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
Ⅰ.
(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有 元素。
(2)铁元素有三种常见的氧化物,分别是FeO、、。其中具有磁性的是 ,可作红色颜料的是 。
(3)某补铁口服液中含有,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,此过程中利用了维生素C的 性。
(4)可作为铜电路板的腐蚀液,其反应原理为Cu与溶液反应生成和,该反应的化学方程式为 。向反应后的溶液中加入 ,可回收Cu,并得到溶液。
Ⅱ.高铁酸钾()是一种新型、高效、多功能水处理剂。工业上制备高铁酸钾的流程如下图所示:
(5)下列说法错误的是_____。
A.中铁元素的化合价为+6价
B.用无水乙醇洗涤可以减少产品的损耗
C.反应Ⅱ中的氧化剂是
D.高铁酸根离子具有强氧化性,能杀菌消毒
(6)用电解饱和食盐水获得原料氯气的过程中有2mol电子发生转移,试计算理论上最多可制得氯气的体积(标准状况)是 L。
17.铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化为Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有 (填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有 (填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意 (写一条即可)。
18.孔雀石的主要成分为Cu2(OH)2CO3.某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):
(1)反应①能观察到的现象是 ,有关反应的化学方程式为 。
(2)反应②加入的金属可能是 ,有关反应的离子方程式为 。
(3)操作a可能的方法是 ,欲除掉的杂质为 ;要从操作a所得到的溶液中得到溶质的晶体,需要进行的操作是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.铁锈的主要成分是氧化铁,则盐酸除铁锈的离子方程式为:,A正确;
B.硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡和氢氧化铜,离子方程式为:,B正确;
C.硝酸银为强电解质,写离子方程式时需要拆开,则向硝酸银溶液中加盐酸的离子方程式为:,C错误;
D.碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为:,D正确;
故选C。
2.A
【分析】反应过程中,中Mn元素由+7价下降到+4价,作为氧化剂,Mn2+中Mn元素由+2价上升到+4价,作还原剂,则既是氧化产物,又是还原产物。
【详解】A.由分析可知,是氧化剂,发生还原反应,故A正确;
B.由分析可知,Mn2+是还原剂, 既是氧化产物,又是还原产物,则还原性:,故B错误;
C.的氧化性强于,与浓盐酸混合在常温下就可以生成,故C错误;
D.每生成,消耗2mol,中Mn元素由+7价下降到+4价,共转移6mol电子,故D错误;
故选A。
3.A
【详解】A.d步反应生成可以作净水、但不能做消毒剂,故A错误;
B.由图可知,过程a、d会产生较多酸性废水破坏矿区生态环境,故B正确;
C.由a可知,1molFeS2转化2molSO失去14个电子,0.1molFeS2完全被氧化时失去电子为1.4mol,需要氧气的物质的量是,标况下的体积是0.35mol×22.4L/mol=7.84L,因此需要空气的体积是7.84L×5=39.2L,即约为39L,故C正确;
D.检验a步反应中是否生成,方法是先向溶液中加入KSCN溶液,无明显变化,说明不存在铁离子,然后通入氯气,若溶液变红,则说明有铁离子生成,所以产物是,故D正确;
故选:A。
4.D
【详解】A.次氯酸是弱酸,不能拆开,离子方程式为:,A项错误;
B.钠先与水反应生成氢氧化钠和氢气,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,离子方程式为,B项错误;
C.磁性氧化铁为四氧化三铁,离子方程式为:,C项错误;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
故选D。
5.B
【详解】A.铁与浓硫酸会发生钝化,常温常压下,0.1mol铁与足量浓硫酸反应不能生成,故A错误;
B.20g 的物质的量为=1mol,中含有10个电子,20g 中含有电子数为10,故B正确;
C.标准状况下,不是气体,11.2L 的物质的量不是0.5mol,故C错误;
D.标况下,5.6L气体的物质的量是0.25mol,由于一氧化氮与氧气反应生成了二氧化氮,所以气体的物质的量减小,故D错误;
故选B。
6.D
【详解】A.若装置A试管内固体粉末由绿色变棕黄色,只能说明生成了棕黄色的,不能得出一定含有,A错误;
B.若装置B中观察到的现象是品红褪色,由此得出绿矾的分解产物中可能含有(可逆化合漂白),也可能含有(氧化漂白),B错误;
C.装置C用于吸收易溶的或尾气,最终还会有生成,C错误;
D.若装置C中有无色气体逸出且使带火星的木条复燃,,氧气支持燃烧,由此得出绿矾分解产物中含,D正确;
故选D。
7.D
【详解】A.工业上制取高纯硅,先制取粗硅,再用氢气还原得到高纯硅,流程为:,A正确;
B.根据侯氏制碱法,饱和食盐水中先通入氨气,使溶液呈碱性,再通入,得到晶体,再受热分解得到纯碱,流程为,B正确;
C.铝能与氢氧化钠溶液反应,生成的偏铝酸钠再与过量的盐酸,得到溶液,流程为:,C正确;
D.在工业上制取硝酸,氨气的催化氧化只能得到,D错误;
故选D。
8.B
【详解】A.不稳定,易被氧化,与医学上作补血剂无关联,A错误;
B.熔融的氯化镁能被电解可以冶炼镁,所以氯化镁可用作冶炼镁的原料,B正确;
C.铝的金属活泼性强,与用于制作铝金属制品没有关联,C错误;
D.鉴别葡萄糖和蔗糖,利用的氧化性,与碱性无关,D错误;
故选B。
9.D
【分析】废铜渣(主要成分CuO,及少量Fe2O3、SiO2等杂质) “酸浸”时CuO、少量Fe2O3与H2SO4反应生成硫酸铜、硫酸铁,SiO2不溶于H2SO4,所以滤渣的成分是SiO2,滤液中加过量氨水沉铁除去Fe3+,铜离子转化为Cu(NH3),所得滤液通二氧化硫沉铜,过滤出产生的CuNH4SO3沉淀,加稀硫酸转化,+1价铜发生歧化反应,得到铜离子、和Cu。
【详解】A.由分析可知,“酸浸”所得滤渣的主要成分为SiO2,故A错误;
B.NH3·H2O是弱碱,在离子方程式中不能拆,故B错误;
C.“沉铜”时含有Cu(NH3)和过量氨水的混合溶液中通入二氧化硫生成CuNH4SO3沉淀,铜元素化合价降低,则发生氧化还原反应,不为复分解反应,故C错误;
D.转化时,CuNH4SO3在稀硫酸中发生歧化反应,得到铜离子、和Cu,结合元素守恒可知, “转化”后所得滤液中含有的主要阳离子:,故D正确;
故选D。
10.D
【详解】A.强酸溶液中,H+和OH-反应生成水而不能大量共存,故A错误;
B.MnO为紫色溶液,故B错误;
C.强碱溶液中,OH-和生成氨水而不能大量共存,故C错误;
D.0.1 溶液中:、、、互不反应可以大量共存,故D正确;
故选D。
11.A
【详解】A.钠的密度介于水和煤油之间,故在分界面处跳动,钠与水反应生成和,与溶液反应生成白色絮状沉淀,A正确;
B.等质量的碳酸钠和碳酸氢钠,碳酸钠产生二氧化碳少,B错误;
C.生成的硫酸钙微溶,覆盖在大理石表面,阻碍反应的进行,C错误;
D.生成的是胶体不是沉淀,D错误;
故选A。
12.B
【详解】A.H2O2可将氰化物转化为氮气,氰化物中N元素化合价升高,作还原剂,则H2O2在该反应中表现氧化性,A错误;
B.维生素C具有还原性,易被空气中的氧气氧化,保护食品不被氧化,用作食品抗氧化剂,B正确;
C.FeCl3能与Cu生成可溶性氯化铜,表现出较强氧化性,可用于蚀刻印刷电路板,与FeCl3溶液显酸性无关,C错误;
D.NaHCO3性质不稳定,受热易发生分解反应生成CO2,CO2能使面团松软多孔,可用作食品膨松剂,D错误;
故选:B。
13.A
【详解】A.酸性KMnO4具有强氧化性,可把Fe2+氧化成Fe3+,本身被还原生成Mn2+,离子方程式正确,A正确;
B.稀硝酸有强氧化性,能把Fe氧化成Fe3+,过量铁粉与Fe反应生成Fe2+,总反应产物应是Fe2+而不是Fe3+,离子方程式为3Fe+8H++2=3Fe2++2NO↑+4H2O,B错误;
C.Fe3+具有较强的氧化性,I-具有较强的还原性,两者能发生氧化还原反应,分别生成Fe2+和,化学方程式为2Fe(OH)3+6HI=2FeI2++6H2O,C错误;
D.Fe与H2O(g)高温反应生成Fe3O4和H2,化学方程式为3Fe+4H2O(g)Fe3O4+4H2,D错误;
故答案选A。
14.C
【分析】硫酸铜遇水变蓝,装置B中硫酸铜粉末变蓝,质量增加9g,说明产物中有水,红棕色固体为氧化铁,说明铁元素化合价升高,而反应物中能降低化合价的只能是硫元素,其还原产物是二氧化硫,反应中生成物有氧化铁,还有二氧化硫和三氧化硫,说明硫酸亚铁晶体分解时只有部分硫元素的化合价降低,反应的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
【详解】根据图象可知,最终生成的氧化铁质量是8g,根据FeSO4 xH2O的化学式可知铁原子和水的个数比为1:x,则: ,解得x=5,故选C。
15.(1)B
(2)BC
(3) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 还原性和酸性
(4)KMnO4>O2
【详解】(1)A.常温下浓盐酸与二氧化锰不反应,图中缺少酒精灯,故A错误;
B.Fe与稀硫酸反应生成的氢气可排出装置内的空气,关闭a,氢气产生的压强可使硫酸亚铁与NaOH反应,可较长时间看到白色Fe(OH)2白色沉淀,故B正确;
C.加热时碳酸氢钠分解有水生成,为防止生成的水倒流,试管口应略向下倾斜,故C错误;
D. HCl与碳酸氢钠溶液反应生成二氧化碳,氢气中引入新杂质,不能除杂,故D错误。
答案选B。
(2)A.硬铝的硬度大,柔韧性不好,通常不用于制导线,故A不符合题意;
B.14C能发生衰变,则考古时利用14C测定一些文物的年代,故B符合题意;
C.锗既有金属性也有非金属性,可以作半导体材料,故C符合题意;
D.不锈钢材料通常是铁锰合金,铁铬合金等,故D不符合题意。
答案为BC。
(3)实验室用MnO2与浓盐酸加热制Cl2,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,浓盐酸表现了还原性和酸性;
(4)氧化还原方程式中,氧化剂的氧化性强于氧化产物,该反应中KMnO4是氧化剂,O2是氧化产物,故氧化性:KMnO4>O2。
16.(1)Mn
(2)
(3) 血红 还原
(4) 适量铁粉
(5)C
(6)22.4
【详解】(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有Mn元素。
(2)FeO、、中具有磁性的是,可作红色颜料的是,氧化铁为红色固体;
(3)铁离子和KSCN反应溶液变为红色,补铁口服液中含有,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为红色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,说明维生素C能将铁离子还原为亚铁离子,此过程中利用了维生素C的还原性
(4)Cu与溶液反应生成和,该反应的化学方程式为;向反应后的溶液中加入铁粉,铁和氯化铜生成铜单质和氯化亚铁,可回收Cu,并得到溶液。
(5)A.中钾氧化合价分别为+1、-2,则铁元素的化合价为+6价,A正确;
B.在有机物乙醇中溶解度较小,用无水乙醇洗涤可以减少产品的损耗,B正确;
C.氯气和氢氧化钾生成强氧化性次氯酸钾,次氯酸钾将硝酸铁氧化为高铁酸根离子,故反应Ⅱ中的氧化剂是次氯酸钾,C错误;
D.高铁酸根离子中铁处于高价态,具有强氧化性,能杀菌消毒,D正确;
故选C;
(6),则有2mol电子发生转移,理论上最多可制得1mol氯气,其体积(标准状况)是22.4L。
17.(1)红
(2)还原性
(3)酸性
(4)避免与氧化性物质接触(或避免与碱性物质接触)
【详解】(1)KSCN溶液遇Fe3+显红色。
(2)试管B中加入维生素C,不显红色,说明维生素C将Fe3+还原,体现了维生素C的还原性。
(3)维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有酸性,与NaHCO3反应生成水和二氧化碳。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意避免与氧化性物质接触(或避免与碱性物质接触)。
18.(1) 固体逐渐溶解,溶液由无色变为蓝色,有气泡产生 Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O
(2) 铁粉 Fe+Cu2+=Fe2++Cu
(3) 过滤 难溶于水和稀硫酸的杂质 加热浓缩、冷却结晶
【分析】孔雀石中加入稀硫酸可看到孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O。经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来即可,故金属可能是Fe;要从滤液中得到CuSO4晶体,需进行加热浓缩、冷却结晶等操作。
【详解】(1)根据分析可知,反应①的现象为固体逐渐溶解,溶液由无色变为蓝色,有气泡产生,反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O。
(2)根据分析可知,反应②中加入的金属为Fe,反应方程式为Fe+Cu2+=Fe2++Cu。
(3)经过滤除去难溶于水和稀硫酸的杂质,故操作a为过滤;要从滤液中得到CuSO4晶体,需进行加热浓缩、冷却结晶等操作。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列相关反应的离子方程式书写错误的是
A.盐酸除铁锈:
B.硫酸铜溶液与氢氧化钡溶液反应:
C.向硝酸银溶液中加盐酸:
D.向NaCl溶液中加入盐酸除去含有的杂质
2.水溶液中的可以用除去,反应的离子方程式为,下列说法正确的是
A.是氧化剂,发生还原反应 B.还原性:
C.与浓盐酸混合加热才可以生成 D.每生成,反应中转移电子的物质的量为12mol
3.黄铁矿(主要成分)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,氧化过程如图所示。
下列有关说法不正确的是
A.d步反应生成胶体可以作消毒剂
B.氧化过程会产生较多酸性废水破坏矿区生态环境
C.a步反应中完全被氧化时大约消耗标准状况下的空气39L
D.检验a步反应中是否生成,方法是先向溶液中加入KSCN溶液,无明显变化,然后通入氯气,若溶液变红,则说明产物是
4.下列离子方程式书写正确的是
A.向水中通入氯气:
B.向硫酸铜溶液中加入小块钠:
C.磁性氧化铁与盐酸反应:
D.用烧碱溶液除去铁粉中的铝粉:
5.阿伏加德罗常数的值为,下列说法正确的是
A.常温常压下,0.1mol铁与足量浓硫酸反应生成的分子数为1.5
B.20g 中含有电子数为10
C.标准状况下,11.2L 含氧原子数为1.5
D.标准状况下,5.6L NO和5.6L 混合后分子总数为0.5
6.绿矾()可作还原剂、着色剂、制药等,在不同温度下易分解成各种铁的氧化物和硫的氧化物。已知是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。下列说法正确的是
A.若装置A试管内固体粉末由绿色变棕黄色,由此得出绿矾的分解产物中一定含有
B.若装置B中可观察到的现象是品红溶液褪色,由此得出绿矾的分解产物中一定含有
C.装置C用于吸收多余的尾气,最终生成,以防止有毒气体排放,污染环境
D.若装置C中有无色气体逸出且使带火星的木条复燃,由此得出绿矾分解产物中含
7.在给定条件下,下列选项所示的物质间转化无法实现的是
A.
B.
C.
D.
8.下列有关物质的性质与用途具有对应关系的是
A.不稳定,可用于医学上作补血剂
B.熔融的氯化镁能被电解,氯化镁可用作冶炼镁的原料
C.铝的金属活泼性强,可用于制作铝金属制品
D.呈碱性,可用于鉴别葡萄糖和蔗糖
9.一种利用废铜渣(主要成分,及少量等杂质)制备超细铜粉的流程如下:
下列说法正确的是
A.“酸浸”所得滤渣的主要成分为
B.“沉铁”发生反应的离子方程式为
C.“沉铜”发生的反应为复分解反应
D.“转化”后所得滤液中含有的主要阳离子:
10.常温下,下列各组离子在指定溶液中能大量共存的是
A.强酸溶液:、、、
B.无色透明的溶液:、、、MnO
C.强碱溶液:、、、
D.0.1 溶液:、、、
11.下列实验装置(部分夹持装置略)或现象均正确的是
A.钠在分界面处跳动,试管内有白色沉淀生成 B.等质量的固体与足量的盐酸反应,乙产生气泡快,反应后甲气球大 C.大理石溶解,有大量气泡产生 D.向沸水中滴入饱和氯化铁,立即生成红褐色沉淀
A.A B.B C.C D.D
12.含氰废水中氰化物的主要形态是HCN和CN-,CN-具有较强的配位能力,能与Cu+形成一种无限长链离子,其片段为≡≡N—…;CN-结合H+能力弱于C。氰化物浓度较低时,可在碱性条件下用H2O2或Cl2将其转化为N2;浓度较高时,可加入HCN、Fe和K2CO3溶液反应生成K4[Fe(CN)6]溶液。下列物质性质与用途具有对应关系的是
A.H2O2具有还原性,可用于处理含氰废水
B.维生素C具有还原性,可用作食品抗氧化剂
C.FeCl3溶液显酸性,可用于刻蚀铜板
D.NaHCO3受热易分解,可用于治疗胃酸过多
13.下列关于铁及其化合物之间转化反应的方程式书写正确的是
A.FeSO4溶液中加入酸性KMnO4溶液:5Fe2++MnO+8H+=5Fe3++Mn2++4H2O
B.过量铁粉加入稀硝酸中:Fe+4H++NO=Fe3++NO↑+2H2O
C.氢氧化铁中加入氢碘酸:Fe(OH)3+3HI=FeI3+3H2O
D.H2O(g)通过灼热铁粉:2Fe+3H2O(g)Fe2O3+3H2
14.研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取一定质量的硫酸亚铁晶体样品按下图高温加热,使其完全分解,生成SO3,反应后装置A中还残留红棕色固体氧化铁,装置B中硫酸铜粉末变蓝,质量增加9g。
根据图中有关数据,可计算出FeSO4·xH2O中x的值是
A.14 B.7 C.5 D.10
二、非选择题
15.回答下列问题:
(1)关于甲、乙、丙、丁四套装置的说法正确的是 。
A.用装置甲制取氯气 B.用丙装置可以较长时间看到白色Fe(OH)2白色沉淀
C.用丁装置证明碳酸氢钠受热易分解 D.用装置乙除去氢气中的少量氯化氢
(2)以下物质(或粒子)与其用途之间关联正确的是 。
A.硬铝——制导线 B.14C——测定文物年代
C.锗——作半导体材料 D.Ti-Fe合金——作不锈钢材料
(3)实验室制取Cl2的化学方程式: 。浓盐酸表现的性质是 。
(4)已知:在稀硫酸中,MnO与H2O2也能发生以下反应:2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O。由上述反应得出物质氧化性强弱的结论是_______>_______(填化学式)。
16.铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
Ⅰ.
(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有 元素。
(2)铁元素有三种常见的氧化物,分别是FeO、、。其中具有磁性的是 ,可作红色颜料的是 。
(3)某补铁口服液中含有,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,此过程中利用了维生素C的 性。
(4)可作为铜电路板的腐蚀液,其反应原理为Cu与溶液反应生成和,该反应的化学方程式为 。向反应后的溶液中加入 ,可回收Cu,并得到溶液。
Ⅱ.高铁酸钾()是一种新型、高效、多功能水处理剂。工业上制备高铁酸钾的流程如下图所示:
(5)下列说法错误的是_____。
A.中铁元素的化合价为+6价
B.用无水乙醇洗涤可以减少产品的损耗
C.反应Ⅱ中的氧化剂是
D.高铁酸根离子具有强氧化性,能杀菌消毒
(6)用电解饱和食盐水获得原料氯气的过程中有2mol电子发生转移,试计算理论上最多可制得氯气的体积(标准状况)是 L。
17.铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化为Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有 (填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有 (填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意 (写一条即可)。
18.孔雀石的主要成分为Cu2(OH)2CO3.某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):
(1)反应①能观察到的现象是 ,有关反应的化学方程式为 。
(2)反应②加入的金属可能是 ,有关反应的离子方程式为 。
(3)操作a可能的方法是 ,欲除掉的杂质为 ;要从操作a所得到的溶液中得到溶质的晶体,需要进行的操作是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.铁锈的主要成分是氧化铁,则盐酸除铁锈的离子方程式为:,A正确;
B.硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡和氢氧化铜,离子方程式为:,B正确;
C.硝酸银为强电解质,写离子方程式时需要拆开,则向硝酸银溶液中加盐酸的离子方程式为:,C错误;
D.碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为:,D正确;
故选C。
2.A
【分析】反应过程中,中Mn元素由+7价下降到+4价,作为氧化剂,Mn2+中Mn元素由+2价上升到+4价,作还原剂,则既是氧化产物,又是还原产物。
【详解】A.由分析可知,是氧化剂,发生还原反应,故A正确;
B.由分析可知,Mn2+是还原剂, 既是氧化产物,又是还原产物,则还原性:,故B错误;
C.的氧化性强于,与浓盐酸混合在常温下就可以生成,故C错误;
D.每生成,消耗2mol,中Mn元素由+7价下降到+4价,共转移6mol电子,故D错误;
故选A。
3.A
【详解】A.d步反应生成可以作净水、但不能做消毒剂,故A错误;
B.由图可知,过程a、d会产生较多酸性废水破坏矿区生态环境,故B正确;
C.由a可知,1molFeS2转化2molSO失去14个电子,0.1molFeS2完全被氧化时失去电子为1.4mol,需要氧气的物质的量是,标况下的体积是0.35mol×22.4L/mol=7.84L,因此需要空气的体积是7.84L×5=39.2L,即约为39L,故C正确;
D.检验a步反应中是否生成,方法是先向溶液中加入KSCN溶液,无明显变化,说明不存在铁离子,然后通入氯气,若溶液变红,则说明有铁离子生成,所以产物是,故D正确;
故选:A。
4.D
【详解】A.次氯酸是弱酸,不能拆开,离子方程式为:,A项错误;
B.钠先与水反应生成氢氧化钠和氢气,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,离子方程式为,B项错误;
C.磁性氧化铁为四氧化三铁,离子方程式为:,C项错误;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
故选D。
5.B
【详解】A.铁与浓硫酸会发生钝化,常温常压下,0.1mol铁与足量浓硫酸反应不能生成,故A错误;
B.20g 的物质的量为=1mol,中含有10个电子,20g 中含有电子数为10,故B正确;
C.标准状况下,不是气体,11.2L 的物质的量不是0.5mol,故C错误;
D.标况下,5.6L气体的物质的量是0.25mol,由于一氧化氮与氧气反应生成了二氧化氮,所以气体的物质的量减小,故D错误;
故选B。
6.D
【详解】A.若装置A试管内固体粉末由绿色变棕黄色,只能说明生成了棕黄色的,不能得出一定含有,A错误;
B.若装置B中观察到的现象是品红褪色,由此得出绿矾的分解产物中可能含有(可逆化合漂白),也可能含有(氧化漂白),B错误;
C.装置C用于吸收易溶的或尾气,最终还会有生成,C错误;
D.若装置C中有无色气体逸出且使带火星的木条复燃,,氧气支持燃烧,由此得出绿矾分解产物中含,D正确;
故选D。
7.D
【详解】A.工业上制取高纯硅,先制取粗硅,再用氢气还原得到高纯硅,流程为:,A正确;
B.根据侯氏制碱法,饱和食盐水中先通入氨气,使溶液呈碱性,再通入,得到晶体,再受热分解得到纯碱,流程为,B正确;
C.铝能与氢氧化钠溶液反应,生成的偏铝酸钠再与过量的盐酸,得到溶液,流程为:,C正确;
D.在工业上制取硝酸,氨气的催化氧化只能得到,D错误;
故选D。
8.B
【详解】A.不稳定,易被氧化,与医学上作补血剂无关联,A错误;
B.熔融的氯化镁能被电解可以冶炼镁,所以氯化镁可用作冶炼镁的原料,B正确;
C.铝的金属活泼性强,与用于制作铝金属制品没有关联,C错误;
D.鉴别葡萄糖和蔗糖,利用的氧化性,与碱性无关,D错误;
故选B。
9.D
【分析】废铜渣(主要成分CuO,及少量Fe2O3、SiO2等杂质) “酸浸”时CuO、少量Fe2O3与H2SO4反应生成硫酸铜、硫酸铁,SiO2不溶于H2SO4,所以滤渣的成分是SiO2,滤液中加过量氨水沉铁除去Fe3+,铜离子转化为Cu(NH3),所得滤液通二氧化硫沉铜,过滤出产生的CuNH4SO3沉淀,加稀硫酸转化,+1价铜发生歧化反应,得到铜离子、和Cu。
【详解】A.由分析可知,“酸浸”所得滤渣的主要成分为SiO2,故A错误;
B.NH3·H2O是弱碱,在离子方程式中不能拆,故B错误;
C.“沉铜”时含有Cu(NH3)和过量氨水的混合溶液中通入二氧化硫生成CuNH4SO3沉淀,铜元素化合价降低,则发生氧化还原反应,不为复分解反应,故C错误;
D.转化时,CuNH4SO3在稀硫酸中发生歧化反应,得到铜离子、和Cu,结合元素守恒可知, “转化”后所得滤液中含有的主要阳离子:,故D正确;
故选D。
10.D
【详解】A.强酸溶液中,H+和OH-反应生成水而不能大量共存,故A错误;
B.MnO为紫色溶液,故B错误;
C.强碱溶液中,OH-和生成氨水而不能大量共存,故C错误;
D.0.1 溶液中:、、、互不反应可以大量共存,故D正确;
故选D。
11.A
【详解】A.钠的密度介于水和煤油之间,故在分界面处跳动,钠与水反应生成和,与溶液反应生成白色絮状沉淀,A正确;
B.等质量的碳酸钠和碳酸氢钠,碳酸钠产生二氧化碳少,B错误;
C.生成的硫酸钙微溶,覆盖在大理石表面,阻碍反应的进行,C错误;
D.生成的是胶体不是沉淀,D错误;
故选A。
12.B
【详解】A.H2O2可将氰化物转化为氮气,氰化物中N元素化合价升高,作还原剂,则H2O2在该反应中表现氧化性,A错误;
B.维生素C具有还原性,易被空气中的氧气氧化,保护食品不被氧化,用作食品抗氧化剂,B正确;
C.FeCl3能与Cu生成可溶性氯化铜,表现出较强氧化性,可用于蚀刻印刷电路板,与FeCl3溶液显酸性无关,C错误;
D.NaHCO3性质不稳定,受热易发生分解反应生成CO2,CO2能使面团松软多孔,可用作食品膨松剂,D错误;
故选:B。
13.A
【详解】A.酸性KMnO4具有强氧化性,可把Fe2+氧化成Fe3+,本身被还原生成Mn2+,离子方程式正确,A正确;
B.稀硝酸有强氧化性,能把Fe氧化成Fe3+,过量铁粉与Fe反应生成Fe2+,总反应产物应是Fe2+而不是Fe3+,离子方程式为3Fe+8H++2=3Fe2++2NO↑+4H2O,B错误;
C.Fe3+具有较强的氧化性,I-具有较强的还原性,两者能发生氧化还原反应,分别生成Fe2+和,化学方程式为2Fe(OH)3+6HI=2FeI2++6H2O,C错误;
D.Fe与H2O(g)高温反应生成Fe3O4和H2,化学方程式为3Fe+4H2O(g)Fe3O4+4H2,D错误;
故答案选A。
14.C
【分析】硫酸铜遇水变蓝,装置B中硫酸铜粉末变蓝,质量增加9g,说明产物中有水,红棕色固体为氧化铁,说明铁元素化合价升高,而反应物中能降低化合价的只能是硫元素,其还原产物是二氧化硫,反应中生成物有氧化铁,还有二氧化硫和三氧化硫,说明硫酸亚铁晶体分解时只有部分硫元素的化合价降低,反应的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
【详解】根据图象可知,最终生成的氧化铁质量是8g,根据FeSO4 xH2O的化学式可知铁原子和水的个数比为1:x,则: ,解得x=5,故选C。
15.(1)B
(2)BC
(3) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 还原性和酸性
(4)KMnO4>O2
【详解】(1)A.常温下浓盐酸与二氧化锰不反应,图中缺少酒精灯,故A错误;
B.Fe与稀硫酸反应生成的氢气可排出装置内的空气,关闭a,氢气产生的压强可使硫酸亚铁与NaOH反应,可较长时间看到白色Fe(OH)2白色沉淀,故B正确;
C.加热时碳酸氢钠分解有水生成,为防止生成的水倒流,试管口应略向下倾斜,故C错误;
D. HCl与碳酸氢钠溶液反应生成二氧化碳,氢气中引入新杂质,不能除杂,故D错误。
答案选B。
(2)A.硬铝的硬度大,柔韧性不好,通常不用于制导线,故A不符合题意;
B.14C能发生衰变,则考古时利用14C测定一些文物的年代,故B符合题意;
C.锗既有金属性也有非金属性,可以作半导体材料,故C符合题意;
D.不锈钢材料通常是铁锰合金,铁铬合金等,故D不符合题意。
答案为BC。
(3)实验室用MnO2与浓盐酸加热制Cl2,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,浓盐酸表现了还原性和酸性;
(4)氧化还原方程式中,氧化剂的氧化性强于氧化产物,该反应中KMnO4是氧化剂,O2是氧化产物,故氧化性:KMnO4>O2。
16.(1)Mn
(2)
(3) 血红 还原
(4) 适量铁粉
(5)C
(6)22.4
【详解】(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有Mn元素。
(2)FeO、、中具有磁性的是,可作红色颜料的是,氧化铁为红色固体;
(3)铁离子和KSCN反应溶液变为红色,补铁口服液中含有,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为红色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,说明维生素C能将铁离子还原为亚铁离子,此过程中利用了维生素C的还原性
(4)Cu与溶液反应生成和,该反应的化学方程式为;向反应后的溶液中加入铁粉,铁和氯化铜生成铜单质和氯化亚铁,可回收Cu,并得到溶液。
(5)A.中钾氧化合价分别为+1、-2,则铁元素的化合价为+6价,A正确;
B.在有机物乙醇中溶解度较小,用无水乙醇洗涤可以减少产品的损耗,B正确;
C.氯气和氢氧化钾生成强氧化性次氯酸钾,次氯酸钾将硝酸铁氧化为高铁酸根离子,故反应Ⅱ中的氧化剂是次氯酸钾,C错误;
D.高铁酸根离子中铁处于高价态,具有强氧化性,能杀菌消毒,D正确;
故选C;
(6),则有2mol电子发生转移,理论上最多可制得1mol氯气,其体积(标准状况)是22.4L。
17.(1)红
(2)还原性
(3)酸性
(4)避免与氧化性物质接触(或避免与碱性物质接触)
【详解】(1)KSCN溶液遇Fe3+显红色。
(2)试管B中加入维生素C,不显红色,说明维生素C将Fe3+还原,体现了维生素C的还原性。
(3)维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有酸性,与NaHCO3反应生成水和二氧化碳。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意避免与氧化性物质接触(或避免与碱性物质接触)。
18.(1) 固体逐渐溶解,溶液由无色变为蓝色,有气泡产生 Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O
(2) 铁粉 Fe+Cu2+=Fe2++Cu
(3) 过滤 难溶于水和稀硫酸的杂质 加热浓缩、冷却结晶
【分析】孔雀石中加入稀硫酸可看到孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O。经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来即可,故金属可能是Fe;要从滤液中得到CuSO4晶体,需进行加热浓缩、冷却结晶等操作。
【详解】(1)根据分析可知,反应①的现象为固体逐渐溶解,溶液由无色变为蓝色,有气泡产生,反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O。
(2)根据分析可知,反应②中加入的金属为Fe,反应方程式为Fe+Cu2+=Fe2++Cu。
(3)经过滤除去难溶于水和稀硫酸的杂质,故操作a为过滤;要从滤液中得到CuSO4晶体,需进行加热浓缩、冷却结晶等操作。
答案第1页,共2页
答案第1页,共2页
