5.2 课时1 氮气与氮的固定 一氧化氮和二氧化氮 课件 (共20张PPT)2023-2024学年高一化学人教版(2019)必修2
文档属性
| 名称 | 5.2 课时1 氮气与氮的固定 一氧化氮和二氧化氮 课件 (共20张PPT)2023-2024学年高一化学人教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 21:20:49 | ||
图片预览






文档简介
(共20张PPT)
第五章 化工生产中的重要非金属原元素
第二节 氮及其化合物 课时1
据了解在新疆与青海两省区交界处有一狭长山谷,这里经常在风和日丽的晴天之时顷刻间电闪雷鸣,下起了雷雨。奇怪的是这里牧草茂盛,四季常青,被当地的牧民称之为“魔鬼谷”。为什么魔鬼谷牧草旺盛?
1. 通过分析氮的原子结构,推断含氮物质可能的化学特性。
2.通过实验知道一氧化氮与氧气反应、二氧化氮与水反应的性质。
3.了解自然界中氮循环的基本过程,认识氮的固定。
知识点一:氮气与氮的固定
1.氮气
在自然界中,氮元素主要以氮分子的形式存在于空气中
氮元素位于元素周期表的第二周期、第VA族。
N
既不容易得到三个电子,也不容易失去5个电子
氮原子一般通过共用电子对与其他物质相互结合形成物质
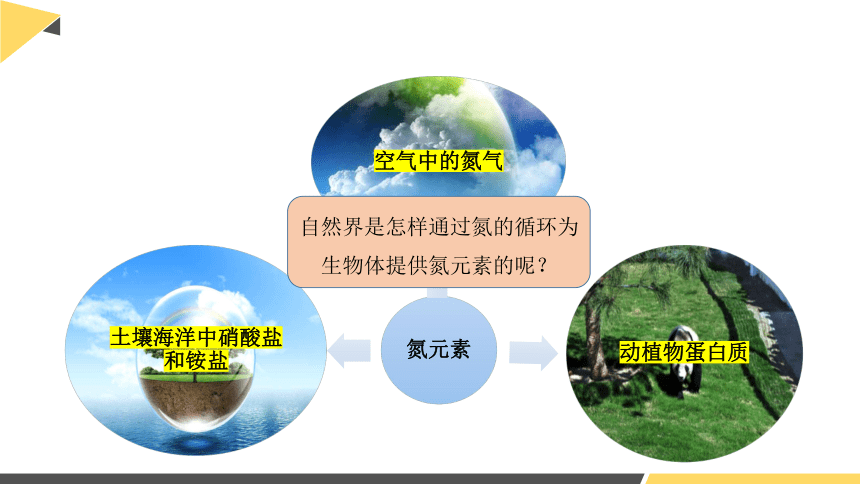
氮元素
动植物蛋白质
土壤海洋中硝酸盐和铵盐
空气中的氮气
自然界是怎样通过氮的循环为生物体提供氮元素的呢?
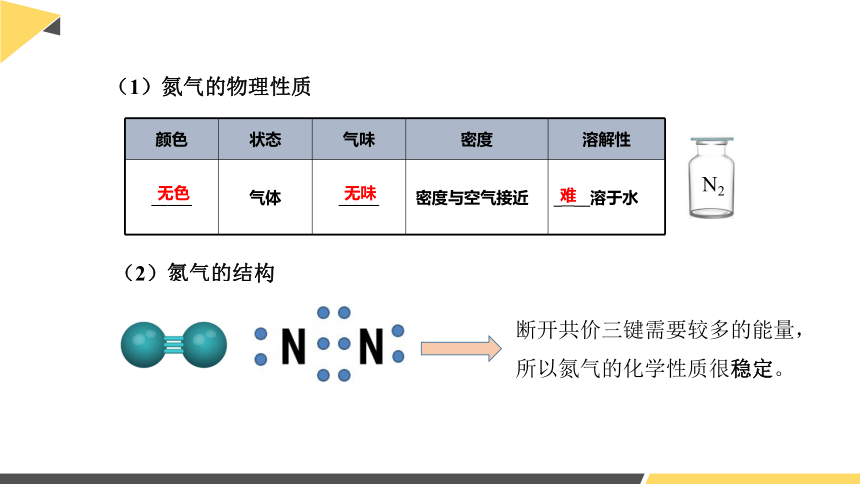
(1)氮气的物理性质
颜色 状态 气味 密度 溶解性
_____ 气体 _____ 密度与空气接近 _ __溶于水
无色
无味
难
(2)氮气的结构
断开共价三键需要较多的能量,所以氮气的化学性质很稳定。
N2
(3)氮气的化学性质
在高温、放电等条件下,氮气能够与镁、氧气、氢气等物质发生化合反应。
获得足够的能量
N2+O2 2NO(无色气体)
放电或高温
==========
N2+3Mg Mg3N2
点燃
====
N2+3H2 2NH3
0
-3
0
+2
0
-3
氧化剂
还原剂
氧化剂
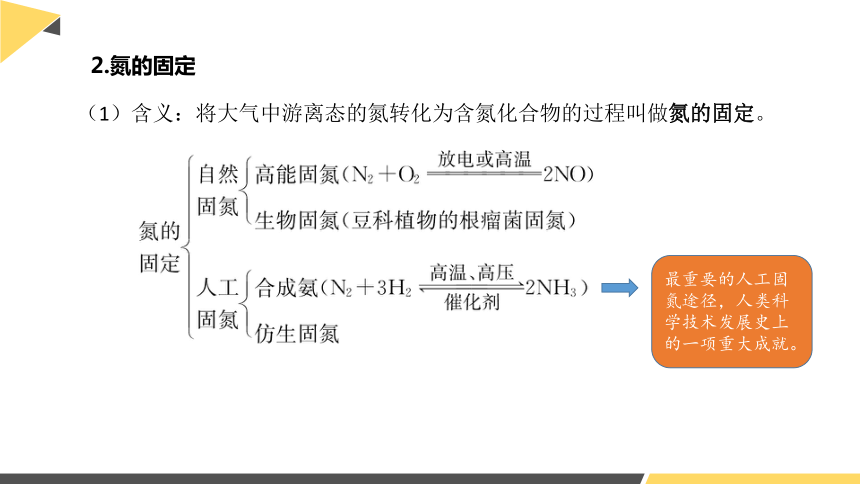
(1)含义:将大气中游离态的氮转化为含氮化合物的过程叫做氮的固定。
2.氮的固定
最重要的人工固氮途径,人类科学技术发展史上的一项重大成就。
N2
HNO3
NH3
NO NO2
NH3
HNO3
游离态
化合态
氮的固定
氨基酸
植物蛋白
动物蛋白
人工固氮(合成氨)
自然固氮
高能固氮
生物固氮
原来雷电所产生的高温使空气中的氮气和氧气生成了一氧化氮,一氧化氮继续与氧气反应生成二氧化氮,二氧化氮遇水形成硝酸,随雨水落下后,与土壤中的岩石作用形成能溶于水、易于植物吸收利用的硝酸盐。
视频
知识点二:一氧化氮和二氧化氮
1.物理性质
物质 NO NO2
颜色
毒性
溶解度
气味
红棕色
无色
NO
NO2
两种气体的收集方法相同吗
排水法
向上排空气法
有毒
有毒
不溶于水
易溶于水
无味
刺激性气味
【实验5-5】如图所示,在一支50mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察现象。振荡注射器,再观察现象。
视频
实验 操作 在一支50 mL的注射器里充入20 mL NO,然后吸入5mL 水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象,然后再振荡注射器
现象 ___________ _________________,
振荡后________________
无明显现象
无色气体变红棕色
红棕色变为无色
【结论】在一定条件下,NO与NO2可以相互转化。
反应的化学方程式为
①NO→NO2: _____________________;
②NO2→NO: __________________________(工业制取硝酸)。
2NO+O2 = 2NO2
3NO2+H2O = 2HNO3+NO
如果将注射器中的NO充分转化,可以采取什么措施?上述实验对工业生产硝酸有什么启示?
【思考与讨论】
NO和NO2是否属于酸性氧化物
NO不和水反应,故不是酸性氧化物;NO2和水生成HNO3和NO,发生氧化还原反应,也不符合酸性氧化物的定义。
(1) 若试管中装10molNO2,则通入多少摩尔O2可以使NO2充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①+②×2得:4NO2+O2+2H2O === 4HNO3,即当NO2和O2的体积比为4︰1时水可以充满试管,需通入2.5 moL O2。
(2) 若试管中装10molNO,则通入多少摩尔O2可以使NO充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①×3+②×2得:4NO+3O2+2H2O === 4HNO3,即当NO和O2的体积比为4︰3时水可以充满试管,需通入7.5 moL O2。
4NO+3O2+2H2O === 4HNO3
当体积比V(NO):V(O2)
4:3
=4:3
>4:3
当NO、O2混合气体与水反应时
O2过量,剩余气体是O2
恰好完全反应
NO过量,剩余气体是NO
当NO2、O2混合气体与水反应时
4NO2+O2+2H2O === 4HNO3
当体积比V(NO2):V(O2)
4:1
=4:1
>4:1
(过量NO2与H2O反应生成NO)
O2过量,剩余气体是O2
恰好完全反应
NO2过量,剩余气体是NO
含氮氧化物和氧气的混合气体与水反应后气体成分的规律总结
(1)将1 mol N2和3 mol H2充入密闭容器中,在一定条件下反应, 能得到2 mol NH3。 ( )
(2)化合态的氮元素只显一种价态。 ( )
(3)N2在通常状况下与O2反应生成NO2。 ( )
(4)氮的固定中氮元素一定被氧化。 ( )
(5)雷雨天含氮物质发生的反应不一定都是氮的固定。( )
x
√
x
x
x
1.判断正误
练一练
2.将盛有1molNO和NO2混合气体的试管倒立于盛满水的水槽中,再通入0.4molO2,充分反应后,整个试管充满水,则原混合气体中NO与NO2体积比为 ( )
A.1︰2 B.2︰5 C.3︰7 D.无法确定
【解析】设1molNO和NO2的混合气体中有a molNO和(1-a) molNO2,
根据4NO+3O2+2H2O 4HNO3和4NO2+O2+2H2O 4HNO3可得:
+ =0.4,所以a=0.3,V(NO)︰V(NO2)=3︰7。
C
║
║
3.下列关于氮气性质的说法中,错误的是( )
A.通常情况下,氮气性质很不活泼
B.可在氧气中燃烧,生成一氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
B
4.一定条件下,将等体积的NO和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积为原总体积的( )
C
自然界中的氮循环
氮的循环
氮的固定
氮气
氮的氧化物
自然固氮
人工固氮
高能固氮
生物固氮
合成氨
合成氨反应
一氧化氮
二氧化氮
无色无味气体,难溶于水
红棕色、刺激性气味气体,易溶于水
自然界中含氮的物质
N2+O2===2NO
放电
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
第五章 化工生产中的重要非金属原元素
第二节 氮及其化合物 课时1
据了解在新疆与青海两省区交界处有一狭长山谷,这里经常在风和日丽的晴天之时顷刻间电闪雷鸣,下起了雷雨。奇怪的是这里牧草茂盛,四季常青,被当地的牧民称之为“魔鬼谷”。为什么魔鬼谷牧草旺盛?
1. 通过分析氮的原子结构,推断含氮物质可能的化学特性。
2.通过实验知道一氧化氮与氧气反应、二氧化氮与水反应的性质。
3.了解自然界中氮循环的基本过程,认识氮的固定。
知识点一:氮气与氮的固定
1.氮气
在自然界中,氮元素主要以氮分子的形式存在于空气中
氮元素位于元素周期表的第二周期、第VA族。
N
既不容易得到三个电子,也不容易失去5个电子
氮原子一般通过共用电子对与其他物质相互结合形成物质
氮元素
动植物蛋白质
土壤海洋中硝酸盐和铵盐
空气中的氮气
自然界是怎样通过氮的循环为生物体提供氮元素的呢?
(1)氮气的物理性质
颜色 状态 气味 密度 溶解性
_____ 气体 _____ 密度与空气接近 _ __溶于水
无色
无味
难
(2)氮气的结构
断开共价三键需要较多的能量,所以氮气的化学性质很稳定。
N2
(3)氮气的化学性质
在高温、放电等条件下,氮气能够与镁、氧气、氢气等物质发生化合反应。
获得足够的能量
N2+O2 2NO(无色气体)
放电或高温
==========
N2+3Mg Mg3N2
点燃
====
N2+3H2 2NH3
0
-3
0
+2
0
-3
氧化剂
还原剂
氧化剂
(1)含义:将大气中游离态的氮转化为含氮化合物的过程叫做氮的固定。
2.氮的固定
最重要的人工固氮途径,人类科学技术发展史上的一项重大成就。
N2
HNO3
NH3
NO NO2
NH3
HNO3
游离态
化合态
氮的固定
氨基酸
植物蛋白
动物蛋白
人工固氮(合成氨)
自然固氮
高能固氮
生物固氮
原来雷电所产生的高温使空气中的氮气和氧气生成了一氧化氮,一氧化氮继续与氧气反应生成二氧化氮,二氧化氮遇水形成硝酸,随雨水落下后,与土壤中的岩石作用形成能溶于水、易于植物吸收利用的硝酸盐。
视频
知识点二:一氧化氮和二氧化氮
1.物理性质
物质 NO NO2
颜色
毒性
溶解度
气味
红棕色
无色
NO
NO2
两种气体的收集方法相同吗
排水法
向上排空气法
有毒
有毒
不溶于水
易溶于水
无味
刺激性气味
【实验5-5】如图所示,在一支50mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察现象。振荡注射器,再观察现象。
视频
实验 操作 在一支50 mL的注射器里充入20 mL NO,然后吸入5mL 水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象,然后再振荡注射器
现象 ___________ _________________,
振荡后________________
无明显现象
无色气体变红棕色
红棕色变为无色
【结论】在一定条件下,NO与NO2可以相互转化。
反应的化学方程式为
①NO→NO2: _____________________;
②NO2→NO: __________________________(工业制取硝酸)。
2NO+O2 = 2NO2
3NO2+H2O = 2HNO3+NO
如果将注射器中的NO充分转化,可以采取什么措施?上述实验对工业生产硝酸有什么启示?
【思考与讨论】
NO和NO2是否属于酸性氧化物
NO不和水反应,故不是酸性氧化物;NO2和水生成HNO3和NO,发生氧化还原反应,也不符合酸性氧化物的定义。
(1) 若试管中装10molNO2,则通入多少摩尔O2可以使NO2充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①+②×2得:4NO2+O2+2H2O === 4HNO3,即当NO2和O2的体积比为4︰1时水可以充满试管,需通入2.5 moL O2。
(2) 若试管中装10molNO,则通入多少摩尔O2可以使NO充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①×3+②×2得:4NO+3O2+2H2O === 4HNO3,即当NO和O2的体积比为4︰3时水可以充满试管,需通入7.5 moL O2。
4NO+3O2+2H2O === 4HNO3
当体积比V(NO):V(O2)
4:3
=4:3
>4:3
当NO、O2混合气体与水反应时
O2过量,剩余气体是O2
恰好完全反应
NO过量,剩余气体是NO
当NO2、O2混合气体与水反应时
4NO2+O2+2H2O === 4HNO3
当体积比V(NO2):V(O2)
4:1
=4:1
>4:1
(过量NO2与H2O反应生成NO)
O2过量,剩余气体是O2
恰好完全反应
NO2过量,剩余气体是NO
含氮氧化物和氧气的混合气体与水反应后气体成分的规律总结
(1)将1 mol N2和3 mol H2充入密闭容器中,在一定条件下反应, 能得到2 mol NH3。 ( )
(2)化合态的氮元素只显一种价态。 ( )
(3)N2在通常状况下与O2反应生成NO2。 ( )
(4)氮的固定中氮元素一定被氧化。 ( )
(5)雷雨天含氮物质发生的反应不一定都是氮的固定。( )
x
√
x
x
x
1.判断正误
练一练
2.将盛有1molNO和NO2混合气体的试管倒立于盛满水的水槽中,再通入0.4molO2,充分反应后,整个试管充满水,则原混合气体中NO与NO2体积比为 ( )
A.1︰2 B.2︰5 C.3︰7 D.无法确定
【解析】设1molNO和NO2的混合气体中有a molNO和(1-a) molNO2,
根据4NO+3O2+2H2O 4HNO3和4NO2+O2+2H2O 4HNO3可得:
+ =0.4,所以a=0.3,V(NO)︰V(NO2)=3︰7。
C
║
║
3.下列关于氮气性质的说法中,错误的是( )
A.通常情况下,氮气性质很不活泼
B.可在氧气中燃烧,生成一氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
B
4.一定条件下,将等体积的NO和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积为原总体积的( )
C
自然界中的氮循环
氮的循环
氮的固定
氮气
氮的氧化物
自然固氮
人工固氮
高能固氮
生物固氮
合成氨
合成氨反应
一氧化氮
二氧化氮
无色无味气体,难溶于水
红棕色、刺激性气味气体,易溶于水
自然界中含氮的物质
N2+O2===2NO
放电
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
