5.2 课时3 硝酸 酸雨及防治 课件(共22张ppt) 2023-2024学年高一化学人教版(2019)必修2
文档属性
| 名称 | 5.2 课时3 硝酸 酸雨及防治 课件(共22张ppt) 2023-2024学年高一化学人教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 21:22:32 | ||
图片预览







文档简介
(共22张PPT)
第五章 化工生产中的重要非金属原元素
第一节 氮及其化合物 课时3
“被溶掉的诺贝尔奖章”
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
由浓盐酸和浓硝酸按体积比3:1组成的混合物。
1.知道硝酸的主要性质——不稳定性和强氧化性。
2.知道硝酸是重要的化工原料。
3.了解酸雨的概念,知道酸雨形成的原因以及造成的危害。
知识点一:硝酸
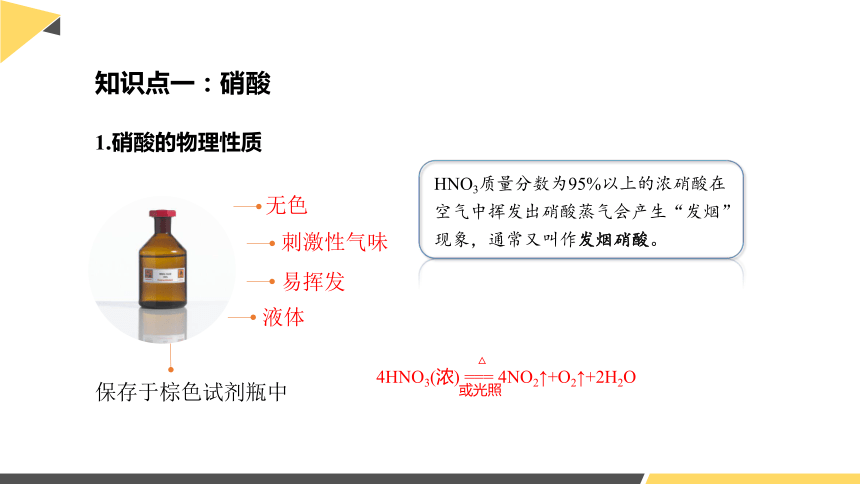
1.硝酸的物理性质
无色
刺激性气味
液体
易挥发
HNO3质量分数为95%以上的浓硝酸在空气中挥发出硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
4HNO3(浓) === 4NO2↑+O2↑+2H2O
△
或光照
保存于棕色试剂瓶中
2.硝酸的化学性质
(1)强氧化性
【实验5-8】在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
视频
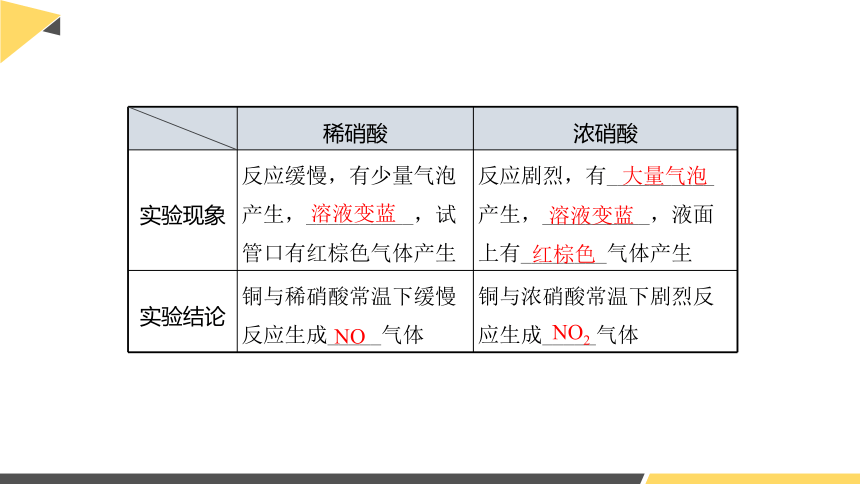
稀硝酸 浓硝酸
实验现象 反应缓慢,有少量气泡产生,__________,试管口有红棕色气体产生 反应剧烈,有__________产生,__________,液面上有________气体产生
实验结论 铜与稀硝酸常温下缓慢反应生成_____气体 铜与浓硝酸常温下剧烈反应生成_____气体
溶液变蓝
大量气泡
溶液变蓝
红棕色
NO
NO2
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) ===3Cu(NO3)2+2NO↑+4H2O
一般情况下:
浓硝酸的还原产物为NO2,稀硝酸的还原产物为NO。
硝酸的浓度不同,与金属反应的产物也不同。
① 与Cu反应
在常温下,铁、铝的表面被浓硝酸或浓硫酸氧化,生成一层致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应。
当加热时,铁、铝会与浓硝酸或浓硫酸发生反应。
常温下,工业上运输和储存浓硝酸时,跟浓硫酸一样可以用铁质或铝制容器。这是为什么呢?
③与非金属反应
硝酸、浓硫酸都是常见的氧化性酸,具有强氧化性。浓硝酸不仅能和金属反应,在加热的条件下,还能与碳单质等非金属单质发生氧化还原反应。试着写出浓硝酸与C和浓硝酸与S反应的化学方程式。
C+4HNO3(浓) === 2H2O+4NO2↑+CO2↑
△
S+6HNO3(浓) === H2SO4+6NO2↑+2H2O
△
3.硝酸的用途
硝酸盐
炸药
染料
塑料
重要的化工原料
【思考与交流】
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
N2
H2
O2
O2
H2O
NH3
NO
NO2
HNO3
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
写出有关化学方程式:
N2→NH3: ________________________________。
NH3→NO: _______________________________。
NO→NO2: _______________________________。
NO2→HNO3: _____________________________。
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
N2+3H2 2NH3
4NH3+5O2 4NO+6H2O
0
-3
-3
+2
+2
+4
+4
+2
+5
酸
单质
盐
氧化物
+2
0
+4
氮元素化合价
物质类别
-3
氢化物
+5
NO2
N2
NO
NH3
HNO3
NH4Cl
NaNO3
H2
Ca(OH)2
HCl
NaOH
H2O
Cu
Cu
O2
H2O
O2
NH3
O2
概括 整合
知识点二:酸雨及其防治
1.酸雨的形成
酸雨:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
S
SO2
SO3
H2SO4
硫酸型酸雨:
硝酸型酸雨:
NO2
HNO3
成因:主要是大气中的SO2与NOx溶于水形成的。
SO2
O2
H2O
H2SO4
化石燃料的燃烧
2SO2+O2 2SO3
催化剂
SO2+H2O H2SO3
SO3+H2O===H2SO4
硫酸型酸雨
化石燃料的燃烧
植物体的焚烧
硝酸型酸雨
大气中的氮氧化物
与水反应生成硝酸和亚硝酸
硝酸型酸雨
2.酸雨的危害
对人体健康也有直接影响
使湖泊水质变酸,导致水生生物死亡
酸雨浸渍土壤,使土壤变得贫瘠
造成森林大面积死亡,腐蚀建筑
3.酸雨的防治
严格规定污染物的排放标准,提高人们的环境保护意识
酸雨的防治
改变能源结构,开发清洁能源
控制酸性物质的排放,对含硫燃料预先进行脱硫等
脱硫塔
1.判断正误(正确的打“√”,错误的打“×”)。
(1)常温下铁与浓硝酸反应,产生大量红棕色气体。( )
(2)用浓硝酸与Cu反应制备NO2。( )
(3)汽车尾气中的氮氧化物与碳氢化合物是产生光化学烟雾的元凶。( )
(4)氮氧化合物也可以形成酸雨。( )
x
√
√
√
练一练
2.下列块状金属在常温时,能全部溶于足量的浓硝酸的是 ( )
A.Au B.Cu C.Al D.Fe
3.下列反应中硝酸只表现强氧化性的是( )
A.灼热的炭与浓硝酸的反应
B.Cu与稀硝酸的反应
C.FeO与稀硝酸的反应
D.Fe(OH)3与硝酸的反应
B
A
4.化学与环境密切相关,下列有关说法正确的是 ( )
A.酸雨是pH小于7的雨水
B.CO2、SO2都会导致酸雨的形成
C.CO2属于大气污染物
D.开发新能源能够有效控制酸雨
D
5.下列离子方程式正确的是( )
D
硝酸及酸雨
硝酸
无色、易挥发、有刺激性气味的液体
见光易分解为二氧化氮、氧气和水
具有强氧化性,能与金属和部分非金属反应
常温下,浓硝酸能使铁、铝等金属钝化
酸雨
pH小于5.6的雨水
硫酸型酸雨
硝酸型酸雨
使土壤、湖泊酸化
加速建筑物、桥梁等的腐蚀
第五章 化工生产中的重要非金属原元素
第一节 氮及其化合物 课时3
“被溶掉的诺贝尔奖章”
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
由浓盐酸和浓硝酸按体积比3:1组成的混合物。
1.知道硝酸的主要性质——不稳定性和强氧化性。
2.知道硝酸是重要的化工原料。
3.了解酸雨的概念,知道酸雨形成的原因以及造成的危害。
知识点一:硝酸
1.硝酸的物理性质
无色
刺激性气味
液体
易挥发
HNO3质量分数为95%以上的浓硝酸在空气中挥发出硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
4HNO3(浓) === 4NO2↑+O2↑+2H2O
△
或光照
保存于棕色试剂瓶中
2.硝酸的化学性质
(1)强氧化性
【实验5-8】在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。向两支具支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象。向上拉铜丝,终止反应。
视频
稀硝酸 浓硝酸
实验现象 反应缓慢,有少量气泡产生,__________,试管口有红棕色气体产生 反应剧烈,有__________产生,__________,液面上有________气体产生
实验结论 铜与稀硝酸常温下缓慢反应生成_____气体 铜与浓硝酸常温下剧烈反应生成_____气体
溶液变蓝
大量气泡
溶液变蓝
红棕色
NO
NO2
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) ===3Cu(NO3)2+2NO↑+4H2O
一般情况下:
浓硝酸的还原产物为NO2,稀硝酸的还原产物为NO。
硝酸的浓度不同,与金属反应的产物也不同。
① 与Cu反应
在常温下,铁、铝的表面被浓硝酸或浓硫酸氧化,生成一层致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应。
当加热时,铁、铝会与浓硝酸或浓硫酸发生反应。
常温下,工业上运输和储存浓硝酸时,跟浓硫酸一样可以用铁质或铝制容器。这是为什么呢?
③与非金属反应
硝酸、浓硫酸都是常见的氧化性酸,具有强氧化性。浓硝酸不仅能和金属反应,在加热的条件下,还能与碳单质等非金属单质发生氧化还原反应。试着写出浓硝酸与C和浓硝酸与S反应的化学方程式。
C+4HNO3(浓) === 2H2O+4NO2↑+CO2↑
△
S+6HNO3(浓) === H2SO4+6NO2↑+2H2O
△
3.硝酸的用途
硝酸盐
炸药
染料
塑料
重要的化工原料
【思考与交流】
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
N2
H2
O2
O2
H2O
NH3
NO
NO2
HNO3
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
写出有关化学方程式:
N2→NH3: ________________________________。
NH3→NO: _______________________________。
NO→NO2: _______________________________。
NO2→HNO3: _____________________________。
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
N2+3H2 2NH3
4NH3+5O2 4NO+6H2O
0
-3
-3
+2
+2
+4
+4
+2
+5
酸
单质
盐
氧化物
+2
0
+4
氮元素化合价
物质类别
-3
氢化物
+5
NO2
N2
NO
NH3
HNO3
NH4Cl
NaNO3
H2
Ca(OH)2
HCl
NaOH
H2O
Cu
Cu
O2
H2O
O2
NH3
O2
概括 整合
知识点二:酸雨及其防治
1.酸雨的形成
酸雨:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
S
SO2
SO3
H2SO4
硫酸型酸雨:
硝酸型酸雨:
NO2
HNO3
成因:主要是大气中的SO2与NOx溶于水形成的。
SO2
O2
H2O
H2SO4
化石燃料的燃烧
2SO2+O2 2SO3
催化剂
SO2+H2O H2SO3
SO3+H2O===H2SO4
硫酸型酸雨
化石燃料的燃烧
植物体的焚烧
硝酸型酸雨
大气中的氮氧化物
与水反应生成硝酸和亚硝酸
硝酸型酸雨
2.酸雨的危害
对人体健康也有直接影响
使湖泊水质变酸,导致水生生物死亡
酸雨浸渍土壤,使土壤变得贫瘠
造成森林大面积死亡,腐蚀建筑
3.酸雨的防治
严格规定污染物的排放标准,提高人们的环境保护意识
酸雨的防治
改变能源结构,开发清洁能源
控制酸性物质的排放,对含硫燃料预先进行脱硫等
脱硫塔
1.判断正误(正确的打“√”,错误的打“×”)。
(1)常温下铁与浓硝酸反应,产生大量红棕色气体。( )
(2)用浓硝酸与Cu反应制备NO2。( )
(3)汽车尾气中的氮氧化物与碳氢化合物是产生光化学烟雾的元凶。( )
(4)氮氧化合物也可以形成酸雨。( )
x
√
√
√
练一练
2.下列块状金属在常温时,能全部溶于足量的浓硝酸的是 ( )
A.Au B.Cu C.Al D.Fe
3.下列反应中硝酸只表现强氧化性的是( )
A.灼热的炭与浓硝酸的反应
B.Cu与稀硝酸的反应
C.FeO与稀硝酸的反应
D.Fe(OH)3与硝酸的反应
B
A
4.化学与环境密切相关,下列有关说法正确的是 ( )
A.酸雨是pH小于7的雨水
B.CO2、SO2都会导致酸雨的形成
C.CO2属于大气污染物
D.开发新能源能够有效控制酸雨
D
5.下列离子方程式正确的是( )
D
硝酸及酸雨
硝酸
无色、易挥发、有刺激性气味的液体
见光易分解为二氧化氮、氧气和水
具有强氧化性,能与金属和部分非金属反应
常温下,浓硝酸能使铁、铝等金属钝化
酸雨
pH小于5.6的雨水
硫酸型酸雨
硝酸型酸雨
使土壤、湖泊酸化
加速建筑物、桥梁等的腐蚀
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
