6.1 课时2 化学反应与电能 课件(共26张ppt) 2023-2024学年高一化学人教版(2019)必修2
文档属性
| 名称 | 6.1 课时2 化学反应与电能 课件(共26张ppt) 2023-2024学年高一化学人教版(2019)必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 19.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 21:25:53 | ||
图片预览



文档简介
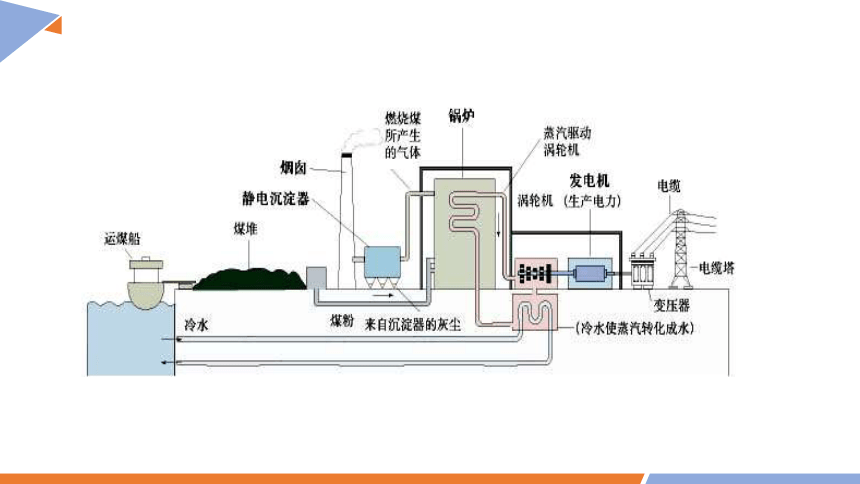
第六章 化学反应与能量
第一节 化学反应与能量变化 课时2
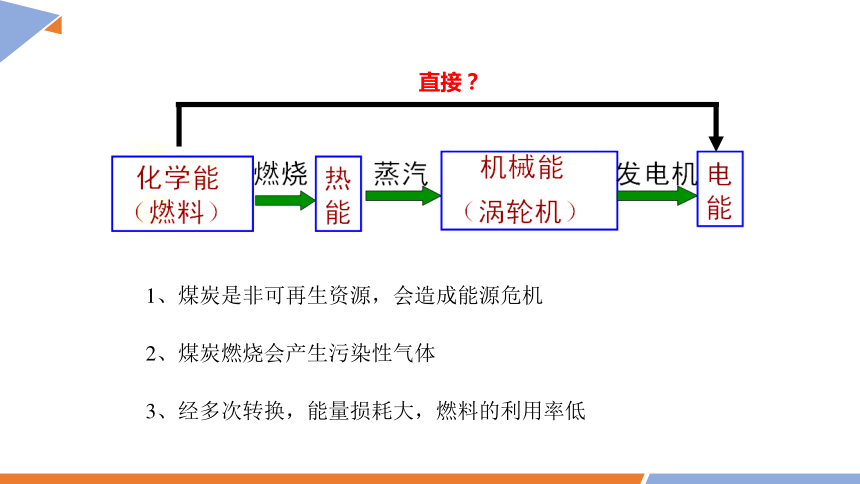
直接?
1、煤炭是非可再生资源,会造成能源危机
2、煤炭燃烧会产生污染性气体
3、经多次转换,能量损耗大,燃料的利用率低
1.知道原电池的装置特点和原理。
2.学会简易电池的设计与制作思路。
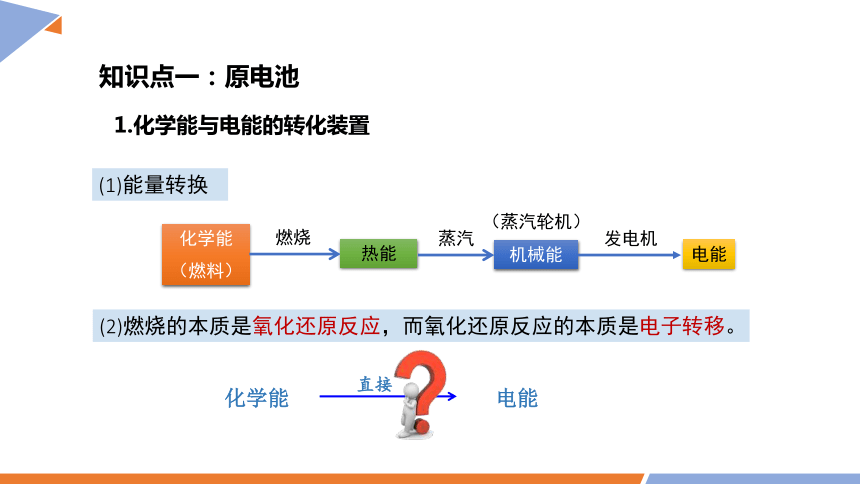
(2)燃烧的本质是氧化还原反应,而氧化还原反应的本质是电子转移。
化学能
(燃料)
热能
机械能
电能
燃烧
蒸汽
发电机
(蒸汽轮机)
(1)能量转换
知识点一:原电池
化学能 电能
直接
1.化学能与电能的转化装置
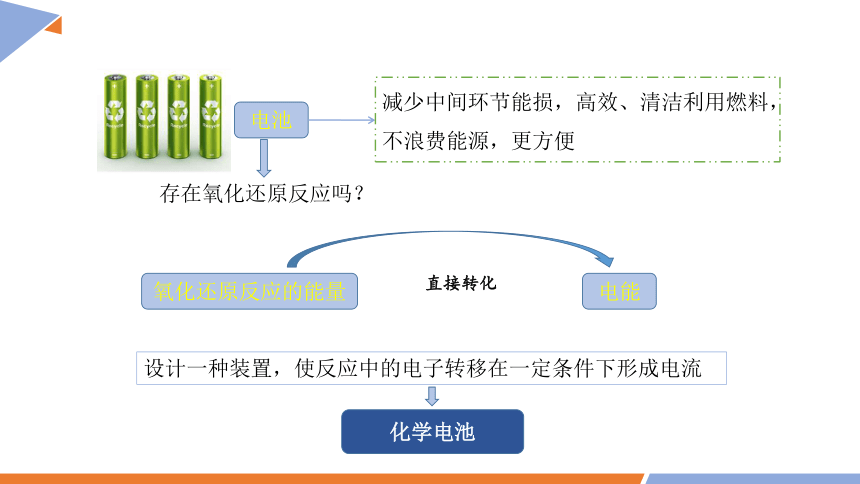
电池
减少中间环节能损,高效、清洁利用燃料,不浪费能源,更方便
存在氧化还原反应吗?
氧化还原反应的能量
电能
直接转化
设计一种装置,使反应中的电子转移在一定条件下形成电流
化学电池
【实验6-3】
(1)分别将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3) 用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
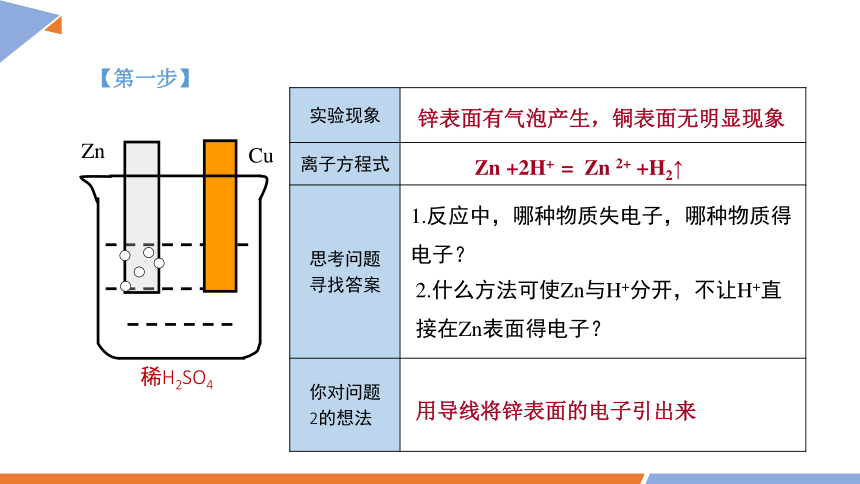
【第一步】
稀H2SO4
Zn
Cu
实验现象
离子方程式
思考问题
寻找答案
你对问题
2的想法
锌表面有气泡产生,铜表面无明显现象
Zn +2H+ = Zn 2+ +H2↑
1.反应中,哪种物质失电子,哪种物质得电子?
2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子?
用导线将锌表面的电子引出来
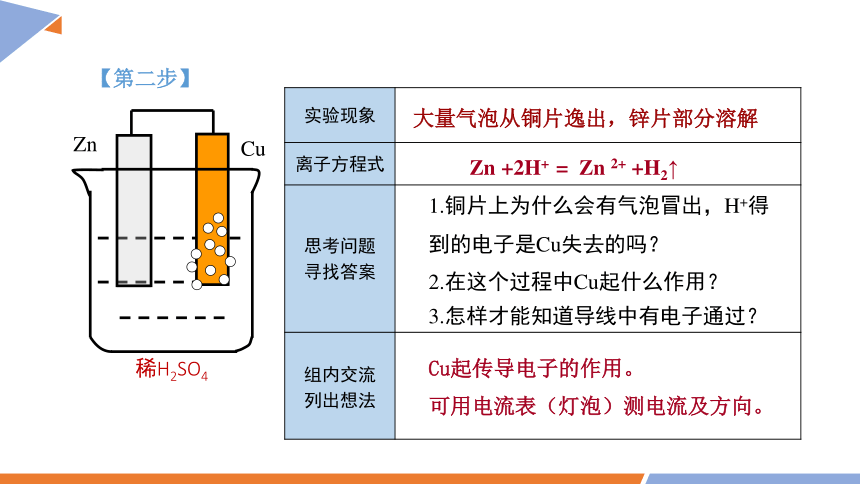
【第二步】
稀H2SO4
实验现象
离子方程式
思考问题
寻找答案
组内交流
列出想法
大量气泡从铜片逸出,锌片部分溶解
Zn +2H+ = Zn 2+ +H2↑
1.铜片上为什么会有气泡冒出,H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.怎样才能知道导线中有电子通过?
Cu起传导电子的作用。
可用电流表(灯泡)测电流及方向。
Zn
Cu
【第三步】
稀H2SO4
实验现象
解释现象
思考问题
寻找答案
组内交流
列出想法
锌表面无气泡,铜表面有气泡,电流表发生偏转。
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
化学能直接转化为电能
电子由Zn→导线→铜片→H+ 定向移动产生电流,故电流表的指针发生偏转
Zn
Cu
A
【实验现象】铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
【实验结论】导线中有电流通过(产生电能)
稀H2SO4
Zn
Cu
A
【离子反应式】
Zn+2H+=Zn2++H2↑
【能量转换形式】
化学能 电能
2.原电池
(1)定义:将化学能转变成电能的装置叫做原电池。
电流方向
正极→负极
稀硫酸
Cu
Zn
A
-
+
电流与电子移动的方向相反
e-→e-→e-→e-
(2)正负极:
负极:
电子流进(或电流流出)的一极
正极:
电子流出(或电流流进)的一极
稀硫酸
Cu
Zn
A
-
+
e-→e-→e-→e-
2.工作原理
负极
氧化反应
Zn-2e-=Zn2+
正极
还原反应
2H++2e-=H2↑
原电池总反应式:
Zn+2H+===Zn2++H2↑
【原电池原理】负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,从而产生电流,使化学能转变成电能。
原电池反应的本质是:氧化还原反应。
较活泼金属
较不活泼金属
负 极
正 极
发生氧化反应
发生还原反应
e-
电流
电子流出,电流流入
电子流入,电流流出
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
电子(电流)流动方向:
电解质溶液中离子的移动方向:
阴离子向负极移动,阳离子向正极移动。
“负极出电子,电子回正极”
3.构成原电池的条件
【探究】构成原电池的条件
稀H2SO4
Zn
Zn
稀H2SO4
Cu
Cu
稀H2SO4
Zn
C
形成条件一:通常用活泼性不同的两种材料作电极
负极:较活泼的金属
正极:较不活泼的金属或非金属(如石墨等)
×
×
√
稀盐酸
Zn
Cu
酒精
Zn
Cu
形成条件二:
两极之间填充电解质溶液;
√
×
稀盐酸
Zn
Cu
Zn
Cu
稀盐酸
稀盐酸
√
×
形成条件三:
必须形成闭合回路
稀H2SO4
Cu
C
×
形成条件四:
必须存在自发的氧化还原反应
【构成原电池的条件】
(1) 有自发进行的氧化还原反应(化学能)→关键
(2) 有活性不同的两极
(3) 有电解质溶液(内电路)
(4) 电极、电解质溶液必形成闭合回路
Zn
Cu
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
A
稀硫酸
A
-
+
-
+
-
+
-
+
【练习】
①判断下列原电池的正负极
②下列哪个装置能构成原电池
√
×
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式。
Ag
Fe
I
e-
e-
I
Fe
Ag
Fe-2e - = Fe2+
2H++2e - = H2↑
Fe+2H+ = Fe2+ +H2↑
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
电极减轻
溶液中离子流向
阳离子流向正极
阴离子
流向负极
【如何判断原电池的正负极】
4.原电池的种类
正极
负极
电解质溶液
①锌锰干电池
电子由锌筒(负极)流向石墨棒(正极),锌逐渐被消耗,二氧化锰不断被还原,属于一次电池。
②二次电池
放电:化学能转化为电能
充电:电能转化为化学能
铅酸蓄电池
镍氢电池
锂电子电池
【探究】简易电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,,电流表。
【实验】
(1)水果电池
(2)简易电池
练一练
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
稀硫酸
Zn
Fe
1.判断下列装置哪些能够构成原电池
√
×
√
√
√
×
2.如图所示电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A. B极为原电池的正极
B. A、B、C分别为Zn、Cu和稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
C
3.某小组同学用如图所示装置探究金属锌与稀硫酸的反应,实验发现A中溶液温度升高,B中电流计指针发生偏转。
(1)A中反应的离子方程式为 。
(2)B中Cu板上的现象是 有大量气泡产生,电极反应式为 。
(3)从能量转化的角度看,A、B中反应物的总能量 (填“大于”“小于”或“等于”)生成物总能量。A中化学能转变为 ,B中将化学能主要转变为 。
Zn+2H+=Zn2++H2↑
2H++2e-=H2↑
大于
热能
电能
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
2H++2e- =H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
第一节 化学反应与能量变化 课时2
直接?
1、煤炭是非可再生资源,会造成能源危机
2、煤炭燃烧会产生污染性气体
3、经多次转换,能量损耗大,燃料的利用率低
1.知道原电池的装置特点和原理。
2.学会简易电池的设计与制作思路。
(2)燃烧的本质是氧化还原反应,而氧化还原反应的本质是电子转移。
化学能
(燃料)
热能
机械能
电能
燃烧
蒸汽
发电机
(蒸汽轮机)
(1)能量转换
知识点一:原电池
化学能 电能
直接
1.化学能与电能的转化装置
电池
减少中间环节能损,高效、清洁利用燃料,不浪费能源,更方便
存在氧化还原反应吗?
氧化还原反应的能量
电能
直接转化
设计一种装置,使反应中的电子转移在一定条件下形成电流
化学电池
【实验6-3】
(1)分别将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3) 用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
【第一步】
稀H2SO4
Zn
Cu
实验现象
离子方程式
思考问题
寻找答案
你对问题
2的想法
锌表面有气泡产生,铜表面无明显现象
Zn +2H+ = Zn 2+ +H2↑
1.反应中,哪种物质失电子,哪种物质得电子?
2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子?
用导线将锌表面的电子引出来
【第二步】
稀H2SO4
实验现象
离子方程式
思考问题
寻找答案
组内交流
列出想法
大量气泡从铜片逸出,锌片部分溶解
Zn +2H+ = Zn 2+ +H2↑
1.铜片上为什么会有气泡冒出,H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?
3.怎样才能知道导线中有电子通过?
Cu起传导电子的作用。
可用电流表(灯泡)测电流及方向。
Zn
Cu
【第三步】
稀H2SO4
实验现象
解释现象
思考问题
寻找答案
组内交流
列出想法
锌表面无气泡,铜表面有气泡,电流表发生偏转。
1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
化学能直接转化为电能
电子由Zn→导线→铜片→H+ 定向移动产生电流,故电流表的指针发生偏转
Zn
Cu
A
【实验现象】铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
【实验结论】导线中有电流通过(产生电能)
稀H2SO4
Zn
Cu
A
【离子反应式】
Zn+2H+=Zn2++H2↑
【能量转换形式】
化学能 电能
2.原电池
(1)定义:将化学能转变成电能的装置叫做原电池。
电流方向
正极→负极
稀硫酸
Cu
Zn
A
-
+
电流与电子移动的方向相反
e-→e-→e-→e-
(2)正负极:
负极:
电子流进(或电流流出)的一极
正极:
电子流出(或电流流进)的一极
稀硫酸
Cu
Zn
A
-
+
e-→e-→e-→e-
2.工作原理
负极
氧化反应
Zn-2e-=Zn2+
正极
还原反应
2H++2e-=H2↑
原电池总反应式:
Zn+2H+===Zn2++H2↑
【原电池原理】负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,从而产生电流,使化学能转变成电能。
原电池反应的本质是:氧化还原反应。
较活泼金属
较不活泼金属
负 极
正 极
发生氧化反应
发生还原反应
e-
电流
电子流出,电流流入
电子流入,电流流出
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
电子(电流)流动方向:
电解质溶液中离子的移动方向:
阴离子向负极移动,阳离子向正极移动。
“负极出电子,电子回正极”
3.构成原电池的条件
【探究】构成原电池的条件
稀H2SO4
Zn
Zn
稀H2SO4
Cu
Cu
稀H2SO4
Zn
C
形成条件一:通常用活泼性不同的两种材料作电极
负极:较活泼的金属
正极:较不活泼的金属或非金属(如石墨等)
×
×
√
稀盐酸
Zn
Cu
酒精
Zn
Cu
形成条件二:
两极之间填充电解质溶液;
√
×
稀盐酸
Zn
Cu
Zn
Cu
稀盐酸
稀盐酸
√
×
形成条件三:
必须形成闭合回路
稀H2SO4
Cu
C
×
形成条件四:
必须存在自发的氧化还原反应
【构成原电池的条件】
(1) 有自发进行的氧化还原反应(化学能)→关键
(2) 有活性不同的两极
(3) 有电解质溶液(内电路)
(4) 电极、电解质溶液必形成闭合回路
Zn
Cu
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
A
稀硫酸
A
-
+
-
+
-
+
-
+
【练习】
①判断下列原电池的正负极
②下列哪个装置能构成原电池
√
×
H2SO4 (aq)
CuSO4 (aq)
Zn
Cu
负极( ): .
正极( ): .
总反应式: .
负极( ): .
正极( ): .
总反应式: .
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式。
Ag
Fe
I
e-
e-
I
Fe
Ag
Fe-2e - = Fe2+
2H++2e - = H2↑
Fe+2H+ = Fe2+ +H2↑
Zn
Cu
Zn-2e - = Zn2+
Cu2+ +2e - = Cu
Zn+Cu2+ = Zn2 ++ Cu
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
电极减轻
溶液中离子流向
阳离子流向正极
阴离子
流向负极
【如何判断原电池的正负极】
4.原电池的种类
正极
负极
电解质溶液
①锌锰干电池
电子由锌筒(负极)流向石墨棒(正极),锌逐渐被消耗,二氧化锰不断被还原,属于一次电池。
②二次电池
放电:化学能转化为电能
充电:电能转化为化学能
铅酸蓄电池
镍氢电池
锂电子电池
【探究】简易电池的设计与制作
【目的】根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
【用品】水果(苹果、柑橘或柠檬等),食盐水,滤纸,铜片、铁片、铝片等金属片,石墨棒,导线,,电流表。
【实验】
(1)水果电池
(2)简易电池
练一练
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
稀硫酸
Zn
Fe
1.判断下列装置哪些能够构成原电池
√
×
√
√
√
×
2.如图所示电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A. B极为原电池的正极
B. A、B、C分别为Zn、Cu和稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
C
3.某小组同学用如图所示装置探究金属锌与稀硫酸的反应,实验发现A中溶液温度升高,B中电流计指针发生偏转。
(1)A中反应的离子方程式为 。
(2)B中Cu板上的现象是 有大量气泡产生,电极反应式为 。
(3)从能量转化的角度看,A、B中反应物的总能量 (填“大于”“小于”或“等于”)生成物总能量。A中化学能转变为 ,B中将化学能主要转变为 。
Zn+2H+=Zn2++H2↑
2H++2e-=H2↑
大于
热能
电能
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
2H++2e- =H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
