8.1 课时1 金属矿物的开发利用 课件(共23张ppt) 2023-2024学年高一化学人教版(2019)必修2
文档属性
| 名称 | 8.1 课时1 金属矿物的开发利用 课件(共23张ppt) 2023-2024学年高一化学人教版(2019)必修2 | 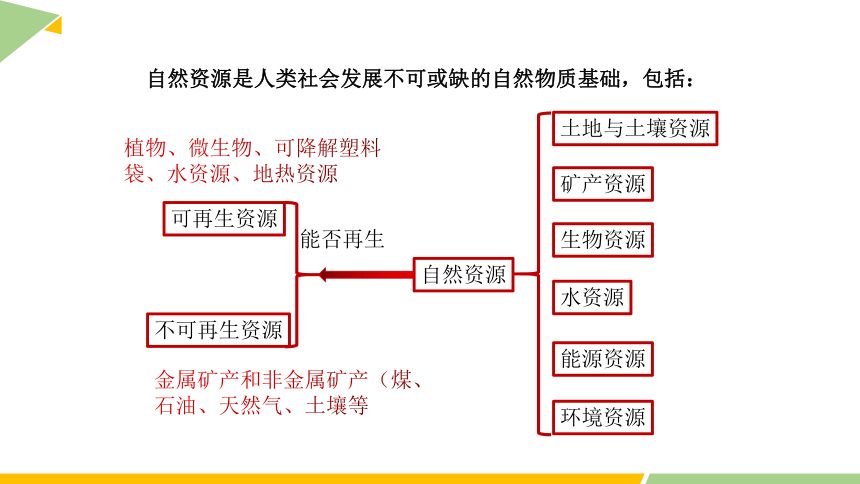 | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 21:41:13 | ||
图片预览







文档简介
自然资源是人类社会发展不可或缺的自然物质基础,包括:
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
可再生资源
不可再生资源
自然资源
能否再生
植物、微生物、可降解塑料袋、水资源、地热资源
金属矿产和非金属矿产(煤、石油、天然气、土壤等
第八章 化学与可持续发展
第一节 自然资源的开发利用 课时1
我国古代炼铁工业长期领先于世界,我们在西汉初时已经懂得用木炭与铁矿石混合高温冶炼生铁,领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。
其他金属矿物是如何开发利用的呢?
1.掌握金属活动顺序与金属冶炼的方法的关系。
2.通过铝的冶炼成本的计算,知道合理开发和利用金属资源的重要性和必要性。
3.掌握氧化还原反应在金属矿物开发中的应用。
知识点一:金属的冶炼
1.金属在自然界中的存在形式
金、铂
其他金属
游离态
化合态
天然金Au
孔雀石
赤铁矿Fe2O3
如何运用化学方法从金属矿物中获取金属单质?
2.金属的冶炼方法
将金属从其化合物中还原出来用于生产和制造金属材料的过程在工业上叫做金属的冶炼。
古代炼丹术士葛洪所著《抱朴子》中记载:“丹砂烧之成水银。”北宋科学家沈括在《梦溪笔谈》中写道:“信州铅山县有哭泉,流水为涧。揖其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之化为铜。”
以上文献中涉及了哪些金属的冶炼?写出相关的化学方程式。
注:丹砂是指HgS
文献中涉及了Hg 、 Cu的冶炼方法
HgS === Hg + S
△
CuSO4 + Fe Cu + FeSO4
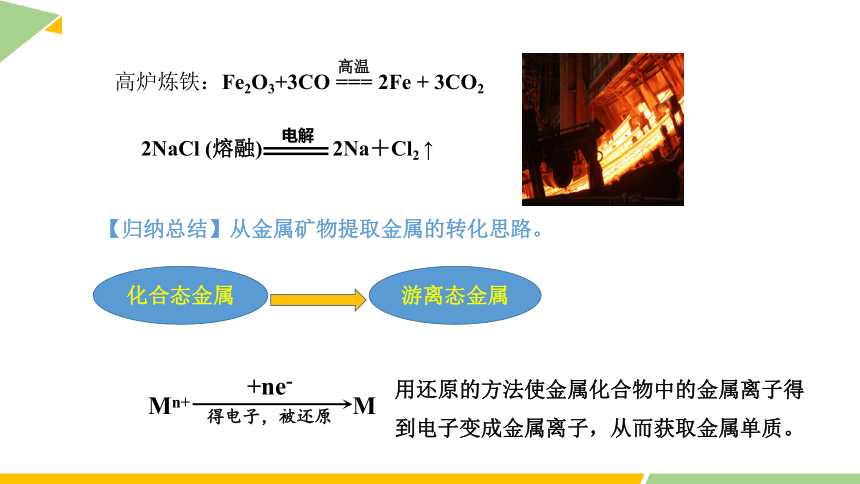
高炉炼铁:Fe2O3+3CO === 2Fe + 3CO2
高温
【归纳总结】从金属矿物提取金属的转化思路。
2NaCl (熔融) 2Na+Cl2 ↑
电解
得电子,被还原
Mn+ M
+ne-
化合态金属
游离态金属
用还原的方法使金属化合物中的金属离子得到电子变成金属离子,从而获取金属单质。
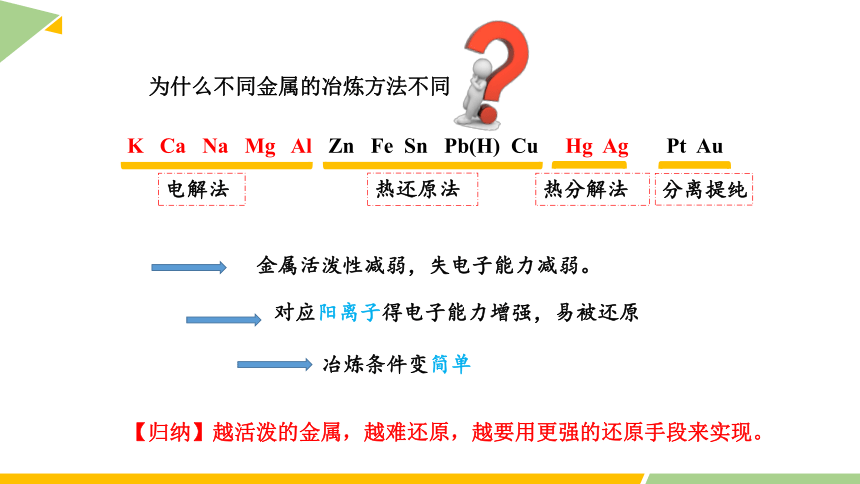
为什么不同金属的冶炼方法不同
【归纳】越活泼的金属,越难还原,越要用更强的还原手段来实现。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
冶炼条件变简单
金属活泼性减弱,失电子能力减弱。
对应阳离子得电子能力增强,易被还原
热分解法
分离提纯
电解法
热还原法
A.电解法
2Al2O3(熔融)===== 4Al + 3O2↑
电解
冰晶石
2NaCl(熔融) ==== 2Na + Cl2↑
电解
MgCl2(熔融) ==== Mg + Cl2↑
电解
如:K、Ca、Na、Mg、Al等非常活泼的金属
【特别注意】1.应该电解熔融金属化合物,而不是水溶液
2.铝不能通过电解AlCl3得到,而应该电解Al2O3。因为AlCl3是共价化合物,在熔融状态下不导电。
来自海水
来自铝土矿
降低氧化铝的熔点
B.热还原法:
Zn、Fe、Sn、Pb、(H)、Cu、
高温
高炉炼铁:Fe2O3 + 3CO === 2Fe + 3CO2
铝热法炼铁
3C+2Fe2O3 ==== 4Fe+3CO2↑
高温
铝和金属氧化物在高温下发生剧烈反应并放出大量热,放出的热量可以维持反应继续进行。
Fe2O3 + 2 Al === 2Fe + Al2O3
高温
铝热反应
实验步骤:
(1)把两张圆形滤纸分别折叠成漏斗状套在已在,取出内层滤纸,在底部剪一小孔后用水润湿,再套回原处,并架在铁圈上,下面放置一盛有沙子的蒸发皿。
(2)将5g干燥的氧化铁和2g铝粉均匀混合后放入纸漏斗中,在混合物上面加少量氯酸钾固体,中间插一根用砂纸打磨过的镁条。
(3)用燃着的小木条点燃镁条,观察现象。
铝热反应
【思考】1.镁条与氯酸钾的作用是什么?
2.蒸发皿为什么要铺一层沙子?
3.铝热反应需要高温,是否需要持续加热?
防止滴落的高温熔融物使蒸发皿炸裂,也防止熔融物溅出伤人。
【实验现象】
1.镁条剧烈燃烧
2.氧化铁与铝粉发生剧烈反应,放出大量
的热,放出耀眼的白光,火星四射
3.漏斗下部烧穿,有熔融物落入细沙中
铝热剂(混合物):
Al+难熔金属氧化物
镁条为引燃剂,氯酸钾为助燃剂;
铝热反应是放热反应,不需要持续加热;
【铝热反应总结】
概念:铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
原理:铝+某些金属氧化物 金属+氧化铝
高温
铝热剂:铝和某些金属氧化物(如Fe2O3、Cr2O3、V2O5)组成的混合物。
镁条作用:提供高温条件(引燃剂)
氯酸钾作用:助燃剂
??? 铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属。
C.热分解法:
适用于 的金属。
不活泼
如:Hg、Ag
2HgO === 2Hg + O2
△
2Ag2O === 4Ag + O2
△
D.富集法:
《浪淘沙》 -刘禹锡
日照澄洲江雾开,涛金女伴满江隈。
美人首饰侯王印,尽是沙中海底来。
适用于极不活泼的金属的冶炼:Pt Au
【淘金原理】
金的密度比沙大
Fe+CuSO4===FeSO4+Cu
“曾青得铁则化为铜”——西汉淮南王刘安《淮南万毕术》
“以曾青涂铁,铁赤色如铜”——晋代的葛洪《抱朴子内篇·黄白》
湿法炼铜
火法炼铜
Cu2S+O2 === 2Cu+SO2
高温
E.其他法:
2CuFeS2+4O2 Cu2S+3SO2↑+2FeO
高温
知识点二:金属资源的开发利用
【思考与讨论】
课本99页思考与讨论,通过对比,你得到了什么?
氧化铝
碳素电极
铝土矿
石油焦
沥青焦
萤石
冰晶石
电解
液态铝
铝锭
消耗电能至少1.8×106J
回收铝质饮料罐得到的铝消耗的能量为铝土矿制铝的3%~5%
加强废旧金属的回收再利用是合理开发和利用金属资源的重要途径,树立金属垃圾也是一种重要资源的理念.在日常生活当中大力提倡垃圾分类回收再利用,养成珍惜自然资源,节约资源,爱护环境,保护环境的意识。
实际生产过程中,金属的冶炼过程是个复条过程,在得到所需产品的同时也会产生废弃物。必须考虑废弃物的处理和生产过程对环境的影响。
从铝土矿中制铝消耗的能量要远远高于回收后制铝消耗的能量,因而,在实际生产过程中必须要考虑成本。
启示
1.合理开发和利用金属矿物资源的原因:
(1)资源有限且分布不均
(2)金属的冶炼消耗许多能量
(3)金属冶炼造成环境污染
(4)金属腐蚀造成大量损失
(1)提高金属矿物的利用率
(2)开发环保高效的金属冶炼方法
(3)防止金属的腐蚀
(4)加强废旧金属的回收和再利用
(5)使用其他材料代替金属材料
2.合理开发和利用金属矿物资源的措施:
练一练
1.列说法错误的是( )
A.对废旧金属的最好处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.热还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等
C
2.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是( )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO和Fe2O3
B
3.在熔融状态下 可用Na与KCl反应制金属K。Na+KCl=K+NaCl。调整合适的温度,可以分离出K单质。已知四种物质的熔、沸点如下:
?
K
Na
KCl
NaCl
熔点(℃)
63.65
97.8
770
801
沸点(℃)
774
882.9
1 500(升华)
1 431
根据上表数据,用Na与KCl反应制K的适宜温度是( )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1 413~1 500 ℃
C
6.冶炼金属常用以下几种方法:①以C或H2、CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。 Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
③
③
①
①
④
4.工业上常采用电解法冶炼的金属是 ( )
A、Fe B、Cu C、Al D、Ag
5.可用热分解法就可能制得的金属有( )
A . Cu Cr B . Ti W
C . Ag Hg D . Na Al
C
C
7.铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AIF6)混合熔融电解制得。I.铝土矿的主要成分是Al2O3和SiO2、Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
(1)反应1的化学方程是
(2)滤液I中加入CaO生成的沉淀是
反应2的离子方程式是
2NaOH+Al2O3=2NaAlO2+H2O
CaSiO3
2AlO2+CO2+3H2O=2Al(OH)3↓+CO3
-
2-
金属冶炼的实质
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力
减弱
增强
得电子能力
冶炼方法不同
得电子能力不同
K+ Ca?+ Na+ Mg?+ Al?+ Zn?+ Fe?+ Sn?+ Pb?+ (H+) Cu?+ Hg?+ Ag+
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
物理法
热分解法
热还原法
电解法
得电子,被还原
Mn+ M
+ne-
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
可再生资源
不可再生资源
自然资源
能否再生
植物、微生物、可降解塑料袋、水资源、地热资源
金属矿产和非金属矿产(煤、石油、天然气、土壤等
第八章 化学与可持续发展
第一节 自然资源的开发利用 课时1
我国古代炼铁工业长期领先于世界,我们在西汉初时已经懂得用木炭与铁矿石混合高温冶炼生铁,领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。
其他金属矿物是如何开发利用的呢?
1.掌握金属活动顺序与金属冶炼的方法的关系。
2.通过铝的冶炼成本的计算,知道合理开发和利用金属资源的重要性和必要性。
3.掌握氧化还原反应在金属矿物开发中的应用。
知识点一:金属的冶炼
1.金属在自然界中的存在形式
金、铂
其他金属
游离态
化合态
天然金Au
孔雀石
赤铁矿Fe2O3
如何运用化学方法从金属矿物中获取金属单质?
2.金属的冶炼方法
将金属从其化合物中还原出来用于生产和制造金属材料的过程在工业上叫做金属的冶炼。
古代炼丹术士葛洪所著《抱朴子》中记载:“丹砂烧之成水银。”北宋科学家沈括在《梦溪笔谈》中写道:“信州铅山县有哭泉,流水为涧。揖其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之化为铜。”
以上文献中涉及了哪些金属的冶炼?写出相关的化学方程式。
注:丹砂是指HgS
文献中涉及了Hg 、 Cu的冶炼方法
HgS === Hg + S
△
CuSO4 + Fe Cu + FeSO4
高炉炼铁:Fe2O3+3CO === 2Fe + 3CO2
高温
【归纳总结】从金属矿物提取金属的转化思路。
2NaCl (熔融) 2Na+Cl2 ↑
电解
得电子,被还原
Mn+ M
+ne-
化合态金属
游离态金属
用还原的方法使金属化合物中的金属离子得到电子变成金属离子,从而获取金属单质。
为什么不同金属的冶炼方法不同
【归纳】越活泼的金属,越难还原,越要用更强的还原手段来实现。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
冶炼条件变简单
金属活泼性减弱,失电子能力减弱。
对应阳离子得电子能力增强,易被还原
热分解法
分离提纯
电解法
热还原法
A.电解法
2Al2O3(熔融)===== 4Al + 3O2↑
电解
冰晶石
2NaCl(熔融) ==== 2Na + Cl2↑
电解
MgCl2(熔融) ==== Mg + Cl2↑
电解
如:K、Ca、Na、Mg、Al等非常活泼的金属
【特别注意】1.应该电解熔融金属化合物,而不是水溶液
2.铝不能通过电解AlCl3得到,而应该电解Al2O3。因为AlCl3是共价化合物,在熔融状态下不导电。
来自海水
来自铝土矿
降低氧化铝的熔点
B.热还原法:
Zn、Fe、Sn、Pb、(H)、Cu、
高温
高炉炼铁:Fe2O3 + 3CO === 2Fe + 3CO2
铝热法炼铁
3C+2Fe2O3 ==== 4Fe+3CO2↑
高温
铝和金属氧化物在高温下发生剧烈反应并放出大量热,放出的热量可以维持反应继续进行。
Fe2O3 + 2 Al === 2Fe + Al2O3
高温
铝热反应
实验步骤:
(1)把两张圆形滤纸分别折叠成漏斗状套在已在,取出内层滤纸,在底部剪一小孔后用水润湿,再套回原处,并架在铁圈上,下面放置一盛有沙子的蒸发皿。
(2)将5g干燥的氧化铁和2g铝粉均匀混合后放入纸漏斗中,在混合物上面加少量氯酸钾固体,中间插一根用砂纸打磨过的镁条。
(3)用燃着的小木条点燃镁条,观察现象。
铝热反应
【思考】1.镁条与氯酸钾的作用是什么?
2.蒸发皿为什么要铺一层沙子?
3.铝热反应需要高温,是否需要持续加热?
防止滴落的高温熔融物使蒸发皿炸裂,也防止熔融物溅出伤人。
【实验现象】
1.镁条剧烈燃烧
2.氧化铁与铝粉发生剧烈反应,放出大量
的热,放出耀眼的白光,火星四射
3.漏斗下部烧穿,有熔融物落入细沙中
铝热剂(混合物):
Al+难熔金属氧化物
镁条为引燃剂,氯酸钾为助燃剂;
铝热反应是放热反应,不需要持续加热;
【铝热反应总结】
概念:铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
原理:铝+某些金属氧化物 金属+氧化铝
高温
铝热剂:铝和某些金属氧化物(如Fe2O3、Cr2O3、V2O5)组成的混合物。
镁条作用:提供高温条件(引燃剂)
氯酸钾作用:助燃剂
??? 铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属。
C.热分解法:
适用于 的金属。
不活泼
如:Hg、Ag
2HgO === 2Hg + O2
△
2Ag2O === 4Ag + O2
△
D.富集法:
《浪淘沙》 -刘禹锡
日照澄洲江雾开,涛金女伴满江隈。
美人首饰侯王印,尽是沙中海底来。
适用于极不活泼的金属的冶炼:Pt Au
【淘金原理】
金的密度比沙大
Fe+CuSO4===FeSO4+Cu
“曾青得铁则化为铜”——西汉淮南王刘安《淮南万毕术》
“以曾青涂铁,铁赤色如铜”——晋代的葛洪《抱朴子内篇·黄白》
湿法炼铜
火法炼铜
Cu2S+O2 === 2Cu+SO2
高温
E.其他法:
2CuFeS2+4O2 Cu2S+3SO2↑+2FeO
高温
知识点二:金属资源的开发利用
【思考与讨论】
课本99页思考与讨论,通过对比,你得到了什么?
氧化铝
碳素电极
铝土矿
石油焦
沥青焦
萤石
冰晶石
电解
液态铝
铝锭
消耗电能至少1.8×106J
回收铝质饮料罐得到的铝消耗的能量为铝土矿制铝的3%~5%
加强废旧金属的回收再利用是合理开发和利用金属资源的重要途径,树立金属垃圾也是一种重要资源的理念.在日常生活当中大力提倡垃圾分类回收再利用,养成珍惜自然资源,节约资源,爱护环境,保护环境的意识。
实际生产过程中,金属的冶炼过程是个复条过程,在得到所需产品的同时也会产生废弃物。必须考虑废弃物的处理和生产过程对环境的影响。
从铝土矿中制铝消耗的能量要远远高于回收后制铝消耗的能量,因而,在实际生产过程中必须要考虑成本。
启示
1.合理开发和利用金属矿物资源的原因:
(1)资源有限且分布不均
(2)金属的冶炼消耗许多能量
(3)金属冶炼造成环境污染
(4)金属腐蚀造成大量损失
(1)提高金属矿物的利用率
(2)开发环保高效的金属冶炼方法
(3)防止金属的腐蚀
(4)加强废旧金属的回收和再利用
(5)使用其他材料代替金属材料
2.合理开发和利用金属矿物资源的措施:
练一练
1.列说法错误的是( )
A.对废旧金属的最好处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.热还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等
C
2.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是( )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO和Fe2O3
B
3.在熔融状态下 可用Na与KCl反应制金属K。Na+KCl=K+NaCl。调整合适的温度,可以分离出K单质。已知四种物质的熔、沸点如下:
?
K
Na
KCl
NaCl
熔点(℃)
63.65
97.8
770
801
沸点(℃)
774
882.9
1 500(升华)
1 431
根据上表数据,用Na与KCl反应制K的适宜温度是( )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1 413~1 500 ℃
C
6.冶炼金属常用以下几种方法:①以C或H2、CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。 Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
③
③
①
①
④
4.工业上常采用电解法冶炼的金属是 ( )
A、Fe B、Cu C、Al D、Ag
5.可用热分解法就可能制得的金属有( )
A . Cu Cr B . Ti W
C . Ag Hg D . Na Al
C
C
7.铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AIF6)混合熔融电解制得。I.铝土矿的主要成分是Al2O3和SiO2、Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
(1)反应1的化学方程是
(2)滤液I中加入CaO生成的沉淀是
反应2的离子方程式是
2NaOH+Al2O3=2NaAlO2+H2O
CaSiO3
2AlO2+CO2+3H2O=2Al(OH)3↓+CO3
-
2-
金属冶炼的实质
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力
减弱
增强
得电子能力
冶炼方法不同
得电子能力不同
K+ Ca?+ Na+ Mg?+ Al?+ Zn?+ Fe?+ Sn?+ Pb?+ (H+) Cu?+ Hg?+ Ag+
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
物理法
热分解法
热还原法
电解法
得电子,被还原
Mn+ M
+ne-
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
