8.1 课时2 海水资源的开发利用 课件(共39张ppt) 2023-2024学年高一化学人教版(2019)必修2
文档属性
| 名称 | 8.1 课时2 海水资源的开发利用 课件(共39张ppt) 2023-2024学年高一化学人教版(2019)必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 21:42:04 | ||
图片预览





文档简介
第八章 化学与可持续发展
第一节 自然资源的开发利用 课时2
1.了解海水水资源及其利用,能准确说出海水淡化的方法。
2.掌握海水化学资源的开发和利用,能准确描述海水制盐,海水提溴、提碘、提镁的方法和过程。
3.了解海水综合利用的意义。
知识点一:海水的淡化
1.认识海水资源
海洋约占地球表面积的71%
海水水资源
海水化学资源
海水生物资源
分散性
广阔性
海水中水的储量约为1.3×109 亿吨,占地球总水量 97%
元素种类很多,总计含有80多种元素
许多元素的富集程度很低
多样性
如:海水中金元素总含量约为50000000t(5千万吨)但一吨海水中只含金元素0.000004g(10亿分之四千克)(百分之0.000004克)
2.海水资源的特点
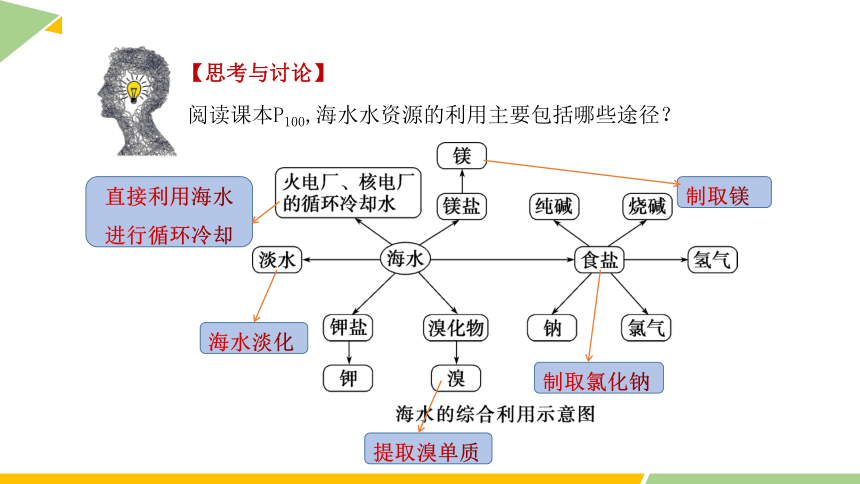
【思考与讨论】
阅读课本P100,海水水资源的利用主要包括哪些途径?
直接利用海水进行循环冷却
海水淡化
提取溴单质
制取氯化钠
制取镁
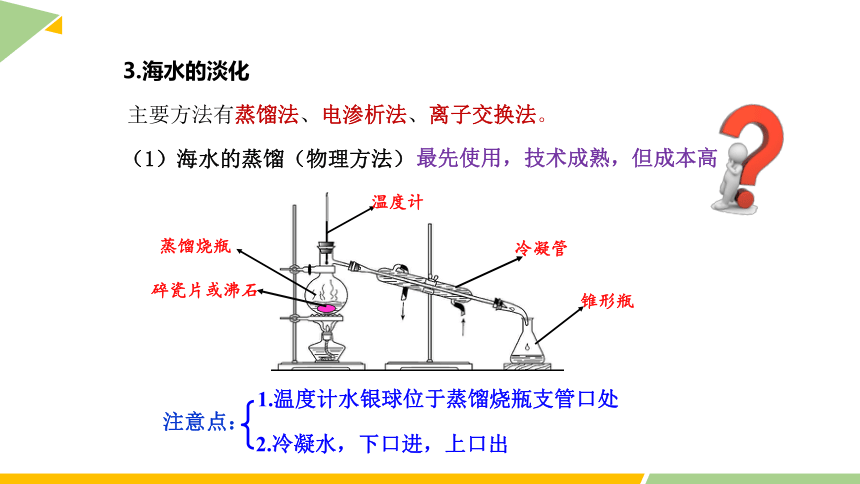
3.海水的淡化
主要方法有蒸馏法、电渗析法、离子交换法。
(1)海水的蒸馏(物理方法)
冷凝管
蒸馏烧瓶
锥形瓶
温度计
碎瓷片或沸石
注意点:
2.冷凝水,下口进,上口出
1.温度计水银球位于蒸馏烧瓶支管口处
最先使用,技术成熟,但成本高
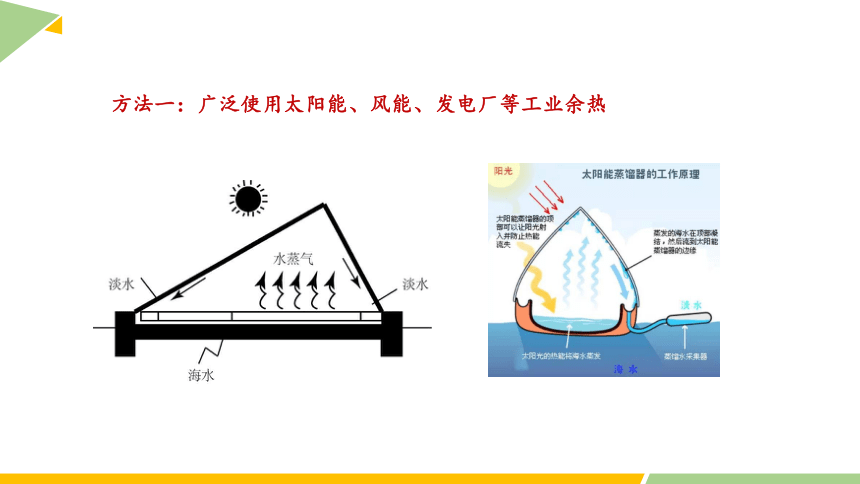
方法一:广泛使用太阳能、风能、发电厂等工业余热
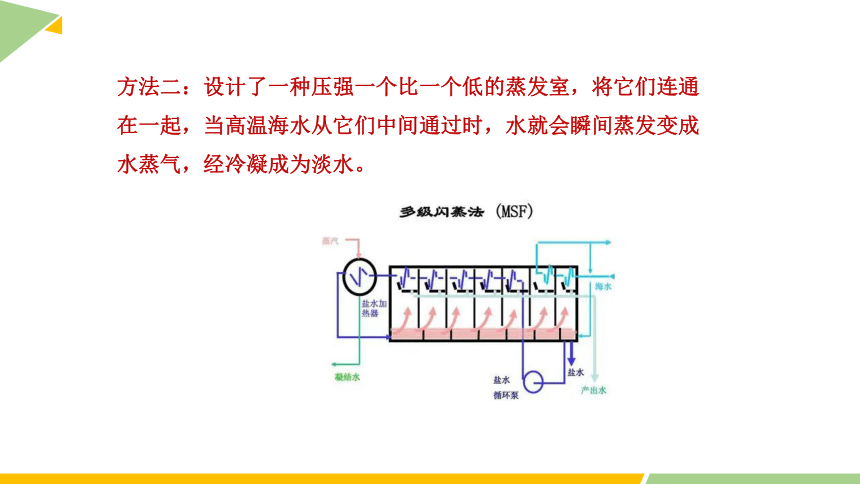
方法二:设计了一种压强一个比一个低的蒸发室,将它们连通在一起,当高温海水从它们中间通过时,水就会瞬间蒸发变成水蒸气,经冷凝成为淡水。
(2)电渗析法
成本低,但未能大量生产
(电渗析法是利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的。)
(3)离子交换法
阳离子交换树脂:HR+Na+ = NaR+H+
阴离子交换树脂:ROH+Cl- = RCl+OH-
H++OH- = H2O
离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
海水中的化学元素
海水因为量太大、面太广,大多数元素尽管总量很大,但许多元素的富集程度很低很低。
海水淡化后的浓缩海水怎么利用?
知识点二:海水资源的利用
1.海水制盐
⑴ 定义:从海水中提取食盐的传统方法称为“盐田法”,又称“滩晒法”,是最简便和经济有效的方法。
⑵ 原理:蒸发、结晶
⑶ 过程:
海水
盐田
饱和食盐水
粗盐
精盐
风吹日晒
水分蒸发
风吹日晒
水分蒸发
引入
提纯
⑷ 用途:制得的氯化钠除食用也是生产烧碱、纯碱、钠、氯气、盐酸的工业原料。
如何除去NaCI溶液中少量
的Mg2+、Ca2+、??????????????????
?
粗盐
不溶性杂质
滤液
溶解
过滤
原则一:尽量不引入新的杂质,如不得不引入,后面应该除去原则二:为了保证除彻底,一般药品要过量
原则三:顺序要合理
BaCl2→Na2CO3→NaOH→HCl
BaCl2→NaOH→Na2CO3→HCl
NaOH→BaCl2→Na2CO3→HCl
试剂及添加顺序:
2.海水提溴
溴是海洋元素,地球上99%的溴分布在海水中,以Br-的形式存在。
实际工业生产中,首先要先对海水中的溴进行富集
①溴在照相术中,溴化银,碘化银担任感光剂的角色。
②溴化钾、溴化钠和溴化铵制成的三溴片,在医学上用作镇静剂,消毒药剂的红药水中,就含有溴和汞。
③溴乙烷、溴苯等都是常用的有机试剂,在制造著名的汽油防震剂四乙基铅时也离不了溴。
④溴化钨制成的溴钨灯体积小却非常明亮。
核心反应
Br-
Br2
如何转化
1.如何选择合适的氧化剂?
科学性 可行性
氧化效果好、操作简单
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
价格(万元/吨)
Cl2
0.155
O2
0.13(不能把Br-氧化为Br2)
KMnO4
3.4
K2CrO4
3.76
KClO3
2.7
H2O2
1.4
核心反应
Cl2+2Br-=Br2+2Cl-
2.如何将卤水中的溴单质提取出来?
萃取:是利用A物质在B溶剂中的溶解能力小于在C溶剂中的溶解能力,把A物质从B溶剂提取到C溶剂里(B和C互不相溶)的分离方法。
分液:是利用两种液体互不相溶的性质将两种液体分离的方法。
溴是唯一在常温呈液态的非金属元素单质,易挥发,沸点58.76℃,红棕色液体,在四氯化碳(一种无色有毒液体,沸点76.8℃,不浴于水,1.595g/cm3))等有机溶剂中的溶解性远大于水中的溶解性。
Br2的水溶液
Br-
(卤水中)
Cl2
CCl4
萃取分液
Br2的四氯化碳溶液
Br2
蒸 馏
工业上做法:“吹出法”。
其过程主要包括氧化(用氯气氧化海水中的溴离子)、吹出(用空气将生成的溴吹出)、吸收(用二氧化硫作还原剂使溴转化为氢溴酸,以使其与空气分离)、蒸馏(再用氯气将氢溴酸氧化为溴后蒸馏分离)等环节。
【思考与讨论】
请分析并讨论以上生产流程,写出氧化和吸收环节主要反应的方程式。
Br-得到浓缩
将溴从海水中吹出
Cl2+2Br-=Br2+2Cl-
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Cl2+2Br-=Br2+2Cl-
通过蒸馏、冷凝得到液溴
为什么氯气氧化时要用硫酸酸化?
再次氯化后得到的溴水混合物与第一次氯化后有什么不同?
pH3.5氧化效果最好
富集溴,降低能耗
依据绿色化学示意图:四氯化碳有毒,从安全和环保角度考虑不合适
为什么不用四氯化碳萃取后再蒸馏?
【学以致用海】水中提取提镁?
3.海水中提镁
CaCO3==CaO+CO2↑ CaO+H2O==Ca(OH)2
Mg2++Ca(OH)2==Mg(OH)2+Ca2+
Mg(OH)2+2HCl ==MgCl2+2H2O
MgCl2(熔融)===Mg+Cl2↑
高温
电解
思考与交流
如何验证海带中含有碘元素?
海带中含有碘元素的检验:
①实验原理: 2H++2I-+H2O2=I2+2H2O 淀粉遇碘单质变蓝
②实验步骤:
蒸馏
萃取
海带
海带灰
溶解过滤
灼烧
含I-的溶液
稀H2SO4 H2O2
含I2的溶液
含I2的有机溶液
I2
残渣
4.从海水中获取能量
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水有一定的战略意义。
潮汐能、波浪能等新型能源的开发和利用也是越来越受到重视。
练一练
1.海水是一个巨大的化学资源宝库。下列关于海水开发利用的说法不正确的是( )
A.海水淡化的方法有:蒸馏法、电渗析法、离子交换法等
B.海底多金属结核矿含有Fe、Mn、Co、B等金属
C.从海水中提取镁的过程涉及化合、分解、复分解等反应类型
D.大海中含有钾、溴、碘等元素,经过氧化还原反应才可得到钾、溴、碘的单质
B
2.“空气吹出法”是目前海水提溴最成熟的工业方法,部分工艺流程如图:
下列说法错误的是( )
A.步骤③发生时溶液的酸性增强
B.溶液中Br2的浓度:Ⅰ<Ⅱ
C.步骤②利用了溴易挥发的性质
D.使用乙醇萃取溶液Ⅱ中Br2后再蒸馏
D
3.海带富含碘元素,在实验室中模拟从海带中提取碘,可经过以下实验步骤完成,下列有关说法正确的是( )
A.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
B.在上述氧化过程中发生反应的离子方程式为2I-+H2O2═I2+2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在灼烧过程中使用的仪器只有酒精灯、三脚架、泥三角、烧杯、玻璃棒
A
4.目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
以下推断不合理的是( )
A.热空气能吹出溴是利用溴易挥发的性质
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2═H2SO4+2HBr
C.因为氧化性Fe3+<Br2,所以氧化过程可选用FeCl3溶液
D.没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
C
5.从海水中提取镁,可按如下步骤进行;
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降,过滤,洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤,干燥产物;
④冶炼③的产物得到金属Mg。
关于提取镁,下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取MgCl2
C.工业生产中常用NaOH代替石灰乳作沉降剂,效果更好
D.以上提取镁的过程中涉及的反应有分解反应、化合反应和复分解反应
C
直接利用海水进行循环冷却
海水淡化
提取溴单质
制取氯化钠
制取镁
蒸馏法、电渗析法、离子交换法
吹出法
第一节 自然资源的开发利用 课时2
1.了解海水水资源及其利用,能准确说出海水淡化的方法。
2.掌握海水化学资源的开发和利用,能准确描述海水制盐,海水提溴、提碘、提镁的方法和过程。
3.了解海水综合利用的意义。
知识点一:海水的淡化
1.认识海水资源
海洋约占地球表面积的71%
海水水资源
海水化学资源
海水生物资源
分散性
广阔性
海水中水的储量约为1.3×109 亿吨,占地球总水量 97%
元素种类很多,总计含有80多种元素
许多元素的富集程度很低
多样性
如:海水中金元素总含量约为50000000t(5千万吨)但一吨海水中只含金元素0.000004g(10亿分之四千克)(百分之0.000004克)
2.海水资源的特点
【思考与讨论】
阅读课本P100,海水水资源的利用主要包括哪些途径?
直接利用海水进行循环冷却
海水淡化
提取溴单质
制取氯化钠
制取镁
3.海水的淡化
主要方法有蒸馏法、电渗析法、离子交换法。
(1)海水的蒸馏(物理方法)
冷凝管
蒸馏烧瓶
锥形瓶
温度计
碎瓷片或沸石
注意点:
2.冷凝水,下口进,上口出
1.温度计水银球位于蒸馏烧瓶支管口处
最先使用,技术成熟,但成本高
方法一:广泛使用太阳能、风能、发电厂等工业余热
方法二:设计了一种压强一个比一个低的蒸发室,将它们连通在一起,当高温海水从它们中间通过时,水就会瞬间蒸发变成水蒸气,经冷凝成为淡水。
(2)电渗析法
成本低,但未能大量生产
(电渗析法是利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的。)
(3)离子交换法
阳离子交换树脂:HR+Na+ = NaR+H+
阴离子交换树脂:ROH+Cl- = RCl+OH-
H++OH- = H2O
离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
海水中的化学元素
海水因为量太大、面太广,大多数元素尽管总量很大,但许多元素的富集程度很低很低。
海水淡化后的浓缩海水怎么利用?
知识点二:海水资源的利用
1.海水制盐
⑴ 定义:从海水中提取食盐的传统方法称为“盐田法”,又称“滩晒法”,是最简便和经济有效的方法。
⑵ 原理:蒸发、结晶
⑶ 过程:
海水
盐田
饱和食盐水
粗盐
精盐
风吹日晒
水分蒸发
风吹日晒
水分蒸发
引入
提纯
⑷ 用途:制得的氯化钠除食用也是生产烧碱、纯碱、钠、氯气、盐酸的工业原料。
如何除去NaCI溶液中少量
的Mg2+、Ca2+、??????????????????
?
粗盐
不溶性杂质
滤液
溶解
过滤
原则一:尽量不引入新的杂质,如不得不引入,后面应该除去原则二:为了保证除彻底,一般药品要过量
原则三:顺序要合理
BaCl2→Na2CO3→NaOH→HCl
BaCl2→NaOH→Na2CO3→HCl
NaOH→BaCl2→Na2CO3→HCl
试剂及添加顺序:
2.海水提溴
溴是海洋元素,地球上99%的溴分布在海水中,以Br-的形式存在。
实际工业生产中,首先要先对海水中的溴进行富集
①溴在照相术中,溴化银,碘化银担任感光剂的角色。
②溴化钾、溴化钠和溴化铵制成的三溴片,在医学上用作镇静剂,消毒药剂的红药水中,就含有溴和汞。
③溴乙烷、溴苯等都是常用的有机试剂,在制造著名的汽油防震剂四乙基铅时也离不了溴。
④溴化钨制成的溴钨灯体积小却非常明亮。
核心反应
Br-
Br2
如何转化
1.如何选择合适的氧化剂?
科学性 可行性
氧化效果好、操作简单
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
价格(万元/吨)
Cl2
0.155
O2
0.13(不能把Br-氧化为Br2)
KMnO4
3.4
K2CrO4
3.76
KClO3
2.7
H2O2
1.4
核心反应
Cl2+2Br-=Br2+2Cl-
2.如何将卤水中的溴单质提取出来?
萃取:是利用A物质在B溶剂中的溶解能力小于在C溶剂中的溶解能力,把A物质从B溶剂提取到C溶剂里(B和C互不相溶)的分离方法。
分液:是利用两种液体互不相溶的性质将两种液体分离的方法。
溴是唯一在常温呈液态的非金属元素单质,易挥发,沸点58.76℃,红棕色液体,在四氯化碳(一种无色有毒液体,沸点76.8℃,不浴于水,1.595g/cm3))等有机溶剂中的溶解性远大于水中的溶解性。
Br2的水溶液
Br-
(卤水中)
Cl2
CCl4
萃取分液
Br2的四氯化碳溶液
Br2
蒸 馏
工业上做法:“吹出法”。
其过程主要包括氧化(用氯气氧化海水中的溴离子)、吹出(用空气将生成的溴吹出)、吸收(用二氧化硫作还原剂使溴转化为氢溴酸,以使其与空气分离)、蒸馏(再用氯气将氢溴酸氧化为溴后蒸馏分离)等环节。
【思考与讨论】
请分析并讨论以上生产流程,写出氧化和吸收环节主要反应的方程式。
Br-得到浓缩
将溴从海水中吹出
Cl2+2Br-=Br2+2Cl-
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Cl2+2Br-=Br2+2Cl-
通过蒸馏、冷凝得到液溴
为什么氯气氧化时要用硫酸酸化?
再次氯化后得到的溴水混合物与第一次氯化后有什么不同?
pH3.5氧化效果最好
富集溴,降低能耗
依据绿色化学示意图:四氯化碳有毒,从安全和环保角度考虑不合适
为什么不用四氯化碳萃取后再蒸馏?
【学以致用海】水中提取提镁?
3.海水中提镁
CaCO3==CaO+CO2↑ CaO+H2O==Ca(OH)2
Mg2++Ca(OH)2==Mg(OH)2+Ca2+
Mg(OH)2+2HCl ==MgCl2+2H2O
MgCl2(熔融)===Mg+Cl2↑
高温
电解
思考与交流
如何验证海带中含有碘元素?
海带中含有碘元素的检验:
①实验原理: 2H++2I-+H2O2=I2+2H2O 淀粉遇碘单质变蓝
②实验步骤:
蒸馏
萃取
海带
海带灰
溶解过滤
灼烧
含I-的溶液
稀H2SO4 H2O2
含I2的溶液
含I2的有机溶液
I2
残渣
4.从海水中获取能量
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水有一定的战略意义。
潮汐能、波浪能等新型能源的开发和利用也是越来越受到重视。
练一练
1.海水是一个巨大的化学资源宝库。下列关于海水开发利用的说法不正确的是( )
A.海水淡化的方法有:蒸馏法、电渗析法、离子交换法等
B.海底多金属结核矿含有Fe、Mn、Co、B等金属
C.从海水中提取镁的过程涉及化合、分解、复分解等反应类型
D.大海中含有钾、溴、碘等元素,经过氧化还原反应才可得到钾、溴、碘的单质
B
2.“空气吹出法”是目前海水提溴最成熟的工业方法,部分工艺流程如图:
下列说法错误的是( )
A.步骤③发生时溶液的酸性增强
B.溶液中Br2的浓度:Ⅰ<Ⅱ
C.步骤②利用了溴易挥发的性质
D.使用乙醇萃取溶液Ⅱ中Br2后再蒸馏
D
3.海带富含碘元素,在实验室中模拟从海带中提取碘,可经过以下实验步骤完成,下列有关说法正确的是( )
A.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
B.在上述氧化过程中发生反应的离子方程式为2I-+H2O2═I2+2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在灼烧过程中使用的仪器只有酒精灯、三脚架、泥三角、烧杯、玻璃棒
A
4.目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
以下推断不合理的是( )
A.热空气能吹出溴是利用溴易挥发的性质
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2═H2SO4+2HBr
C.因为氧化性Fe3+<Br2,所以氧化过程可选用FeCl3溶液
D.没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
C
5.从海水中提取镁,可按如下步骤进行;
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降,过滤,洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤,干燥产物;
④冶炼③的产物得到金属Mg。
关于提取镁,下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取MgCl2
C.工业生产中常用NaOH代替石灰乳作沉降剂,效果更好
D.以上提取镁的过程中涉及的反应有分解反应、化合反应和复分解反应
C
直接利用海水进行循环冷却
海水淡化
提取溴单质
制取氯化钠
制取镁
蒸馏法、电渗析法、离子交换法
吹出法
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
