1.2 课时1 有机化合物的分离、提纯 课件(共20页) 2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2 课时1 有机化合物的分离、提纯 课件(共20页) 2023-2024学年高二化学人教版(2019)选择性必修3 |
|
|
| 格式 | pptx | ||
| 文件大小 | 48.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 00:00:00 | ||
图片预览







文档简介
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法 课时1
青蒿素结构的测定
科学·技术·社会
20世纪70年代初,我国屠呦呦等科学家使用乙醚从中药中提取并用色谱分离得到抗疟有效成分青蒿素,随后展开了对青蒿素分子结构的测定和相关医学研究。科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。经红外光谱和核磁共振谱分析,确定青蒿素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(—O—O—)。1975年底,我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
研究有机物的一般步骤:
蒸馏、萃取、重结晶等
元素定量分析
质谱法
红外光谱、核磁共振氢谱、X射线衍射谱
每一个操作步骤是怎样完成的呢?
分离、提纯
确定实验式
确定分子结构
确定分子式
1.了解研究有机化合物的一般方法,能说出研究有机化合物的主要步骤;
2.能依据有机化合物分离和提纯的原理,以及有机化合物自身的性质,选择分离和提纯的方法,并能初步学会分离和提纯的基本操作;
3.通过苯甲酸重结晶的实验探究,感受科学研究的方法。
一、有机化合物的分离、提纯
提纯含杂质的有机化合物的基本方法是利用有机化合物与杂质物理性质的差异将它们分离。在有机化学中常用的分离和提纯方法有蒸馏、萃取和重结晶等。
分离提纯的基本原则:
不增:
不减:
易分离:
易复原:
不引入新杂质
不减少被提纯物
杂质转换为沉淀、气体等容易分离除去
被提纯物易复原
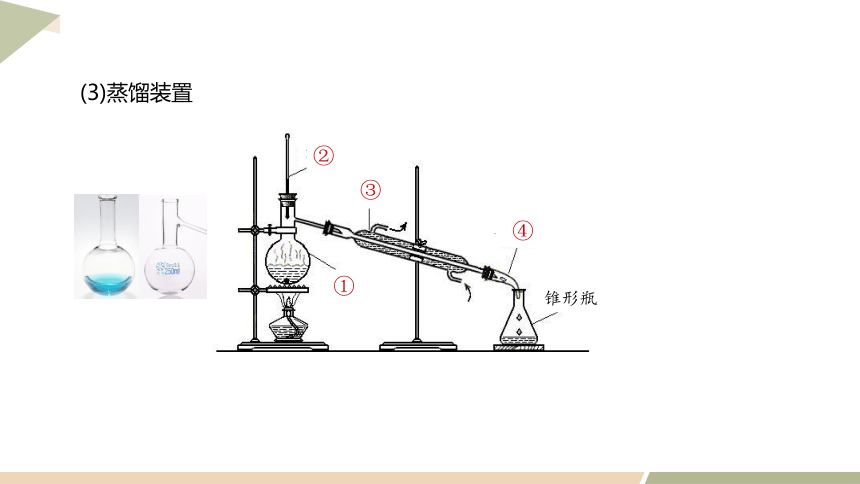
1.蒸馏
(1)蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
(2)蒸馏提纯的条件
①被提纯有机物热稳定性较强;
②与杂质的沸点相差较大(一般约大于30℃)
(常用于分离、提纯液态有机物)
蒸馏烧瓶
温度计
冷凝管
牛角管
锥形瓶
①
②
③
④
(3)蒸馏装置
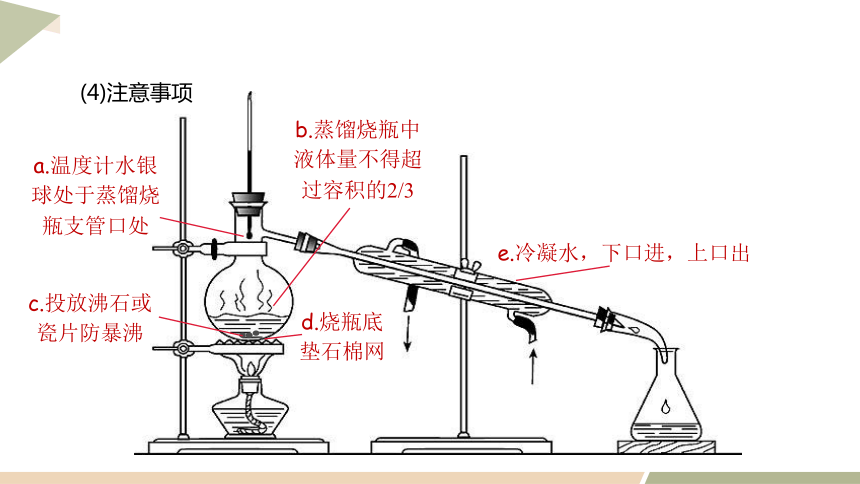
c.投放沸石或瓷片防暴沸
d.烧瓶底
垫石棉网
e.冷凝水,下口进,上口出
b.蒸馏烧瓶中液体量不得超过容积的2/3
a.温度计水银球处于蒸馏烧瓶支管口处
(4)注意事项
思考与讨论
Ⅰ.分离液态混合物中含二氯甲烷、三氯甲烷和四氯化碳的方法是什么?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 产物
二氯甲烷
三氯甲烷
四氯化碳
沸点
40℃
62℃
77℃
甲烷与氯气发生取代反应,反应历程如下:
蒸馏
2.萃取
(1)萃取的原理
液-液萃取
:利用有机物在两种互不相溶的溶剂中的溶解性不同,
将有机物从一种溶剂转移到另一种溶剂中的过程
固-液萃取
:用有机溶剂从固体混合物中溶解出有机物的过程
(2)萃取剂
的选择
①萃取剂与原溶液中的溶剂不反应,不互溶;
②溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
③萃取剂与溶质不反应
常用的萃取剂有:乙醚、乙酸乙酯、
二氯甲烷等。
(3)分液
:将萃取后两种互不相溶的液体分开的操作,常要使用分液漏斗。
梨形分液漏斗
球形分液漏斗
控制液体的流量
瓶塞(玻璃塞)
凹槽、小孔
活塞
分液漏斗使用前要检漏
(4)主要实验步骤:
加萃取剂,充分振荡
静置分层
打开分液漏斗活塞,从下口将下层液体放出
及时关闭活塞,上层液体从上口倒出
3.重结晶
(提纯固体有机化合物常用的方法)
(1)原理
:利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
(2)溶剂要求
③被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,
高温时,溶解度大,低温时,溶解度小,冷却后易于结晶析出。
②杂质在此溶剂中溶解度很小或者很大,易于除去。
①不与被提纯物质发生化学反应
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
探究:重结晶法提纯苯甲酸
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过
哪些步骤?
{5940675A-B579-460E-94D1-54222C63F5DA}温度/℃
25
50
75
溶解度/g
0.34
0.85
2.2
资料:苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点12℃,沸点29℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
【讨论】
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(1)杂质:泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加少量热水溶解,趁热过量,除去泥沙,冷却结晶,过滤。
(2)加热:使苯甲酸溶解。趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
(3)玻璃棒:加热溶解——搅拌,加速苯甲酸溶解
过滤——引流
(4)取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
1.在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中放入几粒碎瓷片,防止液体暴沸
B.将温度计水银球放在蒸馏烧瓶支管口附近
C.冷水从冷凝管下口入,上口出
D.蒸馏烧瓶不用垫石棉网,可直接加热
D
[练一练]
2.下列说法中错误的是( )
A.用酒精萃取甲苯水溶液中甲苯的操作可选用分液漏斗,然后静置分液
B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.对于密度不同、互不相溶的液体混合物,可采用分液的方法将它们分离
D.对于热稳定性较强、沸点较高的液态有机物和沸点较低的杂质可用蒸馏法除杂
A
3.下列有关苯甲酸重结晶实验中操作说法正确的是( )
A.粗苯甲酸加热溶解后可以直接趁热过滤
B.趁热过滤中,为了防止苯甲酸结晶,可先将漏斗进行预热
C.趁热过滤后,为了析出更多晶体,热滤液用冰盐水充分冷却,同时缩短结晶的时间
D.温度越低,苯甲酸的溶解度越小,所以温度越低越有利于苯甲酸的重结晶实验
B
4.现有3组混合物:①乙酸乙酯和乙酸钠溶液、②乙醇和丁醇、③溴化钠和单质溴的水溶液,分离以上各组混合物的正确方法依次是( )
A.分液法、萃取法、蒸馏法 B.萃取法、蒸馏法、分液法
C.分液法、蒸馏法、萃取法 D.蒸馏法、萃取法、分液法
C
分离
提纯
蒸馏
萃取
重结晶
原理
原理
原理
条件
蒸馏装置
利用混合物的沸点不同,除去难挥发或不挥发的杂质
注意事项
被提纯有机物热稳定性较强
与杂质的沸点相差较大
萃取剂的选择
实验步骤
萃取剂与原溶液中的溶剂不反应,不互溶
溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取剂与溶质不反应
溶剂要求
杂质在此溶剂中溶解度很小或者很大,易于除去
被提纯的有机化合物在此溶剂中的溶解度受温度影响较大
不与被提纯物质发生化学反应
第二节 研究有机化合物的一般方法 课时1
青蒿素结构的测定
科学·技术·社会
20世纪70年代初,我国屠呦呦等科学家使用乙醚从中药中提取并用色谱分离得到抗疟有效成分青蒿素,随后展开了对青蒿素分子结构的测定和相关医学研究。科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。经红外光谱和核磁共振谱分析,确定青蒿素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(—O—O—)。1975年底,我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
研究有机物的一般步骤:
蒸馏、萃取、重结晶等
元素定量分析
质谱法
红外光谱、核磁共振氢谱、X射线衍射谱
每一个操作步骤是怎样完成的呢?
分离、提纯
确定实验式
确定分子结构
确定分子式
1.了解研究有机化合物的一般方法,能说出研究有机化合物的主要步骤;
2.能依据有机化合物分离和提纯的原理,以及有机化合物自身的性质,选择分离和提纯的方法,并能初步学会分离和提纯的基本操作;
3.通过苯甲酸重结晶的实验探究,感受科学研究的方法。
一、有机化合物的分离、提纯
提纯含杂质的有机化合物的基本方法是利用有机化合物与杂质物理性质的差异将它们分离。在有机化学中常用的分离和提纯方法有蒸馏、萃取和重结晶等。
分离提纯的基本原则:
不增:
不减:
易分离:
易复原:
不引入新杂质
不减少被提纯物
杂质转换为沉淀、气体等容易分离除去
被提纯物易复原
1.蒸馏
(1)蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
(2)蒸馏提纯的条件
①被提纯有机物热稳定性较强;
②与杂质的沸点相差较大(一般约大于30℃)
(常用于分离、提纯液态有机物)
蒸馏烧瓶
温度计
冷凝管
牛角管
锥形瓶
①
②
③
④
(3)蒸馏装置
c.投放沸石或瓷片防暴沸
d.烧瓶底
垫石棉网
e.冷凝水,下口进,上口出
b.蒸馏烧瓶中液体量不得超过容积的2/3
a.温度计水银球处于蒸馏烧瓶支管口处
(4)注意事项
思考与讨论
Ⅰ.分离液态混合物中含二氯甲烷、三氯甲烷和四氯化碳的方法是什么?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 产物
二氯甲烷
三氯甲烷
四氯化碳
沸点
40℃
62℃
77℃
甲烷与氯气发生取代反应,反应历程如下:
蒸馏
2.萃取
(1)萃取的原理
液-液萃取
:利用有机物在两种互不相溶的溶剂中的溶解性不同,
将有机物从一种溶剂转移到另一种溶剂中的过程
固-液萃取
:用有机溶剂从固体混合物中溶解出有机物的过程
(2)萃取剂
的选择
①萃取剂与原溶液中的溶剂不反应,不互溶;
②溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
③萃取剂与溶质不反应
常用的萃取剂有:乙醚、乙酸乙酯、
二氯甲烷等。
(3)分液
:将萃取后两种互不相溶的液体分开的操作,常要使用分液漏斗。
梨形分液漏斗
球形分液漏斗
控制液体的流量
瓶塞(玻璃塞)
凹槽、小孔
活塞
分液漏斗使用前要检漏
(4)主要实验步骤:
加萃取剂,充分振荡
静置分层
打开分液漏斗活塞,从下口将下层液体放出
及时关闭活塞,上层液体从上口倒出
3.重结晶
(提纯固体有机化合物常用的方法)
(1)原理
:利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
(2)溶剂要求
③被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,
高温时,溶解度大,低温时,溶解度小,冷却后易于结晶析出。
②杂质在此溶剂中溶解度很小或者很大,易于除去。
①不与被提纯物质发生化学反应
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
探究:重结晶法提纯苯甲酸
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过
哪些步骤?
{5940675A-B579-460E-94D1-54222C63F5DA}温度/℃
25
50
75
溶解度/g
0.34
0.85
2.2
资料:苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为 ,熔点12℃,沸点29℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
【讨论】
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(1)杂质:泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加少量热水溶解,趁热过量,除去泥沙,冷却结晶,过滤。
(2)加热:使苯甲酸溶解。趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
(3)玻璃棒:加热溶解——搅拌,加速苯甲酸溶解
过滤——引流
(4)取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
1.在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中放入几粒碎瓷片,防止液体暴沸
B.将温度计水银球放在蒸馏烧瓶支管口附近
C.冷水从冷凝管下口入,上口出
D.蒸馏烧瓶不用垫石棉网,可直接加热
D
[练一练]
2.下列说法中错误的是( )
A.用酒精萃取甲苯水溶液中甲苯的操作可选用分液漏斗,然后静置分液
B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.对于密度不同、互不相溶的液体混合物,可采用分液的方法将它们分离
D.对于热稳定性较强、沸点较高的液态有机物和沸点较低的杂质可用蒸馏法除杂
A
3.下列有关苯甲酸重结晶实验中操作说法正确的是( )
A.粗苯甲酸加热溶解后可以直接趁热过滤
B.趁热过滤中,为了防止苯甲酸结晶,可先将漏斗进行预热
C.趁热过滤后,为了析出更多晶体,热滤液用冰盐水充分冷却,同时缩短结晶的时间
D.温度越低,苯甲酸的溶解度越小,所以温度越低越有利于苯甲酸的重结晶实验
B
4.现有3组混合物:①乙酸乙酯和乙酸钠溶液、②乙醇和丁醇、③溴化钠和单质溴的水溶液,分离以上各组混合物的正确方法依次是( )
A.分液法、萃取法、蒸馏法 B.萃取法、蒸馏法、分液法
C.分液法、蒸馏法、萃取法 D.蒸馏法、萃取法、分液法
C
分离
提纯
蒸馏
萃取
重结晶
原理
原理
原理
条件
蒸馏装置
利用混合物的沸点不同,除去难挥发或不挥发的杂质
注意事项
被提纯有机物热稳定性较强
与杂质的沸点相差较大
萃取剂的选择
实验步骤
萃取剂与原溶液中的溶剂不反应,不互溶
溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取剂与溶质不反应
溶剂要求
杂质在此溶剂中溶解度很小或者很大,易于除去
被提纯的有机化合物在此溶剂中的溶解度受温度影响较大
不与被提纯物质发生化学反应
