第二章 章末复习 课件(共42页) 2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第二章 章末复习 课件(共42页) 2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 22:46:30 | ||
图片预览










文档简介
(共42张PPT)
第二章 烃
章末复习
1.能写出简单烷烃、烯烃、炔烃、芳香烃的结构简式及名称;
2.能书写烷烃、烯烃、炔烃和苯的同系物的通式,认识同系物的主要物理变化规律;
3.能正确书写烷烃、烯烃、炔烃、芳香烃的同分异构体;
4.能依据甲烷、乙烯、乙炔、苯、甲苯的结构特点认识其性质,并能书写相关化学方程式;
5.能基于苯与甲苯的化学性质,通过对比认识苯的同系物分子中基团的相互作用。
知识点一:烷烃
1.烷烃的结构和性质
(1)烷烃的结构:
碳原子杂化类型 碳原子为中心 的空间构型 共价键类型
单键、σ键
sp3杂化
四面体结构
(2)烷烃同系物的通式:
CnH2n+2
(3)同系物:
像甲烷、乙烷、丙烷这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
同系物判断的三个关键点:
①两种物质属于同一类物质,官能团的种类和数目一样。
②两种物质结构相似,碳骨架的链接方式相同。
③两种物质分子组成上相差一个或多个CH2原子团
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高,密度逐渐增大。
C17以上为固态
C5~C16液态
C1~C4气态
常温下烷烃的状态
所有烷烃难溶于水,密度均小于1。
(3)物理性质:
预测化学反应中烃分子可能的断键部位与相应反应类型的依据:
烃中碳原子的饱和程度和化学键的类型
①稳定性
②特征反应——取代反应
③氧化反应——可燃性
(4)化学性质:
④分解反应——高温裂化或裂解
C16H34 C8H16+C8H18
催化剂
高温
常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
2.烷烃的命名
(1)习惯命名法:
以烷烃分子中碳原子数命名。按分子中的碳原子数称为“某烷”,碳原子数在十以内用“天干数字”表示。
“天干”:
碳原子数在十以上的用汉字数字表示。
碳原子数n相同,结构不同时,用 表示。
甲、乙、丙、丁、戊、己、庚、辛、壬、癸。
正、异、新
CH3CH2CH2CH2CH3
CH3—CH—CH2CH3
CH3
CH3—C—CH3
CH3
CH3
沸点:36.1℃
沸点: 27.8 ℃
沸点: 9.5℃
正戊烷
异戊烷
新戊烷
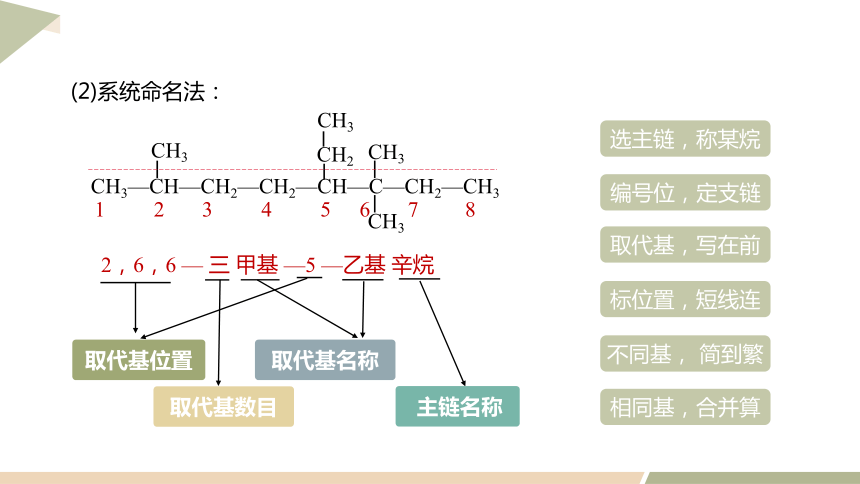
(2)系统命名法:
2,6,6 — 三 甲基 —5 —乙基 辛烷
CH3—CH—CH2—CH2—CH—C—CH2—CH3
CH3
CH3
CH2
CH3
CH3
1 2 3 4 5 6 7 8
取代基位置
取代基数目
主链名称
取代基名称
编号位,定支链
取代基,写在前
不同基, 简到繁
选主链,称某烷
标位置,短线连
相同基,合并算
①最长原则:
②最多原则:
③最近原则:
④最简原则:
⑤最小原则:
烷烃命名的原则
应选最长的碳链为主链。
若存在多条等长主链时,应选择含支链数最多的碳链为主链。
应从离支链最近一端对主链碳原子进行编号。
若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子进行编号。
若相同的支链距主链两端等长时,应以支链位号之和最小为原则,对主链碳原子进行编号。
知识点二:烯烃
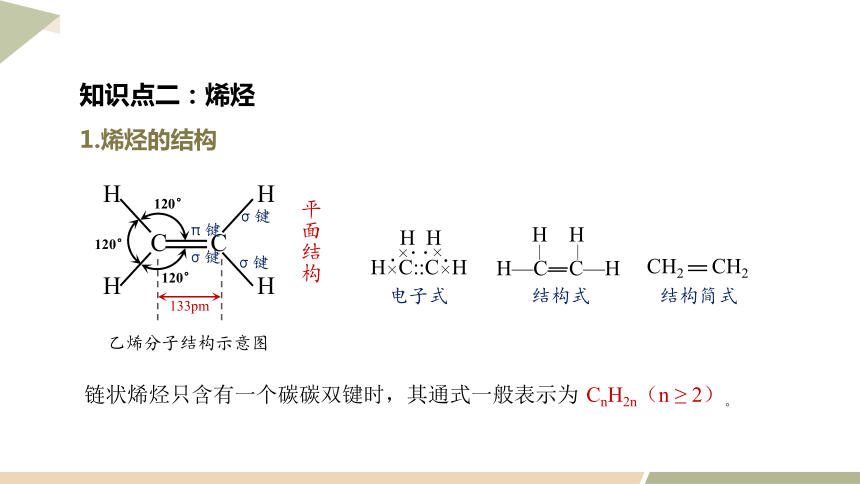
1.烯烃的结构
H—C C—H
H H
∣
∣
电子式
结构式
结构简式
H×C::C×H
·
H H
·
·
×
·
×
CH2 CH2
C
C
H
H
H
H
σ键
σ键
π键
σ键
133pm
120°
120°
120°
乙烯分子结构示意图
平面结构
链状烯烃只含有一个碳碳双键时,其通式一般表示为
CnH2n(n ≥ 2)。
烯烃的同分异构——顺反异构
通过碳碳双键连接的原子或原子团 会导致其空间 不同,产生顺反异构现象。
不能绕键轴旋转
排列方式
顺式结构:
反式结构:
互为顺反异构体
两个相同原子或基团在双键同侧
两个相同原子或基团分别在双键两侧
顺反异构的条件
①具有碳碳双键
②组成双键的每个碳原子必须连接两个不同的原子或原子团。
化学性质基本相同,而物理性质有一定的差异。
2.烯烃的性质
(1)烯烃的物理性质
颜色:
溶解性:
密度:
熔沸点:
状态:
无色
难溶于水
均小于水
一般随分子中碳原子数的增加而升高;同碳时,支链越多熔沸点越低。
一般随着分子中碳原子数的增加,在常温下的状态由气态变为液态,再到固态。
(2)烯烃的化学性质
①氧化反应
使酸性高锰酸钾溶液褪色
②加成反应
CH2=CHCH3 + HCl CH3CHClCH3
CH2=CHCH3 + HCl CH2ClCH2CH3
丙烯与氯化氢反应
③加聚反应
nCH3CH=CH2 [ CH—CH2 ]n
催化剂
CH3
知识点三:炔烃
1.炔烃的结构
电子式
结构简式
H×C C×H
·
·
180°
乙炔分子结构示意图
直线形结构
C
C
H
H
120pm
结构式
H—C C—H
CH CH
·
·
·
·
·
·
碳原子和碳原子之间以三键( )相连接。
含一个碳碳三键的炔烃通式为
通式:
1个σ键和2个π键
CnH2n-2(n≥2)。
2.炔烃的性质
(1)物理性质:
颜色 状态 气味 溶解性
炔烃的物理性质的递变与烷烃和烯烃的相似,沸点也随分子中
碳原子数的递增而逐渐升高。
无色
气体
无臭
微溶于水,易溶于有机溶剂
(2)化学性质:
①氧化反应
②加成反应
③加聚反应
2CnH2n-2+(3n-1)O2 2nCO2+(2n-2) H2O
点燃
使酸性KMnO4溶液褪色
乙炔能与溴的四氯化碳溶液(或溴水)、卤素单质、氢气、氢氰酸、氢卤酸、水等在一定条件下发生加成反应。
nCH ≡ CH [ CH=CH ]n
催化剂
3.炔烃的性质探究实验
CaC2+2H2O C2H2↑+Ca(OH)2
反应原理:
原料:电石(主要是CaC2,还含有 CaS、Ca3P2等)与 H2O
制乙炔
CuSO4溶液
KMnO4/H+
Br2/H2O
点燃
尾气处理
检验装置气密性
知识点四:苯
1.苯的分子结构
苯分子中的6个碳原子均采取 杂化,分别与氢原子及相邻碳原子以 结合,键间夹角均为 ,连接成六元环状。每个碳碳键的键长 (139pm)每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成 ,均匀地对称分布在苯环平面的上下两侧。分子中的所有原子 。
sp2
σ键
120°
相等
大π键
共平面
苯中碳原子间的化学键:
介于碳碳单键和双键之间的特殊的键
σ键
π键
2.苯的物理性质
(1)无色带有特殊气味的液体,有毒
(2)常温下密度0.88g/cm3,比水小,不溶于水
(3)熔沸点低,沸点80.1℃,熔点5.5℃,易挥发
3.苯的化学性质
2C6H6+15O2 12CO2+6H2O
点燃
不与酸性KMnO4溶液、溴水反应。
(1)可燃性
(2)取代反应
FeBr3作催化剂,苯环上氢原子被溴原子所取代。
①卤代反应:
溴苯
+ Br2
FeBr3
Br+HBr↑
a.苯只与纯卤素反应,遇到溴水发生萃取分层。
b.必须有催化剂;反应中加入的催化剂是铁粉,实际起催化作用的是FeBr3
c.苯与Br2只发生一元取代反应
【注意】
浓硫酸的作用
②硝化反应:
硝基苯
+ HNO3
NO2+H2O
浓硫酸
:催化剂和脱水剂
③磺化反应:
苯磺酸
+ HO—SO3H
SO3H+H2O
工业制取环己烷的主要方法
+ 3H2
(3)加成反应
在以Pt、Ni等作催化剂并加热的条件下,苯能与氢气发生加成反应,生成环己烷。
催化剂
知识点五:苯的同系物
1.苯的同系物的组成、结构
CnH2n-6(n≥6)
(1)结构特点:
①分子中有一个苯环
②侧链都是烷基
(2)通式:
2.苯的同系物的物理性质
一般具有类似苯的气味的无色液体
密度比水小
不溶于水、易溶于有机溶剂
3.苯的同系物的化学性质
(1)氧化反应
①可燃
②可使酸性高锰酸钾溶液褪色,甲苯上的甲基被酸性KMnO4氧化(侧链氧化)
2CnH2n-6 + 3 (n-1)O2
2nCO2+ 2(n-3)H2O
点燃
酸性KMnO4
C—H
COOH
苯环对侧链影响:苯环活化侧链, 使侧链易于氧化。
(2)取代反应
①卤代反应
一氯取代物
光照
CH3+Cl2 CH2Cl+HCl↑
苯环和侧链都能发生取代反应,但条件不同,取代的位置不同。
CH3
Br
FeBr3
CH3+Br2 +HBr
甲苯分子中的—CH3使苯环上与甲基处于邻、对位的氢原子活化而易被取代。
CH3
CH3
NO2
O2N
NO2
浓硫酸
+3HNO3
+3H2O
②硝化反应
2,4,6-三硝基甲苯
(3)加成反应
CH3
CH3+3H2
催化剂
知识点五:烃类的转化规律
醇
聚合物
醛
硝基化合物
烷烃
烯烃
炔烃
芳香烃
环烷烃
卤代烃
【考点一】有机化合物分子中原子共线、共面分析
1.有关 分子结构的下列叙述中,正确的是( )
A.除苯环外的其余碳原子有可能都在一条直线上
B.所有的原子都在同一平面上
C.12个碳原子不可能都在同一平面上
D.12个碳原子有可能都在同一平面上
D
(1)以上4种分子中的H原子如果被其他原子(如C、O、N、Cl等)所取代,则取代后的分子构型基本不变。
(2)共价单键可以自由旋转,共价双键和共价三键则不能旋转。
(3)若在分子结构中有一个碳原子形成四个单键,则该分子中所有原子不可能共面。
(4)若两个平面形结构通过一个碳碳单键相连接,则所有原子可能共平面。
方法归纳
3
6
4
12
2.在分子 中,同一平面内的碳原子最多有( )
A.7个 B.8个
C.9个 D.14个
D
3.已知C—C单键可以绕键轴旋转。某烃的结构简式如图,下列说法中正确的是( )
A.该烃的核磁共振氢谱有6组峰
B.1 mol该烃完全燃烧消耗16.5 mol O2
C.该烃分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
C
1.现有CH4、C2H4、C2H6、C3H6、C3H8五种有机化合物,同质量的以上物质中,在相同状况下体积最大的是 ;同质量的以上物质完全燃烧时耗O2的量最多的是 ;同状况、同体积、同物质的量的以上物质完全燃烧时耗O2的量最多的是 ;同质量的以上物质完全燃烧时,生成的CO2最多的是 ,生成水最多的是 。在120 ℃、1.01×105 Pa时,以上气态烃和足量的O2点燃完全燃烧,相同条件下测得反应前后气体体积没有发生变化的是 。
【考点二】烃的燃烧规律
CH4
CH4
C3H8
C2H4、C3H6
CH4
CH4、C2H4
2.由两种气态烃组成的混合物,体积为10 mL,与过量的氧气混合再充分燃烧,将生成物通过浓硫酸,气体体积减少15 mL,再通过碱石灰,气体体积又减少20 mL(气体体积均在同温同压下)。混合烃的组成可能为( )
A.C2H4和C2H2
B.C2H6和C2H4
C.CH4和C3H4
D.C4H10和C2H4
A
【考点三】烷烃、烯烃的性质
1.关于有机物的性质,下列说法不正确的是( )
A.CH4气体与Cl2在光照条件下发生取代反应能生成CCl4
B.CH2=CH2能使酸性高锰酸钾溶液褪色是因为发生了氧化反应
C.通常情况下,苯是无色液体,能在催化剂条件下与Br2发生取代反应
D.聚乙烯在一定条件下可以与溴水发生加成反应
D
2.下列五种烃,按它们的沸点由低到高排列正确的是( )
①2﹣甲基戊烷、②2,2﹣二甲基丁烷、③正己烷、④丙烷、⑤丁烷
A.①②③④⑤ B.②③④⑤① C.③①②④⑤ D.④⑤②①③
3.能使溴水褪色的是( )
A.乙烯 B.甲烷 C.四氯化碳 D.聚乙烯
D
A
【考点五】乙炔的性质实验
10.实验室用如图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:
(1)实验室制乙炔的化学方程式是: ;为了得到较为平稳的乙炔气流,装置 A 的分液漏斗中常用 来代替水。
(2)装置 B 中CuSO4溶液的作用是 。
饱和食盐水
除去H2S杂质,以防干扰后续实验
CaC2+2H2O C2H2↑+Ca(OH)2
(3)装置 D 中观察到的现象是 。
(4)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为
(用m与n表示)。
(5)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是:
紫红色褪去
×100%
CH≡CH+HCl CH2=CHCl
催化剂
nCH2=CHCl [ CH2—CH ]n
催化剂
Cl
【考点六】苯的结构与性质
5.苯分子结构中不存在碳碳单双键交替结构,不能作为证据的事实是( )
A.苯分子中碳碳键的键长均相等
B.苯不能使酸性高锰酸钾溶液褪色
C.经实验测得邻二甲苯只有一种结构
D.苯和氢气发生加成反应生成环己烷
6.由苯作原料不能经一步化学反应制得的是( )
A.硝基苯 B.环己烷 C.溴苯 D.苯酚
D
D
11.苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
(1)把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在 层。(填“上”或“下”)
(2)把苯加入到盛有少量酸性高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中 (填“有”或“没有”)碳碳双键;
(3)在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,反应的化学方程式为:
上
没有
+ HNO3
NO2+H2O
浓硫酸
【考点七】苯的同系物
7.在苯的同系物中,加入少量高锰酸钾酸性溶液,振荡后溶液褪色,下列正确的解释是( )
A.苯的同系物中碳原子数比苯分子中碳原子数多
B.侧链受苯环的影响而易被氧化
C.苯环被KMnO4所氧化而破坏
D.苯环和侧链的相互影响,同时被氧化
B
8.甲苯和苯一样能发生溴代反应,产物四溴甲苯(苯环上的取代)可能的结构有( )
A.6种 B.4种 C.5种 D.3种
9.分子组成为C10H14的苯的同系物,已知苯环上只有一个取代基,下列说法正确的是( )
A.该有机物不能发生加成反应,但能发生取代反应
B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C.该有机物分子中的所有原子可能在同一平面上
D.该有机物有4种不同结构
D
D
各类烃与常见试剂反应的比较:
烃 溴单质 溴水 溴的四氯 化碳溶液 酸性高锰
酸钾溶液
烷烃
烯烃
炔烃
苯
苯的 同系物
(光照)取代
不反应,萃取
使溴水褪色
不反应,互
溶不褪色
不反应
加成
加成
加成褪色
加成褪色
加成褪色
加成褪色
氧化褪色
氧化褪色
一般不反应,催
化条件下可取代
不反应,萃取
使溴水褪色
不反应
不反应
氧化褪色
不反应
不反应,萃取使溴水褪色
一般不反应,光照条件发生侧链上的取代,催化条件发生苯环上的取代
烃
脂肪烃
芳香烃
烷烃:同系物
烯烃:立体异构
炔烃:乙炔
苯:大π键
苯的同系物:基团相互作用
结构、性质、应用
转化、反应类型
系统命名法
书写同分异构体
第二章 烃
章末复习
1.能写出简单烷烃、烯烃、炔烃、芳香烃的结构简式及名称;
2.能书写烷烃、烯烃、炔烃和苯的同系物的通式,认识同系物的主要物理变化规律;
3.能正确书写烷烃、烯烃、炔烃、芳香烃的同分异构体;
4.能依据甲烷、乙烯、乙炔、苯、甲苯的结构特点认识其性质,并能书写相关化学方程式;
5.能基于苯与甲苯的化学性质,通过对比认识苯的同系物分子中基团的相互作用。
知识点一:烷烃
1.烷烃的结构和性质
(1)烷烃的结构:
碳原子杂化类型 碳原子为中心 的空间构型 共价键类型
单键、σ键
sp3杂化
四面体结构
(2)烷烃同系物的通式:
CnH2n+2
(3)同系物:
像甲烷、乙烷、丙烷这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
同系物判断的三个关键点:
①两种物质属于同一类物质,官能团的种类和数目一样。
②两种物质结构相似,碳骨架的链接方式相同。
③两种物质分子组成上相差一个或多个CH2原子团
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高,密度逐渐增大。
C17以上为固态
C5~C16液态
C1~C4气态
常温下烷烃的状态
所有烷烃难溶于水,密度均小于1。
(3)物理性质:
预测化学反应中烃分子可能的断键部位与相应反应类型的依据:
烃中碳原子的饱和程度和化学键的类型
①稳定性
②特征反应——取代反应
③氧化反应——可燃性
(4)化学性质:
④分解反应——高温裂化或裂解
C16H34 C8H16+C8H18
催化剂
高温
常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
2.烷烃的命名
(1)习惯命名法:
以烷烃分子中碳原子数命名。按分子中的碳原子数称为“某烷”,碳原子数在十以内用“天干数字”表示。
“天干”:
碳原子数在十以上的用汉字数字表示。
碳原子数n相同,结构不同时,用 表示。
甲、乙、丙、丁、戊、己、庚、辛、壬、癸。
正、异、新
CH3CH2CH2CH2CH3
CH3—CH—CH2CH3
CH3
CH3—C—CH3
CH3
CH3
沸点:36.1℃
沸点: 27.8 ℃
沸点: 9.5℃
正戊烷
异戊烷
新戊烷
(2)系统命名法:
2,6,6 — 三 甲基 —5 —乙基 辛烷
CH3—CH—CH2—CH2—CH—C—CH2—CH3
CH3
CH3
CH2
CH3
CH3
1 2 3 4 5 6 7 8
取代基位置
取代基数目
主链名称
取代基名称
编号位,定支链
取代基,写在前
不同基, 简到繁
选主链,称某烷
标位置,短线连
相同基,合并算
①最长原则:
②最多原则:
③最近原则:
④最简原则:
⑤最小原则:
烷烃命名的原则
应选最长的碳链为主链。
若存在多条等长主链时,应选择含支链数最多的碳链为主链。
应从离支链最近一端对主链碳原子进行编号。
若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子进行编号。
若相同的支链距主链两端等长时,应以支链位号之和最小为原则,对主链碳原子进行编号。
知识点二:烯烃
1.烯烃的结构
H—C C—H
H H
∣
∣
电子式
结构式
结构简式
H×C::C×H
·
H H
·
·
×
·
×
CH2 CH2
C
C
H
H
H
H
σ键
σ键
π键
σ键
133pm
120°
120°
120°
乙烯分子结构示意图
平面结构
链状烯烃只含有一个碳碳双键时,其通式一般表示为
CnH2n(n ≥ 2)。
烯烃的同分异构——顺反异构
通过碳碳双键连接的原子或原子团 会导致其空间 不同,产生顺反异构现象。
不能绕键轴旋转
排列方式
顺式结构:
反式结构:
互为顺反异构体
两个相同原子或基团在双键同侧
两个相同原子或基团分别在双键两侧
顺反异构的条件
①具有碳碳双键
②组成双键的每个碳原子必须连接两个不同的原子或原子团。
化学性质基本相同,而物理性质有一定的差异。
2.烯烃的性质
(1)烯烃的物理性质
颜色:
溶解性:
密度:
熔沸点:
状态:
无色
难溶于水
均小于水
一般随分子中碳原子数的增加而升高;同碳时,支链越多熔沸点越低。
一般随着分子中碳原子数的增加,在常温下的状态由气态变为液态,再到固态。
(2)烯烃的化学性质
①氧化反应
使酸性高锰酸钾溶液褪色
②加成反应
CH2=CHCH3 + HCl CH3CHClCH3
CH2=CHCH3 + HCl CH2ClCH2CH3
丙烯与氯化氢反应
③加聚反应
nCH3CH=CH2 [ CH—CH2 ]n
催化剂
CH3
知识点三:炔烃
1.炔烃的结构
电子式
结构简式
H×C C×H
·
·
180°
乙炔分子结构示意图
直线形结构
C
C
H
H
120pm
结构式
H—C C—H
CH CH
·
·
·
·
·
·
碳原子和碳原子之间以三键( )相连接。
含一个碳碳三键的炔烃通式为
通式:
1个σ键和2个π键
CnH2n-2(n≥2)。
2.炔烃的性质
(1)物理性质:
颜色 状态 气味 溶解性
炔烃的物理性质的递变与烷烃和烯烃的相似,沸点也随分子中
碳原子数的递增而逐渐升高。
无色
气体
无臭
微溶于水,易溶于有机溶剂
(2)化学性质:
①氧化反应
②加成反应
③加聚反应
2CnH2n-2+(3n-1)O2 2nCO2+(2n-2) H2O
点燃
使酸性KMnO4溶液褪色
乙炔能与溴的四氯化碳溶液(或溴水)、卤素单质、氢气、氢氰酸、氢卤酸、水等在一定条件下发生加成反应。
nCH ≡ CH [ CH=CH ]n
催化剂
3.炔烃的性质探究实验
CaC2+2H2O C2H2↑+Ca(OH)2
反应原理:
原料:电石(主要是CaC2,还含有 CaS、Ca3P2等)与 H2O
制乙炔
CuSO4溶液
KMnO4/H+
Br2/H2O
点燃
尾气处理
检验装置气密性
知识点四:苯
1.苯的分子结构
苯分子中的6个碳原子均采取 杂化,分别与氢原子及相邻碳原子以 结合,键间夹角均为 ,连接成六元环状。每个碳碳键的键长 (139pm)每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成 ,均匀地对称分布在苯环平面的上下两侧。分子中的所有原子 。
sp2
σ键
120°
相等
大π键
共平面
苯中碳原子间的化学键:
介于碳碳单键和双键之间的特殊的键
σ键
π键
2.苯的物理性质
(1)无色带有特殊气味的液体,有毒
(2)常温下密度0.88g/cm3,比水小,不溶于水
(3)熔沸点低,沸点80.1℃,熔点5.5℃,易挥发
3.苯的化学性质
2C6H6+15O2 12CO2+6H2O
点燃
不与酸性KMnO4溶液、溴水反应。
(1)可燃性
(2)取代反应
FeBr3作催化剂,苯环上氢原子被溴原子所取代。
①卤代反应:
溴苯
+ Br2
FeBr3
Br+HBr↑
a.苯只与纯卤素反应,遇到溴水发生萃取分层。
b.必须有催化剂;反应中加入的催化剂是铁粉,实际起催化作用的是FeBr3
c.苯与Br2只发生一元取代反应
【注意】
浓硫酸的作用
②硝化反应:
硝基苯
+ HNO3
NO2+H2O
浓硫酸
:催化剂和脱水剂
③磺化反应:
苯磺酸
+ HO—SO3H
SO3H+H2O
工业制取环己烷的主要方法
+ 3H2
(3)加成反应
在以Pt、Ni等作催化剂并加热的条件下,苯能与氢气发生加成反应,生成环己烷。
催化剂
知识点五:苯的同系物
1.苯的同系物的组成、结构
CnH2n-6(n≥6)
(1)结构特点:
①分子中有一个苯环
②侧链都是烷基
(2)通式:
2.苯的同系物的物理性质
一般具有类似苯的气味的无色液体
密度比水小
不溶于水、易溶于有机溶剂
3.苯的同系物的化学性质
(1)氧化反应
①可燃
②可使酸性高锰酸钾溶液褪色,甲苯上的甲基被酸性KMnO4氧化(侧链氧化)
2CnH2n-6 + 3 (n-1)O2
2nCO2+ 2(n-3)H2O
点燃
酸性KMnO4
C—H
COOH
苯环对侧链影响:苯环活化侧链, 使侧链易于氧化。
(2)取代反应
①卤代反应
一氯取代物
光照
CH3+Cl2 CH2Cl+HCl↑
苯环和侧链都能发生取代反应,但条件不同,取代的位置不同。
CH3
Br
FeBr3
CH3+Br2 +HBr
甲苯分子中的—CH3使苯环上与甲基处于邻、对位的氢原子活化而易被取代。
CH3
CH3
NO2
O2N
NO2
浓硫酸
+3HNO3
+3H2O
②硝化反应
2,4,6-三硝基甲苯
(3)加成反应
CH3
CH3+3H2
催化剂
知识点五:烃类的转化规律
醇
聚合物
醛
硝基化合物
烷烃
烯烃
炔烃
芳香烃
环烷烃
卤代烃
【考点一】有机化合物分子中原子共线、共面分析
1.有关 分子结构的下列叙述中,正确的是( )
A.除苯环外的其余碳原子有可能都在一条直线上
B.所有的原子都在同一平面上
C.12个碳原子不可能都在同一平面上
D.12个碳原子有可能都在同一平面上
D
(1)以上4种分子中的H原子如果被其他原子(如C、O、N、Cl等)所取代,则取代后的分子构型基本不变。
(2)共价单键可以自由旋转,共价双键和共价三键则不能旋转。
(3)若在分子结构中有一个碳原子形成四个单键,则该分子中所有原子不可能共面。
(4)若两个平面形结构通过一个碳碳单键相连接,则所有原子可能共平面。
方法归纳
3
6
4
12
2.在分子 中,同一平面内的碳原子最多有( )
A.7个 B.8个
C.9个 D.14个
D
3.已知C—C单键可以绕键轴旋转。某烃的结构简式如图,下列说法中正确的是( )
A.该烃的核磁共振氢谱有6组峰
B.1 mol该烃完全燃烧消耗16.5 mol O2
C.该烃分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
C
1.现有CH4、C2H4、C2H6、C3H6、C3H8五种有机化合物,同质量的以上物质中,在相同状况下体积最大的是 ;同质量的以上物质完全燃烧时耗O2的量最多的是 ;同状况、同体积、同物质的量的以上物质完全燃烧时耗O2的量最多的是 ;同质量的以上物质完全燃烧时,生成的CO2最多的是 ,生成水最多的是 。在120 ℃、1.01×105 Pa时,以上气态烃和足量的O2点燃完全燃烧,相同条件下测得反应前后气体体积没有发生变化的是 。
【考点二】烃的燃烧规律
CH4
CH4
C3H8
C2H4、C3H6
CH4
CH4、C2H4
2.由两种气态烃组成的混合物,体积为10 mL,与过量的氧气混合再充分燃烧,将生成物通过浓硫酸,气体体积减少15 mL,再通过碱石灰,气体体积又减少20 mL(气体体积均在同温同压下)。混合烃的组成可能为( )
A.C2H4和C2H2
B.C2H6和C2H4
C.CH4和C3H4
D.C4H10和C2H4
A
【考点三】烷烃、烯烃的性质
1.关于有机物的性质,下列说法不正确的是( )
A.CH4气体与Cl2在光照条件下发生取代反应能生成CCl4
B.CH2=CH2能使酸性高锰酸钾溶液褪色是因为发生了氧化反应
C.通常情况下,苯是无色液体,能在催化剂条件下与Br2发生取代反应
D.聚乙烯在一定条件下可以与溴水发生加成反应
D
2.下列五种烃,按它们的沸点由低到高排列正确的是( )
①2﹣甲基戊烷、②2,2﹣二甲基丁烷、③正己烷、④丙烷、⑤丁烷
A.①②③④⑤ B.②③④⑤① C.③①②④⑤ D.④⑤②①③
3.能使溴水褪色的是( )
A.乙烯 B.甲烷 C.四氯化碳 D.聚乙烯
D
A
【考点五】乙炔的性质实验
10.实验室用如图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:
(1)实验室制乙炔的化学方程式是: ;为了得到较为平稳的乙炔气流,装置 A 的分液漏斗中常用 来代替水。
(2)装置 B 中CuSO4溶液的作用是 。
饱和食盐水
除去H2S杂质,以防干扰后续实验
CaC2+2H2O C2H2↑+Ca(OH)2
(3)装置 D 中观察到的现象是 。
(4)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为
(用m与n表示)。
(5)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是:
紫红色褪去
×100%
CH≡CH+HCl CH2=CHCl
催化剂
nCH2=CHCl [ CH2—CH ]n
催化剂
Cl
【考点六】苯的结构与性质
5.苯分子结构中不存在碳碳单双键交替结构,不能作为证据的事实是( )
A.苯分子中碳碳键的键长均相等
B.苯不能使酸性高锰酸钾溶液褪色
C.经实验测得邻二甲苯只有一种结构
D.苯和氢气发生加成反应生成环己烷
6.由苯作原料不能经一步化学反应制得的是( )
A.硝基苯 B.环己烷 C.溴苯 D.苯酚
D
D
11.苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
(1)把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在 层。(填“上”或“下”)
(2)把苯加入到盛有少量酸性高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中 (填“有”或“没有”)碳碳双键;
(3)在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,反应的化学方程式为:
上
没有
+ HNO3
NO2+H2O
浓硫酸
【考点七】苯的同系物
7.在苯的同系物中,加入少量高锰酸钾酸性溶液,振荡后溶液褪色,下列正确的解释是( )
A.苯的同系物中碳原子数比苯分子中碳原子数多
B.侧链受苯环的影响而易被氧化
C.苯环被KMnO4所氧化而破坏
D.苯环和侧链的相互影响,同时被氧化
B
8.甲苯和苯一样能发生溴代反应,产物四溴甲苯(苯环上的取代)可能的结构有( )
A.6种 B.4种 C.5种 D.3种
9.分子组成为C10H14的苯的同系物,已知苯环上只有一个取代基,下列说法正确的是( )
A.该有机物不能发生加成反应,但能发生取代反应
B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C.该有机物分子中的所有原子可能在同一平面上
D.该有机物有4种不同结构
D
D
各类烃与常见试剂反应的比较:
烃 溴单质 溴水 溴的四氯 化碳溶液 酸性高锰
酸钾溶液
烷烃
烯烃
炔烃
苯
苯的 同系物
(光照)取代
不反应,萃取
使溴水褪色
不反应,互
溶不褪色
不反应
加成
加成
加成褪色
加成褪色
加成褪色
加成褪色
氧化褪色
氧化褪色
一般不反应,催
化条件下可取代
不反应,萃取
使溴水褪色
不反应
不反应
氧化褪色
不反应
不反应,萃取使溴水褪色
一般不反应,光照条件发生侧链上的取代,催化条件发生苯环上的取代
烃
脂肪烃
芳香烃
烷烃:同系物
烯烃:立体异构
炔烃:乙炔
苯:大π键
苯的同系物:基团相互作用
结构、性质、应用
转化、反应类型
系统命名法
书写同分异构体
