第三章 章末复习 课件 (共41张PPT)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第三章 章末复习 课件 (共41张PPT)2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 22:27:32 | ||
图片预览










文档简介
第三章 烃的衍生物
章末复习
1.掌握卤代烃、醇、酚、醛、酮、羧酸及羧酸衍生物的结构特点,能列举典型物质的物理性质,并能根据其化学键与官能团推测化学性质,能写出相关化学方程式;
2.能综合应用有关知识完成推断有机化合物、检验官能团、设计有机合成路线等任务。
知识点一:卤代烃
1.卤代烃的结构与物理性质
(1)卤代烃的定义:
烃分子中的氢原子被卤素原子取代后生成的化合物,可表示为R—X
饱和一卤代烃的通式为:
CnH2n+1X
(2)卤代烃的物理性质:
密度:
沸点:
状态:
溶解度:
常温下卤代烃中除个别为气体(如一氯甲烷)外,大多为液体或固体。
卤代烃不溶于水,可溶于有机溶剂。
卤代烃的密度高于相应的烃;一般随着烃基中碳原子数目的增加而减小
卤代烃的沸点高于相应的烃;一般随碳原子数增多,沸点依次升高
(3)卤代烃的化学性质:
①取代反应——又称水解反应
C2H5Br+NaOH C2H5OH+NaBr
水
?
稀硝酸酸化
白色沉淀(AgCl)
淡黄色沉淀(AgBr)
黄色沉淀(AgI)
NaOH水溶液
R—X
?
AgNO3溶液
卤代烃中卤素原子的检验:
取上层清液
NaBr+AgNO3===AgBr↓+NaNO3
②消去反应——又称消除反应
CH2=CH2 ↑ + NaBr+H2O
△
乙醇
CH2—CH2
Br
H
+ NaOH
a 必须有相邻的碳,否则不能发生消去反应。
b 邻位碳原子上必须有氢原子,否则不能发生消去反应。
c 直接连接在苯环上的卤原子不能消去。
发生消去反应的规律:
③加成反应和加聚反应
含不饱和键的卤代烃可以发生加成反应和加聚反应。
聚氯乙烯管道
含氟聚合物制成的充气薄膜建材
四氯化碳灭火器
清洗剂
氟氯代烷(氟利昂)破坏臭氧层
(4)卤代烃的应用与危害
知识点二:醇
1.醇的结构及物理性质
(1)醇的定义:
羟基与饱和碳原子相连的化合物称为醇
(2)醇的物理性质:
①沸点
氢键
a.饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
b.碳原子数相同时,羟基个数越多,醇的沸点越高。
c.相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
②溶解性
c.醇在水中的溶解度随着分子中碳原子数的增加而降低。
a.低级醇可与水以任意比例混溶。
b.醇的溶解度大于含有相同碳原子数烃类的溶解度。
2.醇的化学性质
(1)与活泼金属(如Na)发生反应
2C2H5OH+2Na→2C2H5ONa+H2↑
(2)酯化反应
(3)氧化反应
2C2H5OH+O2 2CH3CHO+2H2O
Cu或Ag
?
浓硫酸
?
C2H5OH+CH3COOH CH3COOC2H5+H2O
点燃
C2H5OH+3O2 2CO2+3H2O
(4)取代反应
①与氢卤酸反应:
②分子间脱水生成醚
C2H5—OH+HO—C2H5 C2H5—O—C2H5+H2O
浓硫酸
140℃
C2H5—OH+H—Br C2H5—Br+H2O
?
(5)消去反应
CH3CH2—OH CH2=CH2↑+H2O
浓硫酸
170℃
(6)氧化反应
乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
生成醛(或羧酸)
生成酮
不能被催化氧化
2~3个H
1个H
没有H
知识点三:酚
1.酚的结构、物理性质及其应用
(1)酚的定义:
羟基与苯环直接相连的化合物称为酚。
(2)苯酚的物理性质
无色有特殊气味晶体,久置被O2氧化呈 ,有毒;密度比水 ;熔点 ;易溶于 等有机溶剂,高于65 ℃时,与 混溶。
苯酚是一种重要的化工原料,用于生产 等。
(3)苯酚的应用
粉红色
大
低
乙醇
水
酚醛树脂、染料,医药,农药
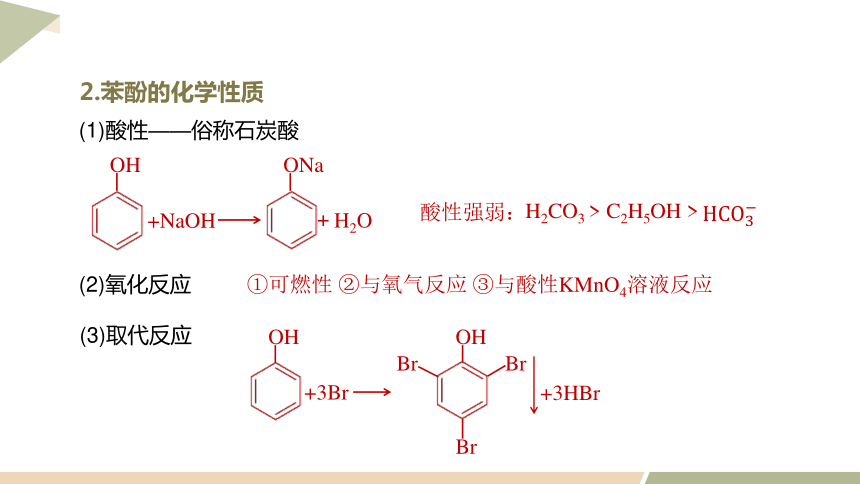
(1)酸性——俗称石炭酸
+H2O
+NaOH
OH
ONa
酸性强弱:
H2CO3 > C2H5OH >
①可燃性 ②与氧气反应 ③与酸性KMnO4溶液反应
(2)氧化反应
2.苯酚的化学性质
(3)取代反应
+3Br
+3HBr
OH
OH
Br
Br
Br
HCO3?
?
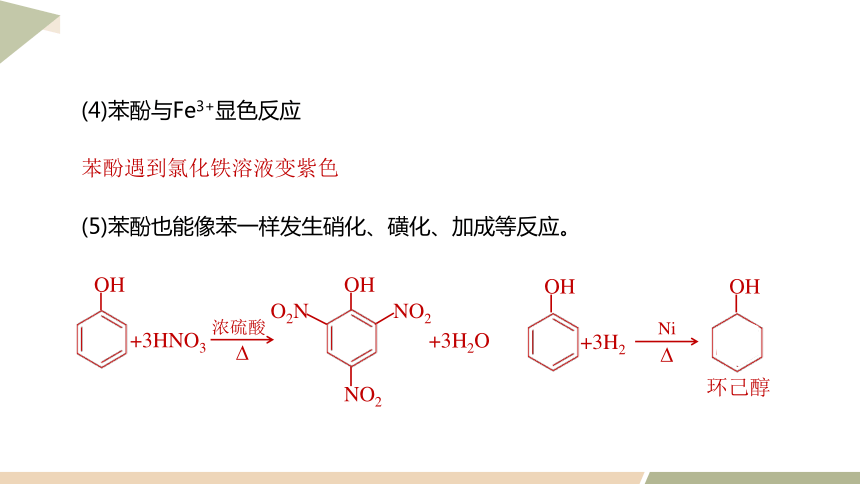
苯酚遇到氯化铁溶液变紫色
(4)苯酚与Fe3+显色反应
(5)苯酚也能像苯一样发生硝化、磺化、加成等反应。
浓硫酸
+3HNO3
+3H2O
OH
OH
NO2
O2N
NO2
?
+3H2
OH
?
Ni
OH
环己醇
有机化合物分子中“基团”的相互影响
烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色
苯酚分子中,苯环影响羟基,使酚羟基比醇羟基更活泼,使苯酚具有弱酸性
链烃基对苯环的影响:甲苯的硝化反应产物是三硝基甲苯,而同样条件下的苯的硝化反应只能生成一硝基苯
羟基对苯环的影响:使苯环邻、对位上的氢原子更易被取代
苯环对
支链影响
支链对
苯环影响
基团相
互影响
知识点四:醛
1.醛的结构与物理性质
(1)醛的定义:
醛基(—CHO)与烃基(或氢原子)相连构成的一类化合物
(2)乙醛的物理性质:
无色液体
有刺激性气味
密度比水小
沸点20.8℃,易挥发
能与水、乙醇等互溶
—CHO
官能团:
饱和一元醛通式:
CnH2nO
—C—
O
H
(1)加成反应
2.醛的化学性质
①催化加氢(还原反应)
CH3—C—H+H2 CH3CH2—OH
催化剂
?
O
②与一些极性试剂发生加成反应(与氢氰酸加成)
O
CH3—C—H+H—CN CH3—CH—CN
催化剂
?
OH
(2)氧化反应
特征反应
现象
注
意
事
项
银镜反应
与新制的Cu(OH)2
反应
产生光亮的银镜
产生砖红色沉淀
(1)试管内壁必须洁净。
(2)银氨溶液随用随配,不可久置。
(3)水浴加热,不可用酒精灯直接加热。
(4)醛用量不宜太多,如乙醛一般滴3滴。
(5)银镜可用稀硝酸浸泡洗涤除去
(1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
使溴水、KMnO4(H+)溶液褪色的有机物
{2D5ABB26-0587-4C30-8999-92F81FD0307C}
碳碳双键
碳碳三键
苯的同系物
醇
酚
醛
溴水
KMnO4(H+)
官能团
试剂
×
√
√
√
√
√
√
√
√
√
×
√
2.常见醛
(1)甲醛
俗名 , 色有强烈刺激性气味的 , 溶于水;
甲醛水溶液( ),可用于 。
蚁醛
无
气体
易
福尔马林
消毒和制作生物标本
(2)苯甲醛
苯甲醛是最简单的 ,俗称苦杏仁油,是一种有苦杏仁气味的无色 ,也是制造染料、香料及药物的重要原料。
芳香醛
液体
知识点五:酮
1.酮的结构与物理性质
羰基与两个烃基相连的化合物
(1)醛的定义:
(2)乙醛的物理性质:
—C—
O
常温下,丙酮是无色透明的液体,易挥发,能与水、乙醇等互溶。
(3)化学性质
①加成(还原)反应:
②难被氧化(燃烧除外):难被银氨溶液或新制氢氧化铜氧化
—C—
O
R2
R1
—CH—
OH
R2
R1
+H2
催化剂
?
知识点六:羧酸
1.酮的结构与物理性质
(1)羧酸的定义:
—C—OH
O
由烃基(或氢原子)与羧基相连而构成的有机化合物。
(2)羧酸的物理性质:
随着分子中碳原子数的增加,熔沸点逐渐升高。
①沸点
氢键
②溶解性
a.甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
b.随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小。
c.高级饱和脂肪酸是不溶于水的蜡状固体。
2.化学性质
(1)酸性:
乙酸 > 碳酸 > 苯酚
(2)酯化反应:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
浓硫酸
△
酸脱羟基 醇脱氢
羟基氢的活泼性(酸性)即电离出的H+能力
CH3COOH
H2CO3
HCO3-
H2O
C2H5OH
>
>
>
>
C6H5OH
>
3.常见的酸
名称
甲酸
苯甲酸
乙二酸
俗称
结构
简式
?
物理
性质
化学
性质
用途
COOH
HOOC-COOH
HCOOH
无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶
无色晶体,易升华,微溶于水,易溶于乙醇
无色晶体,通常含有两分子结晶水,可溶于水和乙醇
既表现羧酸的性质,又表现醛的性质
表现羧酸的性质
表现羧酸的性质
工业上可用作还原剂,也是合成医药、农药和染料等的原料
用于合成香料、药物等,其钠盐是常用食品防腐剂
化学分析中常用的还原剂,也是重要的化工原料
蚁酸
安息香酸
草酸
知识点七:羧酸衍生物
1.酯
—C—O—
O
酯化反应和酯水解反应的比较
酯化反应
水解
反应关系
催化剂
催化剂的其他作用
反应类型
浓H2SO4
稀H2SO4或NaOH溶液
酯化反应,取代反应
水解反应,取代反应
吸水,提高乙酸和乙醇的转化率
NaOH中和酯水解生成的乙酸,提高酯的水解率
其中 和 是饱和脂肪酸, 是不饱和脂肪酸。
2.油脂
(1)组成结构
日常生活中食用的油脂是由 与 形成的 。
高级脂肪酸
甘油
酯
①高级脂肪酸分为 和 ;
软脂酸
油酸
硬脂酸
饱和脂肪酸
不饱和脂肪酸
(2)化学性质
①水解反应
②油脂氢化(油脂的硬化)
3.酰胺
(1)胺:
烃分子中的氢原子被氨基所替代。
一般可写作R—NH2
化学性质:
胺类化合物具有 。
碱性
(2)酰胺:
羧酸分子中羟基被氨基所替代得到的化合物。
化学性质:
在酸或碱存在并加热的条件下可以发生水解反应。
应用:
酰胺常被用作溶剂和化工原料。
知识点八:有机合成
1.构建碳骨架
(1)碳链的增长
①炔烃与氢氰酸的加成反应
②醛与氢氰酸的加成反应
③酮与氢氰酸的加成反应
④羟醛缩合反应
(2)碳链的缩短
①烯烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮
②炔烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮
③芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸
(3)成环反应
①第尔斯-阿尔德反应
②形成环酯
2.引入官能团
官能团
引入方法
碳碳双键
碳卤键
羟基
醛基
羧基
酯基
卤代烃的消去或醇的消去或炔烃的不完全加成
醇、酚、烷烃、苯及苯的同系物的取代,烯烃、炔烃的加成
烯烃与水的加成或卤代烃的水解或醛的还原或酯的水解
醇的催化氧化或烯烃的氧化
醇的氧化或醛的氧化或酯的水解
酯化反应
3.有机合成路线的设计与实施
方法
内容
正合成分析法
采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间体,逐步推向待合成有机化合物,其思维程序:原料→中间体→产品
逆合成分析法
采用逆向思维方法,从产品的组成、结构、性质入手,找出合成所需要的直接或间接的中间体,逐步推向已知原料,其思维程序:产品→中间体→原料
综合比较法
采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳合成路线
【考点一】多官能团有机物的性质判断
1.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。
下列关于calebin A的说法错误的是( )
A.可与FeCl3溶液发生显色反应
B.其酸性水解的产物均可与Na2CO3溶液反应
C.苯环上氢原子发生氯代时,一氯代物有6种
D.1 mol该分子最多与8 mol H2发生加成反应
D
2.(双选)化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:
下列有关化合物X、Y的说法正确的是( )
A.X分子中所有原子一定在同一平面上
B.Y与Br2的加成产物分子中含有手性碳原子
C.X、Y均不能使酸性KMnO4溶液褪色
D.X→Y的反应为取代反应
BD
【考点二】有机反应类型的判断
1.氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
写出序号相应的反应类型,供选择的反应类型如下:氧化、还原、硝化、氯代、酸化、碱化、成盐、酯化、酯交换、水解。
①硝化 ②氯代 ③氧化 ④酯化 ⑥还原
(1)判断有机化学反应类型的基本思路
方法归纳:
(2)常见的反应类型
①取代反应——“有进有出”
常见的取代反应:
烃的卤代、芳香烃的硝化、卤代烃的水解、醇分子间的脱水、醇与氢卤酸的反应、酚的卤代、酯化反应、酯的水解以及蛋白质的水解等。
方法归纳:
②加成反应——“只进不出”
常见的加成反应:氢气、卤素单质、氢卤酸、水等与分子中含碳碳双键、碳碳三键的有机化合物发生的加成反应;苯环与氢气的加成;醛、酮与H2、HCN的加成等。
③消去反应——“只出不进”
常见的消去反应:醇分子内脱水、卤代烃分子内脱卤化氢是中学阶段必须掌握的消去反应。
④根据反应条件推断反应类型
NaOH的水溶液
酯或卤代烃的水解反应等
NaOH的乙醇溶液中加热
卤代烃的消去反应
浓硫酸,加热
醇的消去反应、酯化反应、成醚反应或硝化反应等
溴水或溴的CCl4溶液
烯烃、炔烃的加成反应
H2,Ni
烯烃、炔烃、芳香烃、醛的加成反应或还原反应
O2、Cu(或Ag)、加热(或CuO、加热)
醇的氧化反应
O2或新制的Cu(OH)2或银氨溶液
—CHO的氧化反应
稀硫酸,加热
酯、低聚糖、多糖的水解反应
光照、X2
烷基上的取代反应
FeX3、X2
苯环上的取代反应
A.取代、消去、酯化、加成
B.酯化、消去、缩聚、取代
C.酯化、取代、缩聚、取代
D.取代、消去、加聚、取代
B
2.结构简式为 的有机化合物可以通过不同的反应得到下列四种物质,生成这四种有机化合物的反应类型依次为( )
COOH
CH2CH2OH
【考点三】解答有机推断题的方法和策略
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
回答下列问题:
(1)A的结构简式为 。C的化学名称是 。?
(2)③的反应试剂和反应条件分别是 ,
该反应的类型是 。?
CH3
三氯甲苯
浓硝酸和浓硫酸、加热
取代反应
(3)F的结构简式为 。
吡啶是一种有机碱,其作用是 。?
(4)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H
可能的结构有 种。?
9
吸收反应产生的HCl,提高反应转化率
方法归纳:
善于寻找解题的突破口
银镜反应或与新制氢氧化铜 ——-CHO
能与钠反应放出H2——-OH或-COOH
能与Na2CO3或NaHCO3溶液反应放出CO2或使紫色石蕊溶液变红的有机化合物——-COOH
能发生消去反应——醇或卤代烃
遇FeCl3溶液显紫色——酚羟基
能发生连续氧化的有机化合物——具有-CH2OH结构
烃的衍生物
酚
卤代烃
醇
醛
羧酸
酯
不饱和烃
有机合成
章末复习
1.掌握卤代烃、醇、酚、醛、酮、羧酸及羧酸衍生物的结构特点,能列举典型物质的物理性质,并能根据其化学键与官能团推测化学性质,能写出相关化学方程式;
2.能综合应用有关知识完成推断有机化合物、检验官能团、设计有机合成路线等任务。
知识点一:卤代烃
1.卤代烃的结构与物理性质
(1)卤代烃的定义:
烃分子中的氢原子被卤素原子取代后生成的化合物,可表示为R—X
饱和一卤代烃的通式为:
CnH2n+1X
(2)卤代烃的物理性质:
密度:
沸点:
状态:
溶解度:
常温下卤代烃中除个别为气体(如一氯甲烷)外,大多为液体或固体。
卤代烃不溶于水,可溶于有机溶剂。
卤代烃的密度高于相应的烃;一般随着烃基中碳原子数目的增加而减小
卤代烃的沸点高于相应的烃;一般随碳原子数增多,沸点依次升高
(3)卤代烃的化学性质:
①取代反应——又称水解反应
C2H5Br+NaOH C2H5OH+NaBr
水
?
稀硝酸酸化
白色沉淀(AgCl)
淡黄色沉淀(AgBr)
黄色沉淀(AgI)
NaOH水溶液
R—X
?
AgNO3溶液
卤代烃中卤素原子的检验:
取上层清液
NaBr+AgNO3===AgBr↓+NaNO3
②消去反应——又称消除反应
CH2=CH2 ↑ + NaBr+H2O
△
乙醇
CH2—CH2
Br
H
+ NaOH
a 必须有相邻的碳,否则不能发生消去反应。
b 邻位碳原子上必须有氢原子,否则不能发生消去反应。
c 直接连接在苯环上的卤原子不能消去。
发生消去反应的规律:
③加成反应和加聚反应
含不饱和键的卤代烃可以发生加成反应和加聚反应。
聚氯乙烯管道
含氟聚合物制成的充气薄膜建材
四氯化碳灭火器
清洗剂
氟氯代烷(氟利昂)破坏臭氧层
(4)卤代烃的应用与危害
知识点二:醇
1.醇的结构及物理性质
(1)醇的定义:
羟基与饱和碳原子相连的化合物称为醇
(2)醇的物理性质:
①沸点
氢键
a.饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
b.碳原子数相同时,羟基个数越多,醇的沸点越高。
c.相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
②溶解性
c.醇在水中的溶解度随着分子中碳原子数的增加而降低。
a.低级醇可与水以任意比例混溶。
b.醇的溶解度大于含有相同碳原子数烃类的溶解度。
2.醇的化学性质
(1)与活泼金属(如Na)发生反应
2C2H5OH+2Na→2C2H5ONa+H2↑
(2)酯化反应
(3)氧化反应
2C2H5OH+O2 2CH3CHO+2H2O
Cu或Ag
?
浓硫酸
?
C2H5OH+CH3COOH CH3COOC2H5+H2O
点燃
C2H5OH+3O2 2CO2+3H2O
(4)取代反应
①与氢卤酸反应:
②分子间脱水生成醚
C2H5—OH+HO—C2H5 C2H5—O—C2H5+H2O
浓硫酸
140℃
C2H5—OH+H—Br C2H5—Br+H2O
?
(5)消去反应
CH3CH2—OH CH2=CH2↑+H2O
浓硫酸
170℃
(6)氧化反应
乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
生成醛(或羧酸)
生成酮
不能被催化氧化
2~3个H
1个H
没有H
知识点三:酚
1.酚的结构、物理性质及其应用
(1)酚的定义:
羟基与苯环直接相连的化合物称为酚。
(2)苯酚的物理性质
无色有特殊气味晶体,久置被O2氧化呈 ,有毒;密度比水 ;熔点 ;易溶于 等有机溶剂,高于65 ℃时,与 混溶。
苯酚是一种重要的化工原料,用于生产 等。
(3)苯酚的应用
粉红色
大
低
乙醇
水
酚醛树脂、染料,医药,农药
(1)酸性——俗称石炭酸
+H2O
+NaOH
OH
ONa
酸性强弱:
H2CO3 > C2H5OH >
①可燃性 ②与氧气反应 ③与酸性KMnO4溶液反应
(2)氧化反应
2.苯酚的化学性质
(3)取代反应
+3Br
+3HBr
OH
OH
Br
Br
Br
HCO3?
?
苯酚遇到氯化铁溶液变紫色
(4)苯酚与Fe3+显色反应
(5)苯酚也能像苯一样发生硝化、磺化、加成等反应。
浓硫酸
+3HNO3
+3H2O
OH
OH
NO2
O2N
NO2
?
+3H2
OH
?
Ni
OH
环己醇
有机化合物分子中“基团”的相互影响
烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色
苯酚分子中,苯环影响羟基,使酚羟基比醇羟基更活泼,使苯酚具有弱酸性
链烃基对苯环的影响:甲苯的硝化反应产物是三硝基甲苯,而同样条件下的苯的硝化反应只能生成一硝基苯
羟基对苯环的影响:使苯环邻、对位上的氢原子更易被取代
苯环对
支链影响
支链对
苯环影响
基团相
互影响
知识点四:醛
1.醛的结构与物理性质
(1)醛的定义:
醛基(—CHO)与烃基(或氢原子)相连构成的一类化合物
(2)乙醛的物理性质:
无色液体
有刺激性气味
密度比水小
沸点20.8℃,易挥发
能与水、乙醇等互溶
—CHO
官能团:
饱和一元醛通式:
CnH2nO
—C—
O
H
(1)加成反应
2.醛的化学性质
①催化加氢(还原反应)
CH3—C—H+H2 CH3CH2—OH
催化剂
?
O
②与一些极性试剂发生加成反应(与氢氰酸加成)
O
CH3—C—H+H—CN CH3—CH—CN
催化剂
?
OH
(2)氧化反应
特征反应
现象
注
意
事
项
银镜反应
与新制的Cu(OH)2
反应
产生光亮的银镜
产生砖红色沉淀
(1)试管内壁必须洁净。
(2)银氨溶液随用随配,不可久置。
(3)水浴加热,不可用酒精灯直接加热。
(4)醛用量不宜太多,如乙醛一般滴3滴。
(5)银镜可用稀硝酸浸泡洗涤除去
(1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
使溴水、KMnO4(H+)溶液褪色的有机物
{2D5ABB26-0587-4C30-8999-92F81FD0307C}
碳碳双键
碳碳三键
苯的同系物
醇
酚
醛
溴水
KMnO4(H+)
官能团
试剂
×
√
√
√
√
√
√
√
√
√
×
√
2.常见醛
(1)甲醛
俗名 , 色有强烈刺激性气味的 , 溶于水;
甲醛水溶液( ),可用于 。
蚁醛
无
气体
易
福尔马林
消毒和制作生物标本
(2)苯甲醛
苯甲醛是最简单的 ,俗称苦杏仁油,是一种有苦杏仁气味的无色 ,也是制造染料、香料及药物的重要原料。
芳香醛
液体
知识点五:酮
1.酮的结构与物理性质
羰基与两个烃基相连的化合物
(1)醛的定义:
(2)乙醛的物理性质:
—C—
O
常温下,丙酮是无色透明的液体,易挥发,能与水、乙醇等互溶。
(3)化学性质
①加成(还原)反应:
②难被氧化(燃烧除外):难被银氨溶液或新制氢氧化铜氧化
—C—
O
R2
R1
—CH—
OH
R2
R1
+H2
催化剂
?
知识点六:羧酸
1.酮的结构与物理性质
(1)羧酸的定义:
—C—OH
O
由烃基(或氢原子)与羧基相连而构成的有机化合物。
(2)羧酸的物理性质:
随着分子中碳原子数的增加,熔沸点逐渐升高。
①沸点
氢键
②溶解性
a.甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
b.随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小。
c.高级饱和脂肪酸是不溶于水的蜡状固体。
2.化学性质
(1)酸性:
乙酸 > 碳酸 > 苯酚
(2)酯化反应:
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
浓硫酸
△
酸脱羟基 醇脱氢
羟基氢的活泼性(酸性)即电离出的H+能力
CH3COOH
H2CO3
HCO3-
H2O
C2H5OH
>
>
>
>
C6H5OH
>
3.常见的酸
名称
甲酸
苯甲酸
乙二酸
俗称
结构
简式
?
物理
性质
化学
性质
用途
COOH
HOOC-COOH
HCOOH
无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶
无色晶体,易升华,微溶于水,易溶于乙醇
无色晶体,通常含有两分子结晶水,可溶于水和乙醇
既表现羧酸的性质,又表现醛的性质
表现羧酸的性质
表现羧酸的性质
工业上可用作还原剂,也是合成医药、农药和染料等的原料
用于合成香料、药物等,其钠盐是常用食品防腐剂
化学分析中常用的还原剂,也是重要的化工原料
蚁酸
安息香酸
草酸
知识点七:羧酸衍生物
1.酯
—C—O—
O
酯化反应和酯水解反应的比较
酯化反应
水解
反应关系
催化剂
催化剂的其他作用
反应类型
浓H2SO4
稀H2SO4或NaOH溶液
酯化反应,取代反应
水解反应,取代反应
吸水,提高乙酸和乙醇的转化率
NaOH中和酯水解生成的乙酸,提高酯的水解率
其中 和 是饱和脂肪酸, 是不饱和脂肪酸。
2.油脂
(1)组成结构
日常生活中食用的油脂是由 与 形成的 。
高级脂肪酸
甘油
酯
①高级脂肪酸分为 和 ;
软脂酸
油酸
硬脂酸
饱和脂肪酸
不饱和脂肪酸
(2)化学性质
①水解反应
②油脂氢化(油脂的硬化)
3.酰胺
(1)胺:
烃分子中的氢原子被氨基所替代。
一般可写作R—NH2
化学性质:
胺类化合物具有 。
碱性
(2)酰胺:
羧酸分子中羟基被氨基所替代得到的化合物。
化学性质:
在酸或碱存在并加热的条件下可以发生水解反应。
应用:
酰胺常被用作溶剂和化工原料。
知识点八:有机合成
1.构建碳骨架
(1)碳链的增长
①炔烃与氢氰酸的加成反应
②醛与氢氰酸的加成反应
③酮与氢氰酸的加成反应
④羟醛缩合反应
(2)碳链的缩短
①烯烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮
②炔烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮
③芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸
(3)成环反应
①第尔斯-阿尔德反应
②形成环酯
2.引入官能团
官能团
引入方法
碳碳双键
碳卤键
羟基
醛基
羧基
酯基
卤代烃的消去或醇的消去或炔烃的不完全加成
醇、酚、烷烃、苯及苯的同系物的取代,烯烃、炔烃的加成
烯烃与水的加成或卤代烃的水解或醛的还原或酯的水解
醇的催化氧化或烯烃的氧化
醇的氧化或醛的氧化或酯的水解
酯化反应
3.有机合成路线的设计与实施
方法
内容
正合成分析法
采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间体,逐步推向待合成有机化合物,其思维程序:原料→中间体→产品
逆合成分析法
采用逆向思维方法,从产品的组成、结构、性质入手,找出合成所需要的直接或间接的中间体,逐步推向已知原料,其思维程序:产品→中间体→原料
综合比较法
采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳合成路线
【考点一】多官能团有机物的性质判断
1.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。
下列关于calebin A的说法错误的是( )
A.可与FeCl3溶液发生显色反应
B.其酸性水解的产物均可与Na2CO3溶液反应
C.苯环上氢原子发生氯代时,一氯代物有6种
D.1 mol该分子最多与8 mol H2发生加成反应
D
2.(双选)化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:
下列有关化合物X、Y的说法正确的是( )
A.X分子中所有原子一定在同一平面上
B.Y与Br2的加成产物分子中含有手性碳原子
C.X、Y均不能使酸性KMnO4溶液褪色
D.X→Y的反应为取代反应
BD
【考点二】有机反应类型的判断
1.氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
写出序号相应的反应类型,供选择的反应类型如下:氧化、还原、硝化、氯代、酸化、碱化、成盐、酯化、酯交换、水解。
①硝化 ②氯代 ③氧化 ④酯化 ⑥还原
(1)判断有机化学反应类型的基本思路
方法归纳:
(2)常见的反应类型
①取代反应——“有进有出”
常见的取代反应:
烃的卤代、芳香烃的硝化、卤代烃的水解、醇分子间的脱水、醇与氢卤酸的反应、酚的卤代、酯化反应、酯的水解以及蛋白质的水解等。
方法归纳:
②加成反应——“只进不出”
常见的加成反应:氢气、卤素单质、氢卤酸、水等与分子中含碳碳双键、碳碳三键的有机化合物发生的加成反应;苯环与氢气的加成;醛、酮与H2、HCN的加成等。
③消去反应——“只出不进”
常见的消去反应:醇分子内脱水、卤代烃分子内脱卤化氢是中学阶段必须掌握的消去反应。
④根据反应条件推断反应类型
NaOH的水溶液
酯或卤代烃的水解反应等
NaOH的乙醇溶液中加热
卤代烃的消去反应
浓硫酸,加热
醇的消去反应、酯化反应、成醚反应或硝化反应等
溴水或溴的CCl4溶液
烯烃、炔烃的加成反应
H2,Ni
烯烃、炔烃、芳香烃、醛的加成反应或还原反应
O2、Cu(或Ag)、加热(或CuO、加热)
醇的氧化反应
O2或新制的Cu(OH)2或银氨溶液
—CHO的氧化反应
稀硫酸,加热
酯、低聚糖、多糖的水解反应
光照、X2
烷基上的取代反应
FeX3、X2
苯环上的取代反应
A.取代、消去、酯化、加成
B.酯化、消去、缩聚、取代
C.酯化、取代、缩聚、取代
D.取代、消去、加聚、取代
B
2.结构简式为 的有机化合物可以通过不同的反应得到下列四种物质,生成这四种有机化合物的反应类型依次为( )
COOH
CH2CH2OH
【考点三】解答有机推断题的方法和策略
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
回答下列问题:
(1)A的结构简式为 。C的化学名称是 。?
(2)③的反应试剂和反应条件分别是 ,
该反应的类型是 。?
CH3
三氯甲苯
浓硝酸和浓硫酸、加热
取代反应
(3)F的结构简式为 。
吡啶是一种有机碱,其作用是 。?
(4)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H
可能的结构有 种。?
9
吸收反应产生的HCl,提高反应转化率
方法归纳:
善于寻找解题的突破口
银镜反应或与新制氢氧化铜 ——-CHO
能与钠反应放出H2——-OH或-COOH
能与Na2CO3或NaHCO3溶液反应放出CO2或使紫色石蕊溶液变红的有机化合物——-COOH
能发生消去反应——醇或卤代烃
遇FeCl3溶液显紫色——酚羟基
能发生连续氧化的有机化合物——具有-CH2OH结构
烃的衍生物
酚
卤代烃
醇
醛
羧酸
酯
不饱和烃
有机合成
