4.2 蛋白质 课件(共23张PPT) 2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 4.2 蛋白质 课件(共23张PPT) 2023-2024学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 134.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-12 22:00:37 | ||
图片预览







文档简介
(共23张PPT)
第四章 生物大分子
第二节 蛋白质
蛋白质是生物体内一类极为重要的生物大分子,是生命活动的主要物质基础。它不仅是细胞的重要成分,而且具有多种生物学功能。
酶
抗体
激素
蛋白质的相对分子质量很大,可以达到上千万。但是如此大的高分子化合物,也是由基本结构单元——氨基酸构成的,要认识蛋白质,必须首先认识氨基酸。
1.通过结构分析认识氨基酸的组成、结构特点和主要化学性质,知道氨基酸、多肽和蛋白质之间的关系能判断氨基酸缩合产物和多肽的水解产物;
2.认识蛋白质的组成和性质特点,能辨识蛋白质结构中的肽键,能说明蛋白质的基本结构特点;
3.认识蛋白质空间结构的复杂性和种类的多样性,了解酶催化反应的特点。
一、氨基酸
1.结构
(1)定义:羧酸分子烃基上的氢原子被氨基取代得到的化合物。
组成蛋白质的氨基酸主要是α-氨基酸
R—CH—COOH
NH2
α-氨基酸
(2)α-氨基酸:
氨基酸分子中含有______和_______,属于_________。
氨基
羧基
取代羧酸
(3)常见的氨基酸
谷氨酸(2-氨基戊二酸)
苯丙氨酸(2-氨基-3-苯基丙酸)
半胱氨酸(2-氨基-3-巯基丙酸)
丙氨酸(α-氨基丙酸)
除甘氨酸外,一般α 氨基酸中含手性碳原子,是手性分子,具有对映异构体。
H2N—CH2—COOH
甘氨酸(氨基乙酸)
CH3—CH—COOH
NH2
HOOC—(CH2)2CH—COOH
NH2
CH2—CH—COOH
NH2
—
HS—CH2—CH—COOH
NH2
(1)物理性质
2.氨基酸的性质
谷氨酸单钠盐
味精
根据以上氨基酸结构简式中所含有的宫能团,推测氨基酸可能具有哪些化学性质。
天然氨基酸均为无色晶体,熔点较高,多在200~300℃熔化时分解。
一般能溶于水,而难溶于乙醇、乙醚等有机溶剂。
(2)化学性质
①两性
氨基酸分子中含有酸性基团—COOH和碱性基团—NH2,因此氨基酸是两性化合物,能与酸、碱反应生成盐。
a.与盐酸的反应:
b.与氢氧化钠反应:
R—CH—COOH+NaOH
NH2
R—CH—COONa+H2O
NH2
R—CH—COOH+HCl
NH2
R—CH—COOH
NH3Cl
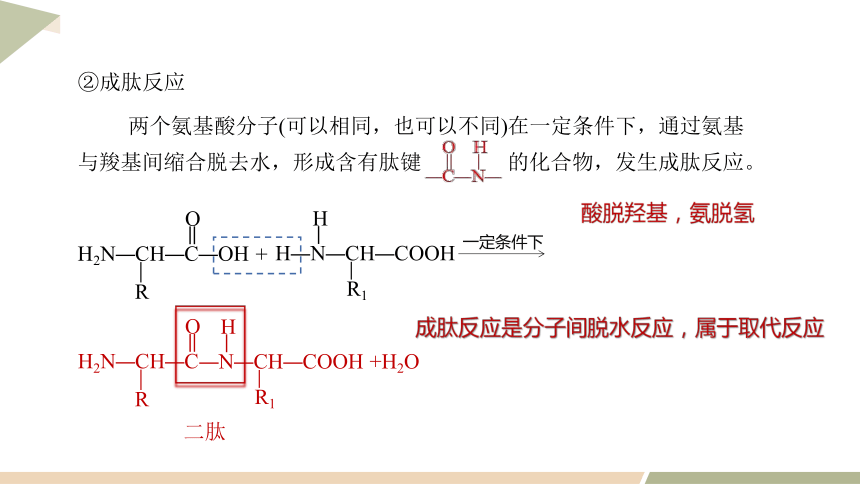
②成肽反应
两个氨基酸分子(可以相同,也可以不同)在一定条件下,通过氨基与羧基间缩合脱去水,形成含有肽键 的化合物,发生成肽反应。
成肽反应是分子间脱水反应,属于取代反应
一定条件下
H2N—CH—C—OH
R
O
H—N—CH—COOH
R1
H
+
二肽
O
H2N—CH—C
R
—N—CH—COOH
R1
H
+H2O
酸脱羟基,氨脱氢
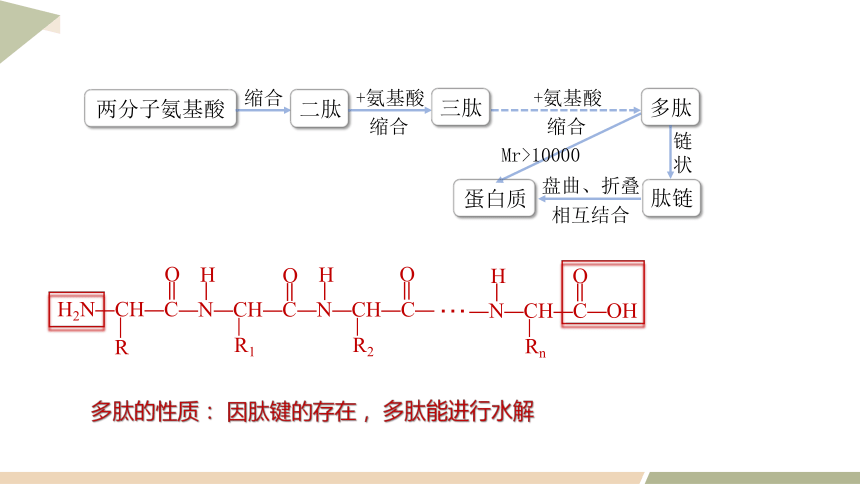
缩合
两分子氨基酸
二肽
+氨基酸
缩合
三肽
+氨基酸
缩合
多肽
多肽的性质: 因肽键的存在, 多肽能进行水解
蛋白质
肽链
链状
盘曲、折叠
相互结合
Mr>10000
O
H2N—CH—C
R
—N—CH—C
R1
H
—N—CH—C—
R2
H
O
—N—CH—C—OH
Rn
H
O
…
O
二、蛋白质
1.定义与组成
蛋白质是由多种氨基酸通过肽键等相互连接形成的一类生物大分子,是一般细胞中含量最多的有机分子。主要由C、H、O、N、S等元素组成,有些蛋白质还含有P、Fe、Zn、Cu等元素。是一种天然有机高分子化合物,蛋白质相对分子质量的变化范围很大,从数万一直到数千万不等,通常所说的蛋白质是混合物。
各种蛋白质都有其特殊功能和活性,这不仅取决于取决于组成多肽链的氨基酸种类、数目及排列顺序,还与其特定的空间结构密切相关。
2.蛋白质的结构
任何一种蛋白质分子在天然状态下均具有独特而稳定的结构,这是蛋白质分子结构中最显著的特征,蛋白质分子中含有未缩合的羧基和氨基;天然蛋白质的结构分为:一级结构、二级结构、三级结构、四级结构。
一级结构:氨基酸单体的排列顺序
①一级结构是蛋白质高级结构的基础,对蛋白质的性质和功能起决定性作用。
血红蛋白分子
缬氨酸
谷氨酸
镰状细胞贫血
一级结构
②肽键中的氧原子与氢原子之间存在氢键,会使肽链盘绕或折叠成特定的空间结构,形成蛋白质的二级结构
③肽链在二级结构基础上还会进一步盘曲折叠,形成更复杂的三级结构
④多个具有特定三级结构的多肽链通过非共价键相互作用(如氢键等)排列组装,形成蛋白质的四级结构。
二级结构
三级结构
四级结构
氢键
3.蛋白质的主要性质
蛋白质的多肽由多个氨基酸缩合形成,在多肽链的两端必然存在着自由的氨基与羧基,同时侧链中也往往存在酸性或碱性基团。因此,蛋白质既能与酸反应,又能与碱反应。
(1)两性
(2)水解
H2N—CH—C—OH
R
O
H—N—CH—COOH
R1
H
+
酸、碱或酶
O
H2N—CH—C
R
—N—CH—COOH
R1
H
+H2O
蛋白质
水解
蛋白酶
人体需要的蛋白质
多肽
氨基酸
水解
吸收进入血液
重新合成
(3)盐析
少量的某些可溶性盐(如硫酸铵、硫酸钠、氯化钠等)能促进蛋白质的溶解。但当这些盐在蛋白质溶液中达到一定浓度时,反而使蛋白质的溶解度降低而使其从溶液中析出,这种作用称为盐析。
视频
加入饱和(NH4)2SO4溶液,试管内产生白色沉淀,加入蒸馏水后沉淀溶解。
【实验现象】
盐析是可逆过程,不影响蛋白质的活性;多次盐析和溶解,可分离提纯蛋白质
适用范围: 易溶于水的蛋白质,不溶性蛋白质没有盐析的性质
三支试管内均产生白色沉淀,加入蒸馏水后沉淀不溶解。
(4)变性
在某些物理或化学因素的影响下,蛋白质的性质和生理功能发生改变的现象。
物理因素:加热、加压、搅拌、振荡、紫外线和放射线、超声波等
化学因素:强酸、强碱、重金属盐、乙醇、甲醛、丙酮等
变性会使蛋白质的结构发生变化,使其失去原有的生理活性,在水中不能重新溶解,是不可逆过程
视频
【实验现象】
思考与讨论
Ⅰ.因误服铅、汞等重金属盐中毒的患者在急救时,为什么可口服牛奶、蛋清或豆浆?
Ⅱ.为什么紫外线可用于环境和物品消毒,放射线可用于医疗器械灭菌?
误食重金属盐会导致人体内的蛋白质发生变性而使人中毒。因此,急救通过口服牛奶、蛋清和豆浆等富含蛋白质的物质进行解毒的原理是使重金属盐与牛奶、蛋清和豆浆中的蛋白质发生变性作用,从而减轻重金属盐对人体的危害。
紫外线和放射线也可以使蛋白质发生变性,因此可使用紫外线和放射线对环境、物品和医疗器械等进行消毒,使细菌和病毒中的蛋白质发生变性而使其死亡。
(5)显色反应
视频
加入浓硝酸后产生白色沉淀,加热后沉淀变黄色
含有苯环的蛋白质遇到浓硝酸呈黄色,可用于蛋白质的分析检测。
天然蛋白质都含苯环,如皮肤、指甲遇浓硝酸变黄色。
【实验现象】
(6)蛋白质灼烧有类似烧焦羽毛的气味
一般生成CO2、H2O、N2、SO2、P2O5等物质,用于鉴别人造羊毛或人造棉与纯羊毛或真丝制品
1.定义
一类由细胞产生的,对生物体内的化学反应具有催化作用的有机物,其中绝大多数是蛋白质。
三、酶
2.酶催化作用具有的特点
(1)条件温和,不需加热——在接近体温和接近中性的条件下
(2)具有高度的专一性——每种酶只催化一种或一类化合物的化学反应
(3)具有高效催化作用——相当于无机催化剂的107~1013倍
【注意】使用酶作催化剂时,反应温度不能过高,原因是高温下蛋白质变性,酶失去催化活性。
3.酶的应用:
(1)淀粉酶应用于食品、发酵、纺织、制药等工业;
(2)蛋白酶应用于医药、制革等工业;
(3)脂肪酶应用于脂肪水解、羊毛脱脂等;
(4)酶还可用于疾病的诊断。
[练一练]
1.判断正误
(1)氨基酸是一种既能与强碱反应又能与强酸反应的有机高分子。 ( )
(2)酶的催化作用是温度越高越好。( )
(3)蛋白质遇浓硝酸都会显黄色。( )
(4)氨基酸能发生酯化反应、成肽反应和水解反应。( )
(5)酶均是蛋白质,是体内反应的催化剂。( )
2.下列关于氨基酸的叙述中,不正确的是( )
A.天然氨基酸都是晶体,一般能溶于水
B.氨基酸都不能发生水解反应
C.氨基酸是两性化合物,能与酸、碱反应生成盐
D.氨基酸的官能团有氨基和羟基
D
3.下列关于乙肝病毒的主要成分的说法不正确的是( )
A.属于高分子
B.水解的最终产物能与酸或碱反应
C.遇浓硝酸会变性
D.水解时碳氧键断裂
D
4.青霉素是一种良效广谱抗生素,经酸性水解后得到青霉素氨基酸分子的结构简式如图,下列关于该物质的叙述不正确的是 ( )
A.属于α-氨基酸
B.能发生加聚反应生成多肽
C.核磁共振氢谱上共有5个峰
D.青霉素过敏严重者会导致死亡,用药前一定要进行皮肤敏感试验
B
5.下列物质中可以使蛋白质变性的是( )
①福尔马林 ②酒精 ③高锰酸钾溶液 ④硫酸铵溶液 ⑤硫酸铜溶液 ⑥双氧水 ⑦硝酸
A.除④⑦外 B.除③⑥外 C.①②⑤ D.除④外
D
水解
缩聚
蛋白质
氨基酸
蛋白质
酶
官能团
结构
性质
两性
水解
盐析
变性
显色反应
灼烧有类似烧焦羽毛的气味
高效生物催化剂
高效性、专一性、适宜条件
羧基
氨基
能与碱反应
能与酸反应
成肽反应
第四章 生物大分子
第二节 蛋白质
蛋白质是生物体内一类极为重要的生物大分子,是生命活动的主要物质基础。它不仅是细胞的重要成分,而且具有多种生物学功能。
酶
抗体
激素
蛋白质的相对分子质量很大,可以达到上千万。但是如此大的高分子化合物,也是由基本结构单元——氨基酸构成的,要认识蛋白质,必须首先认识氨基酸。
1.通过结构分析认识氨基酸的组成、结构特点和主要化学性质,知道氨基酸、多肽和蛋白质之间的关系能判断氨基酸缩合产物和多肽的水解产物;
2.认识蛋白质的组成和性质特点,能辨识蛋白质结构中的肽键,能说明蛋白质的基本结构特点;
3.认识蛋白质空间结构的复杂性和种类的多样性,了解酶催化反应的特点。
一、氨基酸
1.结构
(1)定义:羧酸分子烃基上的氢原子被氨基取代得到的化合物。
组成蛋白质的氨基酸主要是α-氨基酸
R—CH—COOH
NH2
α-氨基酸
(2)α-氨基酸:
氨基酸分子中含有______和_______,属于_________。
氨基
羧基
取代羧酸
(3)常见的氨基酸
谷氨酸(2-氨基戊二酸)
苯丙氨酸(2-氨基-3-苯基丙酸)
半胱氨酸(2-氨基-3-巯基丙酸)
丙氨酸(α-氨基丙酸)
除甘氨酸外,一般α 氨基酸中含手性碳原子,是手性分子,具有对映异构体。
H2N—CH2—COOH
甘氨酸(氨基乙酸)
CH3—CH—COOH
NH2
HOOC—(CH2)2CH—COOH
NH2
CH2—CH—COOH
NH2
—
HS—CH2—CH—COOH
NH2
(1)物理性质
2.氨基酸的性质
谷氨酸单钠盐
味精
根据以上氨基酸结构简式中所含有的宫能团,推测氨基酸可能具有哪些化学性质。
天然氨基酸均为无色晶体,熔点较高,多在200~300℃熔化时分解。
一般能溶于水,而难溶于乙醇、乙醚等有机溶剂。
(2)化学性质
①两性
氨基酸分子中含有酸性基团—COOH和碱性基团—NH2,因此氨基酸是两性化合物,能与酸、碱反应生成盐。
a.与盐酸的反应:
b.与氢氧化钠反应:
R—CH—COOH+NaOH
NH2
R—CH—COONa+H2O
NH2
R—CH—COOH+HCl
NH2
R—CH—COOH
NH3Cl
②成肽反应
两个氨基酸分子(可以相同,也可以不同)在一定条件下,通过氨基与羧基间缩合脱去水,形成含有肽键 的化合物,发生成肽反应。
成肽反应是分子间脱水反应,属于取代反应
一定条件下
H2N—CH—C—OH
R
O
H—N—CH—COOH
R1
H
+
二肽
O
H2N—CH—C
R
—N—CH—COOH
R1
H
+H2O
酸脱羟基,氨脱氢
缩合
两分子氨基酸
二肽
+氨基酸
缩合
三肽
+氨基酸
缩合
多肽
多肽的性质: 因肽键的存在, 多肽能进行水解
蛋白质
肽链
链状
盘曲、折叠
相互结合
Mr>10000
O
H2N—CH—C
R
—N—CH—C
R1
H
—N—CH—C—
R2
H
O
—N—CH—C—OH
Rn
H
O
…
O
二、蛋白质
1.定义与组成
蛋白质是由多种氨基酸通过肽键等相互连接形成的一类生物大分子,是一般细胞中含量最多的有机分子。主要由C、H、O、N、S等元素组成,有些蛋白质还含有P、Fe、Zn、Cu等元素。是一种天然有机高分子化合物,蛋白质相对分子质量的变化范围很大,从数万一直到数千万不等,通常所说的蛋白质是混合物。
各种蛋白质都有其特殊功能和活性,这不仅取决于取决于组成多肽链的氨基酸种类、数目及排列顺序,还与其特定的空间结构密切相关。
2.蛋白质的结构
任何一种蛋白质分子在天然状态下均具有独特而稳定的结构,这是蛋白质分子结构中最显著的特征,蛋白质分子中含有未缩合的羧基和氨基;天然蛋白质的结构分为:一级结构、二级结构、三级结构、四级结构。
一级结构:氨基酸单体的排列顺序
①一级结构是蛋白质高级结构的基础,对蛋白质的性质和功能起决定性作用。
血红蛋白分子
缬氨酸
谷氨酸
镰状细胞贫血
一级结构
②肽键中的氧原子与氢原子之间存在氢键,会使肽链盘绕或折叠成特定的空间结构,形成蛋白质的二级结构
③肽链在二级结构基础上还会进一步盘曲折叠,形成更复杂的三级结构
④多个具有特定三级结构的多肽链通过非共价键相互作用(如氢键等)排列组装,形成蛋白质的四级结构。
二级结构
三级结构
四级结构
氢键
3.蛋白质的主要性质
蛋白质的多肽由多个氨基酸缩合形成,在多肽链的两端必然存在着自由的氨基与羧基,同时侧链中也往往存在酸性或碱性基团。因此,蛋白质既能与酸反应,又能与碱反应。
(1)两性
(2)水解
H2N—CH—C—OH
R
O
H—N—CH—COOH
R1
H
+
酸、碱或酶
O
H2N—CH—C
R
—N—CH—COOH
R1
H
+H2O
蛋白质
水解
蛋白酶
人体需要的蛋白质
多肽
氨基酸
水解
吸收进入血液
重新合成
(3)盐析
少量的某些可溶性盐(如硫酸铵、硫酸钠、氯化钠等)能促进蛋白质的溶解。但当这些盐在蛋白质溶液中达到一定浓度时,反而使蛋白质的溶解度降低而使其从溶液中析出,这种作用称为盐析。
视频
加入饱和(NH4)2SO4溶液,试管内产生白色沉淀,加入蒸馏水后沉淀溶解。
【实验现象】
盐析是可逆过程,不影响蛋白质的活性;多次盐析和溶解,可分离提纯蛋白质
适用范围: 易溶于水的蛋白质,不溶性蛋白质没有盐析的性质
三支试管内均产生白色沉淀,加入蒸馏水后沉淀不溶解。
(4)变性
在某些物理或化学因素的影响下,蛋白质的性质和生理功能发生改变的现象。
物理因素:加热、加压、搅拌、振荡、紫外线和放射线、超声波等
化学因素:强酸、强碱、重金属盐、乙醇、甲醛、丙酮等
变性会使蛋白质的结构发生变化,使其失去原有的生理活性,在水中不能重新溶解,是不可逆过程
视频
【实验现象】
思考与讨论
Ⅰ.因误服铅、汞等重金属盐中毒的患者在急救时,为什么可口服牛奶、蛋清或豆浆?
Ⅱ.为什么紫外线可用于环境和物品消毒,放射线可用于医疗器械灭菌?
误食重金属盐会导致人体内的蛋白质发生变性而使人中毒。因此,急救通过口服牛奶、蛋清和豆浆等富含蛋白质的物质进行解毒的原理是使重金属盐与牛奶、蛋清和豆浆中的蛋白质发生变性作用,从而减轻重金属盐对人体的危害。
紫外线和放射线也可以使蛋白质发生变性,因此可使用紫外线和放射线对环境、物品和医疗器械等进行消毒,使细菌和病毒中的蛋白质发生变性而使其死亡。
(5)显色反应
视频
加入浓硝酸后产生白色沉淀,加热后沉淀变黄色
含有苯环的蛋白质遇到浓硝酸呈黄色,可用于蛋白质的分析检测。
天然蛋白质都含苯环,如皮肤、指甲遇浓硝酸变黄色。
【实验现象】
(6)蛋白质灼烧有类似烧焦羽毛的气味
一般生成CO2、H2O、N2、SO2、P2O5等物质,用于鉴别人造羊毛或人造棉与纯羊毛或真丝制品
1.定义
一类由细胞产生的,对生物体内的化学反应具有催化作用的有机物,其中绝大多数是蛋白质。
三、酶
2.酶催化作用具有的特点
(1)条件温和,不需加热——在接近体温和接近中性的条件下
(2)具有高度的专一性——每种酶只催化一种或一类化合物的化学反应
(3)具有高效催化作用——相当于无机催化剂的107~1013倍
【注意】使用酶作催化剂时,反应温度不能过高,原因是高温下蛋白质变性,酶失去催化活性。
3.酶的应用:
(1)淀粉酶应用于食品、发酵、纺织、制药等工业;
(2)蛋白酶应用于医药、制革等工业;
(3)脂肪酶应用于脂肪水解、羊毛脱脂等;
(4)酶还可用于疾病的诊断。
[练一练]
1.判断正误
(1)氨基酸是一种既能与强碱反应又能与强酸反应的有机高分子。 ( )
(2)酶的催化作用是温度越高越好。( )
(3)蛋白质遇浓硝酸都会显黄色。( )
(4)氨基酸能发生酯化反应、成肽反应和水解反应。( )
(5)酶均是蛋白质,是体内反应的催化剂。( )
2.下列关于氨基酸的叙述中,不正确的是( )
A.天然氨基酸都是晶体,一般能溶于水
B.氨基酸都不能发生水解反应
C.氨基酸是两性化合物,能与酸、碱反应生成盐
D.氨基酸的官能团有氨基和羟基
D
3.下列关于乙肝病毒的主要成分的说法不正确的是( )
A.属于高分子
B.水解的最终产物能与酸或碱反应
C.遇浓硝酸会变性
D.水解时碳氧键断裂
D
4.青霉素是一种良效广谱抗生素,经酸性水解后得到青霉素氨基酸分子的结构简式如图,下列关于该物质的叙述不正确的是 ( )
A.属于α-氨基酸
B.能发生加聚反应生成多肽
C.核磁共振氢谱上共有5个峰
D.青霉素过敏严重者会导致死亡,用药前一定要进行皮肤敏感试验
B
5.下列物质中可以使蛋白质变性的是( )
①福尔马林 ②酒精 ③高锰酸钾溶液 ④硫酸铵溶液 ⑤硫酸铜溶液 ⑥双氧水 ⑦硝酸
A.除④⑦外 B.除③⑥外 C.①②⑤ D.除④外
D
水解
缩聚
蛋白质
氨基酸
蛋白质
酶
官能团
结构
性质
两性
水解
盐析
变性
显色反应
灼烧有类似烧焦羽毛的气味
高效生物催化剂
高效性、专一性、适宜条件
羧基
氨基
能与碱反应
能与酸反应
成肽反应
