化学人教版(2019)必修第一册4.3化学键 课件(共32张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3化学键 课件(共32张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 09:51:15 | ||
图片预览




文档简介
(共32张PPT)
固态
液态
气态
分子间存在作用力
分子内部也有作用力
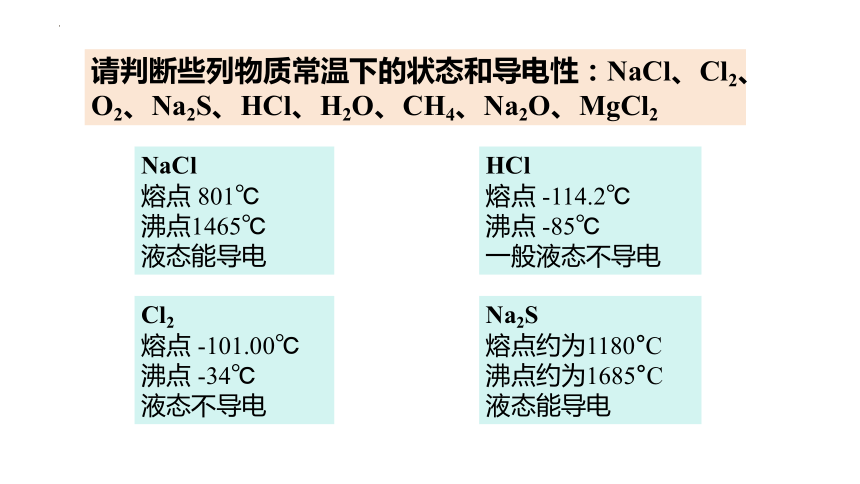
请判断些列物质常温下的状态和导电性:NaCl、Cl2、O2、Na2S、HCl、H2O、CH4、Na2O、MgCl2
NaCl
熔点 801℃
沸点1465℃
液态能导电
HCl
熔点 -114.2℃
沸点 -85℃
一般液态不导电
Cl2
熔点 -101.00℃
沸点 -34℃
液态不导电
Na2S
熔点约为1180°C
沸点约为1685°C
液态能导电
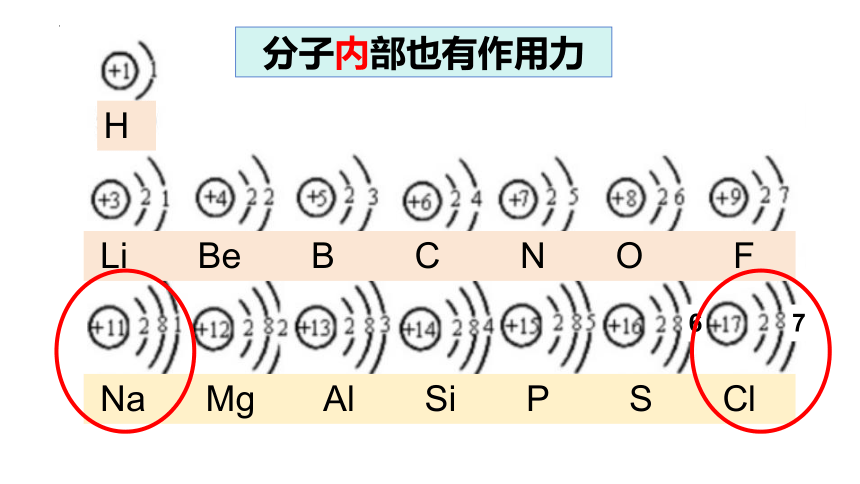
Na Mg Al Si P S Cl
Li Be B C N O F
H
6
7
分子内部也有作用力
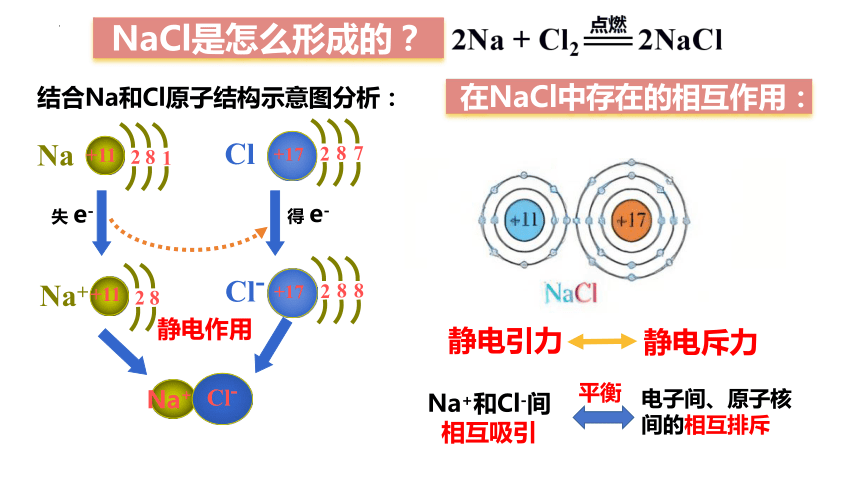
从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
剧烈燃烧,产生黄色火焰
NaCl是怎么形成的?
结合Na和Cl原子结构示意图分析:
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
失 e-
得 e-
静电作用
Na+
+11
8
2
Na+和Cl-间 相互吸引
电子间、原子核间的相互排斥
平衡
静电引力
在NaCl中存在的相互作用:
静电斥力
Cl-
+17
8
8
2
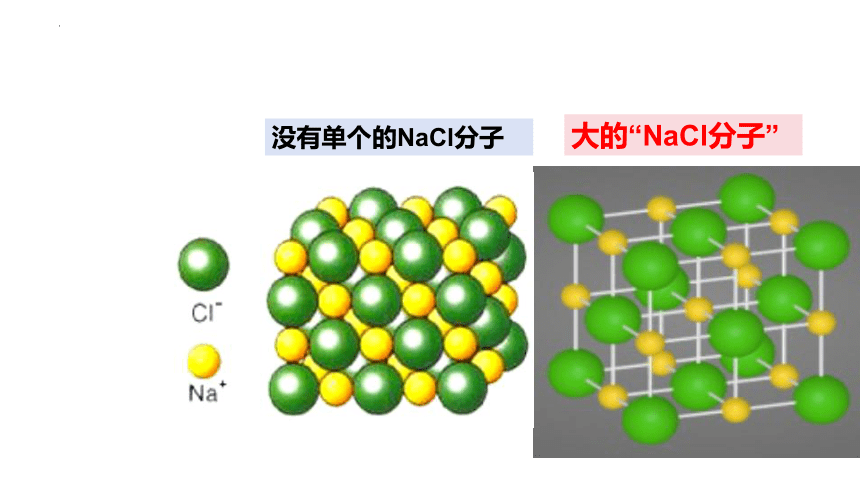
没有单个的NaCl分子
大的“NaCl分子”
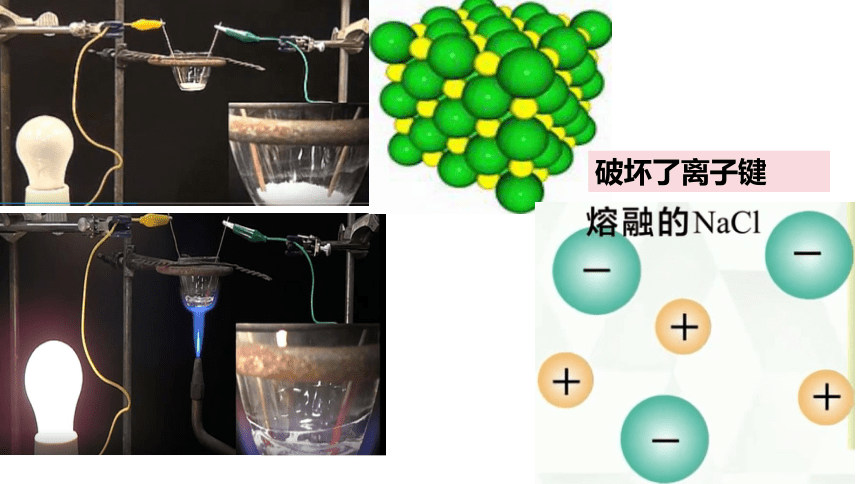
破坏了离子键
一、离子键Ionic Bond
1.定 义:
阴、阳离子之间的静电作用叫做离子键。
成键微粒
成键本质
静电引力
静电斥力
电子得失
原子
由离子键构成的化合物叫做离子化合物。
离子化合物:
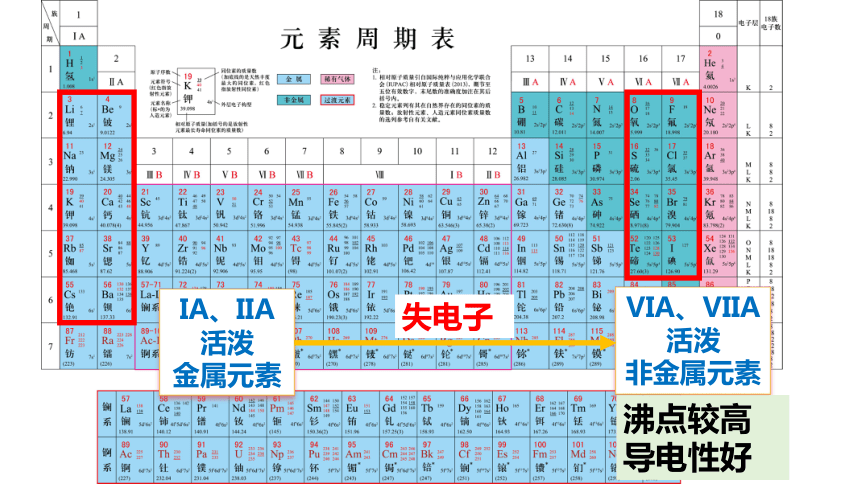
IA、IIA活泼
金属元素
VIA、VIIA活泼
非金属元素
失电子
沸点较高导电性好
1、原子:
H
O
Cl
Mg
Na
在元素符号周围用小点 (或×)来表示原子的最外层电子,这种式子叫电子式。
二、电子式
书写:力求均匀、对称,分上、下、左、右四个方向,
每个方向不超过两个电子
写锂原子、钙原子、硫原子、氮原子的电子式。
练习
主族元素价电子即为最外层电子
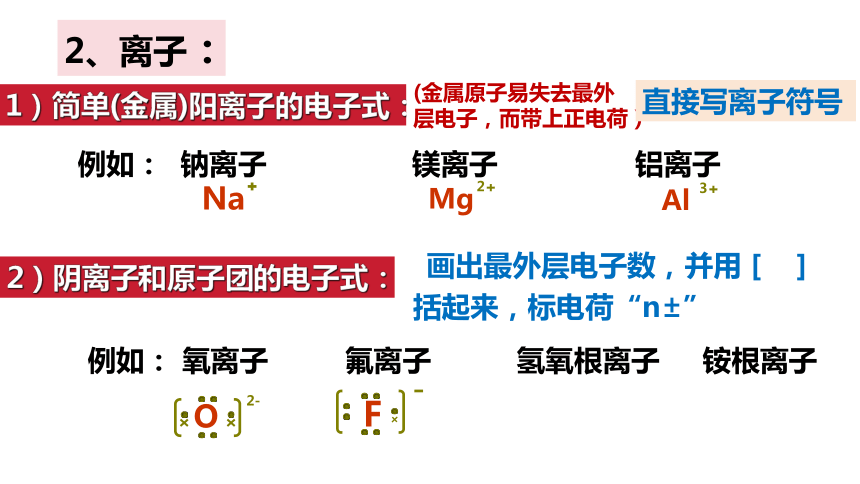
1)简单(金属)阳离子的电子式:
画出最外层电子数,并用[ ]括起来,标电荷“n±”
2、离子:
Mg
2
O
2-
Na
F
Al
3
例如: 钠离子 镁离子 铝离子
2)阴离子和原子团的电子式:
例如: 氧离子 氟离子 氢氧根离子 铵根离子
(金属原子易失去最外层电子,而带上正电荷)
直接写离子符号
3、离子化合物的电子式
Cl
K
K
O
2-
K
Cl
Ca
2
Cl
写出氯化钾、氧化钾、氯化钙的电子式。
练习
氯化钠、氧化钙:
氧化钠:
氯化镁:
Na Mg Al Si P S Cl
Li Be B C N O F
H
6
7
分子内部也有作用力
得失电子达到最外层8电子的稳定结构
HCl分子是通过什么方式结合的呢?
【思考】
+1
+17
H2+Cl2===2HCl
点燃
+17
+1
为什么1个H原子和1个Cl原子结合成HCl分子,而不是以其他的个数比结合呢?
原子与原子之间的相互作用叫做共价键。
1个共用电子对
孤电子对
为什么1个H原子和1个Cl原子结合成HCl分子,而不是以其他的个数比结合呢?
Cl2
+17
+17
+17
+1
HCl
八隅律(8电子规则):原子最外层电子达到8电子的结构(稀有气体的电子层结构),即趋于稳定
H2、O2、CH4、HCl、H2O、 CO2 、NH3各有多少共用电子对?
4、共价键形成的分子的电子式
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
过氧化氢
甲烷
二氧化碳
氮气
沸点较低
导电性差
以共用电子对形成分子的化合物,叫共价化合物
共价键形成的分子的结构式
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
过氧化氢
甲烷
二氧化碳
氮气
O =C=O
H—H
H-C-H
H
H
H—Cl
Cl—Cl
H—O—H
H—O—O—H
1 根短线“—”表示一对共用电子
IA、IIA活泼
金属元素
VIA、VIIA活泼
非金属元素
电子
多为离子键形成的离子化合物
H:+1价 共价键
-1价 离子键
沸点较高导电性好
沸点较低
导电性差
离子化合物和共价化合物的判定
八隅律(8电子规则):原子最外层电子(得失或共用电子)达到8电子的结构(稀有气体的电子层结构),即趋于稳定。
多为共价键形成的是共价化合物
判断以下哪些物质含有离子键、共价键?
属于离子化合物还是共价化合物?
NaBr HCl MgO CO2 BaCl2 H2O AlCl3 SO3 NaH HClO NaOH Na2O2 NH4Cl NH4NO3
H2SO4 KNO3 H2S NaClO Cl2
电子式:
结构式:H—O—Cl
【思考】
H2中H元素化合价为O,HCl中为什么H显+1价 ,Cl显-1价
Cl
··
··
H
··
··
H H
··
·· ··
.Cl
:
H
共用电子对偏移
+1 -1
极性共价键
五、共价键的分类
Cl 原子
吸引力强
H
H
.
非极性共价键
共用电子对不偏移
吸引力
大小相等
H2中H元素化合价为O,HCl中为什么H显+1价 ,Cl显-1价
Cl
··
··
H
··
··
H H
··
化学键 Chemical Bond
使离子相结合或原子相结合的作用力叫做
化学键(bond)。
离子化合物的形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化钙的形成过程
Na ·
+
→
[ Cl ]-
··
··
:
:
Na+
Br ·
··
··
:
·Ca·
Br :
··
··
.
+
+
→
Cl
··
··
·
..
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
书 写 要 点
1.原子:要标出最外层电子;
2.阴离子:用【 】,标电荷;
3.箭头右边相同的离子不能合并;
4.不能把“→”写成“=”;
5.用箭头 标明电子转移方向。
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
共价键的形成过程表示
★ 二氧化碳分子的形成:
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· C ·
·
·
+
··
· O ·
··
2
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
NaCl晶体
熔融NaCl
不导电
导电
破坏离子键
物理变化
通
电
Na 和Cl2
化学变化
溶
于
水
NaCl溶液
破坏离子键
导电
物理变化
形成金属键、非极性键
分析氯化钠晶体的变化
离子化合物
分析HCl溶于水的变化
HCl
不导电
溶
于
水
HCl溶液
破坏共价键
导电
物理变化
固态
液态
气态
水分子间存在作用力,水分子内部也有作用力
破坏了分子间作用力
水分子间存在氢键(冰具有规整的结构)
分析HCl状态的变化
HCl(g)
不导电
溶
于
水
HCl溶液
破坏共价键
和分子间作用力
导电
物理变化
HCl(l)
破坏分子间作用力
物理变化
HCl(s)
破坏分子间作用力
NaCl晶体
熔融NaCl
不导电
导电
破坏离子键
物理变化
通
电
Na 和Cl2
化学变化
溶
于
水
NaCl溶液
破坏离子键
导电
物理变化
形成金属键、非极性键
分析氯化钠晶体的变化
分析HCl、金属Na溶于水的变化
化学反应的实质:有旧化学键的断裂,新化学键的形成
吸收热量
释放热量
热量的变化
固态
液态
气态
分子间存在作用力
分子内部也有作用力
请判断些列物质常温下的状态和导电性:NaCl、Cl2、O2、Na2S、HCl、H2O、CH4、Na2O、MgCl2
NaCl
熔点 801℃
沸点1465℃
液态能导电
HCl
熔点 -114.2℃
沸点 -85℃
一般液态不导电
Cl2
熔点 -101.00℃
沸点 -34℃
液态不导电
Na2S
熔点约为1180°C
沸点约为1685°C
液态能导电
Na Mg Al Si P S Cl
Li Be B C N O F
H
6
7
分子内部也有作用力
从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
剧烈燃烧,产生黄色火焰
NaCl是怎么形成的?
结合Na和Cl原子结构示意图分析:
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
失 e-
得 e-
静电作用
Na+
+11
8
2
Na+和Cl-间 相互吸引
电子间、原子核间的相互排斥
平衡
静电引力
在NaCl中存在的相互作用:
静电斥力
Cl-
+17
8
8
2
没有单个的NaCl分子
大的“NaCl分子”
破坏了离子键
一、离子键Ionic Bond
1.定 义:
阴、阳离子之间的静电作用叫做离子键。
成键微粒
成键本质
静电引力
静电斥力
电子得失
原子
由离子键构成的化合物叫做离子化合物。
离子化合物:
IA、IIA活泼
金属元素
VIA、VIIA活泼
非金属元素
失电子
沸点较高导电性好
1、原子:
H
O
Cl
Mg
Na
在元素符号周围用小点 (或×)来表示原子的最外层电子,这种式子叫电子式。
二、电子式
书写:力求均匀、对称,分上、下、左、右四个方向,
每个方向不超过两个电子
写锂原子、钙原子、硫原子、氮原子的电子式。
练习
主族元素价电子即为最外层电子
1)简单(金属)阳离子的电子式:
画出最外层电子数,并用[ ]括起来,标电荷“n±”
2、离子:
Mg
2
O
2-
Na
F
Al
3
例如: 钠离子 镁离子 铝离子
2)阴离子和原子团的电子式:
例如: 氧离子 氟离子 氢氧根离子 铵根离子
(金属原子易失去最外层电子,而带上正电荷)
直接写离子符号
3、离子化合物的电子式
Cl
K
K
O
2-
K
Cl
Ca
2
Cl
写出氯化钾、氧化钾、氯化钙的电子式。
练习
氯化钠、氧化钙:
氧化钠:
氯化镁:
Na Mg Al Si P S Cl
Li Be B C N O F
H
6
7
分子内部也有作用力
得失电子达到最外层8电子的稳定结构
HCl分子是通过什么方式结合的呢?
【思考】
+1
+17
H2+Cl2===2HCl
点燃
+17
+1
为什么1个H原子和1个Cl原子结合成HCl分子,而不是以其他的个数比结合呢?
原子与原子之间的相互作用叫做共价键。
1个共用电子对
孤电子对
为什么1个H原子和1个Cl原子结合成HCl分子,而不是以其他的个数比结合呢?
Cl2
+17
+17
+17
+1
HCl
八隅律(8电子规则):原子最外层电子达到8电子的结构(稀有气体的电子层结构),即趋于稳定
H2、O2、CH4、HCl、H2O、 CO2 、NH3各有多少共用电子对?
4、共价键形成的分子的电子式
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
过氧化氢
甲烷
二氧化碳
氮气
沸点较低
导电性差
以共用电子对形成分子的化合物,叫共价化合物
共价键形成的分子的结构式
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
过氧化氢
甲烷
二氧化碳
氮气
O =C=O
H—H
H-C-H
H
H
H—Cl
Cl—Cl
H—O—H
H—O—O—H
1 根短线“—”表示一对共用电子
IA、IIA活泼
金属元素
VIA、VIIA活泼
非金属元素
电子
多为离子键形成的离子化合物
H:+1价 共价键
-1价 离子键
沸点较高导电性好
沸点较低
导电性差
离子化合物和共价化合物的判定
八隅律(8电子规则):原子最外层电子(得失或共用电子)达到8电子的结构(稀有气体的电子层结构),即趋于稳定。
多为共价键形成的是共价化合物
判断以下哪些物质含有离子键、共价键?
属于离子化合物还是共价化合物?
NaBr HCl MgO CO2 BaCl2 H2O AlCl3 SO3 NaH HClO NaOH Na2O2 NH4Cl NH4NO3
H2SO4 KNO3 H2S NaClO Cl2
电子式:
结构式:H—O—Cl
【思考】
H2中H元素化合价为O,HCl中为什么H显+1价 ,Cl显-1价
Cl
··
··
H
··
··
H H
··
·· ··
.Cl
:
H
共用电子对偏移
+1 -1
极性共价键
五、共价键的分类
Cl 原子
吸引力强
H
H
.
非极性共价键
共用电子对不偏移
吸引力
大小相等
H2中H元素化合价为O,HCl中为什么H显+1价 ,Cl显-1价
Cl
··
··
H
··
··
H H
··
化学键 Chemical Bond
使离子相结合或原子相结合的作用力叫做
化学键(bond)。
离子化合物的形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化钙的形成过程
Na ·
+
→
[ Cl ]-
··
··
:
:
Na+
Br ·
··
··
:
·Ca·
Br :
··
··
.
+
+
→
Cl
··
··
·
..
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
书 写 要 点
1.原子:要标出最外层电子;
2.阴离子:用【 】,标电荷;
3.箭头右边相同的离子不能合并;
4.不能把“→”写成“=”;
5.用箭头 标明电子转移方向。
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
共价键的形成过程表示
★ 二氧化碳分子的形成:
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· C ·
·
·
+
··
· O ·
··
2
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
NaCl晶体
熔融NaCl
不导电
导电
破坏离子键
物理变化
通
电
Na 和Cl2
化学变化
溶
于
水
NaCl溶液
破坏离子键
导电
物理变化
形成金属键、非极性键
分析氯化钠晶体的变化
离子化合物
分析HCl溶于水的变化
HCl
不导电
溶
于
水
HCl溶液
破坏共价键
导电
物理变化
固态
液态
气态
水分子间存在作用力,水分子内部也有作用力
破坏了分子间作用力
水分子间存在氢键(冰具有规整的结构)
分析HCl状态的变化
HCl(g)
不导电
溶
于
水
HCl溶液
破坏共价键
和分子间作用力
导电
物理变化
HCl(l)
破坏分子间作用力
物理变化
HCl(s)
破坏分子间作用力
NaCl晶体
熔融NaCl
不导电
导电
破坏离子键
物理变化
通
电
Na 和Cl2
化学变化
溶
于
水
NaCl溶液
破坏离子键
导电
物理变化
形成金属键、非极性键
分析氯化钠晶体的变化
分析HCl、金属Na溶于水的变化
化学反应的实质:有旧化学键的断裂,新化学键的形成
吸收热量
释放热量
热量的变化
