2.3.4分子结构与物质的性质 课件(共48张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.4分子结构与物质的性质 课件(共48张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 00:00:00 | ||
图片预览





文档简介
(共48张PPT)
第三节 分子结构与物质的性质
第二章 分子结构与性质
学习
目标
PART
01
PART
02
分子的手性
·分子间的作用力
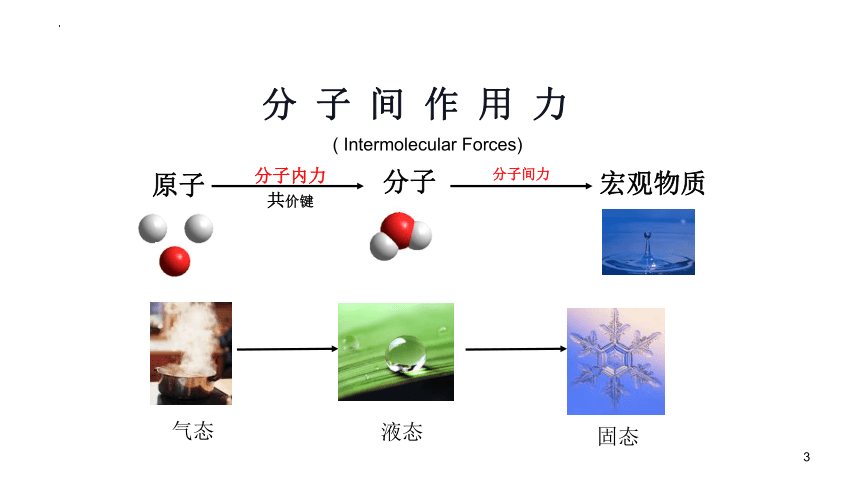
分子间力
分子内力
共价键
宏观物质
分子
原子
气态
液态
分 子 间 作 用 力
固态
( Intermolecular Forces)
3
范德华力是怎样产生的?
自然法则:电性作用
极性分子-极性分子
极性分子-非极性分子
非极性分子-非极性分子
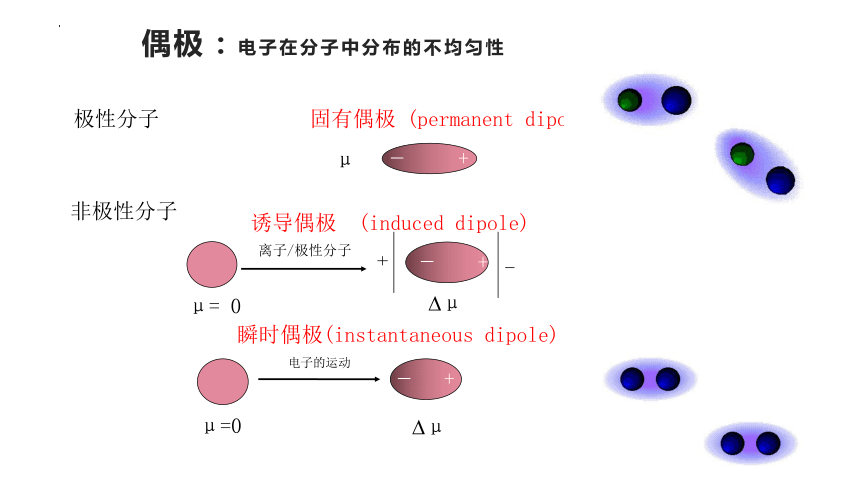
偶极:电子在分子中分布的不均匀性
瞬时偶极(instantaneous dipole)
非极性分子
μ= 0
极性分子 固有偶极 (permanent dipole)
- +
μ
- +
μ
μ=0
电子的运动
+
-
- +
μ
离子/极性分子
诱导偶极 (induced dipole)
5
分子的极性与变形性是产生范德华力的原因
范德华力是怎样产生的?
分子的形状
相对分子质量
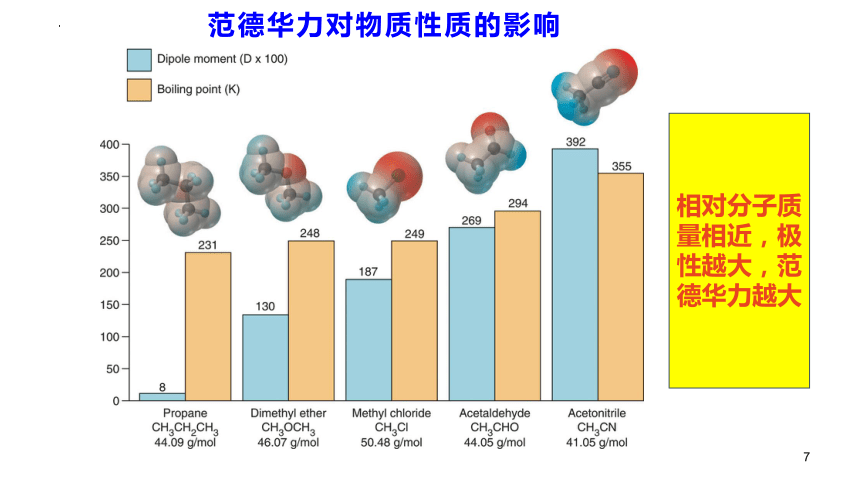
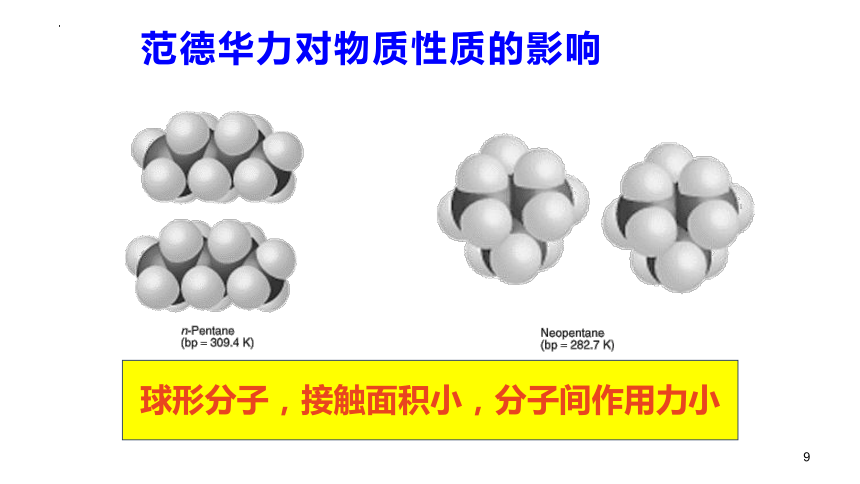
范德华力对物质性质的影响
7
相对分子质量相近,极性越大,范德华力越大
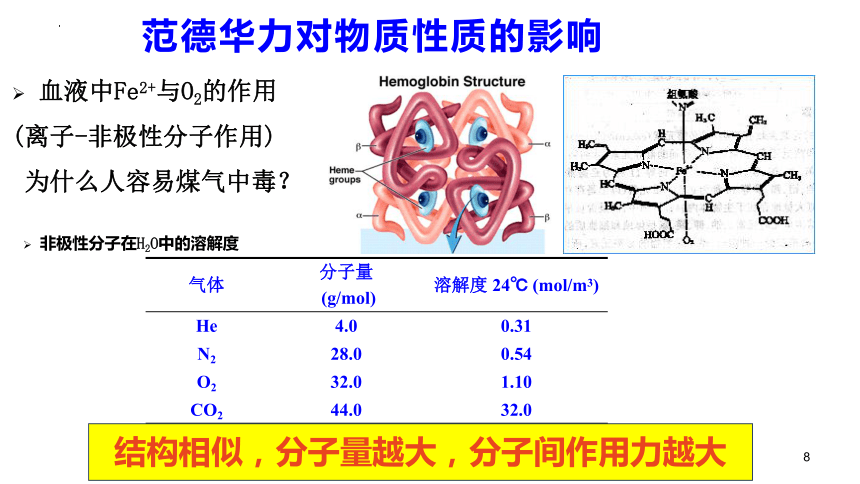
气体 分子量 (g/mol) 溶解度 24℃ (mol/m3)
He 4.0 0.31
N2 28.0 0.54
O2 32.0 1.10
CO2 44.0 32.0
血液中Fe2+与O2的作用
(离子-非极性分子作用)
为什么人容易煤气中毒?
8
范德华力对物质性质的影响
结构相似,分子量越大,分子间作用力越大
非极性分子在H2O中的溶解度
9
球形分子,接触面积小,分子间作用力小
范德华力对物质性质的影响
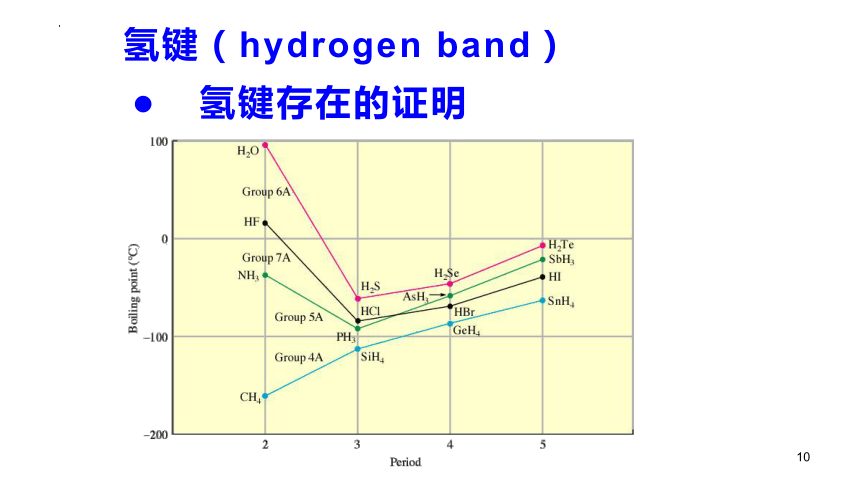
● 氢键存在的证明
氢键(hydrogen band)
10
氢键是一种特殊的分子间作用力 1936年 Pauling
氢键:
氢键:氢原子与电负性大的X原子以共价键结合以后,它还可以和另一个电负性大的X’原子产生吸引力。这种吸引力叫做氢键。
即:强极性键(X-H)上的氢核与电负性很大、含有孤对电子的原子(X’)之间的静电引力。
11
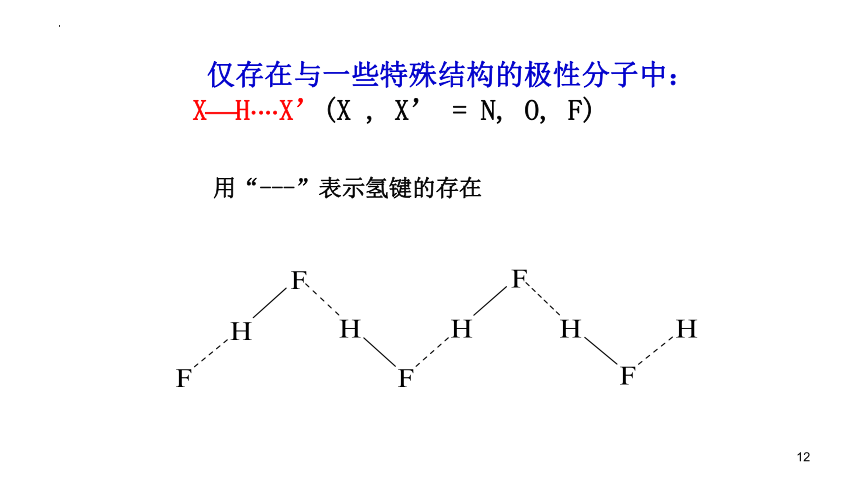
仅存在与一些特殊结构的极性分子中:
X H X’(X , X’ = N, O, F)
用“---”表示氢键的存在
12
形成氢键的两个条件:
H与X键连; 附近有另一X’原子存在
Cl原子的电负性虽然很强,但氯的原子半径也很大,所以氢键OH…Cl很弱。
13
氢键的特点:
氢键不属于化学键,也不属于范德华力,是特殊形式的分子间的作用力
氢键与共价键相同具有方向性和饱和性:
饱和性:
一般而言,分子中X-H键的每一个H只能与一个另外分子中的强电负性原子X’形成氢键。
bp: H2O > HF
14
方向性:
X-H…X’尽可能在同一直线上
X,X’斥力最小,体系最稳定
(除非有其他外力的影响,才可能改变方向)
15
03、氢键对物质性质的影响
①存在分子间氢键的物质一般具有较高的熔、沸点。
对物质熔、沸点的影响
(熔点16.6 ℃)
(熔点-42℃)
【思考与讨论】
CH3COOH
HNO3
Q:用质谱仪检测气态乙酸时,谱图中出现质荷比为120的峰
邻羟基苯甲醛(熔点-7 ℃)
对羟基苯甲醛(熔点115 ℃)
分子内氢键
分子间氢键
【思考与讨论】
②存在分子内氢键的物质一般具有较低的熔、沸点。
含有分子间氢键的液体一般黏度较大(甘油,浓硫酸)
氢键对物质性质的影响
氢键对物质性质的影响
水的熔点(℃) 水的沸点(℃) 水在0 ℃时密度(g/ml) 水在4 ℃时密度(g/ml)
0.00 100.00 0.9998 1.0000
冰的密度比液体水小?
氢键对物质密度的影响
氢键对物质性质的影响
生物大分子中的氢键
羊毛织品水洗后为什么会变形
羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原先的氢键部位可能发生移动,由此引起羊毛织品变形。
思考讨论:NH3极易溶于水,可能存在的氢键有哪些?
H N
H
H
H O
H
H N
H
H
H
H
O
H
H
H N
H N
H
H
H
H
O
H O
H
HF酸溶液中的氢键?
01、“相似相溶”规律
在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性。
在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察现象。
再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,可发生如下反应:I2+I-=I3-(无色)
【思考与讨论】
01、“相似相溶”规律
2、KI3 易溶于水,碘单质参与发生反应 。
加入 CCl4
加入 KI 溶液
振荡
振荡
实验现象:
实验结论:
1、I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
溶液分层,下层
溶液呈紫红色
溶液分层,
下层溶液紫红色变浅
溶解性
01、“相似相溶”规律
1)“相似相溶”规律
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
①Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
②盐类(NaCl等)这些离子化合物可看做是极性最强的,它们易溶于
水而不溶于CCl4、苯等非极性溶剂。
③HCl、H2SO4是强极性分子,易溶于水而难溶于CCl4。
溶解性
01、“相似相溶”规律
乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小?
“相似相溶”规律
02
影响溶解性的因素
02、影响溶解性的因素
分析下表,你能得到哪些规律,并加以解释
气体的溶解度(气体的压强为1.01×105 Pa,温度为293K,在100 g水中的溶解度)
【思考与讨论】
水是极性溶剂,根据“相似相溶”,
非极性溶质在水中的溶解度不大。
02、影响溶解性的因素
化学反应:如果溶质与水发生化学反应,可增大其溶解度。
【思考与讨论】
气体的溶解度(气体的压强为1.01×105 Pa,温度为293K,在100 g水中的溶解度)
02、影响溶解性的因素
在该表中,氨气溶解度最高。NH3是极性分子,NH3和H2O发生反应,且NH3分子和H2O分子间能形成氢键
【思考与讨论】
02、影响溶解性的因素
(1)外因:
影响固体溶解度的主要因素是温度;
“相似相溶”规律
影响溶解性的因素
影响气体溶解度的主要因素是温度;压强
02、影响溶解性的因素
(2)其他因素:
①氢键:
如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
②分子结构的相似性:
溶质和溶剂的分子结构相似程度越大,其溶解性越好,如乙醇与水互溶,而戊醇与水的溶解度要小很多。
③溶质是否与水反应:
溶质若与水发生反应会增大其溶解度,如:SO2。
影响溶解性的因素
为什么需要用乙醚来提取青蒿素,用水不可以呢?
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,
在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
CH3CH2—O—CH2CH3
乙醚
青蒿素
【思考与讨论】
03
分子的手性
03、分子的手性
1.手性异构体:具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(或对映异构体)
分子的手性
03、分子的手性
2.手性分子:有手性异构体的分子叫做手性分子。
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
镜面
分子的手性
“反应停””
03、分子的手性
手性分子形成的条件
CHFClBr
互为镜像关系的分子不能叠合,不是同种分子
绕轴旋转
不能叠合
03、分子的手性
*
*
*
酒石酸
乳酸
03、分子的手性
具有手性的有机物,是因为含有手性碳原子造成的。
如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C 。
手性分子的判断方法
03、分子的手性
HOOC—CH—OH
CH3
﹡
※
※
手性分子的判断方法
03、分子的手性
(1) 合成手性药物 (2) 合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
手性分子的应用
03、分子的手性
C
1.推测下列最适合溶解白磷(P4)的溶剂是A.水
B.CH3OHC.CS2
D.CH3COOH
A
2.在相同条件下,SO2在水中的溶解度比CO2在水中的溶解度A.大 B.小
C.一样 D.无法比较
3.将几种物质在水和四氯化碳中的溶解情况填入下表:
葡萄糖 磷酸 碘 苯
(1)水 _____ _____ _____ _____
(2)四氯化碳 _____ _____ _____ _____
易溶 易溶 难溶 难溶
难溶 难溶 易溶 易溶
第三节 分子结构与物质的性质
第二章 分子结构与性质
学习
目标
PART
01
PART
02
分子的手性
·分子间的作用力
分子间力
分子内力
共价键
宏观物质
分子
原子
气态
液态
分 子 间 作 用 力
固态
( Intermolecular Forces)
3
范德华力是怎样产生的?
自然法则:电性作用
极性分子-极性分子
极性分子-非极性分子
非极性分子-非极性分子
偶极:电子在分子中分布的不均匀性
瞬时偶极(instantaneous dipole)
非极性分子
μ= 0
极性分子 固有偶极 (permanent dipole)
- +
μ
- +
μ
μ=0
电子的运动
+
-
- +
μ
离子/极性分子
诱导偶极 (induced dipole)
5
分子的极性与变形性是产生范德华力的原因
范德华力是怎样产生的?
分子的形状
相对分子质量
范德华力对物质性质的影响
7
相对分子质量相近,极性越大,范德华力越大
气体 分子量 (g/mol) 溶解度 24℃ (mol/m3)
He 4.0 0.31
N2 28.0 0.54
O2 32.0 1.10
CO2 44.0 32.0
血液中Fe2+与O2的作用
(离子-非极性分子作用)
为什么人容易煤气中毒?
8
范德华力对物质性质的影响
结构相似,分子量越大,分子间作用力越大
非极性分子在H2O中的溶解度
9
球形分子,接触面积小,分子间作用力小
范德华力对物质性质的影响
● 氢键存在的证明
氢键(hydrogen band)
10
氢键是一种特殊的分子间作用力 1936年 Pauling
氢键:
氢键:氢原子与电负性大的X原子以共价键结合以后,它还可以和另一个电负性大的X’原子产生吸引力。这种吸引力叫做氢键。
即:强极性键(X-H)上的氢核与电负性很大、含有孤对电子的原子(X’)之间的静电引力。
11
仅存在与一些特殊结构的极性分子中:
X H X’(X , X’ = N, O, F)
用“---”表示氢键的存在
12
形成氢键的两个条件:
H与X键连; 附近有另一X’原子存在
Cl原子的电负性虽然很强,但氯的原子半径也很大,所以氢键OH…Cl很弱。
13
氢键的特点:
氢键不属于化学键,也不属于范德华力,是特殊形式的分子间的作用力
氢键与共价键相同具有方向性和饱和性:
饱和性:
一般而言,分子中X-H键的每一个H只能与一个另外分子中的强电负性原子X’形成氢键。
bp: H2O > HF
14
方向性:
X-H…X’尽可能在同一直线上
X,X’斥力最小,体系最稳定
(除非有其他外力的影响,才可能改变方向)
15
03、氢键对物质性质的影响
①存在分子间氢键的物质一般具有较高的熔、沸点。
对物质熔、沸点的影响
(熔点16.6 ℃)
(熔点-42℃)
【思考与讨论】
CH3COOH
HNO3
Q:用质谱仪检测气态乙酸时,谱图中出现质荷比为120的峰
邻羟基苯甲醛(熔点-7 ℃)
对羟基苯甲醛(熔点115 ℃)
分子内氢键
分子间氢键
【思考与讨论】
②存在分子内氢键的物质一般具有较低的熔、沸点。
含有分子间氢键的液体一般黏度较大(甘油,浓硫酸)
氢键对物质性质的影响
氢键对物质性质的影响
水的熔点(℃) 水的沸点(℃) 水在0 ℃时密度(g/ml) 水在4 ℃时密度(g/ml)
0.00 100.00 0.9998 1.0000
冰的密度比液体水小?
氢键对物质密度的影响
氢键对物质性质的影响
生物大分子中的氢键
羊毛织品水洗后为什么会变形
羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原先的氢键部位可能发生移动,由此引起羊毛织品变形。
思考讨论:NH3极易溶于水,可能存在的氢键有哪些?
H N
H
H
H O
H
H N
H
H
H
H
O
H
H
H N
H N
H
H
H
H
O
H O
H
HF酸溶液中的氢键?
01、“相似相溶”规律
在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性。
在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察现象。
再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,可发生如下反应:I2+I-=I3-(无色)
【思考与讨论】
01、“相似相溶”规律
2、KI3 易溶于水,碘单质参与发生反应 。
加入 CCl4
加入 KI 溶液
振荡
振荡
实验现象:
实验结论:
1、I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
溶液分层,下层
溶液呈紫红色
溶液分层,
下层溶液紫红色变浅
溶解性
01、“相似相溶”规律
1)“相似相溶”规律
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
①Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
②盐类(NaCl等)这些离子化合物可看做是极性最强的,它们易溶于
水而不溶于CCl4、苯等非极性溶剂。
③HCl、H2SO4是强极性分子,易溶于水而难溶于CCl4。
溶解性
01、“相似相溶”规律
乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小?
“相似相溶”规律
02
影响溶解性的因素
02、影响溶解性的因素
分析下表,你能得到哪些规律,并加以解释
气体的溶解度(气体的压强为1.01×105 Pa,温度为293K,在100 g水中的溶解度)
【思考与讨论】
水是极性溶剂,根据“相似相溶”,
非极性溶质在水中的溶解度不大。
02、影响溶解性的因素
化学反应:如果溶质与水发生化学反应,可增大其溶解度。
【思考与讨论】
气体的溶解度(气体的压强为1.01×105 Pa,温度为293K,在100 g水中的溶解度)
02、影响溶解性的因素
在该表中,氨气溶解度最高。NH3是极性分子,NH3和H2O发生反应,且NH3分子和H2O分子间能形成氢键
【思考与讨论】
02、影响溶解性的因素
(1)外因:
影响固体溶解度的主要因素是温度;
“相似相溶”规律
影响溶解性的因素
影响气体溶解度的主要因素是温度;压强
02、影响溶解性的因素
(2)其他因素:
①氢键:
如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
②分子结构的相似性:
溶质和溶剂的分子结构相似程度越大,其溶解性越好,如乙醇与水互溶,而戊醇与水的溶解度要小很多。
③溶质是否与水反应:
溶质若与水发生反应会增大其溶解度,如:SO2。
影响溶解性的因素
为什么需要用乙醚来提取青蒿素,用水不可以呢?
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,
在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
CH3CH2—O—CH2CH3
乙醚
青蒿素
【思考与讨论】
03
分子的手性
03、分子的手性
1.手性异构体:具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(或对映异构体)
分子的手性
03、分子的手性
2.手性分子:有手性异构体的分子叫做手性分子。
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
镜面
分子的手性
“反应停””
03、分子的手性
手性分子形成的条件
CHFClBr
互为镜像关系的分子不能叠合,不是同种分子
绕轴旋转
不能叠合
03、分子的手性
*
*
*
酒石酸
乳酸
03、分子的手性
具有手性的有机物,是因为含有手性碳原子造成的。
如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C 。
手性分子的判断方法
03、分子的手性
HOOC—CH—OH
CH3
﹡
※
※
手性分子的判断方法
03、分子的手性
(1) 合成手性药物 (2) 合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
手性分子的应用
03、分子的手性
C
1.推测下列最适合溶解白磷(P4)的溶剂是A.水
B.CH3OHC.CS2
D.CH3COOH
A
2.在相同条件下,SO2在水中的溶解度比CO2在水中的溶解度A.大 B.小
C.一样 D.无法比较
3.将几种物质在水和四氯化碳中的溶解情况填入下表:
葡萄糖 磷酸 碘 苯
(1)水 _____ _____ _____ _____
(2)四氯化碳 _____ _____ _____ _____
易溶 易溶 难溶 难溶
难溶 难溶 易溶 易溶
