专题2《化学反应速率与化学平衡》(含解析)单元检测题2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》(含解析)单元检测题2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 847.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 19:45:19 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》
一、单选题(共13题)
1.下列现象或事实可用同一原理解释的是
A.乙烯能使酸性高锰酸钾溶液和溴水褪色
B.H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率
C.次氯酸和二氧化硫都具有漂白作用,能使品红溶液褪色
D.二氧化硅在氢氟酸,氢氧化钠溶液中都能溶解
2.在一定温度下,只改变起始时反应物中,对反应的影响如图所示,下列说法正确的是
A.b点时与的物质的量之比约为2∶1
B.a、b、c点均为平衡点,且b点时的转化率最大
C.平衡常数:
D.反应速率:
3.已如反应X(g)+Y(g)R(g)+Q(g)的平衡常数与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.2molX和0.8molY,反应初始4s内v(X)=0.005mol/(L s)。下列说法正确的是
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
A.4s时容器内c(Y)=0.78mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.830℃时,待反应达平衡后,再向容器中充入0.2molX和0.8molY,再次平衡后,n(R):n(Q)<1
4.一定温度下,在恒容密闭容器中,将10molCO和一定量的H2S混合加热,发生反应 ,达到平衡后CO的物质的量为8mol。下列说法错误的是
A.的平衡转化率为80%
B.反应前的物质的量为7mol
C.通入后,正反应速率突然增大后又减小
D.升高温度,浓度增加,表明该反应是放热反应
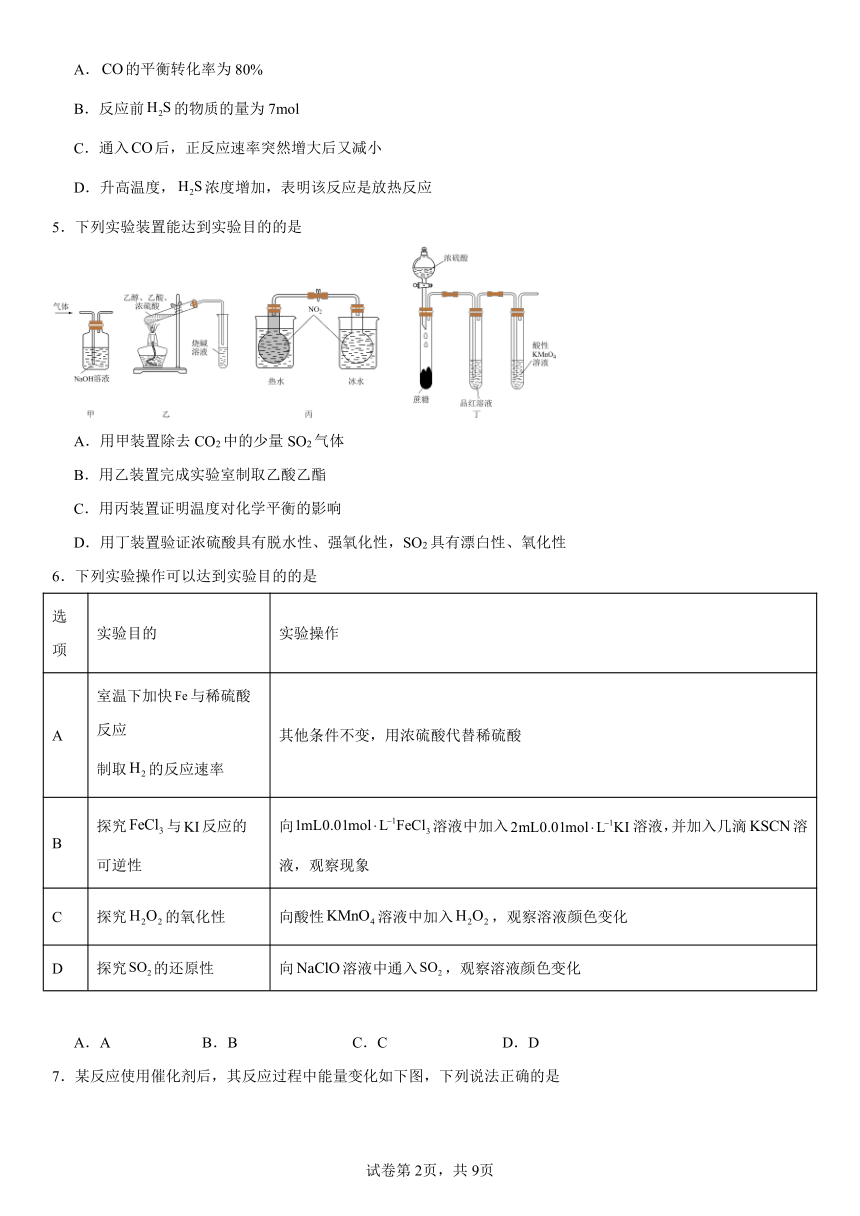
5.下列实验装置能达到实验目的的是
A.用甲装置除去CO2中的少量SO2气体
B.用乙装置完成实验室制取乙酸乙酯
C.用丙装置证明温度对化学平衡的影响
D.用丁装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性
6.下列实验操作可以达到实验目的的是
选项 实验目的 实验操作
A 室温下加快与稀硫酸反应 制取的反应速率 其他条件不变,用浓硫酸代替稀硫酸
B 探究与反应的可逆性 向溶液中加入溶液,并加入几滴溶液,观察现象
C 探究的氧化性 向酸性溶液中加入,观察溶液颜色变化
D 探究的还原性 向溶液中通入,观察溶液颜色变化
A.A B.B C.C D.D
7.某反应使用催化剂后,其反应过程中能量变化如下图,下列说法正确的是
A.使用催化剂可以加快反应速率的原因是提高了反应的活化能
B.使用催化剂后,不变
C.反应①是放热反应,反应②是吸热反应
D.
8.温度为T时,在2 L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
C.反应进行的前3 min内,用X表示的反应速率v(X)=0.1 mol·L-1·min-1
D.保持其他条件不变,升高温度,平衡逆向移动
9.下列说法中正确的是
A.非自发反应在任何条件下都不能实现
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.知道了某过程有自发性之后,可预测过程发生反应的快慢
D.熵增加且放热的反应一定是自发反应
10.一定条件下,密闭容器中投入少量的粗镍和气体(假设固体杂质不和反应)模拟羰基化法精炼镍的实验:。反应时间和容器中气体总物质的量关系如图所示。下列分析正确的是
A.如升温,该反应逆反应速率增大,正反应速率减小
B.0~t1时刻平均反应速率:
C.t1时刻到达平衡,且剩余固体均为杂质
D.t1时刻后,降温,平衡常数会减小
11.乙酸甲酯转化为乙醇的反应原理为CH3COOCH3(g)+2H2(g) C2H5OH(g)+CH3OH(g) ΔH<0。该反应中反应速率随时间变化的关系如图所示,t1、t3、t4时刻分别改变某一外界条件。下列说法错误的是
A.t1时升高温度
B.t3时加入催化剂
C.t4时增大反应容器的容积,使体系压强减小
D.在反应保持化学平衡的时间段中,C2H5OH的体积分数最小的时间段是t2~t3
12.某实验小组为研究黄铜(Cu—Zn合金)的抗腐蚀性能,进行了系列实验,结果如下:
实验 0~1h 1h 2h
1 6mol/L盐酸 无气泡产生
2 3mol/L硫酸 无气泡产生 黄铜表面出现少量小气泡,反应缓慢 黄铜表面小气泡数量增加不明显,反应缓慢
3 6mol/L硝酸 2min时出现较多气泡,反应迅速进行;10min时出现明显的红棕色气体 溶液变为蓝色,反应持续进行,但不剧烈 溶液变为蓝色,反应持续进行,较为缓慢
4 2mol/L硝酸 黄铜表面出现少量小气泡,反应缓慢 溶液出现淡蓝色,反应缓慢 溶液出现淡蓝色,反应缓慢
4 浓硝酸 反应物接触后迅速反应,反应剧烈,产生大量红棕色气体,溶液变为深蓝色
依据上述实验,所得结论不正确的是
A.实验1、2、3中反应速率不同,与溶液中阴离子种类有关
B.可用稀硫酸溶解黄铜以测定铜的质量分数
C.硝酸与黄铜反应的速率随硝酸浓度增大而加快
D.黄铜在稀硫酸中有较强的抗腐蚀性能,说明其结构与简单Cu—Zn混合物不同
13.在2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,该反应的平衡常数为25L2/mol2
B.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(L·min)
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
二、填空题(共7题)
14.填空。
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧热的热化学方程式: 。
(2)已知反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一定温度下达到平衡,该反应的平衡常数表达式K= 。
(3)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+1/2O2(g)=CO2(g)+2H2O(g) ΔH=-akJ/mol,则a 238.6(填“>”“<”或“=”)。
(4)升高温度能够 反应速率(填“加快”或“减慢”);加入正催化剂能够 反应速率,(填“加快”或“减慢”),但影响化学平衡 移动。(填“会”或“不会”)
15.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,回答下列问题:
t/s 0 50 150 250 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
(1)反应在前50s—250s内的用PCl5表示平均速率为
(2)该反应的平衡常数K= 。
(3)体系平衡时与反应起始时的压强之比为
(4)其它条件均不变,在上述平衡体系中再加入1.0molPCl5,达到新平衡时n(PCl3) 0.4mol(填>,<,=)
(5)相同温度下,起始时向容器中充入0.6molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正) v(逆)(填>,<,=)
16.一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g) CO(g)+H2(g)。
(1)请写出该反应的化学平衡常数表达式 K= 。
(2)不能判断该反应一定达到化学平衡状态的依据是 (填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),△H<0,t1秒时,H2的物质的量为 0.2 mol,到 t2秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
①t1~t2这段时间内的反应速率υ(H2O)= ;达到平衡时,H2的体积分数为 。
②若继续加入 2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为 。
③该反应的逆反应速率随时间变化的关系如图:
t1时改变了某种条件,改变的条件可能是 。
17.一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行,达平衡后,试回答:(A.变快 B.不变 C变慢,填字母代号)。
(1)增加Fe的物质的量,其正反应速率 ,逆反应速率 。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)若保持体积不变,充入Ar,其逆反应速率 ,逆反应速率 。
(4)保持压强不变,充入Ar,其正反应速率 ,逆反应速率 。
(5)使用催化剂,其正反应速率 ,逆反应速率 。
18.已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为 。
(2)下列能说明该反应已经达到平衡状态的是 。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率 ,向该容器中通入Ar,则反应速率 (选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是 。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为: (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = (用数据表达,列出式子即可)。
19.研究CO还原NOx对环境的治理有重要意义,相关的主要化学反应有:
Ⅰ NO2(g)+CO(g)CO2(g)+NO(g) ΔH1
Ⅱ 2NO2(g)+4CO(g)N2(g)+4CO2(g) ΔH2<0
Ⅲ 2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH3<0
(1)已知:每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 CO CO2 NO
819kJ 1076kJ 1490kJ 632kJ
①根据上述信息计算ΔH1= kJ·molˉ1。
②下列描述正确的是 。
A 在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
B 反应Ⅱ ΔH<0,ΔS<0;该反应在低温下自发进行
C 恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
D 上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
(2)在一个恒温恒压的密闭容器中, NO2和CO的起始物质的量比为1∶2进行反应,反应在无分子筛膜时二氧化氮平衡转化率和有分子筛膜时二氧化氮转化率随温度的变化如图所示,其中分子筛膜能选择性分离出N2。
①二氧化氮平衡转化率随温度升高而降低的原因为 。
②P点二氧化氮转化率高于T点的原因为 。
(3)实验测得,V正=k 正·c2(NO)·c2(CO) ,V逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①一定温度下,向体积为1L的密闭容器中充入一定量的NO和CO,只发生反应Ⅲ,在tl时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=amol,且N2占平衡总体积的1/4则:= 。
②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下.t3时刻达到新的平衡状态。请在图中补充画出t2 -t3-t4时段,正反应速率的变化曲线 。
20.大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为 mol/(L min)。
Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为 。
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要 、 (填写试剂名称)。不使用碳酸铵的原因是 (用化学方程式表示)。
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是 。
NH3脱除烟气中NO的原理如图3:
(5)该脱硝原理中,NO最终转化为 (填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为 L。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.乙烯使酸性高锰酸钾溶液褪色,是乙烯被氧化了,乙烯使溴水褪色,是发生了加成反应,故A不符合题意;
B.MnO2或FeCl3溶液都是H2O2溶液分解反应的催化剂,故B符合题意;
C.次氯酸使品红褪色是发生了氧化还原反应,二氧化硫使品红褪色没有反生氧化还原反应,故C不符合题意;
D.二氧化硅和氢氟酸反应生成四氟化硅和水,和氢氧化钠反应生成硅酸钠和水,故D不符和题意;
本题答案B。
2.A
【详解】A.投料比等于系数比时,平衡体系中生成物的百分含量最大,b点时与的物质的量之比约为2∶1,故A正确;
B.a、b、c点均为平衡点,a点的投料最少,所以a点时的转化率最大,故B错误;
C.平衡常数只与温度有关,a、b、c点温度相同,所以平衡常数:,故C错误;
D.的投料越多,浓度越大,反应速率越快,所以,故D错误;
选A。
3.B
【详解】A.反应初始4s内v(X)=0.005mol/(L s),则4s内X的浓度降低0.02mol/L,根据方程式可知,Y的浓度同时降低0.02mol/L ,4s时容器内c(Y)= ,故A错误;
B.830℃达平衡时,K=1,
,x=0.08, X的转化率为80%,故B正确;
C.随温度升高,平衡常数减小,所以升高温度,平衡逆向移动,故C错误;
D.R、Q都是生成物,物质的量比始终等于系数比,n(R):n(Q)=1,故D错误;
选B。
4.A
【分析】一定温度下,在恒容密闭容器中,将10molCO和一定量的H2S混合加热,发生反应 ,达到平衡后CO的物质的量为8mol。说明消耗CO物质的量为2mol,消耗的H2S物质的量为2mol,生成COS、H2物质的量都为2mol。
【详解】A.根据消耗CO物质的量为2mol,的平衡转化率为,故A错误;
B.根据,接的n(H2S)=5mol,反应消耗的H2S物质的量为2mol,因此反应前的物质的量为7mol,故B正确;
C.通入后,CO物质的量浓度突然增大,正反应速率突然增大,后来浓度减小,反应速率减小,因此正反应速率突然增大后又减小,故C正确;
D.升高温度,浓度增加,说明平衡逆向移动,逆向是吸热反应,则正反应为放热反应即该反应是放热反应,故D正确。
综上所述,答案为A。
5.C
【详解】A.氢氧化钠是碱性溶液,可以和酸性气体CO2、SO2等反应,故不能用NaOH溶液除去CO2中的少量SO2气体,故A错误;
B.乙酸乙酯在氢氧化钠溶液中会发生水解反应,应该用饱和的碳酸钠溶液收集乙酸乙酯,故B错误;
C.热水与冷水的温度不同,根据容器内气体颜色的变化,判断平衡移动的方向,证明温度对化学平衡的影响,故C正确;
D.该装置中,若蔗糖变黑说明浓硫酸具有脱水性,浓硫酸将碳单质氧化生成CO2和SO2,说明浓硫酸具有强氧化性,反应生成SO2使品红溶液褪色,使酸性高锰酸钾溶液褪色,说明SO2具有漂白性、还原性,故D错误;
答案选C。
6.B
【详解】A.室温下用浓硫酸代替稀硫酸,不能加快与稀硫酸制取的反应速率,因为浓硫酸在室温下和铁发生钝化,故A错误;
B.根据可知,向溶液中加入溶液,过量,加入几滴溶液,如果观察到溶液显红色,铁离子有剩余,说明与反应具有可逆性,故B正确;
C.向酸性溶液中加入,紫色褪去,说明与发生了氧化还原反应,做氧化剂,做还原剂具有还原性,故C错误;
D.具有氧化性,能把氧化成硫酸,但溶液和硫酸溶液都是没有颜色,所以看不到颜色变化,故D错误;
故答案:B。
7.B
【详解】A.使用催化剂后,活化能降低,可以加快反应速率,故A错误;
B.使用催化剂后,活化能降低,焓变不变,故B正确;
C.根据图中信息,反应①是吸热反应,反应②是放热反应,故C错误;
D.根据图中信息得到总反应=①+②,按盖斯定律,ΔH=ΔH1 +ΔH2,故D错误。
综上所述,答案为B。
8.D
【详解】A.根据图示可知反应物是X、Y,生成物是Z,在前3 min内反应达到平衡时,各种物质的物质的量分别改变了0.6 mol、0.2 mol、0.4 mol,△n(X):△n(Y):△n(Z)=0.6 mol:0.2 mol:0.4 mol=3:1:2,由于物质改变的物质的量的比等于化学方程式中相应物质的化学计量数的比,则该反应方程式为3X(g)+Y(g)2Z(g),A正确;
B.根据图1、图3对比可知:反应达到平衡所需时间缩短,但反应达到平衡时各种物质的浓度不变,说明化学平衡没有移动,根据A分析可知该反应反应前后气体的物质的量不相等,则改变的条件只能是使用催化剂,缩短达到平衡所需时间,B正确;
C.根据反应速率的含义可知反应进行的前3 min内,用X表示的反应速率v(X)==0.1 mol·L-1·min-1,C正确;
D.在其它条件不变时,升高温度,反应速率加快,达到平衡所需时间缩短。根据图2可知反应达到平衡所需时间:T2<T1,说明反应温度:T2>T1,升高温度,Y的体积分数减小,根据平衡移动原理,升高温度化学平衡向吸热反应分析移动,说明升高温度,化学平衡正向移动,正反应为吸热反应,D错误;
故合理选项是D。
9.D
【详解】A.是非自发反应,在电解的条件下能实现,故A错误;
B.有些自发反应的熵减小,有些非自发反的熵增大,熵变不是判断反应能否自发进行的唯一依据,故B错误;
C.知道了某过程有自发性之后,不能预测过程发生反应的快慢,故C错误;
D.熵增加且放热的反应,一定小于0,反应一定是自发反应,故D正确;
选D。
10.B
【详解】A.升温,正反应速率和逆反应速率均增大,选项A错误;
B.设时刻气体反应了,列式计算如下:
则,解得。所以,选项B正确;
C.该反应为可逆反应,粗镍中镍单质不能完全反应,剩余固体为镍和杂质,选项C错误;
D.时刻到达平衡,该反应为放热反应,降温,平衡正向移动,平衡常数会增大,选项D错误;
答案选B。
11.D
【详解】A.升高温度,正逆反应速率均增大,且平衡逆向移动,因此t1时改变的条件是升高温度,故A正确;
B.加入催化剂,正逆反应速率同等程度增大,平衡不移动,因此t3时改变的条件是加入高效催化剂,故B正确;
C.当温度一定时,扩大反应容器,使反应组分气体压强减小,平衡逆向移动,正逆反应速率都会减小,故C正确;
D.由图可知,在到达化学平衡的时间段中,C2H5OH的体积分数最小的一段时间是t5→t6,故D错误;
故选:D。
12.B
【详解】A.实验1、2、3中阳离子都是氢离子,且c(H+)均为6mol/L,但阴离子各不相同,因此反应速率不同,与溶液中阴离子种类有关,故A正确;
B.根据实验2,1h以上稀硫酸才与黄铜缓慢反应,经过2h气泡数量增加都不明显,不能保证其中的锌全部溶解,不能用来测定其中铜的质量分数,故B错误;
C.根据实验3、4、5可知,硝酸与黄铜反应的速率随硝酸浓度增大而加快,故C正确;
D.根据实验2,1h以内,稀硫酸与黄铜不反应,经过2h,反应缓慢,气泡数量增加都不明显,说明黄铜在稀硫酸中有较强的抗腐蚀性能,说明黄铜合金的结构与简单Cu—Zn混合物不同,故D正确;
故选B。
13.A
【分析】由图甲可知,200℃时,反应从开始到平衡A物质的量变化量=0.8mol-0.4mol=0.4mol,B物质的量变化量=0.4mol-0.2mol=0.2mol,C物质的量变化量=0.2mol,物质的量之比等于化学方程式计量数之比,所以化学方程式为:2A+BC,据此分析解答。
【详解】A.平衡状态下A、B、C物质的量分别为0.4mol、0.2mol,0.2mol,则该反应的平衡常数,A正确;
B.由甲可知反应从开始到平衡B物质的量变化量=0.4mol-0.2mol=0.2mol,v(B)=,B错误;
C.由图乙可知,当外界条件由200℃降温到100℃,平衡时C的体积分数减小,则原平衡一定被破坏,且正逆反应速率均减小,C错误;
D.由分析可知,化学方程式为:2A+BC,计算得到a=2,再根据乙图图象分析可知温度升高平衡时C的体积分数增大,说明升温平衡正向进行,正反应为吸热反应,△H>0,D错误;
答案选A。
14.(1)
(2)
(3)<
(4) 加快 加快 不会
【详解】(1)(1)16g硫的物质的量为,则1mol固体硫完全燃烧放出的热量为,则硫的燃烧热的热化学方程式:,故填;
(2)(2)根据平衡常数的定义,反应的平衡常数表达式为,故填;
(3)(3) 燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,该反应中生成水为气态,故放出的热少于238.6kJ,所以a<238.6,故填<;
(4)(4)升高温度、使用催化剂,均使反应速率加快,但加入催化剂不影响平衡移动,故填加快、加快、不会;
15.(1)1×10-4mol/(L·s)或0.0001mol/(L·s)
(2)0.025
(3)6:5
(4)<
(5)<
【分析】(1)
反应在前50s-250s内的用PCl5表示平均速率为。
(2)
达到平衡时,,,,,该反应的平衡常数。
(3)
平衡时,,恒温恒容时,压强之比等于物质的量之比,则体系平衡时与反应起始时的压强之比为。
(4)
其它条件均不变,在上述平衡体系中再加入1.0molPCl5,若平衡不移动,达到新平衡时n(PCl3)=0.4mol,但在恒容条件下,再加入1.0molPCl5,相当于加压,平衡向逆向移动,则达到新平衡时n(PCl3)<0.4mol。
(5)
相同温度下,起始时向容器中充入0.6molPCl5、0.20molPCl3和0.20molCl2,此时浓度商为,则反应逆向进行,故反应达到平衡前v(正)<v(逆)。
16. B mol/(L·s) 35% 不 0.7 增大 H2O(g)的浓度
【分析】(1)根据平衡常数的定义:生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数列出该反应的化学平衡常数的表达式;
(2)根据化学平衡的判断标志进行判断,化学平衡状态时正逆反应速率相等,各物质的量、浓度等保持不变,以及衍生出来的一些量也不变,但一定得是“变化的量”不变了,才可作为判断平衡的标志;
(3)①根据公式计算t1~t2这段时间内氢气的反应速率,再根据化学反应速率之比等于化学计量数之比计算v(H2O);根据该反应为反应前后气体体积不变的反应可知,达到平衡时,气体总物质的量不变,仍为1mol,从而计算氢气的体积分数;
②改变固体的用量平衡不移动;继续通入1mol H2O再次达到的新平衡相当于一次性加入2mol H2O达到的平衡状态,而该反应前后气体体积不变,则加入2mol H2O与加入1mol H2O建立等效平衡;
③根据外界条件对化学反应速率的影响判断。
【详解】(1)根据平衡常数的定义:生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,故该反应的化学平衡常数表达式为;
故答案为;
(2)A.υ正(H2O)=υ逆(H2)时,代表正逆反应速率相等,反应达到平衡,故A可以判断;
B.消耗 n mol H2 的同时消耗 n mol CO,反应都代表逆反应,故B不可以判断;
C.碳为固体,则气体的总质量为变量,容器容积不变,则密度为变量,当容器中混合气体的密度不随时间而变化时,反应达到平衡,故C可以判断;
D.该反应前后气体的体积变化,则混合气体的压强为变量,当混合气体的压强不再变化时,反应达到平衡,故D可以判断;
综上所述,B项不能判断该反应一定达到化学平衡状态;
故答案为B;
(3)①t1~t2这段时间内,氢气的反应速率为,根据化学反应速率之比等于化学计量数之比可知,v(H2O)= v(H2)= mol/(L·s);
该反应为反应前后气体体积不变的反应,达到平衡时,气体总物质的量不变,仍为1mol,则H2的体积分数为;
故答案为mol/(L·s);35%;
②Fe为固体,若继续加入2 mol Fe(s),则平衡不移动;继续通入1mol H2O再次达到的新平衡相当于一次性加入2mol H2O达到的平衡状态,而该反应前后气体体积不变,则加入2mol H2O与加入1mol H2O建立等效平衡,继续通入1molH2O再次达到平衡后,H2的物质的量为原来的2倍,即为0.7mol;
故答案为不;0.7;
③根据图象可得,t1时刻逆反应速率逐渐增大,所以可能增H2O(g)的浓度;
故答案为增大H2O(g)的浓度。
17. B B A A B B C C A A
【详解】(1)因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率,其正反应速率不变,逆反应速率也不变,故答案为:B;B;
(2)容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,所以其正反应速率、逆反应速率都变快,故答案是:A;A;
(3)体积不变,充入Ar,使体系压强增大,但各物质的浓度不变,所以反应速率不变,即其正逆反应速率不变,故答案是:B;B;
(4)压强不变,充入Ar,使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,其正逆反应速率变慢,故答案是:C;C;
(5) 使用催化剂,降低了反应活化能,其正逆反应速率都增大,故答案是:A;A;
18. 25% BD 减小 不变 C (0.14×0.156)/(0.34×0.3755)
【详解】(1)5s后,达到平衡并生成1molNO,根据反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),消耗氧气1.25mol,则氧气的转化率为:;(2)A.反应物都为气态物质,反应过程中容器中气体总质量始终不变,选项A错误;B.c(O2)不变,则各反应物的浓度保持不变,反应达到平衡状态,选项B正确;C.当4v(O2)正 = 5v(NO)逆 才能说明正逆反应速率相等,才能说明达到平衡状态,选项C错误;D.对于反应前后气体体积可变的反应,体系压强不变,则总物质的量不变,则说明反应达到平衡状态,选项D正确。答案选BD;(3)降低容器的温度则反应速率减小;通入Ar,压强增大,但物质的浓度不变,则反应速率不变;(4)由于该反应为放热反应,且反应在绝热密闭系统中进行。所以在反应开始阶段,主要受体系温度升高的影响,反应速率增大;而随着反应的进行,反应物的浓度逐渐降低,所以在反应后阶段,主要受浓度减小因素的影响,反应速率减慢,答案选C;
(5) 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
开始时浓度/mol/L 0.4 0.5 0 0
改变的浓度/mol/L 0.1 0. 125 0.1 0.15
平衡时浓度/mol/L 0.3 0. 375 0.1 0.15
K=。
点睛:本题考查可逆反应平衡状态的判断、外界条件对反应速率的影响。该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。另外在判断外界条件对反应速率的影响时,应注意压强和浓度的适用范围。
19. -227 AB 反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) 分子筛膜从反应体系中不断分离出N2,有利于反应正向进行,二氧化氮转化率升高 270 (起点的纵坐标为16,t3时刻达到平衡,t3- t4处于平衡状态与已有线平齐)
【详解】(1) ①ΔH1=E反应物-E生成物=819+1076-1490-632=-227kJ/mol;
②A.反应前后气体系数不变,如果是恒温恒容,无论平衡是否移动,容器中的压强均不变,换为绝热容器后,随着反应的正向进行,反应放出热量,体系温度升高,等量气体的压强随之增大,此时压强是变量,可以作为平衡的依据,A项正确;
B.当ΔH-TΔS<0时,反应自发进行,由ΔH<0,ΔS<0,推出该反应低温下自发进行,B项正确;
C.增大CO的浓度可以使反应Ⅲ的平衡向正向移动,但是平衡常数只受到温度的影响,温度不变,平衡常数不变,C项错误;
D.温度升高,反应速率增大,三个反应的逆反应速率均增大,三个反应均为放热反应,温度升高,反应向吸热方向进行,则平衡逆向移动,所以平衡移动的初期为逆反应速率大于正反应速率,为了达到新的平衡,逆反应速率向正反应速率靠近,逆反应速率会减小,所以逆反应速率的变化趋势为先增大后减小,D项错误;
(2)①反应为放热反应,温度升高,平衡向逆反应(吸热)方向进行,二氧化氮转化率降低;
②相同温度下,二氧化氮的转化率在P点较高是因为使用了分子筛膜,将产物N2分离出来,降低了产物的浓度,使平衡正向进行,从而二氧化氮的转化率提高;
(3)①列三段式求解:,因为N2占平衡总体积的1/4,所以,a=0.3mol,此时为平衡状态,有v正= v逆,即k 正·c2(NO)·c2(CO)= k逆·c(N2)·c2(CO2),;
②在t2时刻,将容器迅速压缩到原容积的1/2,压强瞬间增大为原来压强的两倍,正逆反应速率均增大,但是压强增大,平衡向正反应(气体系数减小)方向进行,则正反应速率大于逆反应速率,所以正反应速率的总体趋势为先突然增大,然后减小,直至平衡,其图象为。
20. 0.015 1:2 消(熟)石灰 碱石灰 (NH4)2CO32NH3↑+CO2↑+2H2O d N2 22.4L
【分析】(1)由图象得到NO物质的量变化,计算得到氧气物质的量变化,结合化学反应速率概念计算V=;
(2)O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3;
(3)实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体;
(4)氨气极易溶于水,在水溶液中易发生倒吸,根据气体压强的知识进行分析;
(5)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算。
【详解】(1)在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示,NO在5min内变化物质的量8.0mol﹣6.5mol=1.5mol,NO在催化剂作用下分解为氮气和氧气,2NO=O2+N2,生成氧气物质的量0.75mol,则0~5min内氧气的平均反应速率==0.015mol/L min;
(2)O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3,此时O3与NO的物质的量之比为1:2;
(3)实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,实验室制取纯净的氨气,除了氯化铵外,还需要消(熟)石灰、碱石灰,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体,反应的化学方程式为:(NH4)2CO32NH3↑+CO2↑+2H2O;
(4)装置abc中都有一个容积较大的仪器,它们能够吸收较多的液体,从而不会使倒吸的液体进入前面的装置,可以防止倒吸,d中导气管插入到水中,氨气极易溶于水,易引起倒吸,不能防倒吸,应是四氯化碳在下层,水在上层,防止倒吸且能吸收氨气,故答案为:d;
(5)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.25mol O2得到1mol电子,则NO转化为N2得到的电子为2mol,所以NO的物质的量为1mol,其体积为22.4L。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13题)
1.下列现象或事实可用同一原理解释的是
A.乙烯能使酸性高锰酸钾溶液和溴水褪色
B.H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率
C.次氯酸和二氧化硫都具有漂白作用,能使品红溶液褪色
D.二氧化硅在氢氟酸,氢氧化钠溶液中都能溶解
2.在一定温度下,只改变起始时反应物中,对反应的影响如图所示,下列说法正确的是
A.b点时与的物质的量之比约为2∶1
B.a、b、c点均为平衡点,且b点时的转化率最大
C.平衡常数:
D.反应速率:
3.已如反应X(g)+Y(g)R(g)+Q(g)的平衡常数与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.2molX和0.8molY,反应初始4s内v(X)=0.005mol/(L s)。下列说法正确的是
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
A.4s时容器内c(Y)=0.78mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.830℃时,待反应达平衡后,再向容器中充入0.2molX和0.8molY,再次平衡后,n(R):n(Q)<1
4.一定温度下,在恒容密闭容器中,将10molCO和一定量的H2S混合加热,发生反应 ,达到平衡后CO的物质的量为8mol。下列说法错误的是
A.的平衡转化率为80%
B.反应前的物质的量为7mol
C.通入后,正反应速率突然增大后又减小
D.升高温度,浓度增加,表明该反应是放热反应
5.下列实验装置能达到实验目的的是
A.用甲装置除去CO2中的少量SO2气体
B.用乙装置完成实验室制取乙酸乙酯
C.用丙装置证明温度对化学平衡的影响
D.用丁装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性
6.下列实验操作可以达到实验目的的是
选项 实验目的 实验操作
A 室温下加快与稀硫酸反应 制取的反应速率 其他条件不变,用浓硫酸代替稀硫酸
B 探究与反应的可逆性 向溶液中加入溶液,并加入几滴溶液,观察现象
C 探究的氧化性 向酸性溶液中加入,观察溶液颜色变化
D 探究的还原性 向溶液中通入,观察溶液颜色变化
A.A B.B C.C D.D
7.某反应使用催化剂后,其反应过程中能量变化如下图,下列说法正确的是
A.使用催化剂可以加快反应速率的原因是提高了反应的活化能
B.使用催化剂后,不变
C.反应①是放热反应,反应②是吸热反应
D.
8.温度为T时,在2 L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
C.反应进行的前3 min内,用X表示的反应速率v(X)=0.1 mol·L-1·min-1
D.保持其他条件不变,升高温度,平衡逆向移动
9.下列说法中正确的是
A.非自发反应在任何条件下都不能实现
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.知道了某过程有自发性之后,可预测过程发生反应的快慢
D.熵增加且放热的反应一定是自发反应
10.一定条件下,密闭容器中投入少量的粗镍和气体(假设固体杂质不和反应)模拟羰基化法精炼镍的实验:。反应时间和容器中气体总物质的量关系如图所示。下列分析正确的是
A.如升温,该反应逆反应速率增大,正反应速率减小
B.0~t1时刻平均反应速率:
C.t1时刻到达平衡,且剩余固体均为杂质
D.t1时刻后,降温,平衡常数会减小
11.乙酸甲酯转化为乙醇的反应原理为CH3COOCH3(g)+2H2(g) C2H5OH(g)+CH3OH(g) ΔH<0。该反应中反应速率随时间变化的关系如图所示,t1、t3、t4时刻分别改变某一外界条件。下列说法错误的是
A.t1时升高温度
B.t3时加入催化剂
C.t4时增大反应容器的容积,使体系压强减小
D.在反应保持化学平衡的时间段中,C2H5OH的体积分数最小的时间段是t2~t3
12.某实验小组为研究黄铜(Cu—Zn合金)的抗腐蚀性能,进行了系列实验,结果如下:
实验 0~1h 1h 2h
1 6mol/L盐酸 无气泡产生
2 3mol/L硫酸 无气泡产生 黄铜表面出现少量小气泡,反应缓慢 黄铜表面小气泡数量增加不明显,反应缓慢
3 6mol/L硝酸 2min时出现较多气泡,反应迅速进行;10min时出现明显的红棕色气体 溶液变为蓝色,反应持续进行,但不剧烈 溶液变为蓝色,反应持续进行,较为缓慢
4 2mol/L硝酸 黄铜表面出现少量小气泡,反应缓慢 溶液出现淡蓝色,反应缓慢 溶液出现淡蓝色,反应缓慢
4 浓硝酸 反应物接触后迅速反应,反应剧烈,产生大量红棕色气体,溶液变为深蓝色
依据上述实验,所得结论不正确的是
A.实验1、2、3中反应速率不同,与溶液中阴离子种类有关
B.可用稀硫酸溶解黄铜以测定铜的质量分数
C.硝酸与黄铜反应的速率随硝酸浓度增大而加快
D.黄铜在稀硫酸中有较强的抗腐蚀性能,说明其结构与简单Cu—Zn混合物不同
13.在2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,该反应的平衡常数为25L2/mol2
B.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(L·min)
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
二、填空题(共7题)
14.填空。
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧热的热化学方程式: 。
(2)已知反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一定温度下达到平衡,该反应的平衡常数表达式K= 。
(3)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+1/2O2(g)=CO2(g)+2H2O(g) ΔH=-akJ/mol,则a 238.6(填“>”“<”或“=”)。
(4)升高温度能够 反应速率(填“加快”或“减慢”);加入正催化剂能够 反应速率,(填“加快”或“减慢”),但影响化学平衡 移动。(填“会”或“不会”)
15.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,回答下列问题:
t/s 0 50 150 250 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
(1)反应在前50s—250s内的用PCl5表示平均速率为
(2)该反应的平衡常数K= 。
(3)体系平衡时与反应起始时的压强之比为
(4)其它条件均不变,在上述平衡体系中再加入1.0molPCl5,达到新平衡时n(PCl3) 0.4mol(填>,<,=)
(5)相同温度下,起始时向容器中充入0.6molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正) v(逆)(填>,<,=)
16.一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g) CO(g)+H2(g)。
(1)请写出该反应的化学平衡常数表达式 K= 。
(2)不能判断该反应一定达到化学平衡状态的依据是 (填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),△H<0,t1秒时,H2的物质的量为 0.2 mol,到 t2秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
①t1~t2这段时间内的反应速率υ(H2O)= ;达到平衡时,H2的体积分数为 。
②若继续加入 2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为 。
③该反应的逆反应速率随时间变化的关系如图:
t1时改变了某种条件,改变的条件可能是 。
17.一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行,达平衡后,试回答:(A.变快 B.不变 C变慢,填字母代号)。
(1)增加Fe的物质的量,其正反应速率 ,逆反应速率 。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)若保持体积不变,充入Ar,其逆反应速率 ,逆反应速率 。
(4)保持压强不变,充入Ar,其正反应速率 ,逆反应速率 。
(5)使用催化剂,其正反应速率 ,逆反应速率 。
18.已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为 。
(2)下列能说明该反应已经达到平衡状态的是 。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率 ,向该容器中通入Ar,则反应速率 (选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是 。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为: (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = (用数据表达,列出式子即可)。
19.研究CO还原NOx对环境的治理有重要意义,相关的主要化学反应有:
Ⅰ NO2(g)+CO(g)CO2(g)+NO(g) ΔH1
Ⅱ 2NO2(g)+4CO(g)N2(g)+4CO2(g) ΔH2<0
Ⅲ 2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH3<0
(1)已知:每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 CO CO2 NO
819kJ 1076kJ 1490kJ 632kJ
①根据上述信息计算ΔH1= kJ·molˉ1。
②下列描述正确的是 。
A 在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
B 反应Ⅱ ΔH<0,ΔS<0;该反应在低温下自发进行
C 恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
D 上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
(2)在一个恒温恒压的密闭容器中, NO2和CO的起始物质的量比为1∶2进行反应,反应在无分子筛膜时二氧化氮平衡转化率和有分子筛膜时二氧化氮转化率随温度的变化如图所示,其中分子筛膜能选择性分离出N2。
①二氧化氮平衡转化率随温度升高而降低的原因为 。
②P点二氧化氮转化率高于T点的原因为 。
(3)实验测得,V正=k 正·c2(NO)·c2(CO) ,V逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①一定温度下,向体积为1L的密闭容器中充入一定量的NO和CO,只发生反应Ⅲ,在tl时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=amol,且N2占平衡总体积的1/4则:= 。
②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下.t3时刻达到新的平衡状态。请在图中补充画出t2 -t3-t4时段,正反应速率的变化曲线 。
20.大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为 mol/(L min)。
Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为 。
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要 、 (填写试剂名称)。不使用碳酸铵的原因是 (用化学方程式表示)。
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是 。
NH3脱除烟气中NO的原理如图3:
(5)该脱硝原理中,NO最终转化为 (填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为 L。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.乙烯使酸性高锰酸钾溶液褪色,是乙烯被氧化了,乙烯使溴水褪色,是发生了加成反应,故A不符合题意;
B.MnO2或FeCl3溶液都是H2O2溶液分解反应的催化剂,故B符合题意;
C.次氯酸使品红褪色是发生了氧化还原反应,二氧化硫使品红褪色没有反生氧化还原反应,故C不符合题意;
D.二氧化硅和氢氟酸反应生成四氟化硅和水,和氢氧化钠反应生成硅酸钠和水,故D不符和题意;
本题答案B。
2.A
【详解】A.投料比等于系数比时,平衡体系中生成物的百分含量最大,b点时与的物质的量之比约为2∶1,故A正确;
B.a、b、c点均为平衡点,a点的投料最少,所以a点时的转化率最大,故B错误;
C.平衡常数只与温度有关,a、b、c点温度相同,所以平衡常数:,故C错误;
D.的投料越多,浓度越大,反应速率越快,所以,故D错误;
选A。
3.B
【详解】A.反应初始4s内v(X)=0.005mol/(L s),则4s内X的浓度降低0.02mol/L,根据方程式可知,Y的浓度同时降低0.02mol/L ,4s时容器内c(Y)= ,故A错误;
B.830℃达平衡时,K=1,
,x=0.08, X的转化率为80%,故B正确;
C.随温度升高,平衡常数减小,所以升高温度,平衡逆向移动,故C错误;
D.R、Q都是生成物,物质的量比始终等于系数比,n(R):n(Q)=1,故D错误;
选B。
4.A
【分析】一定温度下,在恒容密闭容器中,将10molCO和一定量的H2S混合加热,发生反应 ,达到平衡后CO的物质的量为8mol。说明消耗CO物质的量为2mol,消耗的H2S物质的量为2mol,生成COS、H2物质的量都为2mol。
【详解】A.根据消耗CO物质的量为2mol,的平衡转化率为,故A错误;
B.根据,接的n(H2S)=5mol,反应消耗的H2S物质的量为2mol,因此反应前的物质的量为7mol,故B正确;
C.通入后,CO物质的量浓度突然增大,正反应速率突然增大,后来浓度减小,反应速率减小,因此正反应速率突然增大后又减小,故C正确;
D.升高温度,浓度增加,说明平衡逆向移动,逆向是吸热反应,则正反应为放热反应即该反应是放热反应,故D正确。
综上所述,答案为A。
5.C
【详解】A.氢氧化钠是碱性溶液,可以和酸性气体CO2、SO2等反应,故不能用NaOH溶液除去CO2中的少量SO2气体,故A错误;
B.乙酸乙酯在氢氧化钠溶液中会发生水解反应,应该用饱和的碳酸钠溶液收集乙酸乙酯,故B错误;
C.热水与冷水的温度不同,根据容器内气体颜色的变化,判断平衡移动的方向,证明温度对化学平衡的影响,故C正确;
D.该装置中,若蔗糖变黑说明浓硫酸具有脱水性,浓硫酸将碳单质氧化生成CO2和SO2,说明浓硫酸具有强氧化性,反应生成SO2使品红溶液褪色,使酸性高锰酸钾溶液褪色,说明SO2具有漂白性、还原性,故D错误;
答案选C。
6.B
【详解】A.室温下用浓硫酸代替稀硫酸,不能加快与稀硫酸制取的反应速率,因为浓硫酸在室温下和铁发生钝化,故A错误;
B.根据可知,向溶液中加入溶液,过量,加入几滴溶液,如果观察到溶液显红色,铁离子有剩余,说明与反应具有可逆性,故B正确;
C.向酸性溶液中加入,紫色褪去,说明与发生了氧化还原反应,做氧化剂,做还原剂具有还原性,故C错误;
D.具有氧化性,能把氧化成硫酸,但溶液和硫酸溶液都是没有颜色,所以看不到颜色变化,故D错误;
故答案:B。
7.B
【详解】A.使用催化剂后,活化能降低,可以加快反应速率,故A错误;
B.使用催化剂后,活化能降低,焓变不变,故B正确;
C.根据图中信息,反应①是吸热反应,反应②是放热反应,故C错误;
D.根据图中信息得到总反应=①+②,按盖斯定律,ΔH=ΔH1 +ΔH2,故D错误。
综上所述,答案为B。
8.D
【详解】A.根据图示可知反应物是X、Y,生成物是Z,在前3 min内反应达到平衡时,各种物质的物质的量分别改变了0.6 mol、0.2 mol、0.4 mol,△n(X):△n(Y):△n(Z)=0.6 mol:0.2 mol:0.4 mol=3:1:2,由于物质改变的物质的量的比等于化学方程式中相应物质的化学计量数的比,则该反应方程式为3X(g)+Y(g)2Z(g),A正确;
B.根据图1、图3对比可知:反应达到平衡所需时间缩短,但反应达到平衡时各种物质的浓度不变,说明化学平衡没有移动,根据A分析可知该反应反应前后气体的物质的量不相等,则改变的条件只能是使用催化剂,缩短达到平衡所需时间,B正确;
C.根据反应速率的含义可知反应进行的前3 min内,用X表示的反应速率v(X)==0.1 mol·L-1·min-1,C正确;
D.在其它条件不变时,升高温度,反应速率加快,达到平衡所需时间缩短。根据图2可知反应达到平衡所需时间:T2<T1,说明反应温度:T2>T1,升高温度,Y的体积分数减小,根据平衡移动原理,升高温度化学平衡向吸热反应分析移动,说明升高温度,化学平衡正向移动,正反应为吸热反应,D错误;
故合理选项是D。
9.D
【详解】A.是非自发反应,在电解的条件下能实现,故A错误;
B.有些自发反应的熵减小,有些非自发反的熵增大,熵变不是判断反应能否自发进行的唯一依据,故B错误;
C.知道了某过程有自发性之后,不能预测过程发生反应的快慢,故C错误;
D.熵增加且放热的反应,一定小于0,反应一定是自发反应,故D正确;
选D。
10.B
【详解】A.升温,正反应速率和逆反应速率均增大,选项A错误;
B.设时刻气体反应了,列式计算如下:
则,解得。所以,选项B正确;
C.该反应为可逆反应,粗镍中镍单质不能完全反应,剩余固体为镍和杂质,选项C错误;
D.时刻到达平衡,该反应为放热反应,降温,平衡正向移动,平衡常数会增大,选项D错误;
答案选B。
11.D
【详解】A.升高温度,正逆反应速率均增大,且平衡逆向移动,因此t1时改变的条件是升高温度,故A正确;
B.加入催化剂,正逆反应速率同等程度增大,平衡不移动,因此t3时改变的条件是加入高效催化剂,故B正确;
C.当温度一定时,扩大反应容器,使反应组分气体压强减小,平衡逆向移动,正逆反应速率都会减小,故C正确;
D.由图可知,在到达化学平衡的时间段中,C2H5OH的体积分数最小的一段时间是t5→t6,故D错误;
故选:D。
12.B
【详解】A.实验1、2、3中阳离子都是氢离子,且c(H+)均为6mol/L,但阴离子各不相同,因此反应速率不同,与溶液中阴离子种类有关,故A正确;
B.根据实验2,1h以上稀硫酸才与黄铜缓慢反应,经过2h气泡数量增加都不明显,不能保证其中的锌全部溶解,不能用来测定其中铜的质量分数,故B错误;
C.根据实验3、4、5可知,硝酸与黄铜反应的速率随硝酸浓度增大而加快,故C正确;
D.根据实验2,1h以内,稀硫酸与黄铜不反应,经过2h,反应缓慢,气泡数量增加都不明显,说明黄铜在稀硫酸中有较强的抗腐蚀性能,说明黄铜合金的结构与简单Cu—Zn混合物不同,故D正确;
故选B。
13.A
【分析】由图甲可知,200℃时,反应从开始到平衡A物质的量变化量=0.8mol-0.4mol=0.4mol,B物质的量变化量=0.4mol-0.2mol=0.2mol,C物质的量变化量=0.2mol,物质的量之比等于化学方程式计量数之比,所以化学方程式为:2A+BC,据此分析解答。
【详解】A.平衡状态下A、B、C物质的量分别为0.4mol、0.2mol,0.2mol,则该反应的平衡常数,A正确;
B.由甲可知反应从开始到平衡B物质的量变化量=0.4mol-0.2mol=0.2mol,v(B)=,B错误;
C.由图乙可知,当外界条件由200℃降温到100℃,平衡时C的体积分数减小,则原平衡一定被破坏,且正逆反应速率均减小,C错误;
D.由分析可知,化学方程式为:2A+BC,计算得到a=2,再根据乙图图象分析可知温度升高平衡时C的体积分数增大,说明升温平衡正向进行,正反应为吸热反应,△H>0,D错误;
答案选A。
14.(1)
(2)
(3)<
(4) 加快 加快 不会
【详解】(1)(1)16g硫的物质的量为,则1mol固体硫完全燃烧放出的热量为,则硫的燃烧热的热化学方程式:,故填;
(2)(2)根据平衡常数的定义,反应的平衡常数表达式为,故填;
(3)(3) 燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,该反应中生成水为气态,故放出的热少于238.6kJ,所以a<238.6,故填<;
(4)(4)升高温度、使用催化剂,均使反应速率加快,但加入催化剂不影响平衡移动,故填加快、加快、不会;
15.(1)1×10-4mol/(L·s)或0.0001mol/(L·s)
(2)0.025
(3)6:5
(4)<
(5)<
【分析】(1)
反应在前50s-250s内的用PCl5表示平均速率为。
(2)
达到平衡时,,,,,该反应的平衡常数。
(3)
平衡时,,恒温恒容时,压强之比等于物质的量之比,则体系平衡时与反应起始时的压强之比为。
(4)
其它条件均不变,在上述平衡体系中再加入1.0molPCl5,若平衡不移动,达到新平衡时n(PCl3)=0.4mol,但在恒容条件下,再加入1.0molPCl5,相当于加压,平衡向逆向移动,则达到新平衡时n(PCl3)<0.4mol。
(5)
相同温度下,起始时向容器中充入0.6molPCl5、0.20molPCl3和0.20molCl2,此时浓度商为,则反应逆向进行,故反应达到平衡前v(正)<v(逆)。
16. B mol/(L·s) 35% 不 0.7 增大 H2O(g)的浓度
【分析】(1)根据平衡常数的定义:生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数列出该反应的化学平衡常数的表达式;
(2)根据化学平衡的判断标志进行判断,化学平衡状态时正逆反应速率相等,各物质的量、浓度等保持不变,以及衍生出来的一些量也不变,但一定得是“变化的量”不变了,才可作为判断平衡的标志;
(3)①根据公式计算t1~t2这段时间内氢气的反应速率,再根据化学反应速率之比等于化学计量数之比计算v(H2O);根据该反应为反应前后气体体积不变的反应可知,达到平衡时,气体总物质的量不变,仍为1mol,从而计算氢气的体积分数;
②改变固体的用量平衡不移动;继续通入1mol H2O再次达到的新平衡相当于一次性加入2mol H2O达到的平衡状态,而该反应前后气体体积不变,则加入2mol H2O与加入1mol H2O建立等效平衡;
③根据外界条件对化学反应速率的影响判断。
【详解】(1)根据平衡常数的定义:生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,故该反应的化学平衡常数表达式为;
故答案为;
(2)A.υ正(H2O)=υ逆(H2)时,代表正逆反应速率相等,反应达到平衡,故A可以判断;
B.消耗 n mol H2 的同时消耗 n mol CO,反应都代表逆反应,故B不可以判断;
C.碳为固体,则气体的总质量为变量,容器容积不变,则密度为变量,当容器中混合气体的密度不随时间而变化时,反应达到平衡,故C可以判断;
D.该反应前后气体的体积变化,则混合气体的压强为变量,当混合气体的压强不再变化时,反应达到平衡,故D可以判断;
综上所述,B项不能判断该反应一定达到化学平衡状态;
故答案为B;
(3)①t1~t2这段时间内,氢气的反应速率为,根据化学反应速率之比等于化学计量数之比可知,v(H2O)= v(H2)= mol/(L·s);
该反应为反应前后气体体积不变的反应,达到平衡时,气体总物质的量不变,仍为1mol,则H2的体积分数为;
故答案为mol/(L·s);35%;
②Fe为固体,若继续加入2 mol Fe(s),则平衡不移动;继续通入1mol H2O再次达到的新平衡相当于一次性加入2mol H2O达到的平衡状态,而该反应前后气体体积不变,则加入2mol H2O与加入1mol H2O建立等效平衡,继续通入1molH2O再次达到平衡后,H2的物质的量为原来的2倍,即为0.7mol;
故答案为不;0.7;
③根据图象可得,t1时刻逆反应速率逐渐增大,所以可能增H2O(g)的浓度;
故答案为增大H2O(g)的浓度。
17. B B A A B B C C A A
【详解】(1)因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率,其正反应速率不变,逆反应速率也不变,故答案为:B;B;
(2)容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快,所以其正反应速率、逆反应速率都变快,故答案是:A;A;
(3)体积不变,充入Ar,使体系压强增大,但各物质的浓度不变,所以反应速率不变,即其正逆反应速率不变,故答案是:B;B;
(4)压强不变,充入Ar,使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小,其正逆反应速率变慢,故答案是:C;C;
(5) 使用催化剂,降低了反应活化能,其正逆反应速率都增大,故答案是:A;A;
18. 25% BD 减小 不变 C (0.14×0.156)/(0.34×0.3755)
【详解】(1)5s后,达到平衡并生成1molNO,根据反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),消耗氧气1.25mol,则氧气的转化率为:;(2)A.反应物都为气态物质,反应过程中容器中气体总质量始终不变,选项A错误;B.c(O2)不变,则各反应物的浓度保持不变,反应达到平衡状态,选项B正确;C.当4v(O2)正 = 5v(NO)逆 才能说明正逆反应速率相等,才能说明达到平衡状态,选项C错误;D.对于反应前后气体体积可变的反应,体系压强不变,则总物质的量不变,则说明反应达到平衡状态,选项D正确。答案选BD;(3)降低容器的温度则反应速率减小;通入Ar,压强增大,但物质的浓度不变,则反应速率不变;(4)由于该反应为放热反应,且反应在绝热密闭系统中进行。所以在反应开始阶段,主要受体系温度升高的影响,反应速率增大;而随着反应的进行,反应物的浓度逐渐降低,所以在反应后阶段,主要受浓度减小因素的影响,反应速率减慢,答案选C;
(5) 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
开始时浓度/mol/L 0.4 0.5 0 0
改变的浓度/mol/L 0.1 0. 125 0.1 0.15
平衡时浓度/mol/L 0.3 0. 375 0.1 0.15
K=。
点睛:本题考查可逆反应平衡状态的判断、外界条件对反应速率的影响。该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。另外在判断外界条件对反应速率的影响时,应注意压强和浓度的适用范围。
19. -227 AB 反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) 分子筛膜从反应体系中不断分离出N2,有利于反应正向进行,二氧化氮转化率升高 270 (起点的纵坐标为16,t3时刻达到平衡,t3- t4处于平衡状态与已有线平齐)
【详解】(1) ①ΔH1=E反应物-E生成物=819+1076-1490-632=-227kJ/mol;
②A.反应前后气体系数不变,如果是恒温恒容,无论平衡是否移动,容器中的压强均不变,换为绝热容器后,随着反应的正向进行,反应放出热量,体系温度升高,等量气体的压强随之增大,此时压强是变量,可以作为平衡的依据,A项正确;
B.当ΔH-TΔS<0时,反应自发进行,由ΔH<0,ΔS<0,推出该反应低温下自发进行,B项正确;
C.增大CO的浓度可以使反应Ⅲ的平衡向正向移动,但是平衡常数只受到温度的影响,温度不变,平衡常数不变,C项错误;
D.温度升高,反应速率增大,三个反应的逆反应速率均增大,三个反应均为放热反应,温度升高,反应向吸热方向进行,则平衡逆向移动,所以平衡移动的初期为逆反应速率大于正反应速率,为了达到新的平衡,逆反应速率向正反应速率靠近,逆反应速率会减小,所以逆反应速率的变化趋势为先增大后减小,D项错误;
(2)①反应为放热反应,温度升高,平衡向逆反应(吸热)方向进行,二氧化氮转化率降低;
②相同温度下,二氧化氮的转化率在P点较高是因为使用了分子筛膜,将产物N2分离出来,降低了产物的浓度,使平衡正向进行,从而二氧化氮的转化率提高;
(3)①列三段式求解:,因为N2占平衡总体积的1/4,所以,a=0.3mol,此时为平衡状态,有v正= v逆,即k 正·c2(NO)·c2(CO)= k逆·c(N2)·c2(CO2),;
②在t2时刻,将容器迅速压缩到原容积的1/2,压强瞬间增大为原来压强的两倍,正逆反应速率均增大,但是压强增大,平衡向正反应(气体系数减小)方向进行,则正反应速率大于逆反应速率,所以正反应速率的总体趋势为先突然增大,然后减小,直至平衡,其图象为。
20. 0.015 1:2 消(熟)石灰 碱石灰 (NH4)2CO32NH3↑+CO2↑+2H2O d N2 22.4L
【分析】(1)由图象得到NO物质的量变化,计算得到氧气物质的量变化,结合化学反应速率概念计算V=;
(2)O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3;
(3)实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体;
(4)氨气极易溶于水,在水溶液中易发生倒吸,根据气体压强的知识进行分析;
(5)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算。
【详解】(1)在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示,NO在5min内变化物质的量8.0mol﹣6.5mol=1.5mol,NO在催化剂作用下分解为氮气和氧气,2NO=O2+N2,生成氧气物质的量0.75mol,则0~5min内氧气的平均反应速率==0.015mol/L min;
(2)O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3,此时O3与NO的物质的量之比为1:2;
(3)实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,实验室制取纯净的氨气,除了氯化铵外,还需要消(熟)石灰、碱石灰,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体,反应的化学方程式为:(NH4)2CO32NH3↑+CO2↑+2H2O;
(4)装置abc中都有一个容积较大的仪器,它们能够吸收较多的液体,从而不会使倒吸的液体进入前面的装置,可以防止倒吸,d中导气管插入到水中,氨气极易溶于水,易引起倒吸,不能防倒吸,应是四氯化碳在下层,水在上层,防止倒吸且能吸收氨气,故答案为:d;
(5)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.25mol O2得到1mol电子,则NO转化为N2得到的电子为2mol,所以NO的物质的量为1mol,其体积为22.4L。
答案第1页,共2页
答案第1页,共2页
