1.3 课时1 物质的量及其单位——摩尔 课件(共22页) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 1.3 课时1 物质的量及其单位——摩尔 课件(共22页) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:01:01 | ||
图片预览






文档简介
(共22张PPT)
?
一滴水约0.05 mL 、 0.05 g,约含17万亿亿个水分子,如果一个个地去数,即使分秒不停,一个人一生也无法完成这项工作。
宏观物质可以称量,微观粒子是难以称量的,那么,怎么才能既科学又方便的知道一定质量或体积的水含有多少个水分子呢?
第3节 化学中常用的物理量——物质的量 课时1
第一章 认识化学科学
1.理解物质的量、摩尔质量的含义和应用。
2.能基于物质的量认识物质的组成,并运用物质的量与微粒数、物质质量之间的相互关系进行简单计算。
【联系生活】
【启发】定量粒子个数可以按照一定的数目标准集合起来
1打汽水 12瓶汽水
1令纸 500张纸
一、物质的量及其单位——摩尔
1.物质的量
(1)定义:
(3)单位:
n
表示含有一定数目粒子的集合体。
(2)符号:
摩尔,简称摩,符号为mol
(4)适用范围:
原子、分子、离子等微观粒子
例如:“1mol苹果、lmol绿豆”
可以表述为:1mol H2、lmol OH-、lmol O。
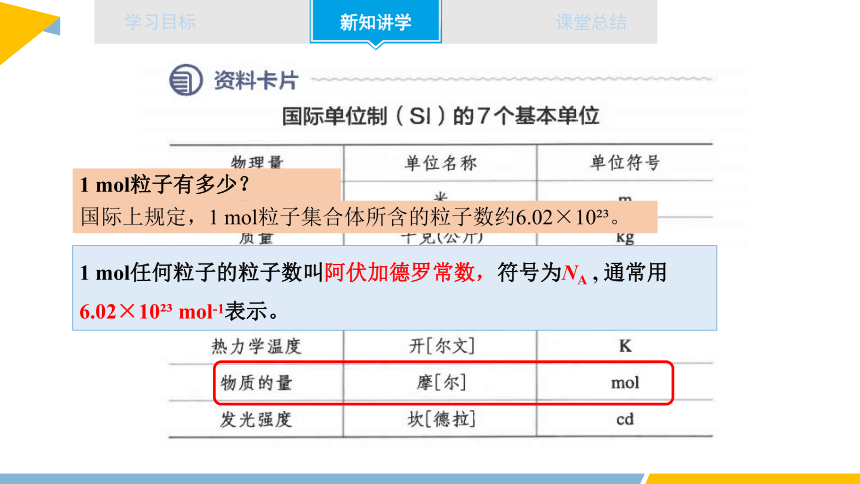
1 mol任何粒子的粒子数叫阿伏加德罗常数,符号为NA , 通常用6.02×10 mol-1表示。
1 mol粒子有多少?
国际上规定,1 mol粒子集合体所含的粒子数约6.02×10 。
(3)“物质的量”是计量微观粒子数目的物理量,“摩尔”是单位。
【注意事项】
(1)“物质的量”是一个专有名词,由固定字数组成,不能分割、不能增减。
(2)“物质的量”衡量的对象是微观粒子(分子、原子、离子、中子、质子、电子、原子团),且粒子必须具体明确。
例如:表述为“物质量”或“物质的数量”都是错误的。
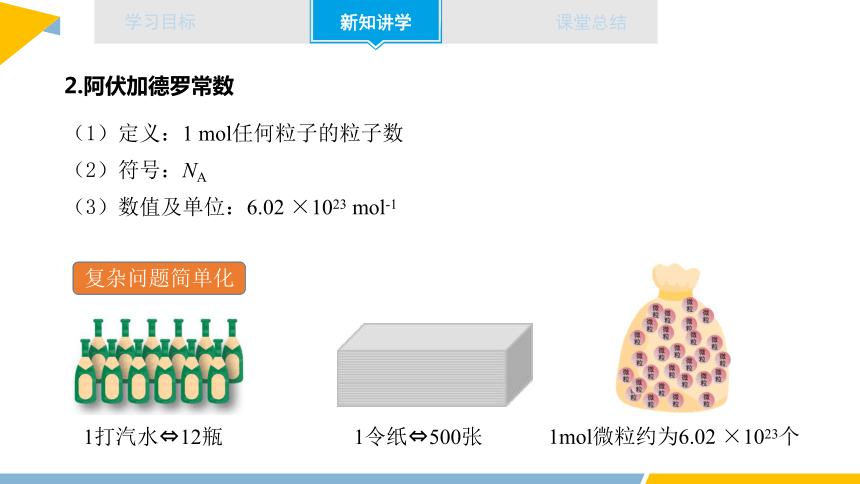
复杂问题简单化
1打汽水 12瓶
1令纸 500张
1mol微粒约为6.02 ×1023个
2.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数
(2)符号:NA
(3)数值及单位:6.02 ×1023 mol-1
例1:1 mol H2 含 个氢分子,0.5 mol H2 含
个氢分子。
6.02 ×1023
3.01 ×1023
粒子数(N)、阿伏加德罗常数(NA)、物质的量(n)之间的关系:
n=
N
NA
变式:
N=n·NA
【小结】
N
n
NA=
例2:3.01 × 1023 个CO2的物质的量是多少?
n(CO2) =
3.01 × 1023
6.02 × 1023 mol-1
= 0.5mol
1.204 ×1024个
6.02 ×1023个
2 mol
1 mol
物质的量这一物理量为我们提供了一个定量认识物质组成的新视角。
练一练
(1)摩尔是国际单位制中七个基本物理量之一。
(2)摩尔是物质的质量单位。
(3)物质的量是一个基本物理量,表示含有一定数目微粒的集合体。
(4)1molCO2和H2的混合气体所含的分子数约为6.02×1023
(5)1mol任何物质含有分子数约为6.02×1023个。
1.判断下列说法是否正确。
(摩尔是物质的量的单位)
(物质可以由分子、离子或原子构成)
(1)0.5molCO2中,含有______molC;含有______molO;含有二氧化碳分子数为________________;碳原子数为_____________;氧原子数为________________。
(2)1molNa2CO3中约含有_____molNa+、______molCO32-离子,共含有离子的个数为 。
(3)0.1mol 中有 mol电子,有 mol质子。
0.5
1
3.01×1023
3.01×1023
6.02×1023
2
1
1.806×1024
1
1.1
2.计算
我们已经学习了一个计算物质的量的公式
那么要知道一杯(180g)水中有多少水分子?我们还需要知道什么数据?
1mol(6.02×1023个)水分子所具有的质量
请下表中有关数据讨论:
1 mol物质的质量在数值上有什么特点?
粒子符号 物质的量(mol) 所含微粒数(N) 每个微粒的质量(g) 质量(g) 质量(kg) 相对原子或相对分子质量
12C 1 6.02×1023 1.993×10-23
O 1 6.02×1023 2.657×10-23
Fe 1 6.02×1023 9.302×10-23
Cu 1 6.02×1023 1.059×10-22
H2O 1 6.02×1023 2.990×10-23
1 mol不同物质的质量
12
16
56
64
18
12
16
56
64
18
0.012
0.016
0.056
0.064
0.018
二、摩尔质量
定义:
l mol任何物质的质量,以克为单位时,其数值上都等于它的的相对原子质量或相对分子质量。
单位物质的量的物质所具有的质量
符号:
M
单位:
g/mol 或 kg/mol
数值:
摩尔质量 = 相对原子(分子)质量
?
两者含义、单位不相同。
例如:镁的相对原子质量为24,摩尔质量为24g/mol。
概念辨析
1.(1)Na的摩尔质量是__________,
(2)KCl的摩尔质量是__________,
(3)CH4的摩尔质量是___________,0.5molCH4的质量是_________。
(4) 的摩尔质量是__________,2mol 的质量是_______。
物质的量(n)、质量(m)、摩尔质量(M)之间有什么关系呢?
23g/mol
74.5g/mol
16g/mol
60g/mol
8g
120g
练一练
n=
m
M
m = n·M
变式:
M =
m
n
2.26.5 g Na2CO3的物质的量是多少?
【解】Na2CO3的相对分子质量为106,摩尔质量为106g/mol。
n(Na2CO3) =
m(Na2CO3)
M(Na2CO3)
26.5g
106g/mol
=
= 0.25mol
答:26.5 g Na2CO3的物质的量是0.25 mol。
【问题回归】
一杯水(180g)水中有多少水分子?
n=
m
M
n=
N
NA
物质的量与粒子数、物质的质量的关系式:
n(H2O)=
m(H2O)
M(H2O)
N(H2O)=n(H2O)·NA
=10mol×6.02×1023
=6.02×1024
180 g
18g/mol
=
=10mol
宏观质量
微观粒子数
桥梁?
n
m
N
M
NA
NA
M
宏观物体的质量
微观粒子的个数
纽带或桥梁
1.204×1024个CH4的质量是多少?
【分析】物质的量是联系宏观质量和微观粒子的桥梁,已知粒子数,求质量,应先求物质的量。
n(CH4)=
N(CH4)
NA
=2mol
=
1.204×1024
6.02×1023mol-1
m(CH4)=2mol×16g/mol=32g
练一练
物质的量
概念
摩尔质量
意义:联系宏观物质和微观粒子之间的桥梁
单位:mol
符号:n
单位物质的量的物质所具有的质量
单位:g/mol
符号:M
n=m/M
阿伏加德罗常数
数值:6.02 1023
n=N/NA
符号:NA
表示含有一定数目粒子的集合体
×
?
一滴水约0.05 mL 、 0.05 g,约含17万亿亿个水分子,如果一个个地去数,即使分秒不停,一个人一生也无法完成这项工作。
宏观物质可以称量,微观粒子是难以称量的,那么,怎么才能既科学又方便的知道一定质量或体积的水含有多少个水分子呢?
第3节 化学中常用的物理量——物质的量 课时1
第一章 认识化学科学
1.理解物质的量、摩尔质量的含义和应用。
2.能基于物质的量认识物质的组成,并运用物质的量与微粒数、物质质量之间的相互关系进行简单计算。
【联系生活】
【启发】定量粒子个数可以按照一定的数目标准集合起来
1打汽水 12瓶汽水
1令纸 500张纸
一、物质的量及其单位——摩尔
1.物质的量
(1)定义:
(3)单位:
n
表示含有一定数目粒子的集合体。
(2)符号:
摩尔,简称摩,符号为mol
(4)适用范围:
原子、分子、离子等微观粒子
例如:“1mol苹果、lmol绿豆”
可以表述为:1mol H2、lmol OH-、lmol O。
1 mol任何粒子的粒子数叫阿伏加德罗常数,符号为NA , 通常用6.02×10 mol-1表示。
1 mol粒子有多少?
国际上规定,1 mol粒子集合体所含的粒子数约6.02×10 。
(3)“物质的量”是计量微观粒子数目的物理量,“摩尔”是单位。
【注意事项】
(1)“物质的量”是一个专有名词,由固定字数组成,不能分割、不能增减。
(2)“物质的量”衡量的对象是微观粒子(分子、原子、离子、中子、质子、电子、原子团),且粒子必须具体明确。
例如:表述为“物质量”或“物质的数量”都是错误的。
复杂问题简单化
1打汽水 12瓶
1令纸 500张
1mol微粒约为6.02 ×1023个
2.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数
(2)符号:NA
(3)数值及单位:6.02 ×1023 mol-1
例1:1 mol H2 含 个氢分子,0.5 mol H2 含
个氢分子。
6.02 ×1023
3.01 ×1023
粒子数(N)、阿伏加德罗常数(NA)、物质的量(n)之间的关系:
n=
N
NA
变式:
N=n·NA
【小结】
N
n
NA=
例2:3.01 × 1023 个CO2的物质的量是多少?
n(CO2) =
3.01 × 1023
6.02 × 1023 mol-1
= 0.5mol
1.204 ×1024个
6.02 ×1023个
2 mol
1 mol
物质的量这一物理量为我们提供了一个定量认识物质组成的新视角。
练一练
(1)摩尔是国际单位制中七个基本物理量之一。
(2)摩尔是物质的质量单位。
(3)物质的量是一个基本物理量,表示含有一定数目微粒的集合体。
(4)1molCO2和H2的混合气体所含的分子数约为6.02×1023
(5)1mol任何物质含有分子数约为6.02×1023个。
1.判断下列说法是否正确。
(摩尔是物质的量的单位)
(物质可以由分子、离子或原子构成)
(1)0.5molCO2中,含有______molC;含有______molO;含有二氧化碳分子数为________________;碳原子数为_____________;氧原子数为________________。
(2)1molNa2CO3中约含有_____molNa+、______molCO32-离子,共含有离子的个数为 。
(3)0.1mol 中有 mol电子,有 mol质子。
0.5
1
3.01×1023
3.01×1023
6.02×1023
2
1
1.806×1024
1
1.1
2.计算
我们已经学习了一个计算物质的量的公式
那么要知道一杯(180g)水中有多少水分子?我们还需要知道什么数据?
1mol(6.02×1023个)水分子所具有的质量
请下表中有关数据讨论:
1 mol物质的质量在数值上有什么特点?
粒子符号 物质的量(mol) 所含微粒数(N) 每个微粒的质量(g) 质量(g) 质量(kg) 相对原子或相对分子质量
12C 1 6.02×1023 1.993×10-23
O 1 6.02×1023 2.657×10-23
Fe 1 6.02×1023 9.302×10-23
Cu 1 6.02×1023 1.059×10-22
H2O 1 6.02×1023 2.990×10-23
1 mol不同物质的质量
12
16
56
64
18
12
16
56
64
18
0.012
0.016
0.056
0.064
0.018
二、摩尔质量
定义:
l mol任何物质的质量,以克为单位时,其数值上都等于它的的相对原子质量或相对分子质量。
单位物质的量的物质所具有的质量
符号:
M
单位:
g/mol 或 kg/mol
数值:
摩尔质量 = 相对原子(分子)质量
?
两者含义、单位不相同。
例如:镁的相对原子质量为24,摩尔质量为24g/mol。
概念辨析
1.(1)Na的摩尔质量是__________,
(2)KCl的摩尔质量是__________,
(3)CH4的摩尔质量是___________,0.5molCH4的质量是_________。
(4) 的摩尔质量是__________,2mol 的质量是_______。
物质的量(n)、质量(m)、摩尔质量(M)之间有什么关系呢?
23g/mol
74.5g/mol
16g/mol
60g/mol
8g
120g
练一练
n=
m
M
m = n·M
变式:
M =
m
n
2.26.5 g Na2CO3的物质的量是多少?
【解】Na2CO3的相对分子质量为106,摩尔质量为106g/mol。
n(Na2CO3) =
m(Na2CO3)
M(Na2CO3)
26.5g
106g/mol
=
= 0.25mol
答:26.5 g Na2CO3的物质的量是0.25 mol。
【问题回归】
一杯水(180g)水中有多少水分子?
n=
m
M
n=
N
NA
物质的量与粒子数、物质的质量的关系式:
n(H2O)=
m(H2O)
M(H2O)
N(H2O)=n(H2O)·NA
=10mol×6.02×1023
=6.02×1024
180 g
18g/mol
=
=10mol
宏观质量
微观粒子数
桥梁?
n
m
N
M
NA
NA
M
宏观物体的质量
微观粒子的个数
纽带或桥梁
1.204×1024个CH4的质量是多少?
【分析】物质的量是联系宏观质量和微观粒子的桥梁,已知粒子数,求质量,应先求物质的量。
n(CH4)=
N(CH4)
NA
=2mol
=
1.204×1024
6.02×1023mol-1
m(CH4)=2mol×16g/mol=32g
练一练
物质的量
概念
摩尔质量
意义:联系宏观物质和微观粒子之间的桥梁
单位:mol
符号:n
单位物质的量的物质所具有的质量
单位:g/mol
符号:M
n=m/M
阿伏加德罗常数
数值:6.02 1023
n=N/NA
符号:NA
表示含有一定数目粒子的集合体
×
