2.1 课时2 物质分类与物质性质 课件(共21页) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.1 课时2 物质分类与物质性质 课件(共21页) 2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 792.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:15:04 | ||
图片预览





文档简介
(共21张PPT)
第1节 元素与物质的分类 课时2
第一章 认识化学科学
1.通过实验探究,理解并体验研究一类物质性质的方法,掌握各类物质的一般性质。
2.尝试利用同一类物质的一般性质预测陌生物质的性质,并设计实验验证。
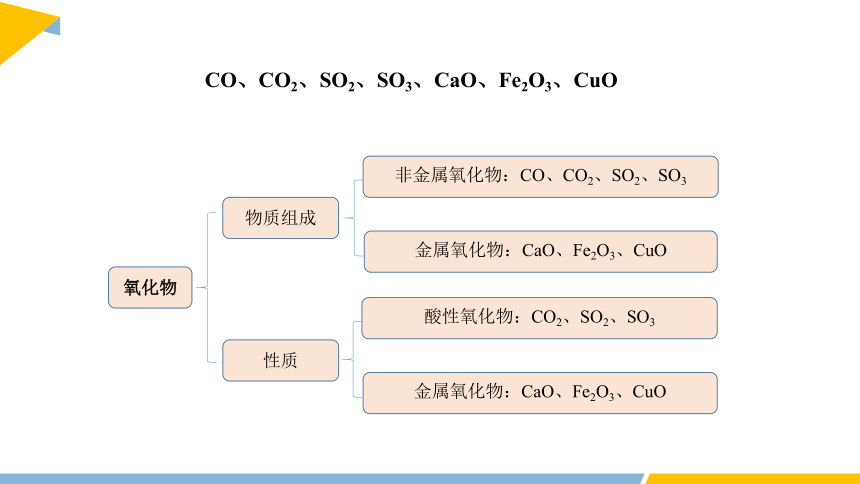
CO、CO2、SO2、SO3、CaO、Fe2O3、CuO
氧化物
物质组成
非金属氧化物:CO、CO2、SO2、SO3
金属氧化物:CaO、Fe2O3、CuO
性质
酸性氧化物:CO2、SO2、SO3
金属氧化物:CaO、Fe2O3、CuO
一、物质分类与物质性质
研究一类物质的性质
1.按照物质类别将下列物质分类。
金属铁、碳单质、二氧化碳、碳酸钙、碳酸钠、氧气、氧化钙、氢氧化钙、盐酸、氯化钠、氯化钡、硫酸、硫酸钠、硫酸铜、氢氧化铜、氢氧化钠、硝酸银。
2.预测酸具有哪些相似的性质。
3.以酸为例,选取相应试剂,设计实验,证明你的预测。
化合物
酸
碱
盐
氧化物
二氧化碳、氧化钙、氧化铜
硫酸、盐酸
氢氧化钠、氢氧化钙
碳酸钙、碳酸钠、氯化钠、氯化钡、硫酸钠、硫酸铜、硝酸银
金属单质
非金属单质
金属铁
碳单质、氧气
单质
HCl+NaOH====NaCl+H2O
指示剂
紫色石蕊试液变红,无色酚酞不变色。
Fe+2HCl====FeCl2+H2↑
2HCl+Na2O====2NaCl+H2O
碱
HCl+AgNO3====AgCl↓+HNO3
酸
金属
氧化物
盐
盐酸
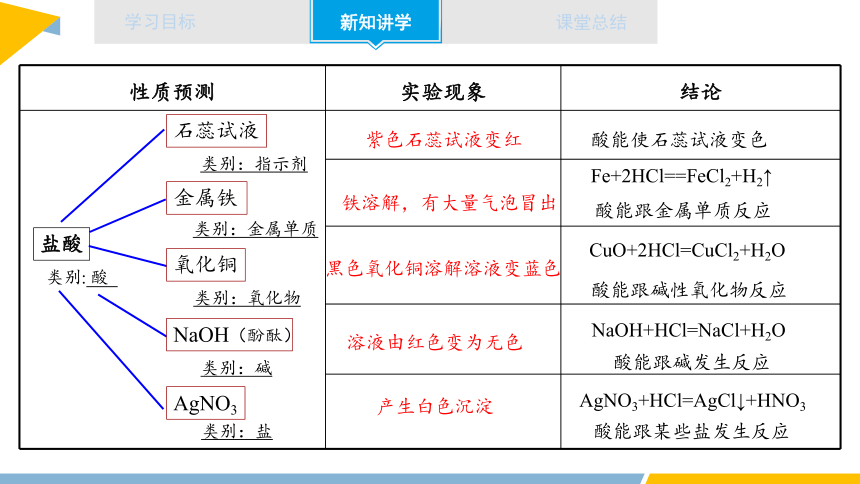
性质预测 实验现象 结论
酸能使石蕊试液变色
Fe+2HCl==FeCl2+H2↑
酸能跟金属单质反应
CuO+2HCl=CuCl2+H2O
NaOH+HCl=NaCl+H2O
AgNO3+HCl=AgCl↓+HNO3
酸能跟碱性氧化物反应
酸能跟碱发生反应
酸能跟某些盐发生反应
紫色石蕊试液变红
铁溶解,有大量气泡冒出
黑色氧化铜溶解溶液变蓝色
产生白色沉淀
溶液由红色变为无色
类别:指示剂
类别:金属单质
类别:氧化物
类别:碱
类别:盐
类别: 酸
石蕊试液
金属铁
氧化铜
NaOH(酚酞)
AgNO3
盐酸
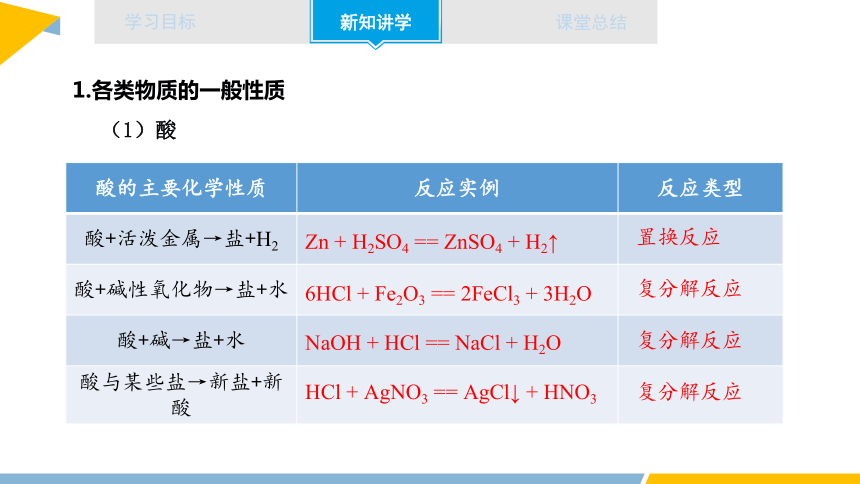
1.各类物质的一般性质
(1)酸
酸的主要化学性质 反应实例 反应类型
酸+活泼金属→盐+H2
酸+碱性氧化物→盐+水
酸+碱→盐+水
酸与某些盐→新盐+新酸
Zn + H2SO4 == ZnSO4 + H2↑
置换反应
6HCl + Fe2O3 == 2FeCl3 + 3H2O
复分解反应
NaOH + HCl == NaCl + H2O
复分解反应
HCl + AgNO3 == AgCl↓ + HNO3
复分解反应
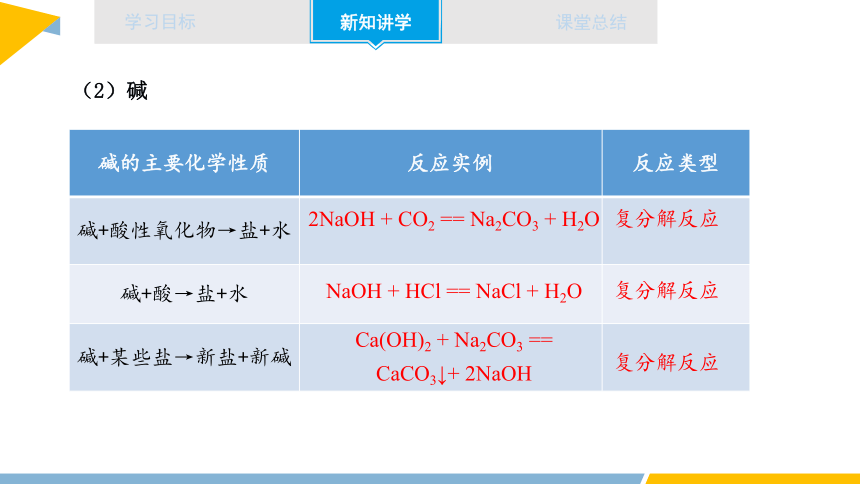
(2)碱
碱的主要化学性质 反应实例 反应类型
碱+酸性氧化物→盐+水
碱+酸→盐+水
碱+某些盐→新盐+新碱
2NaOH + CO2 == Na2CO3 + H2O
NaOH + HCl == NaCl + H2O
Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
复分解反应
复分解反应
复分解反应
(3)盐
盐的主要化学性质 反应实例 反应类型
盐与金属反应
盐与酸反应
盐与碱反应
盐与某些盐反应
Fe + CuSO4 == FeSO4 + Cu
BaCl2 + H2SO4 == BaSO4↓ + 2HCl
FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓
BaCl2 + Na2SO4 == BaSO4↓ + 2NaCl
置换反应
复分解反应
复分解反应
复分解反应
(4)氧化物
能与碱反应生成盐和水的氧化物为酸性氧化物,如二氧化碳、二氧化硫等;能与酸反应生成盐和水的氧化物为碱性氧化物,如氧化钠、氧化钙等。多数非金属氧化物属于酸性氧化物,多数金属氧化物属于碱性氧化物。
碱性氧化物
少数能与水反应生成碱
能与酸反应生成盐和水
能与某些酸性氧化物化合成盐
酸性氧化物
多数能与水反应生成酸
能与碱反应生成盐和水
能与某些碱性氧化物化合成盐
CO2
Na2O
Na2O+H2O====2NaOH
Na2O+2HCl====2NaCl+H2O
Na2O+CO2====Na2CO3
CO2+H2O====H2CO3
CO2+2NaOH====Na2CO3+H2O
CO2+Na2O====Na2CO3
【思考·讨论】
不是。有些酸不能与金属活动性顺序中氢元素之后的金属反应。
1.酸的通性之一是酸可以与金属反应,是不是酸能与所有的金属发生反应
碱和盐反应时应该符合复分解反应的条件,如生成沉淀或气体或难电离的物质。
2.碱和盐反应时符合什么条件才能发生
根据物质类别预测陌生物质的性质
1.判断陌生物质所属物质类别,根据该类别物质的一般性质及相关反应规律预测该物质可能会与哪些类别的物质发生反应;
2.选择可能与该物质反应的各类物质的代表物,推断可能发生的具体反应。
3.实验验证预测是否正确。
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。
试着以C、Ca为例写出上述物质之间的转化关系,体会由金属单质到盐、非金属到盐的转化关系。
2.物质转化的规律
0
+2
Ca
CaO
Ca(OH)2
CaCl2
单质
氧化物
盐
碱
酸
Ca CaO Ca(OH)2 CaCl2
O2
H2O
HCl
HCl
HCl
C CO2 H 2CO3 CaCO3
Ca (OH)2
O2
H2O
Ca (OH)2
HCl
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
金属单质
非金属单质
酸
酸
酸
碱
练一练
1.对于化学反应A+B===C+D的下列说法中,正确的是( )
A.若生成物C、D有一种为单质,该反应一定是置换反应
B.若生成物C、D分别为两种沉淀,A、B有可能为盐和碱
C.若生成物C、D是盐和水,则A、B一定是酸和碱
D.若生成物C、D是两种化合物,则A、B一定是化合物
B
2.以Fe、CuO、CuCl2溶液、盐酸、氢氧化钠溶液为反应物,两两间可发生的反应有( )
A.6个 B.5个 C.4个 D.3个
B
3.下列变化不能通过一步反应实现的是 ( )
A.Na2CO3→NaOH
B.CuO→CuCl2
C.CaCO3→Ca(OH)2
D.CaO→Ca(OH)2
C
4.分类法是一种重要的学习方法。下列4组物质中均有一种物质的类别与其他三种不同,请分别填出其化学式。
甲:Na、H2、O2、Cl2;
乙:CO、Na2O、CO2、SO2;
丙:NaOH、K2CO3、KHCO3、K2SO4;
丁:NaOH、Ca(OH)2、KOH、NaCl。
(1)甲 ,乙 ,丙 ,丁 。
(2)根据下图写出序号所示反应的化学方程式:
①4Na+O2====2Na2O
②Na2O+H2O====2NaOH
③NaOH+HCl====NaCl+H2O
Na
Na2O
NaOH
NaCl
纯净物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
酸性氧化物
碱性氧化物
第1节 元素与物质的分类 课时2
第一章 认识化学科学
1.通过实验探究,理解并体验研究一类物质性质的方法,掌握各类物质的一般性质。
2.尝试利用同一类物质的一般性质预测陌生物质的性质,并设计实验验证。
CO、CO2、SO2、SO3、CaO、Fe2O3、CuO
氧化物
物质组成
非金属氧化物:CO、CO2、SO2、SO3
金属氧化物:CaO、Fe2O3、CuO
性质
酸性氧化物:CO2、SO2、SO3
金属氧化物:CaO、Fe2O3、CuO
一、物质分类与物质性质
研究一类物质的性质
1.按照物质类别将下列物质分类。
金属铁、碳单质、二氧化碳、碳酸钙、碳酸钠、氧气、氧化钙、氢氧化钙、盐酸、氯化钠、氯化钡、硫酸、硫酸钠、硫酸铜、氢氧化铜、氢氧化钠、硝酸银。
2.预测酸具有哪些相似的性质。
3.以酸为例,选取相应试剂,设计实验,证明你的预测。
化合物
酸
碱
盐
氧化物
二氧化碳、氧化钙、氧化铜
硫酸、盐酸
氢氧化钠、氢氧化钙
碳酸钙、碳酸钠、氯化钠、氯化钡、硫酸钠、硫酸铜、硝酸银
金属单质
非金属单质
金属铁
碳单质、氧气
单质
HCl+NaOH====NaCl+H2O
指示剂
紫色石蕊试液变红,无色酚酞不变色。
Fe+2HCl====FeCl2+H2↑
2HCl+Na2O====2NaCl+H2O
碱
HCl+AgNO3====AgCl↓+HNO3
酸
金属
氧化物
盐
盐酸
性质预测 实验现象 结论
酸能使石蕊试液变色
Fe+2HCl==FeCl2+H2↑
酸能跟金属单质反应
CuO+2HCl=CuCl2+H2O
NaOH+HCl=NaCl+H2O
AgNO3+HCl=AgCl↓+HNO3
酸能跟碱性氧化物反应
酸能跟碱发生反应
酸能跟某些盐发生反应
紫色石蕊试液变红
铁溶解,有大量气泡冒出
黑色氧化铜溶解溶液变蓝色
产生白色沉淀
溶液由红色变为无色
类别:指示剂
类别:金属单质
类别:氧化物
类别:碱
类别:盐
类别: 酸
石蕊试液
金属铁
氧化铜
NaOH(酚酞)
AgNO3
盐酸
1.各类物质的一般性质
(1)酸
酸的主要化学性质 反应实例 反应类型
酸+活泼金属→盐+H2
酸+碱性氧化物→盐+水
酸+碱→盐+水
酸与某些盐→新盐+新酸
Zn + H2SO4 == ZnSO4 + H2↑
置换反应
6HCl + Fe2O3 == 2FeCl3 + 3H2O
复分解反应
NaOH + HCl == NaCl + H2O
复分解反应
HCl + AgNO3 == AgCl↓ + HNO3
复分解反应
(2)碱
碱的主要化学性质 反应实例 反应类型
碱+酸性氧化物→盐+水
碱+酸→盐+水
碱+某些盐→新盐+新碱
2NaOH + CO2 == Na2CO3 + H2O
NaOH + HCl == NaCl + H2O
Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
复分解反应
复分解反应
复分解反应
(3)盐
盐的主要化学性质 反应实例 反应类型
盐与金属反应
盐与酸反应
盐与碱反应
盐与某些盐反应
Fe + CuSO4 == FeSO4 + Cu
BaCl2 + H2SO4 == BaSO4↓ + 2HCl
FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓
BaCl2 + Na2SO4 == BaSO4↓ + 2NaCl
置换反应
复分解反应
复分解反应
复分解反应
(4)氧化物
能与碱反应生成盐和水的氧化物为酸性氧化物,如二氧化碳、二氧化硫等;能与酸反应生成盐和水的氧化物为碱性氧化物,如氧化钠、氧化钙等。多数非金属氧化物属于酸性氧化物,多数金属氧化物属于碱性氧化物。
碱性氧化物
少数能与水反应生成碱
能与酸反应生成盐和水
能与某些酸性氧化物化合成盐
酸性氧化物
多数能与水反应生成酸
能与碱反应生成盐和水
能与某些碱性氧化物化合成盐
CO2
Na2O
Na2O+H2O====2NaOH
Na2O+2HCl====2NaCl+H2O
Na2O+CO2====Na2CO3
CO2+H2O====H2CO3
CO2+2NaOH====Na2CO3+H2O
CO2+Na2O====Na2CO3
【思考·讨论】
不是。有些酸不能与金属活动性顺序中氢元素之后的金属反应。
1.酸的通性之一是酸可以与金属反应,是不是酸能与所有的金属发生反应
碱和盐反应时应该符合复分解反应的条件,如生成沉淀或气体或难电离的物质。
2.碱和盐反应时符合什么条件才能发生
根据物质类别预测陌生物质的性质
1.判断陌生物质所属物质类别,根据该类别物质的一般性质及相关反应规律预测该物质可能会与哪些类别的物质发生反应;
2.选择可能与该物质反应的各类物质的代表物,推断可能发生的具体反应。
3.实验验证预测是否正确。
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。
试着以C、Ca为例写出上述物质之间的转化关系,体会由金属单质到盐、非金属到盐的转化关系。
2.物质转化的规律
0
+2
Ca
CaO
Ca(OH)2
CaCl2
单质
氧化物
盐
碱
酸
Ca CaO Ca(OH)2 CaCl2
O2
H2O
HCl
HCl
HCl
C CO2 H 2CO3 CaCO3
Ca (OH)2
O2
H2O
Ca (OH)2
HCl
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
金属单质
非金属单质
酸
酸
酸
碱
练一练
1.对于化学反应A+B===C+D的下列说法中,正确的是( )
A.若生成物C、D有一种为单质,该反应一定是置换反应
B.若生成物C、D分别为两种沉淀,A、B有可能为盐和碱
C.若生成物C、D是盐和水,则A、B一定是酸和碱
D.若生成物C、D是两种化合物,则A、B一定是化合物
B
2.以Fe、CuO、CuCl2溶液、盐酸、氢氧化钠溶液为反应物,两两间可发生的反应有( )
A.6个 B.5个 C.4个 D.3个
B
3.下列变化不能通过一步反应实现的是 ( )
A.Na2CO3→NaOH
B.CuO→CuCl2
C.CaCO3→Ca(OH)2
D.CaO→Ca(OH)2
C
4.分类法是一种重要的学习方法。下列4组物质中均有一种物质的类别与其他三种不同,请分别填出其化学式。
甲:Na、H2、O2、Cl2;
乙:CO、Na2O、CO2、SO2;
丙:NaOH、K2CO3、KHCO3、K2SO4;
丁:NaOH、Ca(OH)2、KOH、NaCl。
(1)甲 ,乙 ,丙 ,丁 。
(2)根据下图写出序号所示反应的化学方程式:
①4Na+O2====2Na2O
②Na2O+H2O====2NaOH
③NaOH+HCl====NaCl+H2O
Na
Na2O
NaOH
NaCl
纯净物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
酸性氧化物
碱性氧化物
