1.2 课时3 氯气与碱反应 课件(共19页) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 1.2 课时3 氯气与碱反应 课件(共19页) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:37:51 | ||
图片预览






文档简介
(共19张PPT)
第2节 研究物质性质的方法和程序 课时3
第一章 认识化学科学
1.掌握氯气与水的反应以及氯水的成分和性质。
2.掌握氯气与碱溶液的反应及应用。
在研究氯气的溶解性时,将氯气放置一段时间后会发现氯水的颜色变浅。这说明氯气具有什么性质呢?
发现新问题。进一步研究
预测 依据
氯气能与水发生反应,产生H+、Cl-等粒子
一、氯气与水的反应
实验用品:氯气,紫色石蕊溶液,AgNO3溶液;
红纸条,试管,胶头滴管,砂纸,烧杯,广口瓶,橡胶塞,导管。(注:Ag+能与Cl-结合生成AgCl沉淀)
请根据右图提示。试用下列实验药品来设计实验方案
实验目的 实验操作
实验目的 实验操作
探究氯气能否与水发生化学反应以及氯水的成分
1.将干燥的氯气依次通过内有干燥红纸条的广口瓶A和内有湿润红纸条的广口瓶B
2.取少量氯水于试管C中,滴加品红试液
3.取少量氯水于试管D中,滴加AgNO3溶液
实验方案设计
视频
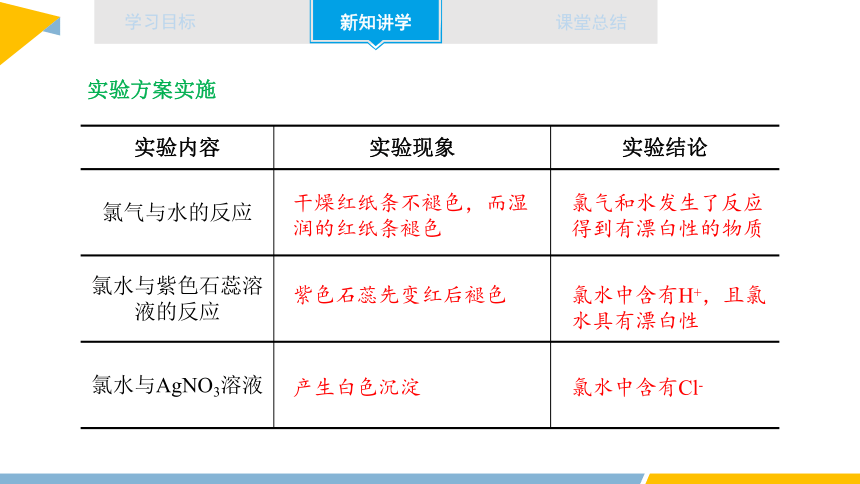
实验内容 实验现象 实验结论
氯气与水的反应
氯水与紫色石蕊溶液的反应
氯水与AgNO3溶液
实验方案实施
干燥红纸条不褪色,而湿润的红纸条褪色
产生白色沉淀
氯气和水发生了反应得到有漂白性的物质
氯水中含有Cl-
紫色石蕊先变红后褪色
氯水中含有H+,且氯水具有漂白性
氯气不仅能溶于水,还能与水发生化学反应,生成盐酸和次氯酸。
Cl2 + H2O==== HCl + HClO
(次氯酸)
很多自来水厂用氯气来杀菌、消毒
次氯酸(HClO)能使有色物质褪色,并能杀灭细菌,因此次氯酸具有漂白作用和消毒作用。
深度思考
1.新制氯水的主要成分有哪些(含有哪些微粒)?
Cl2、HClO、H2O、H+、Cl-、ClO-、OH-(极少量)
2.久置氯水的主要成分有哪些(含有哪些微粒)?
H2O、H+、Cl-、OH-(极少量)
视频
次氯酸不稳定,在光照条件下容易分解放出氧气
光照
2HClO 2HCl+O2↑
液氯和氯水的区别
液氯 氯水
分类
成分
性质 /
纯净物
混合物
分子:
离子:
Cl2 、HClO、H2O
H+、 Cl- 、ClO-、OH-(极少量)
分子:H2O
离子:H+、Cl-、OH-(极少量)
新制氯水
酸性、能漂白、消毒
久置氯水
只有Cl2
酸性
二、氯气与碱的反应
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
有效成分:次氯酸钠
Cl2 + 2 NaOH = NaCl + NaClO + H2O
漂白液(84消毒液)
1.氯气与氢氧化钠的反应
实验室制氯气时,多余的氯气用NaOH溶液吸收。
2.氯气与氢氧化钙的反应
2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
漂白粉成份:CaCl2和Ca(ClO)2;漂白粉有效成份:Ca(ClO)2
【思考】氯气跟碱反应的化学方程式有规律吗?
氯气+碱 氯化物+次氯酸盐+水
常温
漂白剂和消毒剂有效成份
【思考】漂白液、漂白粉的漂白杀菌、消毒的原理是什么?应如何保存?
漂白粉(消毒剂)Ca(ClO)2
漂白液(84消毒液)NaClO
反应原理:强酸制取弱酸
含氯漂白剂和消毒剂通常应避光并置于阴凉处密封保存。
Ca(ClO)2 + CO2 + H2O = CaCO3 ↓ + 2 HClO
NaClO+ CO2 + H2O = NaHCO3 + HClO
用途:既可做漂白棉、麻、纸张的漂白剂,又可做游泳池及环境的消毒剂
【化学与生活】
练一练
1.下列关于氯水的叙述中正确的是( )
A.新制氯水中只含有Cl2和H2O
B.新制氯水可以使紫色石蕊试液先变红后褪色
C.光照氯水有气泡冒出,该气体是氯气
D.氯水放置数天后,溶液的酸性减弱
B
2.下列关于氯气和含氯化合物的叙述不正确的是( )
A.干燥的氯气和新制氯水都能使鲜艳的红花褪色
B.用排水法可以收集到纯净的氯气
C.氯气和氯化氢通入硝酸银溶液中均能生成白色沉淀
D.氯气能用于杀菌、消毒和漂白
B
3.如图:A处通入氯气,C中是干燥的红色布条。关闭
B阀时,C处红布条无变化;打开B阀时,C处红布条褪色。
下列叙述不正确的是( )
A.D中可能是浓硫酸 B.通入的氯气含有水蒸气
C.D中可以是NaOH溶液 D.D中可以是饱和食盐水
A
D
Cl2被D吸收,或被D干燥。
4.将一盛满氯气的试管倒立在盛有氢氧化钠溶液的烧杯中,一段时间后的现象是( )
A.液体充满试管
B.液体进入试管,试管中剩余少量无色气体
C.无明显现象
D.少量液体进入试管,液体呈黄绿色
A
氯气的化学性质
与水反应
与碱反应
Cl2 + H2O= HCl + HClO
Cl2 + 2 NaOH = NaCl + NaClO + H2O
2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
第2节 研究物质性质的方法和程序 课时3
第一章 认识化学科学
1.掌握氯气与水的反应以及氯水的成分和性质。
2.掌握氯气与碱溶液的反应及应用。
在研究氯气的溶解性时,将氯气放置一段时间后会发现氯水的颜色变浅。这说明氯气具有什么性质呢?
发现新问题。进一步研究
预测 依据
氯气能与水发生反应,产生H+、Cl-等粒子
一、氯气与水的反应
实验用品:氯气,紫色石蕊溶液,AgNO3溶液;
红纸条,试管,胶头滴管,砂纸,烧杯,广口瓶,橡胶塞,导管。(注:Ag+能与Cl-结合生成AgCl沉淀)
请根据右图提示。试用下列实验药品来设计实验方案
实验目的 实验操作
实验目的 实验操作
探究氯气能否与水发生化学反应以及氯水的成分
1.将干燥的氯气依次通过内有干燥红纸条的广口瓶A和内有湿润红纸条的广口瓶B
2.取少量氯水于试管C中,滴加品红试液
3.取少量氯水于试管D中,滴加AgNO3溶液
实验方案设计
视频
实验内容 实验现象 实验结论
氯气与水的反应
氯水与紫色石蕊溶液的反应
氯水与AgNO3溶液
实验方案实施
干燥红纸条不褪色,而湿润的红纸条褪色
产生白色沉淀
氯气和水发生了反应得到有漂白性的物质
氯水中含有Cl-
紫色石蕊先变红后褪色
氯水中含有H+,且氯水具有漂白性
氯气不仅能溶于水,还能与水发生化学反应,生成盐酸和次氯酸。
Cl2 + H2O==== HCl + HClO
(次氯酸)
很多自来水厂用氯气来杀菌、消毒
次氯酸(HClO)能使有色物质褪色,并能杀灭细菌,因此次氯酸具有漂白作用和消毒作用。
深度思考
1.新制氯水的主要成分有哪些(含有哪些微粒)?
Cl2、HClO、H2O、H+、Cl-、ClO-、OH-(极少量)
2.久置氯水的主要成分有哪些(含有哪些微粒)?
H2O、H+、Cl-、OH-(极少量)
视频
次氯酸不稳定,在光照条件下容易分解放出氧气
光照
2HClO 2HCl+O2↑
液氯和氯水的区别
液氯 氯水
分类
成分
性质 /
纯净物
混合物
分子:
离子:
Cl2 、HClO、H2O
H+、 Cl- 、ClO-、OH-(极少量)
分子:H2O
离子:H+、Cl-、OH-(极少量)
新制氯水
酸性、能漂白、消毒
久置氯水
只有Cl2
酸性
二、氯气与碱的反应
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
有效成分:次氯酸钠
Cl2 + 2 NaOH = NaCl + NaClO + H2O
漂白液(84消毒液)
1.氯气与氢氧化钠的反应
实验室制氯气时,多余的氯气用NaOH溶液吸收。
2.氯气与氢氧化钙的反应
2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
漂白粉成份:CaCl2和Ca(ClO)2;漂白粉有效成份:Ca(ClO)2
【思考】氯气跟碱反应的化学方程式有规律吗?
氯气+碱 氯化物+次氯酸盐+水
常温
漂白剂和消毒剂有效成份
【思考】漂白液、漂白粉的漂白杀菌、消毒的原理是什么?应如何保存?
漂白粉(消毒剂)Ca(ClO)2
漂白液(84消毒液)NaClO
反应原理:强酸制取弱酸
含氯漂白剂和消毒剂通常应避光并置于阴凉处密封保存。
Ca(ClO)2 + CO2 + H2O = CaCO3 ↓ + 2 HClO
NaClO+ CO2 + H2O = NaHCO3 + HClO
用途:既可做漂白棉、麻、纸张的漂白剂,又可做游泳池及环境的消毒剂
【化学与生活】
练一练
1.下列关于氯水的叙述中正确的是( )
A.新制氯水中只含有Cl2和H2O
B.新制氯水可以使紫色石蕊试液先变红后褪色
C.光照氯水有气泡冒出,该气体是氯气
D.氯水放置数天后,溶液的酸性减弱
B
2.下列关于氯气和含氯化合物的叙述不正确的是( )
A.干燥的氯气和新制氯水都能使鲜艳的红花褪色
B.用排水法可以收集到纯净的氯气
C.氯气和氯化氢通入硝酸银溶液中均能生成白色沉淀
D.氯气能用于杀菌、消毒和漂白
B
3.如图:A处通入氯气,C中是干燥的红色布条。关闭
B阀时,C处红布条无变化;打开B阀时,C处红布条褪色。
下列叙述不正确的是( )
A.D中可能是浓硫酸 B.通入的氯气含有水蒸气
C.D中可以是NaOH溶液 D.D中可以是饱和食盐水
A
D
Cl2被D吸收,或被D干燥。
4.将一盛满氯气的试管倒立在盛有氢氧化钠溶液的烧杯中,一段时间后的现象是( )
A.液体充满试管
B.液体进入试管,试管中剩余少量无色气体
C.无明显现象
D.少量液体进入试管,液体呈黄绿色
A
氯气的化学性质
与水反应
与碱反应
Cl2 + H2O= HCl + HClO
Cl2 + 2 NaOH = NaCl + NaClO + H2O
2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
