2.3 课时5 氧化还原反应方程式的配平 课件 (共19页)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 课时5 氧化还原反应方程式的配平 课件 (共19页)2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 978.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第3节 氧化还原反应 课时5
第二章 元素与物质世界
1.能根据氧化还原反应得失电子守恒规律配平氧化还原反应方程式。
2.能运用氧化还原反应得失电子守恒规律解决与氧化还原反应有关的计算。
一、氧化还原反应的配平
1.配平原则
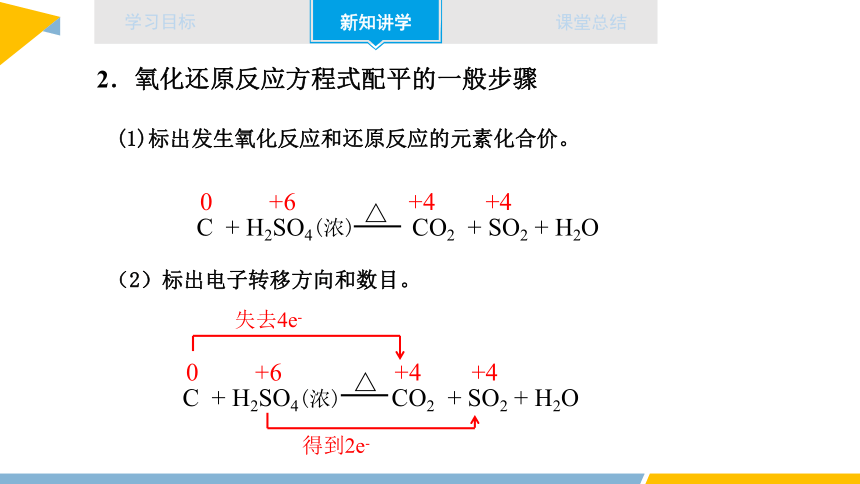
2.氧化还原反应方程式配平的一般步骤
(1)标出发生氧化反应和还原反应的元素化合价。
0 +6 +4 +4
C + H2SO4(浓) CO2 + SO2 + H2O
△
(2)标出电子转移方向和数目。
得到2e-
失去4e-
0 +6 +4 +4
C + H2SO4(浓) CO2 + SO2 + H2O
△
(3)依据得失电子守恒,使化合价升高和降低的总数相等。
得到2e-
失去4e-
0 +6 +4 +4
C + H2SO4(浓) CO2 + SO2 + H2O
△
× 1
× 2
(4)确定氧化剂,还原剂,氧化产物,还原产物的系数;用观察法配平其他各物质的化学计量数。
1
2
1
2
2
(5)检查质量、得失电子、电荷是否守恒
S + HNO3 === H2SO4 + NO2↑ + H2O
C + HNO3 === NO2 ↑ + CO2 ↑ + H2O
1
6
1
6
2
1
4
4
1
2
练一练
3.三种配平方法
(1)正向配平法
若参加反应的氧化剂全部被还原,参加反应的还原剂全部被氧化,可根据化合价升降总数相等,确定氧化剂和还原剂的化学计量数,然后用观察法配平其他物质。
例:请完成下列方程式的配平。
H2S + SO2 — S + H2O
H2S + HNO3 — S↓ + NO↑ + H2O
H2S + SO2 — S + H2O
-2
+4
0
2
4
1
2
3
2
2
H2S + HNO3 — S↓ + NO↑ + H2O
-2
+5
0
3
3
2
3
3
2
2
+2
2
4
(2)逆向配平法
部分氧化还原反应、自身氧化还原反应等,应先确定氧化产物和还原产物的化学计量数,然后用观察法确定氧化剂和还原剂的化学计量数。
例:请完成下列方程式的配平。
S + KOH — K2S + K2SO3 + H2O
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
S + KOH — K2S + K2SO3 + H2O
0
-2
+4
6
2
4
2
1
2
3
3
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
+6
-1
+3
0
3 2
1 2
1
3
2
3
14
7
2
6
8
(3)缺项配平法
缺项物质一般为水、酸或碱;若为离子方程式,则配平时补H2O、H+或OH—。先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后用元素守恒确定未知物,再根据离子守恒和电荷守恒进行配平。
条件 补项原则
酸性条件 缺H(氢)或多O(氧)补H+,少O(氧)补H2O
碱性条件 缺H(氢)或多O(氧)补H2O,少O(氧)补OH-
例:请完成下列方程式的配平。
+ H2C2O4+ H+ = Mn2++ CO2 +____
+ H2C2O4+ H+ Mn2++ CO2 +____
+7
+3
+2
+4
2
5
2
5
2
5
6
2
10
8H2O
练一练
__+__H2O2+___===__Mn2++__O2↑+__H2O
2
5
6H+
2
5
8
1.请完成下列方程式的配平。
2.将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
NaBiO3+__Mn2++__→__Na++__Bi3++__+__
【答案】 5 2 14H+ 5 5 2 7H2O
3.+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的还原成Cr3+,该反应的离子方程式为 。
+ +5H+=2Cr3++ +4H2O
二、氧化还原反应有关的计算
【例1】24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
【解析】根据电子得失守恒法计算,设Cr在还原产物中的化合价为x,则0.024 L×0.05 mol·L-1×2=0.02 L×0.02 mol·L-1×2×(6-x)得x=+3。
B
【例2】将0.195 g锌粉加入20.0 mL的0.100 mol·L-1溶液中,恰好反应,则还原产物可能是( )
A.M B.M2+
C.M3+ D.MO2+
【解析】依据氧化还原反应中得失电子守恒,0.003 mol锌的化合价变化等于元素M在反应中的化合价变化,设M由+5变为x,所以(5-x)×0.02×0.1=0.006,可得x=+2,B项正确。
B
方法小结:解决有关氧化还原反应的计算问题,应遵循氧化还原反应中的得失电子守恒规律,即氧化剂和还原剂得失电子总数相等,化合价升高总数等于化合价降低总数。
练一练
1.NaNO2是一种食品添加剂,它能致癌。酸性高锰酸钾溶液与亚硝酸钠反应的离子方程式是++ →Mn2+++H2O。下列叙述正确的是( )
A.该反应中被还原
B.反应过程中溶液的pH变小
C.生成1 mol NaNO3需要消耗0.4 mol KMnO4
D. 中的粒子是OH-
C
2.一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 。
2︰3
氧化还原反应的配平与计算
配平
计算
依据
步骤
方法
电荷守恒
得失电子守恒
标、等、定、平、查
正向配平法
逆向配平法
缺项配平法
依据
得失电子守恒
质量守恒
第3节 氧化还原反应 课时5
第二章 元素与物质世界
1.能根据氧化还原反应得失电子守恒规律配平氧化还原反应方程式。
2.能运用氧化还原反应得失电子守恒规律解决与氧化还原反应有关的计算。
一、氧化还原反应的配平
1.配平原则
2.氧化还原反应方程式配平的一般步骤
(1)标出发生氧化反应和还原反应的元素化合价。
0 +6 +4 +4
C + H2SO4(浓) CO2 + SO2 + H2O
△
(2)标出电子转移方向和数目。
得到2e-
失去4e-
0 +6 +4 +4
C + H2SO4(浓) CO2 + SO2 + H2O
△
(3)依据得失电子守恒,使化合价升高和降低的总数相等。
得到2e-
失去4e-
0 +6 +4 +4
C + H2SO4(浓) CO2 + SO2 + H2O
△
× 1
× 2
(4)确定氧化剂,还原剂,氧化产物,还原产物的系数;用观察法配平其他各物质的化学计量数。
1
2
1
2
2
(5)检查质量、得失电子、电荷是否守恒
S + HNO3 === H2SO4 + NO2↑ + H2O
C + HNO3 === NO2 ↑ + CO2 ↑ + H2O
1
6
1
6
2
1
4
4
1
2
练一练
3.三种配平方法
(1)正向配平法
若参加反应的氧化剂全部被还原,参加反应的还原剂全部被氧化,可根据化合价升降总数相等,确定氧化剂和还原剂的化学计量数,然后用观察法配平其他物质。
例:请完成下列方程式的配平。
H2S + SO2 — S + H2O
H2S + HNO3 — S↓ + NO↑ + H2O
H2S + SO2 — S + H2O
-2
+4
0
2
4
1
2
3
2
2
H2S + HNO3 — S↓ + NO↑ + H2O
-2
+5
0
3
3
2
3
3
2
2
+2
2
4
(2)逆向配平法
部分氧化还原反应、自身氧化还原反应等,应先确定氧化产物和还原产物的化学计量数,然后用观察法确定氧化剂和还原剂的化学计量数。
例:请完成下列方程式的配平。
S + KOH — K2S + K2SO3 + H2O
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
S + KOH — K2S + K2SO3 + H2O
0
-2
+4
6
2
4
2
1
2
3
3
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
+6
-1
+3
0
3 2
1 2
1
3
2
3
14
7
2
6
8
(3)缺项配平法
缺项物质一般为水、酸或碱;若为离子方程式,则配平时补H2O、H+或OH—。先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后用元素守恒确定未知物,再根据离子守恒和电荷守恒进行配平。
条件 补项原则
酸性条件 缺H(氢)或多O(氧)补H+,少O(氧)补H2O
碱性条件 缺H(氢)或多O(氧)补H2O,少O(氧)补OH-
例:请完成下列方程式的配平。
+ H2C2O4+ H+ = Mn2++ CO2 +____
+ H2C2O4+ H+ Mn2++ CO2 +____
+7
+3
+2
+4
2
5
2
5
2
5
6
2
10
8H2O
练一练
__+__H2O2+___===__Mn2++__O2↑+__H2O
2
5
6H+
2
5
8
1.请完成下列方程式的配平。
2.将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
NaBiO3+__Mn2++__→__Na++__Bi3++__+__
【答案】 5 2 14H+ 5 5 2 7H2O
3.+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的还原成Cr3+,该反应的离子方程式为 。
+ +5H+=2Cr3++ +4H2O
二、氧化还原反应有关的计算
【例1】24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
【解析】根据电子得失守恒法计算,设Cr在还原产物中的化合价为x,则0.024 L×0.05 mol·L-1×2=0.02 L×0.02 mol·L-1×2×(6-x)得x=+3。
B
【例2】将0.195 g锌粉加入20.0 mL的0.100 mol·L-1溶液中,恰好反应,则还原产物可能是( )
A.M B.M2+
C.M3+ D.MO2+
【解析】依据氧化还原反应中得失电子守恒,0.003 mol锌的化合价变化等于元素M在反应中的化合价变化,设M由+5变为x,所以(5-x)×0.02×0.1=0.006,可得x=+2,B项正确。
B
方法小结:解决有关氧化还原反应的计算问题,应遵循氧化还原反应中的得失电子守恒规律,即氧化剂和还原剂得失电子总数相等,化合价升高总数等于化合价降低总数。
练一练
1.NaNO2是一种食品添加剂,它能致癌。酸性高锰酸钾溶液与亚硝酸钠反应的离子方程式是++ →Mn2+++H2O。下列叙述正确的是( )
A.该反应中被还原
B.反应过程中溶液的pH变小
C.生成1 mol NaNO3需要消耗0.4 mol KMnO4
D. 中的粒子是OH-
C
2.一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 。
2︰3
氧化还原反应的配平与计算
配平
计算
依据
步骤
方法
电荷守恒
得失电子守恒
标、等、定、平、查
正向配平法
逆向配平法
缺项配平法
依据
得失电子守恒
质量守恒
