第3章 章末复习 课件 (共42页)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章 章末复习 课件 (共42页)2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:34:43 | ||
图片预览








文档简介
(共42张PPT)
章末复习
第三章 物质的性质与转化
1.能分别列举、描述含有铁、硫或氮元素的典型物质重要的物理和化学性质,并能书写相关的化学方程式和离子方程式。
2.能熟练掌握硝酸与金属反应的计算问题。
3.能掌握铁、硫、氮及其化合物的转化关系。
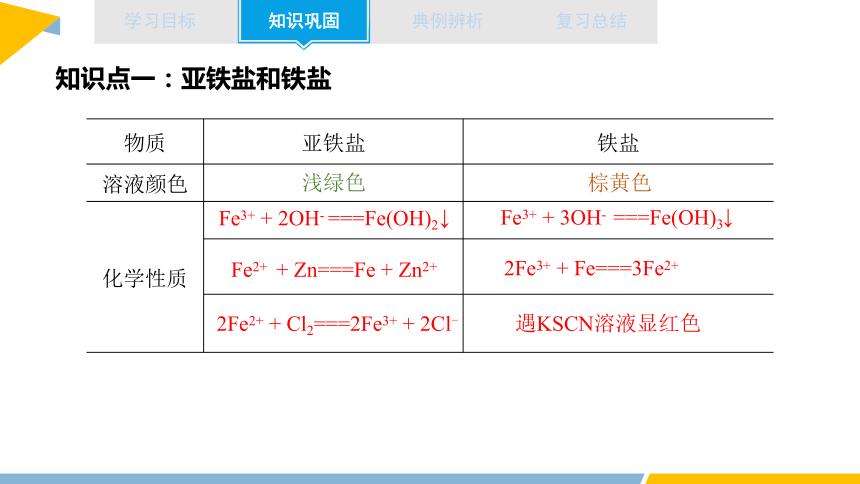
知识点一:亚铁盐和铁盐
物质 亚铁盐 铁盐
溶液颜色
化学性质
浅绿色
棕黄色
与碱反应
与碱反应
Fe3+ + 3OH- ===Fe(OH)3
↓
Fe3+ + 2OH- ===Fe(OH)2
↓
2Fe2+ + Cl2===2Fe3+ + 2Cl-
Fe2+ + Zn===Fe + Zn2+
2Fe3+ + Fe===3Fe2+
遇KSCN溶液显红色
知识点二:铁、铁的氧化物和铁的氢氧化物
1.铁的化学性质
(1)与非金属单质反应
(2)与非氧化性酸反应
(3)与盐溶液反应
(4)与水反应
3Fe+4H2O(g)===Fe3O4+4H2
高温
2.铁的氧化物的化学性质
(1)与稀盐酸反应
(2)与还原剂反应(铝热反应)
Fe2O3+2Al===2Fe+Al2O3
高温
3.铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
物理性质
化学性质
特征转化
白色固体,难溶
红褐色固体,难溶
与酸反应
4 Fe(OH)2+ 2H2O + O2===4 Fe(OH)3
白色沉淀先变成灰绿色,最终变为红褐色
知识点三:硫单质
1.物理性质
通常状况下,它是一种黄色或淡黄色固体;不溶于水,微溶于酒精,易溶于CS2;熔点和沸点都不高。
2.化学性质
(2)还原性
(1)氧化性
Fe + S===FeS
S + O2===SO2
3.用途
硫黄主要用于制造硫酸、化肥、火柴、杀虫剂等。
低价态化合物
知识点四:二氧化硫
1.物理性质
2.化学性质
无色有刺激性气味气体,易溶于水,有毒
(1)酸性氧化物
的性质
(2)氧化性
(3)还原性
(4)漂白性
SO2+2NaOH===Na2SO3+H2O
SO2+2H2S===3S↓+2H2O
能使品红等有色物质褪色
Cl2+SO2+2H2O===H2SO4+2HCl
SO2+H2O H2SO3
知识点五:氮气
1.物理性质
2.化学性质
无色无味的气体,难溶于水。
N2+3H2 2NH3
N2+O2===2NO
放电
3.氮的固定
将空气中游离态的氮转化为含氮化合物的过程。
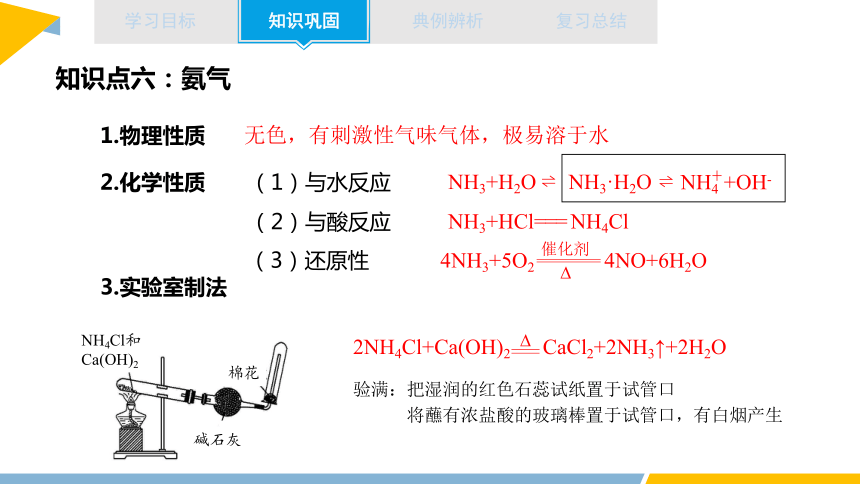
知识点六:氨气
1.物理性质
2.化学性质
无色,有刺激性气味气体,极易溶于水
(1)与水反应
(2)与酸反应
NH3+H2O NH3·H2O
NH3+HCl=== NH4Cl
(3)还原性
4NH3+5O2 4NO+6H2O
催化剂
3.实验室制法
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
碱石灰
棉花
NH4Cl和Ca(OH)2
验满:把湿润的红色石蕊试纸置于试管口
将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
NH4 +OH-
+
知识点七:铵盐
1.物理性质
易溶于水的白色晶体
(1)受热分解
2.化学性质
①NH4Cl不稳定,受热分解:
②NH4HCO3不稳定,受热分解:
NH4Cl
NH3↑+HCl↑
NH4HCO3
NH3↑+H2O+CO2↑
(2)与碱反应
+OH-
NH3↑+H2O
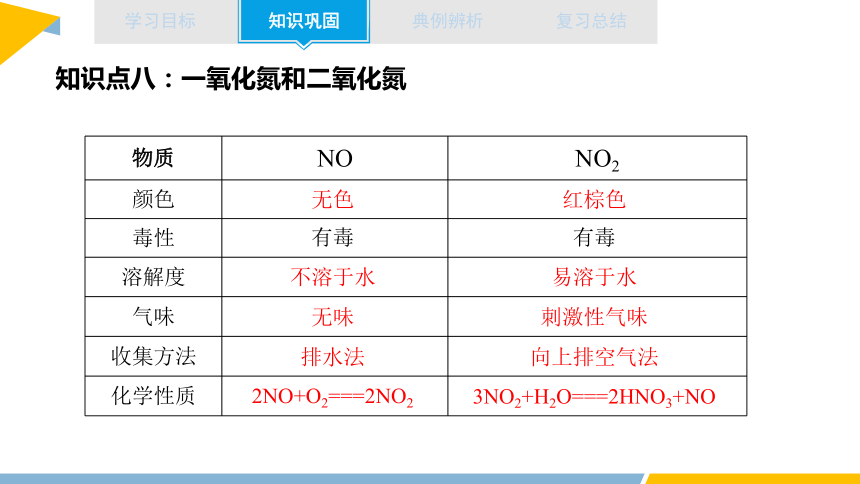
知识点八:一氧化氮和二氧化氮
物质 NO NO2
颜色
毒性
溶解度
气味
收集方法
化学性质
红棕色
无色
有毒
有毒
不溶于水
易溶于水
无味
刺激性气味
排水法
向上排空气法
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
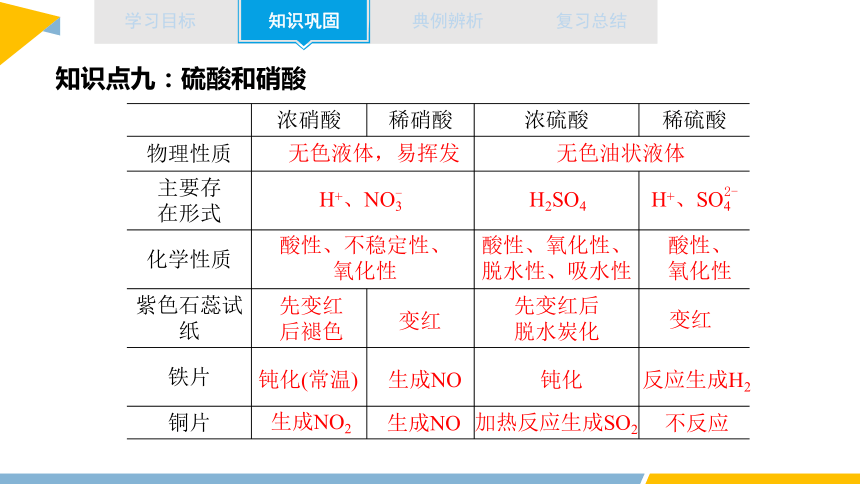
知识点九:硫酸和硝酸
浓硝酸 稀硝酸 浓硫酸 稀硫酸
物理性质
主要存 在形式
化学性质
紫色石蕊试纸
铁片
铜片
H+、NO3
-
H+、SO4
2-
无色液体,易挥发
无色油状液体
H2SO4
酸性、不稳定性、
氧化性
酸性、氧化性、脱水性、吸水性
酸性、
氧化性
先变红
后褪色
变红
先变红后
脱水炭化
变红
钝化(常温)
生成NO
钝化
反应生成H2
不反应
加热反应生成SO2
生成NO
生成NO2
知识点十:规律与方法
1.预测物质的性质
2.物质的转化思路
3.复杂体系中某种微粒检验的思路
物质类别
中心元素价态
(1)含有相同价态中心元素的物质间的转化,
可借助复分解反应实现;
(2)含有不同价态中心元素的物质间的转化,
可借助氧化还原反应实现。
分析体系微粒,明确性质差异,排除干扰因素,选择检验方法
【考点一】SO2的漂白性
【例1】下列实验能说明SO2具有漂白性的是( )
A.SO2能使溴水褪色
B.SO2能使KMnO4溶液褪色
C.SO2能使滴有酚酞的NaOH溶液褪色
D.SO2能使品红溶液褪色
D
【方法归纳】
并不是所有与SO2有关的褪色现象都属于SO2的漂白性,如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2与碱发生反应;②SO2能使溴水和酸性KMnO4溶液褪色是因为SO2的还原性。
练一练
1.下列说法正确的是
(1)二氧化硫与氯水混合使用漂白效果会更好( )
(2)二氧化硫使湿润的蓝色石蕊试纸先变红后褪色( )
(3)某气体通入溴水中,能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生,说明该气体是二氧化硫。( )
【考点二】SO2和CO2的检验
【例1】不能鉴别二氧化硫和二氧化碳的化学试剂是( )
A.溴水 B.高锰酸钾溶液
C.品红溶液 D.澄清石灰水
D
【方法归纳】
SO2和CO2都能使澄清石灰水变浑浊。
SO2和CO2的最大区别在于SO2具有漂白性、还原性和氧化性,而CO2只有氧化性。
1.为验证木炭与浓硫酸反应生成物中有二氧化硫和二氧化碳,选用下图仪器(含所盛物质),组装成套实验装置,试回答下列问题。
(1)在实验进行中,按气流方向从左到右顺序,A、B、C、D各装置的连接应该(用字母符号)是:___________。
A D C B
练一练
(2)试管B、C、D中各有什么现象,才能表示已检出二氧化碳、二氧化硫?
B中为_________________。C中为___________________________________________________________________
D中为_____________。
(3)写出A装置中反应化学方程式:___________________________________。
澄清石灰水变浑浊
品红溶液褪色
C中第二支试管中酸性高锰酸钾溶液褪色,第一支试管中酸性高锰酸钾溶液不褪色
2H2SO4(浓)+C===2SO2↑+CO2↑+2H2O
【考点三】酸的氧化性和氧化性酸
【例1】室温下,某兴趣小组用下图所示装置在通风橱中进行如下实验:
下列说法不正确的是( )
A.试管Ⅱ中红棕色气体为NO2,由硝酸被还原生成
B.等质量的Cu完全溶解时,Ⅱ试管中消耗的HNO3多
C.将Cu换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
C
【方法归纳】
①酸的氧化性实质上指H+的氧化性
②氧化性酸是酸根离子中心原子显示氧化性的酸,酸根离子获得电子后,中心原子化合价降低,形成相应的低价含氧化合物甚至单质。
③作为氧化性酸,不仅能氧化金属而且还能氧化某些非金属单质。而酸的氧化性即H+的氧化能力较弱,只能氧化较活泼的金属(即金属活动性顺序中氢前面的金属)。
1.关于下列事实的解释错误的是( )
A.纸张上滴上浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,可以通过通入O2消除黄色
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.浓硫酸常温下与铜不反应,加热时才能发生反应
C
练一练
【考点四】检验铵根离子
【例1】检验铵根离子的实验所依据的是:①氨气极易溶于水;②铵根离子与OH- 间发生反应产生氨气;③NH3·H2O电离出NH4+和OH -;④石蕊在碱性条件下变为蓝色。( )
A.②④ B.①②③④ C.①②③ D.②③④
D
【方法归纳】
离子方程式:
碱
加热
氨气
湿润的红色石蕊试纸
变蓝
浓盐酸
白烟
铵盐
+OH-
NH3↑+H2O
【易错混淆】
必须先加碱再加热,因为铵盐受热不一定分解产生氨气。
1.检验铵根离子的一般方法是取少许待测物置于试管中,然后( )
A.直接加热,用湿润的红色石蕊试纸在试管口检验
B.向溶液中滴加紫色石蕊试液
C.加入强酸溶液加热后,再滴入酚酞试液
D.加入强碱溶液加热后,再用湿润的红色石蕊试纸靠近试管口检验
D
练一练
【考点五】制备氢氧化亚铁
【例1】用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________________。
避免生成的Fe(OH)2与氧气接触而被氧化
稀硫酸、铁屑
加热煮沸
【方法归纳】
Fe(OH)2制备成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭的、隔绝空气的体系中。
常用方法:①反应在试管底部进行。②加隔氧剂,如加入汽油、苯等比水轻的有机溶剂。③还原性气体保护法,利用的H2排尽整个装置中的空气。
练一练
1.下列各图所示的实验中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③ B.①②④ C.①②③④ D.②③④
B
【考点六】硝酸与金属反应的计算
【例1】在浓硝酸中放入铜片。
(1)反应开始的化学方程式为 ,
现象为 。
(2)若铜有剩余,反应快结束时的化学方程式是
。
(3)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,
其原因是 。
(4)若将12.8 g铜跟一定质量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),
则所消耗的硝酸的物质的量是 。
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
铜片逐渐溶解,溶液由无色变为蓝色,有红棕色气体生成
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
H+、NO3与Cu发生反应:3Cu+8H++2NO3 === 3Cu2++2NO↑+4H2O
-
-
0.65 mol
【方法归纳】
(1)N原子守恒:反应前所有的N只存在于HNO3中,反应后含N的物质有HNO3的还原产物、Cu(NO3)2和剩余的HNO3,则有:
n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n剩(HNO3)
(2)得失电子守恒:Cu-2e-→Cu2+
NO3+e-→NO2、 NO3+3e-→NO
(3)溶液中的电荷守恒:①若HNO3不过量:n(NO3)=2n(Cu2+)
②若HNO3过量:n(NO3)=2n(Cu2+)+n(H+)
-
-
-
-
练一练
1.将32gCu投入到80mL5mol/L的HNO3溶液中,充分反应后,向溶液中再加入200mL2mol/LH2SO4溶液,使之充分反应,两步反应共生成NO在标况下的体积( )
A.2.24L B.6.72L C.8.96L D.11.2L
B
2.铜与足量浓硝酸反应,得到硝酸铜溶液和由NO2、N2O4、NO组成的混合气体,这些气体与896ml(标准状况)O2混合后通入水中,能完全被水吸收生成硝酸。则消耗铜的质量为( )
A.2.56g B.5.12g C.6.4g D.10.24g
B
【考点七】元素及其化合物的转化与推断
请回答下列问题:
I.若B是碱性气体;D气体为红棕色。
(1)请写出A的化学式:_______。
(2)请写出下列转化过程的化学方程式:
【例1】A、B、C、D中均含有同一种元素,其中A是单质,它们的转化关系如图所示:
N2
A→B: ____ __;B→C:_____ 。
4NH3+5O2 4NO+6H2O
催化剂
(3)向D溶于水形成的稀溶液中加入过量铜片,待铜片不再溶解时,向其中加入几滴浓硫酸,可观察到铜片继续溶解。请用离子方程式解释该现象:___ ___。
II.若A、B、D既能与强酸溶液反应,又能与强碱溶液反应。
(1)C→D可通过滴加氨水实现,该反应的离子方程式为:
____ _ _。
(2)请写出A用于焊接铁轨的化学方程式:____ ___。
3Cu+8H++2NO3===3Cu2++2NO↑+4H2O
-
Al3++3NH3 H2O===Al(OH)3↓+3NH4
+
Fe2O3+2Al===2Fe+Al2O3
高温
【方法归纳】
1.解题“五步曲”
①审:审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
②找:找“题眼”即找到解题的突破口。
③析:从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维进行综合分析、推理,初步得出结论。
④验:验证确认,将结果代入原题检验。
⑤答:按题目的要求写出答案。
2.破题最关键:寻找解题“突破口”,抓“特”字
(1)特征现象
①颜色:NO2(红棕色)、亚铁盐溶液(浅绿色)等。
②有漂白作用的气体:Cl2(有水时)、SO2等。
③通常可作为保护气的气体:N2和Ar等。
④溶于水显碱性的气体只有NH3。
⑤在空气中迅速由无色变为红棕色的气体只有NO。
⑥能与盐酸作用产生有刺激性气味的无色气体,且将该气体通入品红溶液中能使之褪色,加热后又恢复原来颜色的物质必含 。
(2)特征转化关系
①连续转化:
②三角转化:
练一练
1.分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
①若E为红棕色气体,则该气体的收集方法为 ;X分子含有10个
电子,则气体X的水溶液显 性。
②若Y为淡黄色固体单质,则物质X与Z反应的化学方程式为 。
向上排空气法
碱
2H2S+SO2===3S+2H2O
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是 ;
若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量
0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为
;
反应快结束时的离子反应方程式为 。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(标况下),则参加反应的硝酸的物质的量为 。
H2
小于
Zn+2 H2SO4(浓)===ZnSO4+SO2↑+2 H2O
Zn+2H+===Zn2++H2↑
0.3mol
【考点八】环境污染问题
【例1】硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中 ②先将铜与O2反应生成CuO,再溶于硝酸中 ③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断中错误的是( )
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
A
【方法归纳】
如何在产业的源头将污染消除,从根本上消除污染。
绿色化学
核心内容
原子经济性和“5R”原则
研究内容
污染类型 具体表现 主要物质
空气污染 酸雨 SO2、氮氧化物
光化学烟雾 氮氧化物、碳氢化合物
雾霾 SO2、氮氧化物、颗粒物
温室效应 CO2、CH4
水体污染 重金属污染 重金属离子(工业废水)
富营养化 N、P(化肥过量使用)
1.2016年1月1日起修订的《中华人民共和国大气污染防治法》正式施行,这将对我国的大气污染防治产生重要影响.下列有关说法正确的是( )
A.“温室效应”“酸雨”的形成都与氮氧化合物有关
B.对矿物燃料进行脱硫脱硝可有效防治酸雨
C.pH在5.6~7.0之间的降水通常称为酸雨
D.PM2.5是指环境空气中直径大于或等于2.5微米的颗粒物
练一练
B
2. “绿色化学”是预防污染的基本手段,下列做法属于“绿色化学”的是( )
A.处理废弃物 B.杜绝污染源 C.禁食有毒物 D.制订治污规章制度
B
物质的性质与转化
铁的多样性
硫的转化
氮的循环
亚铁盐和铁盐
铁
铁的氧化物
铁的氢氧化物
硫单质
二氧化硫
硫酸
酸雨
氮气
氮的氧化物
氨气
光化学污染
与水蒸气反应
铝热反应
还原性
氧化性
酸性氧化物
氧化性、还原性、漂白性
氧化性
与铜反应
吸水性
脱水性
干燥剂
<5.6
氮的固定
还原性
NO
NO2
制取氨气
铵盐
硝酸
受热易分解
与碱反应
不稳定性
强氧化性
酸的通性
章末复习
第三章 物质的性质与转化
1.能分别列举、描述含有铁、硫或氮元素的典型物质重要的物理和化学性质,并能书写相关的化学方程式和离子方程式。
2.能熟练掌握硝酸与金属反应的计算问题。
3.能掌握铁、硫、氮及其化合物的转化关系。
知识点一:亚铁盐和铁盐
物质 亚铁盐 铁盐
溶液颜色
化学性质
浅绿色
棕黄色
与碱反应
与碱反应
Fe3+ + 3OH- ===Fe(OH)3
↓
Fe3+ + 2OH- ===Fe(OH)2
↓
2Fe2+ + Cl2===2Fe3+ + 2Cl-
Fe2+ + Zn===Fe + Zn2+
2Fe3+ + Fe===3Fe2+
遇KSCN溶液显红色
知识点二:铁、铁的氧化物和铁的氢氧化物
1.铁的化学性质
(1)与非金属单质反应
(2)与非氧化性酸反应
(3)与盐溶液反应
(4)与水反应
3Fe+4H2O(g)===Fe3O4+4H2
高温
2.铁的氧化物的化学性质
(1)与稀盐酸反应
(2)与还原剂反应(铝热反应)
Fe2O3+2Al===2Fe+Al2O3
高温
3.铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
物理性质
化学性质
特征转化
白色固体,难溶
红褐色固体,难溶
与酸反应
4 Fe(OH)2+ 2H2O + O2===4 Fe(OH)3
白色沉淀先变成灰绿色,最终变为红褐色
知识点三:硫单质
1.物理性质
通常状况下,它是一种黄色或淡黄色固体;不溶于水,微溶于酒精,易溶于CS2;熔点和沸点都不高。
2.化学性质
(2)还原性
(1)氧化性
Fe + S===FeS
S + O2===SO2
3.用途
硫黄主要用于制造硫酸、化肥、火柴、杀虫剂等。
低价态化合物
知识点四:二氧化硫
1.物理性质
2.化学性质
无色有刺激性气味气体,易溶于水,有毒
(1)酸性氧化物
的性质
(2)氧化性
(3)还原性
(4)漂白性
SO2+2NaOH===Na2SO3+H2O
SO2+2H2S===3S↓+2H2O
能使品红等有色物质褪色
Cl2+SO2+2H2O===H2SO4+2HCl
SO2+H2O H2SO3
知识点五:氮气
1.物理性质
2.化学性质
无色无味的气体,难溶于水。
N2+3H2 2NH3
N2+O2===2NO
放电
3.氮的固定
将空气中游离态的氮转化为含氮化合物的过程。
知识点六:氨气
1.物理性质
2.化学性质
无色,有刺激性气味气体,极易溶于水
(1)与水反应
(2)与酸反应
NH3+H2O NH3·H2O
NH3+HCl=== NH4Cl
(3)还原性
4NH3+5O2 4NO+6H2O
催化剂
3.实验室制法
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
碱石灰
棉花
NH4Cl和Ca(OH)2
验满:把湿润的红色石蕊试纸置于试管口
将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
NH4 +OH-
+
知识点七:铵盐
1.物理性质
易溶于水的白色晶体
(1)受热分解
2.化学性质
①NH4Cl不稳定,受热分解:
②NH4HCO3不稳定,受热分解:
NH4Cl
NH3↑+HCl↑
NH4HCO3
NH3↑+H2O+CO2↑
(2)与碱反应
+OH-
NH3↑+H2O
知识点八:一氧化氮和二氧化氮
物质 NO NO2
颜色
毒性
溶解度
气味
收集方法
化学性质
红棕色
无色
有毒
有毒
不溶于水
易溶于水
无味
刺激性气味
排水法
向上排空气法
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
知识点九:硫酸和硝酸
浓硝酸 稀硝酸 浓硫酸 稀硫酸
物理性质
主要存 在形式
化学性质
紫色石蕊试纸
铁片
铜片
H+、NO3
-
H+、SO4
2-
无色液体,易挥发
无色油状液体
H2SO4
酸性、不稳定性、
氧化性
酸性、氧化性、脱水性、吸水性
酸性、
氧化性
先变红
后褪色
变红
先变红后
脱水炭化
变红
钝化(常温)
生成NO
钝化
反应生成H2
不反应
加热反应生成SO2
生成NO
生成NO2
知识点十:规律与方法
1.预测物质的性质
2.物质的转化思路
3.复杂体系中某种微粒检验的思路
物质类别
中心元素价态
(1)含有相同价态中心元素的物质间的转化,
可借助复分解反应实现;
(2)含有不同价态中心元素的物质间的转化,
可借助氧化还原反应实现。
分析体系微粒,明确性质差异,排除干扰因素,选择检验方法
【考点一】SO2的漂白性
【例1】下列实验能说明SO2具有漂白性的是( )
A.SO2能使溴水褪色
B.SO2能使KMnO4溶液褪色
C.SO2能使滴有酚酞的NaOH溶液褪色
D.SO2能使品红溶液褪色
D
【方法归纳】
并不是所有与SO2有关的褪色现象都属于SO2的漂白性,如①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2与碱发生反应;②SO2能使溴水和酸性KMnO4溶液褪色是因为SO2的还原性。
练一练
1.下列说法正确的是
(1)二氧化硫与氯水混合使用漂白效果会更好( )
(2)二氧化硫使湿润的蓝色石蕊试纸先变红后褪色( )
(3)某气体通入溴水中,能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生,说明该气体是二氧化硫。( )
【考点二】SO2和CO2的检验
【例1】不能鉴别二氧化硫和二氧化碳的化学试剂是( )
A.溴水 B.高锰酸钾溶液
C.品红溶液 D.澄清石灰水
D
【方法归纳】
SO2和CO2都能使澄清石灰水变浑浊。
SO2和CO2的最大区别在于SO2具有漂白性、还原性和氧化性,而CO2只有氧化性。
1.为验证木炭与浓硫酸反应生成物中有二氧化硫和二氧化碳,选用下图仪器(含所盛物质),组装成套实验装置,试回答下列问题。
(1)在实验进行中,按气流方向从左到右顺序,A、B、C、D各装置的连接应该(用字母符号)是:___________。
A D C B
练一练
(2)试管B、C、D中各有什么现象,才能表示已检出二氧化碳、二氧化硫?
B中为_________________。C中为___________________________________________________________________
D中为_____________。
(3)写出A装置中反应化学方程式:___________________________________。
澄清石灰水变浑浊
品红溶液褪色
C中第二支试管中酸性高锰酸钾溶液褪色,第一支试管中酸性高锰酸钾溶液不褪色
2H2SO4(浓)+C===2SO2↑+CO2↑+2H2O
【考点三】酸的氧化性和氧化性酸
【例1】室温下,某兴趣小组用下图所示装置在通风橱中进行如下实验:
下列说法不正确的是( )
A.试管Ⅱ中红棕色气体为NO2,由硝酸被还原生成
B.等质量的Cu完全溶解时,Ⅱ试管中消耗的HNO3多
C.将Cu换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
C
【方法归纳】
①酸的氧化性实质上指H+的氧化性
②氧化性酸是酸根离子中心原子显示氧化性的酸,酸根离子获得电子后,中心原子化合价降低,形成相应的低价含氧化合物甚至单质。
③作为氧化性酸,不仅能氧化金属而且还能氧化某些非金属单质。而酸的氧化性即H+的氧化能力较弱,只能氧化较活泼的金属(即金属活动性顺序中氢前面的金属)。
1.关于下列事实的解释错误的是( )
A.纸张上滴上浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,可以通过通入O2消除黄色
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.浓硫酸常温下与铜不反应,加热时才能发生反应
C
练一练
【考点四】检验铵根离子
【例1】检验铵根离子的实验所依据的是:①氨气极易溶于水;②铵根离子与OH- 间发生反应产生氨气;③NH3·H2O电离出NH4+和OH -;④石蕊在碱性条件下变为蓝色。( )
A.②④ B.①②③④ C.①②③ D.②③④
D
【方法归纳】
离子方程式:
碱
加热
氨气
湿润的红色石蕊试纸
变蓝
浓盐酸
白烟
铵盐
+OH-
NH3↑+H2O
【易错混淆】
必须先加碱再加热,因为铵盐受热不一定分解产生氨气。
1.检验铵根离子的一般方法是取少许待测物置于试管中,然后( )
A.直接加热,用湿润的红色石蕊试纸在试管口检验
B.向溶液中滴加紫色石蕊试液
C.加入强酸溶液加热后,再滴入酚酞试液
D.加入强碱溶液加热后,再用湿润的红色石蕊试纸靠近试管口检验
D
练一练
【考点五】制备氢氧化亚铁
【例1】用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________________。
避免生成的Fe(OH)2与氧气接触而被氧化
稀硫酸、铁屑
加热煮沸
【方法归纳】
Fe(OH)2制备成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭的、隔绝空气的体系中。
常用方法:①反应在试管底部进行。②加隔氧剂,如加入汽油、苯等比水轻的有机溶剂。③还原性气体保护法,利用的H2排尽整个装置中的空气。
练一练
1.下列各图所示的实验中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③ B.①②④ C.①②③④ D.②③④
B
【考点六】硝酸与金属反应的计算
【例1】在浓硝酸中放入铜片。
(1)反应开始的化学方程式为 ,
现象为 。
(2)若铜有剩余,反应快结束时的化学方程式是
。
(3)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,
其原因是 。
(4)若将12.8 g铜跟一定质量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),
则所消耗的硝酸的物质的量是 。
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
铜片逐渐溶解,溶液由无色变为蓝色,有红棕色气体生成
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
H+、NO3与Cu发生反应:3Cu+8H++2NO3 === 3Cu2++2NO↑+4H2O
-
-
0.65 mol
【方法归纳】
(1)N原子守恒:反应前所有的N只存在于HNO3中,反应后含N的物质有HNO3的还原产物、Cu(NO3)2和剩余的HNO3,则有:
n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n剩(HNO3)
(2)得失电子守恒:Cu-2e-→Cu2+
NO3+e-→NO2、 NO3+3e-→NO
(3)溶液中的电荷守恒:①若HNO3不过量:n(NO3)=2n(Cu2+)
②若HNO3过量:n(NO3)=2n(Cu2+)+n(H+)
-
-
-
-
练一练
1.将32gCu投入到80mL5mol/L的HNO3溶液中,充分反应后,向溶液中再加入200mL2mol/LH2SO4溶液,使之充分反应,两步反应共生成NO在标况下的体积( )
A.2.24L B.6.72L C.8.96L D.11.2L
B
2.铜与足量浓硝酸反应,得到硝酸铜溶液和由NO2、N2O4、NO组成的混合气体,这些气体与896ml(标准状况)O2混合后通入水中,能完全被水吸收生成硝酸。则消耗铜的质量为( )
A.2.56g B.5.12g C.6.4g D.10.24g
B
【考点七】元素及其化合物的转化与推断
请回答下列问题:
I.若B是碱性气体;D气体为红棕色。
(1)请写出A的化学式:_______。
(2)请写出下列转化过程的化学方程式:
【例1】A、B、C、D中均含有同一种元素,其中A是单质,它们的转化关系如图所示:
N2
A→B: ____ __;B→C:_____ 。
4NH3+5O2 4NO+6H2O
催化剂
(3)向D溶于水形成的稀溶液中加入过量铜片,待铜片不再溶解时,向其中加入几滴浓硫酸,可观察到铜片继续溶解。请用离子方程式解释该现象:___ ___。
II.若A、B、D既能与强酸溶液反应,又能与强碱溶液反应。
(1)C→D可通过滴加氨水实现,该反应的离子方程式为:
____ _ _。
(2)请写出A用于焊接铁轨的化学方程式:____ ___。
3Cu+8H++2NO3===3Cu2++2NO↑+4H2O
-
Al3++3NH3 H2O===Al(OH)3↓+3NH4
+
Fe2O3+2Al===2Fe+Al2O3
高温
【方法归纳】
1.解题“五步曲”
①审:审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
②找:找“题眼”即找到解题的突破口。
③析:从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维进行综合分析、推理,初步得出结论。
④验:验证确认,将结果代入原题检验。
⑤答:按题目的要求写出答案。
2.破题最关键:寻找解题“突破口”,抓“特”字
(1)特征现象
①颜色:NO2(红棕色)、亚铁盐溶液(浅绿色)等。
②有漂白作用的气体:Cl2(有水时)、SO2等。
③通常可作为保护气的气体:N2和Ar等。
④溶于水显碱性的气体只有NH3。
⑤在空气中迅速由无色变为红棕色的气体只有NO。
⑥能与盐酸作用产生有刺激性气味的无色气体,且将该气体通入品红溶液中能使之褪色,加热后又恢复原来颜色的物质必含 。
(2)特征转化关系
①连续转化:
②三角转化:
练一练
1.分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
①若E为红棕色气体,则该气体的收集方法为 ;X分子含有10个
电子,则气体X的水溶液显 性。
②若Y为淡黄色固体单质,则物质X与Z反应的化学方程式为 。
向上排空气法
碱
2H2S+SO2===3S+2H2O
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是 ;
若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量
0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为
;
反应快结束时的离子反应方程式为 。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(标况下),则参加反应的硝酸的物质的量为 。
H2
小于
Zn+2 H2SO4(浓)===ZnSO4+SO2↑+2 H2O
Zn+2H+===Zn2++H2↑
0.3mol
【考点八】环境污染问题
【例1】硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中 ②先将铜与O2反应生成CuO,再溶于硝酸中 ③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断中错误的是( )
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
A
【方法归纳】
如何在产业的源头将污染消除,从根本上消除污染。
绿色化学
核心内容
原子经济性和“5R”原则
研究内容
污染类型 具体表现 主要物质
空气污染 酸雨 SO2、氮氧化物
光化学烟雾 氮氧化物、碳氢化合物
雾霾 SO2、氮氧化物、颗粒物
温室效应 CO2、CH4
水体污染 重金属污染 重金属离子(工业废水)
富营养化 N、P(化肥过量使用)
1.2016年1月1日起修订的《中华人民共和国大气污染防治法》正式施行,这将对我国的大气污染防治产生重要影响.下列有关说法正确的是( )
A.“温室效应”“酸雨”的形成都与氮氧化合物有关
B.对矿物燃料进行脱硫脱硝可有效防治酸雨
C.pH在5.6~7.0之间的降水通常称为酸雨
D.PM2.5是指环境空气中直径大于或等于2.5微米的颗粒物
练一练
B
2. “绿色化学”是预防污染的基本手段,下列做法属于“绿色化学”的是( )
A.处理废弃物 B.杜绝污染源 C.禁食有毒物 D.制订治污规章制度
B
物质的性质与转化
铁的多样性
硫的转化
氮的循环
亚铁盐和铁盐
铁
铁的氧化物
铁的氢氧化物
硫单质
二氧化硫
硫酸
酸雨
氮气
氮的氧化物
氨气
光化学污染
与水蒸气反应
铝热反应
还原性
氧化性
酸性氧化物
氧化性、还原性、漂白性
氧化性
与铜反应
吸水性
脱水性
干燥剂
<5.6
氮的固定
还原性
NO
NO2
制取氨气
铵盐
硝酸
受热易分解
与碱反应
不稳定性
强氧化性
酸的通性
