3.3 课时3 硝酸的性质 课件 (共22页)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.3 课时3 硝酸的性质 课件 (共22页)2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-14 00:17:09 | ||
图片预览







文档简介
(共22张PPT)
氮的循环 课时3
第三章 物质的性质与转化
1.掌握硝酸的主要性质,能正确书写相关化学方程式和离子方程式。
2.认识氮的氧化物对生态环境的影响。
“被溶掉的诺贝尔奖章”
在二战时,德国纳粹政府开始抵制诺贝尔奖。无奈之下,科学家弗兰克和劳厄只能将奖牌托付给玻尔保管。不久之后,纳粹入侵了丹麦,玻尔实验室需要在短时间内消除黄金奖章的证据,于是,他们最终选择了王水。
由浓盐酸和浓硝酸按体积比3:1组成的混合物。
一、硝酸
1.硝酸的物理性质
无色
刺激性气味
液体
易挥发
HNO3质量分数为95%以上的浓硝酸在空气中挥发出硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
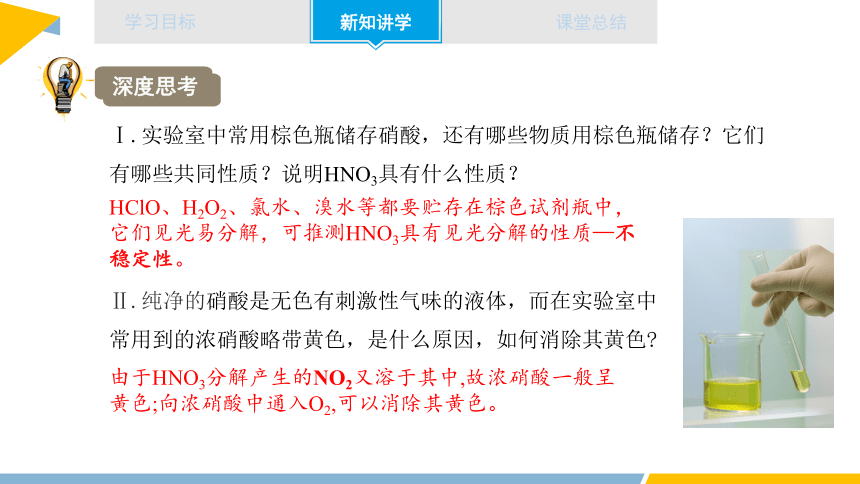
Ⅰ.实验室中常用棕色瓶储存硝酸,还有哪些物质用棕色瓶储存?它们有哪些共同性质?说明HNO3具有什么性质?
深度思考
HClO、H2O2、氯水、溴水等都要贮存在棕色试剂瓶中,它们见光易分解,可推测HNO3具有见光分解的性质—不稳定性。
Ⅱ.纯净的硝酸是无色有刺激性气味的液体,而在实验室中常用到的浓硝酸略带黄色,是什么原因,如何消除其黄色
由于HNO3分解产生的NO2又溶于其中,故浓硝酸一般呈黄色;向浓硝酸中通入O2,可以消除其黄色。
硝酸还有哪些性质呢?请你预测硝酸的性质。
氧化性
(1)不稳定性
2.硝酸的化学性质
深度思考
HNO3
+5
酸
a.与酸碱指示剂反应
b.与金属反应
c.与金属氧化物反应
d.与碱反应
e.与某些盐反应
4HNO3===4NO2↑+O2↑+2H2O
光照
(2)氧化性
稀硝酸+铜:反应缓慢,有少量气泡产生,溶液变蓝,产生无色气体。
浓硝酸+铜:反应剧烈,有大量气泡产生,溶液变蓝,产生红棕色气体。
视频:与Cu反应
实验现象
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①与金属反应
3Cu+8H++2NO3===3Cu2++2NO↑+4H2O
-
Cu+4H++2NO3===Cu2++2NO2↑+2H2O
-
视频
Ⅰ.硝酸与铜反应时体现了硝酸什么性质?
Ⅱ.足量的铜与浓硝酸反应,其还原产物可能是什么?
浓硝酸和铜反应生成NO2,在反应过程中,硝酸浓度逐渐减小,反应物变成稀硝酸和铜,生成NO。所以还原产物可能是NO2和NO的混合物。
体现了硝酸的氧化性和酸性。硝酸被还原成氮的氧化物体现出了氧化性,与金属结合成硝酸盐体现了硝酸的酸性。
深度思考
由铜与浓、稀硝酸反应的剧烈程度可知,硝酸的浓度越大氧化性越强。
Ⅲ.由上述实验分析硝酸的氧化性与其浓度有没有关系
在工业上运输和储存浓硝酸时,跟浓硫酸一样可以用铁质或铝制容器。那么浓硝酸是否也和浓硫酸一样会使Fe、Al钝化呢?
视频:与Fe反应
实验现象
稀硝酸+铁:铁片逐渐溶解;刚开始产生无色气体;反应一段时间后液面上方出现浅红棕色气体;溶液变为棕黄色。
浓硝酸+铁:钝化。
冷的浓硝酸可使铁、铝钝化。
化学方程式
Fe+4HNO3===Fe(NO3)3+NO↑+2H2O
Fe+4H++NO3===Fe3++NO↑+2H2O
-
视频
Ⅰ.若是往上述稀硝酸和铁的反应后的溶液中继续加过量的铁,会发生怎样的变化?
Ⅱ.上述实验中会产生对环境有污染的氮氧化物气体,应该如何改进装置,防止污染空气呢?
深度思考
过量的铁会和生成的Fe3+反应生成Fe2+:
2Fe3++Fe=3Fe2+
3Fe+8H++2NO3 === 3Fe2++2NO↑+4H2O
-
可以用注射器、密封塑料袋等用品完成实验。
小结
硝酸具有强氧化性,能与除金、铂、钛以外的大多数金属反应,其还原产物与硝酸的浓度有关。
通常,浓硝酸与金属反应生成的还原产物主要是二氧化氮,稀硝酸与金属反应生成的还原产物主要是一氧化氮。
②与非金属反应
硝酸、浓硫酸都是常见的氧化性酸,具有强氧化性。浓硝酸不仅能和金属反应,在加热的条件下,还能与碳单质等非金属单质发生氧化还原反应。试着写出浓硝酸与C反应的化学方程式。
C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
3.硝酸的用途
硝酸盐
炸药
染料
塑料
重要的化工原料
二、人类活动对氮循环和环境的影响
1.含氮物质的来源及其危害
化石燃料的燃烧
植物体的焚烧
大气中的氮氧化合物
光化学烟雾
与碳氢化合物产生二次污染物
与水反应生成硝酸和亚硝酸
硝酸型酸雨
工业废水
生活污水
农田灌溉
肥料饵料
水体中的含氮元素的物质
水体富营养化
藻类“疯长”
2.减少人类活动对氮循环和环境影响的措施
(1)控制进入大气、土壤和水体中含有氮元素的物质的量。
(2)增强生态系统对含有氮元素的物质的吸收能力。
酸
单质
盐
氧化物
+2
0
+4
氮元素化合价
物质类别
-3
氢化物
+5
NO2
N2
NO
NH3
HNO3
NH4Cl
NaNO3
H2
Ca(OH)2
HCl
NaOH
H2O
Cu
Cu
O2
H2O
O2
NH3
O2
概括 整合
练一练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)常温下铁与浓硝酸反应,产生大量红棕色气体。( )
(2)用浓硝酸与Cu反应制备NO2。( )
(3)汽车尾气中的氮氧化物与碳氢化合物是产生光化学烟雾的元凶。( )
(4)氮氧化合物也可以形成酸雨。( )
x
√
√
√
2.下列块状金属在常温时,能全部溶于足量的浓硝酸的是 ( )
A.Au B.Cu C.Al D.Fe
3.下列反应中硝酸只表现氧化性的是( )
A.灼热的炭与浓硝酸的反应
B.Cu与稀硝酸的反应
C.FeO与稀硝酸的反应
D.Fe(OH)3与硝酸的反应
B
A
5.下列离子方程式正确的是( )
D
硝酸
氮的氧化物对环境的影响
物理性质
化学性质
用途
影响
改进
无色液体
刺激性气味
易挥发
酸的通性
强氧化性
不稳定性
制造炸药、染料、塑料、化工原料
与金属反应
与非金属反应
光化学烟雾
硝酸型酸雨
水体富营养化
控制含氮元素物质排放
增强环境对含氮元素物质的吸收
硝酸及人类活动对氮循环和活动的影响
氮的循环 课时3
第三章 物质的性质与转化
1.掌握硝酸的主要性质,能正确书写相关化学方程式和离子方程式。
2.认识氮的氧化物对生态环境的影响。
“被溶掉的诺贝尔奖章”
在二战时,德国纳粹政府开始抵制诺贝尔奖。无奈之下,科学家弗兰克和劳厄只能将奖牌托付给玻尔保管。不久之后,纳粹入侵了丹麦,玻尔实验室需要在短时间内消除黄金奖章的证据,于是,他们最终选择了王水。
由浓盐酸和浓硝酸按体积比3:1组成的混合物。
一、硝酸
1.硝酸的物理性质
无色
刺激性气味
液体
易挥发
HNO3质量分数为95%以上的浓硝酸在空气中挥发出硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
Ⅰ.实验室中常用棕色瓶储存硝酸,还有哪些物质用棕色瓶储存?它们有哪些共同性质?说明HNO3具有什么性质?
深度思考
HClO、H2O2、氯水、溴水等都要贮存在棕色试剂瓶中,它们见光易分解,可推测HNO3具有见光分解的性质—不稳定性。
Ⅱ.纯净的硝酸是无色有刺激性气味的液体,而在实验室中常用到的浓硝酸略带黄色,是什么原因,如何消除其黄色
由于HNO3分解产生的NO2又溶于其中,故浓硝酸一般呈黄色;向浓硝酸中通入O2,可以消除其黄色。
硝酸还有哪些性质呢?请你预测硝酸的性质。
氧化性
(1)不稳定性
2.硝酸的化学性质
深度思考
HNO3
+5
酸
a.与酸碱指示剂反应
b.与金属反应
c.与金属氧化物反应
d.与碱反应
e.与某些盐反应
4HNO3===4NO2↑+O2↑+2H2O
光照
(2)氧化性
稀硝酸+铜:反应缓慢,有少量气泡产生,溶液变蓝,产生无色气体。
浓硝酸+铜:反应剧烈,有大量气泡产生,溶液变蓝,产生红棕色气体。
视频:与Cu反应
实验现象
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①与金属反应
3Cu+8H++2NO3===3Cu2++2NO↑+4H2O
-
Cu+4H++2NO3===Cu2++2NO2↑+2H2O
-
视频
Ⅰ.硝酸与铜反应时体现了硝酸什么性质?
Ⅱ.足量的铜与浓硝酸反应,其还原产物可能是什么?
浓硝酸和铜反应生成NO2,在反应过程中,硝酸浓度逐渐减小,反应物变成稀硝酸和铜,生成NO。所以还原产物可能是NO2和NO的混合物。
体现了硝酸的氧化性和酸性。硝酸被还原成氮的氧化物体现出了氧化性,与金属结合成硝酸盐体现了硝酸的酸性。
深度思考
由铜与浓、稀硝酸反应的剧烈程度可知,硝酸的浓度越大氧化性越强。
Ⅲ.由上述实验分析硝酸的氧化性与其浓度有没有关系
在工业上运输和储存浓硝酸时,跟浓硫酸一样可以用铁质或铝制容器。那么浓硝酸是否也和浓硫酸一样会使Fe、Al钝化呢?
视频:与Fe反应
实验现象
稀硝酸+铁:铁片逐渐溶解;刚开始产生无色气体;反应一段时间后液面上方出现浅红棕色气体;溶液变为棕黄色。
浓硝酸+铁:钝化。
冷的浓硝酸可使铁、铝钝化。
化学方程式
Fe+4HNO3===Fe(NO3)3+NO↑+2H2O
Fe+4H++NO3===Fe3++NO↑+2H2O
-
视频
Ⅰ.若是往上述稀硝酸和铁的反应后的溶液中继续加过量的铁,会发生怎样的变化?
Ⅱ.上述实验中会产生对环境有污染的氮氧化物气体,应该如何改进装置,防止污染空气呢?
深度思考
过量的铁会和生成的Fe3+反应生成Fe2+:
2Fe3++Fe=3Fe2+
3Fe+8H++2NO3 === 3Fe2++2NO↑+4H2O
-
可以用注射器、密封塑料袋等用品完成实验。
小结
硝酸具有强氧化性,能与除金、铂、钛以外的大多数金属反应,其还原产物与硝酸的浓度有关。
通常,浓硝酸与金属反应生成的还原产物主要是二氧化氮,稀硝酸与金属反应生成的还原产物主要是一氧化氮。
②与非金属反应
硝酸、浓硫酸都是常见的氧化性酸,具有强氧化性。浓硝酸不仅能和金属反应,在加热的条件下,还能与碳单质等非金属单质发生氧化还原反应。试着写出浓硝酸与C反应的化学方程式。
C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
3.硝酸的用途
硝酸盐
炸药
染料
塑料
重要的化工原料
二、人类活动对氮循环和环境的影响
1.含氮物质的来源及其危害
化石燃料的燃烧
植物体的焚烧
大气中的氮氧化合物
光化学烟雾
与碳氢化合物产生二次污染物
与水反应生成硝酸和亚硝酸
硝酸型酸雨
工业废水
生活污水
农田灌溉
肥料饵料
水体中的含氮元素的物质
水体富营养化
藻类“疯长”
2.减少人类活动对氮循环和环境影响的措施
(1)控制进入大气、土壤和水体中含有氮元素的物质的量。
(2)增强生态系统对含有氮元素的物质的吸收能力。
酸
单质
盐
氧化物
+2
0
+4
氮元素化合价
物质类别
-3
氢化物
+5
NO2
N2
NO
NH3
HNO3
NH4Cl
NaNO3
H2
Ca(OH)2
HCl
NaOH
H2O
Cu
Cu
O2
H2O
O2
NH3
O2
概括 整合
练一练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)常温下铁与浓硝酸反应,产生大量红棕色气体。( )
(2)用浓硝酸与Cu反应制备NO2。( )
(3)汽车尾气中的氮氧化物与碳氢化合物是产生光化学烟雾的元凶。( )
(4)氮氧化合物也可以形成酸雨。( )
x
√
√
√
2.下列块状金属在常温时,能全部溶于足量的浓硝酸的是 ( )
A.Au B.Cu C.Al D.Fe
3.下列反应中硝酸只表现氧化性的是( )
A.灼热的炭与浓硝酸的反应
B.Cu与稀硝酸的反应
C.FeO与稀硝酸的反应
D.Fe(OH)3与硝酸的反应
B
A
5.下列离子方程式正确的是( )
D
硝酸
氮的氧化物对环境的影响
物理性质
化学性质
用途
影响
改进
无色液体
刺激性气味
易挥发
酸的通性
强氧化性
不稳定性
制造炸药、染料、塑料、化工原料
与金属反应
与非金属反应
光化学烟雾
硝酸型酸雨
水体富营养化
控制含氮元素物质排放
增强环境对含氮元素物质的吸收
硝酸及人类活动对氮循环和活动的影响
