3.2.11 硫和二氧化硫 课件 (共22张PPT)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.2.11 硫和二氧化硫 课件 (共22张PPT)2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 65.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
硫的转化 课时1
第三章 物质的性质与转化
1.了解含有硫元素的物质在自然界中的存在和转化。
2.掌握硫、二氧化硫的性质、典型的实验现象及主要应用。
雷欧维拉力河又称“酸河”,其中约含8%的硫酸,河里鱼虾绝迹。河底有许多孔洞与火山相连。随着火山一次次的喷发,硫酸浓度越来越大。
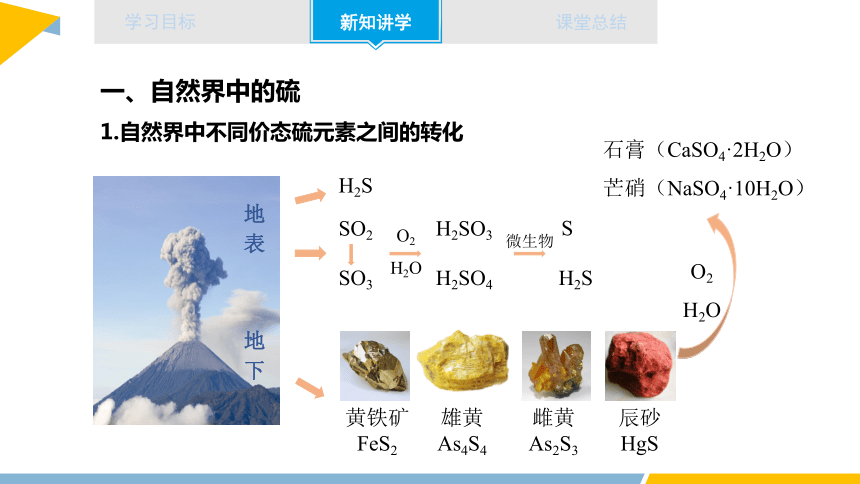
一、自然界中的硫
1.自然界中不同价态硫元素之间的转化
H2S
SO3
H2SO4
H2S
黄铁矿
FeS2
雄黄
As4S4
雌黄
As2S3
辰砂
HgS
石膏(CaSO4·2H2O)
芒硝(NaSO4·10H2O)
地表
SO2
地下
H2SO3
S
微生物
O2
H2O
O2
H2O
2.硫及其化合物的“价—类”二维图
酸
单质
盐
氧化物
+4
0
+6
硫元素化合价
物质类别
-2
氢化物
H2S
SO3
H2SO4
SO2
H2SO3
Na2SO4
Na2SO3
S
1.物理性质
硫黄
颜色状态 硬度 溶解性 熔点
沸点
水 酒精 CS2
很脆 不溶 微溶
黄色或淡黄色固体
易溶
都不高
二、认识硫单质
视频:硫的熔化
若试管内壁附着有单
质硫时,如何洗涤除去
答:用CS2洗涤。
视频
单斜硫
正交硫
同一种元素组成的性质不同的几种物质
同素异形体
S
0
非金属单质
与金属反应
与非金属反应
还原性
氧化性
2.化学性质
你认为硫单质会有哪些化学性质?
深度思考
实验现象
混合物一端红热,直到整个混合物红热,结成黑色块状“FeS”
Fe + S FeS
║
氧化性
视频:硫单质与铁的反应
观察实验
视频
实验现象
发出明亮的蓝紫色火焰,放出大量的热,生成一种
有刺激性气味的气体
S + O2 SO2
║
还原性
视频:硫单质与氧气的反应
观察实验
视频
实验结论
S的化学性质
氧化性
还原性
与非金属反应
与金属反应
Fe + S FeS
║
S + O2 SO2
║
Hg + S HgS
║
可以用于除去不慎洒落的汞
3.用途
硫黄主要用于制造硫酸、化肥、火柴、杀虫剂等。
三、二氧化硫
1.物理性质
颜色 状态 气味 密度 溶解性 毒性
深度思考
预测二氧化硫的化学性质
SO2
+4
酸性氧化物
与水反应
与氢氧化钠反应
还原性
氧化性
无色
气体
刺激性
气味
比空
气大
易溶
于水
有毒
2.化学性质
(1)与水反应
SO2+H2O H2SO3
实验现象
试管内液面上升,玻璃棒蘸取反应后的溶液在pH试纸上,pH试纸显红色
可逆反应:在相同条件下能同时向正、反两个方向进行的反应。在可逆反应的化学方程式中用“ ”代替“ ”。
║
视频
(3)氧化性
实验现象
生成淡黄色沉淀
Na2SO3溶液与Na2S溶液反应
Na2SO3+2Na2S+3H2SO4 3Na2SO4+3S↓+3H2O
║
得4e—
失2×2e—
思考:推测SO2和H2S的反应方程式:
SO2+2H2S 3S↓+2H2O
║
视频
(4)还原性
①与氧气反应
2SO2+O2 2SO3
催化剂
②与氯水反应
实验现象
加入氯水后,无明显现象,再加BaCl2溶液,有不溶于HCl溶液的白色沉淀生成,
Cl2+SO2+2H2O===H2SO4+2HCl
失2e—
视频
(5)漂白性
实验现象
通入SO2,品红溶液褪色,加热后又恢复原色
视频
常见的漂白剂及漂白原理
类型 吸附型 氧化型 化合型
物质 活性炭 氯水、次氯酸 二氧化硫
漂白原理
变化类别 物理变化 氧化还原反应 化学变化
漂白特点 不可逆
能漂白的物质 一般用于溶液漂白 可漂白所有 有机色质 具有选择性如
品红、棉、麻、草等
知识拓展
二氧化硫不能
使石蕊试纸褪色。
吸附漂白
利用强氧
化性漂白
与有色物质化合生成
不稳定的无色物质
加热恢复原色
2.用途
漂白剂
防腐剂、抗氧化剂
1.下列关于硫的说法不正确的是( )
A.游离态的硫存在于火山口附近或地壳的岩层里
B.单质硫既有氧化性,又有还原性
C.试管内壁附着的硫可用二硫化碳溶解除去
D.硫与铁、铜反应,生成FeS、CuS
D
练一练
2.下列有关硫的氧化物说法中正确的是( )
A.SO2易溶于水,且与水反应生成H2SO4
B.SO2、SO3都具有漂白性,也都能使石蕊溶液变红色
C.SO2可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加D.SO2在空气中易被氧化为SO3
C
3.检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过澄清石灰水
D
硫的存在和转化
硫
二氧化硫
氧化性
自然界
硫单质、氢化物、氧化物
黄铁矿、雄黄、雌黄、辰砂
芒硝、石膏
还原性
与Fe反应
与O2反应
酸性氧化物
与水反应
与碱反应
氧化性
还原性
漂白性
与H2S
与O2、Cl2反应
使品红褪色
硫的转化 课时1
第三章 物质的性质与转化
1.了解含有硫元素的物质在自然界中的存在和转化。
2.掌握硫、二氧化硫的性质、典型的实验现象及主要应用。
雷欧维拉力河又称“酸河”,其中约含8%的硫酸,河里鱼虾绝迹。河底有许多孔洞与火山相连。随着火山一次次的喷发,硫酸浓度越来越大。
一、自然界中的硫
1.自然界中不同价态硫元素之间的转化
H2S
SO3
H2SO4
H2S
黄铁矿
FeS2
雄黄
As4S4
雌黄
As2S3
辰砂
HgS
石膏(CaSO4·2H2O)
芒硝(NaSO4·10H2O)
地表
SO2
地下
H2SO3
S
微生物
O2
H2O
O2
H2O
2.硫及其化合物的“价—类”二维图
酸
单质
盐
氧化物
+4
0
+6
硫元素化合价
物质类别
-2
氢化物
H2S
SO3
H2SO4
SO2
H2SO3
Na2SO4
Na2SO3
S
1.物理性质
硫黄
颜色状态 硬度 溶解性 熔点
沸点
水 酒精 CS2
很脆 不溶 微溶
黄色或淡黄色固体
易溶
都不高
二、认识硫单质
视频:硫的熔化
若试管内壁附着有单
质硫时,如何洗涤除去
答:用CS2洗涤。
视频
单斜硫
正交硫
同一种元素组成的性质不同的几种物质
同素异形体
S
0
非金属单质
与金属反应
与非金属反应
还原性
氧化性
2.化学性质
你认为硫单质会有哪些化学性质?
深度思考
实验现象
混合物一端红热,直到整个混合物红热,结成黑色块状“FeS”
Fe + S FeS
║
氧化性
视频:硫单质与铁的反应
观察实验
视频
实验现象
发出明亮的蓝紫色火焰,放出大量的热,生成一种
有刺激性气味的气体
S + O2 SO2
║
还原性
视频:硫单质与氧气的反应
观察实验
视频
实验结论
S的化学性质
氧化性
还原性
与非金属反应
与金属反应
Fe + S FeS
║
S + O2 SO2
║
Hg + S HgS
║
可以用于除去不慎洒落的汞
3.用途
硫黄主要用于制造硫酸、化肥、火柴、杀虫剂等。
三、二氧化硫
1.物理性质
颜色 状态 气味 密度 溶解性 毒性
深度思考
预测二氧化硫的化学性质
SO2
+4
酸性氧化物
与水反应
与氢氧化钠反应
还原性
氧化性
无色
气体
刺激性
气味
比空
气大
易溶
于水
有毒
2.化学性质
(1)与水反应
SO2+H2O H2SO3
实验现象
试管内液面上升,玻璃棒蘸取反应后的溶液在pH试纸上,pH试纸显红色
可逆反应:在相同条件下能同时向正、反两个方向进行的反应。在可逆反应的化学方程式中用“ ”代替“ ”。
║
视频
(3)氧化性
实验现象
生成淡黄色沉淀
Na2SO3溶液与Na2S溶液反应
Na2SO3+2Na2S+3H2SO4 3Na2SO4+3S↓+3H2O
║
得4e—
失2×2e—
思考:推测SO2和H2S的反应方程式:
SO2+2H2S 3S↓+2H2O
║
视频
(4)还原性
①与氧气反应
2SO2+O2 2SO3
催化剂
②与氯水反应
实验现象
加入氯水后,无明显现象,再加BaCl2溶液,有不溶于HCl溶液的白色沉淀生成,
Cl2+SO2+2H2O===H2SO4+2HCl
失2e—
视频
(5)漂白性
实验现象
通入SO2,品红溶液褪色,加热后又恢复原色
视频
常见的漂白剂及漂白原理
类型 吸附型 氧化型 化合型
物质 活性炭 氯水、次氯酸 二氧化硫
漂白原理
变化类别 物理变化 氧化还原反应 化学变化
漂白特点 不可逆
能漂白的物质 一般用于溶液漂白 可漂白所有 有机色质 具有选择性如
品红、棉、麻、草等
知识拓展
二氧化硫不能
使石蕊试纸褪色。
吸附漂白
利用强氧
化性漂白
与有色物质化合生成
不稳定的无色物质
加热恢复原色
2.用途
漂白剂
防腐剂、抗氧化剂
1.下列关于硫的说法不正确的是( )
A.游离态的硫存在于火山口附近或地壳的岩层里
B.单质硫既有氧化性,又有还原性
C.试管内壁附着的硫可用二硫化碳溶解除去
D.硫与铁、铜反应,生成FeS、CuS
D
练一练
2.下列有关硫的氧化物说法中正确的是( )
A.SO2易溶于水,且与水反应生成H2SO4
B.SO2、SO3都具有漂白性,也都能使石蕊溶液变红色
C.SO2可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加D.SO2在空气中易被氧化为SO3
C
3.检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过澄清石灰水
D
硫的存在和转化
硫
二氧化硫
氧化性
自然界
硫单质、氢化物、氧化物
黄铁矿、雄黄、雌黄、辰砂
芒硝、石膏
还原性
与Fe反应
与O2反应
酸性氧化物
与水反应
与碱反应
氧化性
还原性
漂白性
与H2S
与O2、Cl2反应
使品红褪色
