专题五 热化学 化学反应速率与平衡 主观题突破 1.热化学方程式的书写与焓变的计算(共41张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题五 热化学 化学反应速率与平衡 主观题突破 1.热化学方程式的书写与焓变的计算(共41张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 22:57:10 | ||
图片预览










文档简介
(共41张PPT)
主观题突破
1.热化学方程式的书写与焓变的计算
核心精讲
01
1.焓变的计算
(1)根据(相对)能量计算
ΔH=H总(生成物)-H总(反应物)
(2)根据键能计算
ΔH=∑E(反应物键能)-∑E(生成物键能)
(3)根据活化能计算
ΔH=E(正反应的活化能)-E(逆反应的活化能)
2.热化学方程式书写易出现的错误
(1)未标明反应物或生成物的状态而造成错误。
(2)反应热的符号使用不正确,即吸热反应未标出“+”号,放热反应未标出“-”号,从而导致错误。
(3)漏写ΔH的单位,或者将ΔH的单位写为kJ,从而造成错误。
(4)反应热的数值与方程式的计量数不对应而造成错误。
(5)对燃烧热的概念理解不到位,忽略其标准是1 mol可燃物而造成错误。
(6)对中和反应反应热理解不准确。
①强酸与强碱中和反应的反应热ΔH=-57.3 kJ·mol-1,若用弱酸代替强酸(或用弱碱代替强碱),因电离吸热,放出的热量减少。
②若用浓硫酸(或NaOH固体)作反应物,放出热量增多。
③若是稀硫酸和Ba(OH)2反应,生成1 mol H2O(l)时所释放的热量会比57.3 kJ多,原因是H+与OH-结合成1 mol H2O(l)的同时,Ba2+和 结合成BaSO4沉淀也会放热。
提醒 对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。
如:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3=-0.33 kJ·mol-1
3.盖斯定律
(1)ΔH与盖斯定律
利用盖斯定律求热化学方程式中的焓变ΔH=ΔH1+ΔH2+ΔH3。
(2)盖斯定律的答题模板——叠加法
步骤1 “倒”
为了将方程式相加得到目标方程式,可将部分方程式颠倒过来,反应热的数值不变,但符号相反。这样就不用再做减法运算了,实践证明,方程式相减时往往容易出错。
步骤2 “乘”
为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要乘以相应倍数。
步骤3 “加”
上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。
真题演练
02
1
2
3
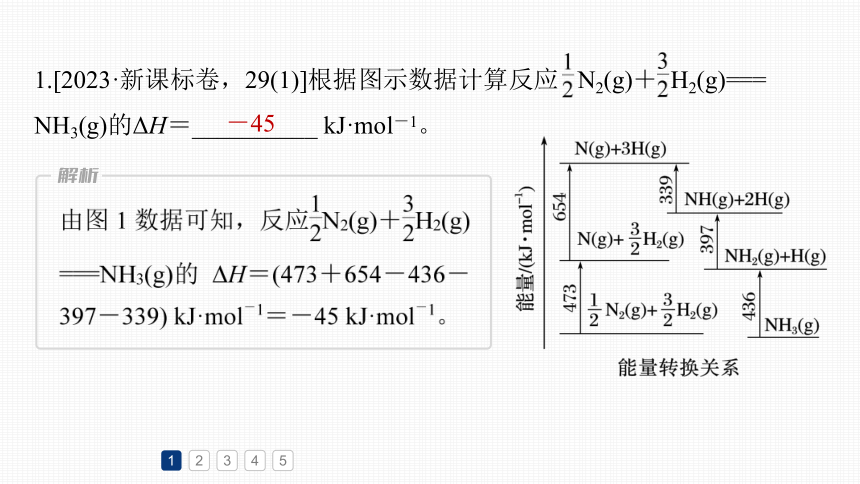
1.[2023·新课标卷,29(1)]根据图示数据计算反应 N2(g)+ H2(g)===
NH3(g)的ΔH=__________ kJ·mol-1。
4
5
-45
1
2
3
2.[2021·湖南,16(1)]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
4
5
在一定温度下,利用催化剂将NH3分解为N2和H2。
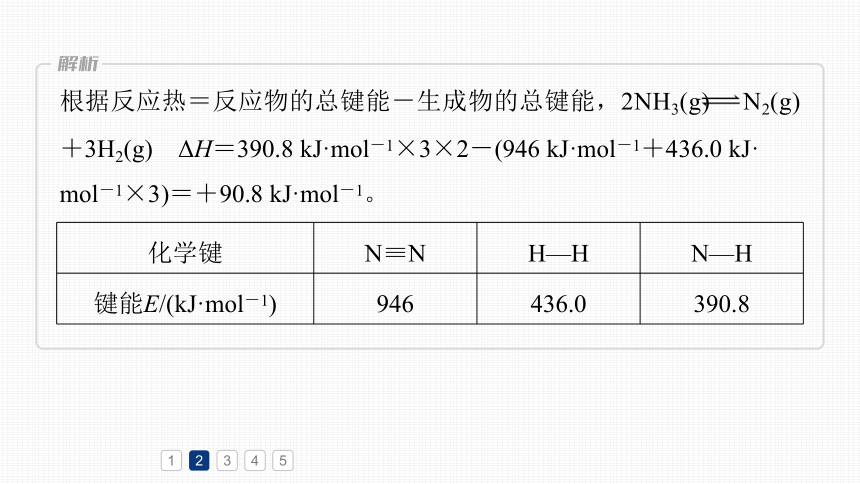
反应2NH3(g) N2(g)+3H2(g) ΔH=_______ kJ·mol-1。
+90.8
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
1
2
3
根据反应热=反应物的总键能-生成物的总键能,2NH3(g) N2(g)+3H2(g) ΔH=390.8 kJ·mol-1×3×2-(946 kJ·mol-1+436.0 kJ·
mol-1×3)=+90.8 kJ·mol-1。
4
5
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
1
2
3
3.[2023·湖南,16(1)]已知下列反应的热化学方程式:
①C6H5C2H5(g)+ O2(g)===8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·mol-1
②C6H5CH===CH2(g)+10O2(g)===8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·
mol-1
③H2(g)+ O2(g)===H2O(g) ΔH3=-241.8 kJ·mol-1
计算反应④C6H5C2H5(g) C6H5CH===CH2(g)+H2(g)的ΔH4=______kJ·
mol-1。
4
5
+118
1
2
3
4
5
根据盖斯定律,将①-②-③可得C6H5C2H5(g) C6H5CH===
CH2(g)+H2(g)ΔH4=-4 386.9 kJ·mol-1-(-4 263.1 kJ·mol-1)-
(-241.8 kJ·mol-1)=+118 kJ·mol-1。
1
2
3
4
5
4.[2023·北京,16(2)]二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.CO2和NH3生成NH2COONH4;
ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法
正确的是______(填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E4
ab
1
2
3
反应ⅰ的活化能是E1,反应ⅱ的活化能是E3,E1从图中反应物和生成物能量的相对大小可看出反应ⅰ为放热反应,反应ⅱ为吸热反应,b项正确;
总反应的ΔH=E1-E2+E3-E4,c项错误。
4
5
1
2
3
5.[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol
H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为_______________
_______________________________。
4
5
===H2O(l) ΔH=-286 kJ·mol-1
298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2燃烧生成1 mol H2O(l)放热286 kJ,表示H2燃烧热
的热化学方程式为H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1。
考向预测
03
1
2
3
4
5
6
7
8
9
10
1.目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
1
2
3
4
5
6
7
8
9
10
氨气的脱附是________(填“吸热”或“放热”)过程,合成氨的热化学方程式为____________________________________________。
吸热
N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
2.CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2(g)+6H2(g)
CH2==CH2(g)+4H2O(g) ΔH。几种物质的能量(在标准状况下规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
则ΔH=_______________。
物质 H2(g) CO2(g) CH2==CH2(g) H2O(g)
能量/ (kJ·mol-1) 0 -394 52 -242
-128 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
反应焓变=生成物总能量-反应物总能量,则该反应的焓变为52 kJ·
mol-1+(-242 kJ·mol-1)×4-(-394 kJ·mol-1)×2-0=-128 kJ·
mol-1。
物质 H2(g) CO2(g) CH2==CH2(g) H2O(g)
能量/ (kJ·mol-1) 0 -394 52 -242
1
2
3
4
5
6
7
8
9
10
3.氢气是主要的工业原料,也是最重要的工业气体和特种气体,可用作合成氨、合成甲醇的原料。相关化学键的键能数据如表所示。
化学键 H—H C—O C—H H—O C==O N—H N≡N
E/(kJ·mol-1) 436 351 412 462 745 391 946
(1)H2可与CO2生成甲醇和水,其反应过程如下。
反应Ⅰ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g)。
由表中化学键键能数据可知,反应Ⅰ的ΔH=_______ kJ·mol-1。
-350
1
2
3
4
5
6
7
8
9
10
ΔH=反应物的键能总和-生成物的键能总和。反应Ⅰ的ΔH=4E(C==O)+6E(H—H)-6E(C—H)-2E(C—O)-6E(H—O)=4×745 kJ·
mol-1+6×436 kJ·mol-1-6×412 kJ·mol-1-2×351 kJ·mol-1-6×462 kJ·mol-1=-350 kJ·mol-1。
1
2
3
4
5
6
7
8
9
10
化学键 H—H C—O C—H H—O C==O N—H N≡N
E/(kJ·mol-1) 436 351 412 462 745 391 946
(2)已知N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,则由表中化学键键能数据可知a=_______。
-92
根据ΔH=反应物的键能总和-生成物的键能总和可知,N2(g)+3H2(g) 2NH3(g)的ΔH=E(N≡N)+3E(H—H)-6E(N—H)=946 kJ·
mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1,则a=-92。
1
2
3
4
5
6
7
8
9
10
4.钌及其化合物在合成工业上有广泛用途,右
图是用钌(Ru)基催化剂催化合成甲酸的过程。
每生成92 g液态HCOOH放出62.4 kJ的热量。
根据图示写出该反应的热化学方程式:
______________________________________
_______________。
H2(g)+CO2(g)===HCOOH(l) ΔH=
-31.2 kJ·mol-1
1
2
3
4
5
6
7
根据整个流程图可知,CO2(g)和H2(g)为反应物,生成物为HCOOH(l),92 g
HCOOH的物质的量为 =2 mol,
所以生成1 mol HCOOH(l)放出31.2 kJ热
量,热化学方程式为H2(g)+CO2(g)===
HCOOH(l) ΔH=-31.2 kJ·mol-1。
8
9
10
1
2
3
4
5
6
7
5.在α-Fe(Ⅲ)铁原子簇表面,以N2和H2为原料合成氨的反应机理如下:
①H2(g)===2H(g) ΔH1
②N2(g)+2H(g) 2(NH)(g) ΔH2
③(NH)(g)+H(g) (NH2)(g) ΔH3
④(NH2)(g)+H(g) NH3(g) ΔH4
总反应:N2(g)+3H2(g) 2NH3(g) ΔH。则ΔH4=_________________
________(用含ΔH1、ΔH2、ΔH3、ΔH的式子表示)。
8
9
10
-2ΔH3)
1
2
3
4
5
6
7
6.实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:
①4KClO3(s)===3KClO4(s)+KCl(s)
②KClO4(s)===KCl(s)+2O2(g)
已知:
8
9
10
则反应4KClO3(s)===3KClO4(s)+KCl(s)的ΔH=________ kJ·mol-1。
-144
1
2
3
4
5
6
7
依据盖斯定律将①+③×3-②×4得到4KClO3(s)===3KClO4(s)+KCl(s)的ΔH=-144 kJ·mol-1。
8
9
10
1
2
3
4
5
6
7
7.1 mol CH4(g)完全燃烧生成气态水的能量变化和1 mol S(g)燃烧的能量变化如图所示。在催化剂作用下,CH4(g)可以还原SO2(g)生成单质S(g)、H2O(g)和CO2(g),写出该反应的热化学方程式:_____________________
___________________________________________。
8
9
10
CH4(g)+2SO2(g)===
2S(g)+CO2(g)+2H2O(g) ΔH=+352 kJ·mol-1
1
2
3
4
5
6
7
根据图像可知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=126 kJ·
mol-1-928 kJ·mol-1=-802 kJ·mol-1;
②S(g)+O2(g)===SO2(g) ΔH=-577 kJ·mol-1;
根据盖斯定律可知①-②×2可得CH4(g)+2SO2(g)===2S(g)+CO2(g)+2H2O(g) ΔH=+352 kJ·mol-1。
8
9
10
1
2
3
4
5
6
7
8.工业上利用甲酸的能量关系转换图如图所示:
8
9
10
反应CO2(g)+H2(g) HCOOH(g)的ΔH=________ kJ·mol-1。
-31.4
1
2
3
4
5
6
根据图示可得如下热化学方程式:①HCOOH(g) CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
7
8
9
10
1
2
3
4
5
6
由盖斯定律可得,将③-①-②得到反应CO2(g)+H2(g) HCOOH(g)的ΔH=ΔH3-ΔH1-ΔH2=-241.8 kJ·mol-1-(+72.6 kJ·mol-1)-
(-283.0 kJ·mol-1)=-31.4 kJ·mol-1。
7
8
9
10
1
2
3
4
5
6
9.硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下。
7
8
9
10
已知:
反应Ⅰ:2H2O(l)===2H2(g)+O2(g) ΔH1=+572 kJ·mol-1
反应Ⅱ:H2SO4(aq)===SO2(g)+H2O(l)+ O2(g) ΔH2=+327 kJ·mol-1
反应Ⅲ:2HI(aq)===H2(g)+I2(g) ΔH3=+172 kJ·mol-1
则反应SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH=
_______________。
-213 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
10.如图表示在CuO存在下HCl催化氧化的反应过程,则总反应的热化学
方程式为____________________________________________________。
7
8
9
10
2HCl(g)+ O2(g)===H2O(g)+Cl2(g) ΔH=ΔH1+ΔH2+ΔH3
1
2
3
4
5
6
7
8
9
10
本课结束
主观题突破
1.热化学方程式的书写与焓变的计算
核心精讲
01
1.焓变的计算
(1)根据(相对)能量计算
ΔH=H总(生成物)-H总(反应物)
(2)根据键能计算
ΔH=∑E(反应物键能)-∑E(生成物键能)
(3)根据活化能计算
ΔH=E(正反应的活化能)-E(逆反应的活化能)
2.热化学方程式书写易出现的错误
(1)未标明反应物或生成物的状态而造成错误。
(2)反应热的符号使用不正确,即吸热反应未标出“+”号,放热反应未标出“-”号,从而导致错误。
(3)漏写ΔH的单位,或者将ΔH的单位写为kJ,从而造成错误。
(4)反应热的数值与方程式的计量数不对应而造成错误。
(5)对燃烧热的概念理解不到位,忽略其标准是1 mol可燃物而造成错误。
(6)对中和反应反应热理解不准确。
①强酸与强碱中和反应的反应热ΔH=-57.3 kJ·mol-1,若用弱酸代替强酸(或用弱碱代替强碱),因电离吸热,放出的热量减少。
②若用浓硫酸(或NaOH固体)作反应物,放出热量增多。
③若是稀硫酸和Ba(OH)2反应,生成1 mol H2O(l)时所释放的热量会比57.3 kJ多,原因是H+与OH-结合成1 mol H2O(l)的同时,Ba2+和 结合成BaSO4沉淀也会放热。
提醒 对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。
如:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3=-0.33 kJ·mol-1
3.盖斯定律
(1)ΔH与盖斯定律
利用盖斯定律求热化学方程式中的焓变ΔH=ΔH1+ΔH2+ΔH3。
(2)盖斯定律的答题模板——叠加法
步骤1 “倒”
为了将方程式相加得到目标方程式,可将部分方程式颠倒过来,反应热的数值不变,但符号相反。这样就不用再做减法运算了,实践证明,方程式相减时往往容易出错。
步骤2 “乘”
为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要乘以相应倍数。
步骤3 “加”
上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。
真题演练
02
1
2
3
1.[2023·新课标卷,29(1)]根据图示数据计算反应 N2(g)+ H2(g)===
NH3(g)的ΔH=__________ kJ·mol-1。
4
5
-45
1
2
3
2.[2021·湖南,16(1)]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
4
5
在一定温度下,利用催化剂将NH3分解为N2和H2。
反应2NH3(g) N2(g)+3H2(g) ΔH=_______ kJ·mol-1。
+90.8
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
1
2
3
根据反应热=反应物的总键能-生成物的总键能,2NH3(g) N2(g)+3H2(g) ΔH=390.8 kJ·mol-1×3×2-(946 kJ·mol-1+436.0 kJ·
mol-1×3)=+90.8 kJ·mol-1。
4
5
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
1
2
3
3.[2023·湖南,16(1)]已知下列反应的热化学方程式:
①C6H5C2H5(g)+ O2(g)===8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·mol-1
②C6H5CH===CH2(g)+10O2(g)===8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·
mol-1
③H2(g)+ O2(g)===H2O(g) ΔH3=-241.8 kJ·mol-1
计算反应④C6H5C2H5(g) C6H5CH===CH2(g)+H2(g)的ΔH4=______kJ·
mol-1。
4
5
+118
1
2
3
4
5
根据盖斯定律,将①-②-③可得C6H5C2H5(g) C6H5CH===
CH2(g)+H2(g)ΔH4=-4 386.9 kJ·mol-1-(-4 263.1 kJ·mol-1)-
(-241.8 kJ·mol-1)=+118 kJ·mol-1。
1
2
3
4
5
4.[2023·北京,16(2)]二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.CO2和NH3生成NH2COONH4;
ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法
正确的是______(填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E4
ab
1
2
3
反应ⅰ的活化能是E1,反应ⅱ的活化能是E3,E1
总反应的ΔH=E1-E2+E3-E4,c项错误。
4
5
1
2
3
5.[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol
H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为_______________
_______________________________。
4
5
===H2O(l) ΔH=-286 kJ·mol-1
298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2燃烧生成1 mol H2O(l)放热286 kJ,表示H2燃烧热
的热化学方程式为H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1。
考向预测
03
1
2
3
4
5
6
7
8
9
10
1.目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
1
2
3
4
5
6
7
8
9
10
氨气的脱附是________(填“吸热”或“放热”)过程,合成氨的热化学方程式为____________________________________________。
吸热
N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
2.CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2(g)+6H2(g)
CH2==CH2(g)+4H2O(g) ΔH。几种物质的能量(在标准状况下规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
则ΔH=_______________。
物质 H2(g) CO2(g) CH2==CH2(g) H2O(g)
能量/ (kJ·mol-1) 0 -394 52 -242
-128 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
反应焓变=生成物总能量-反应物总能量,则该反应的焓变为52 kJ·
mol-1+(-242 kJ·mol-1)×4-(-394 kJ·mol-1)×2-0=-128 kJ·
mol-1。
物质 H2(g) CO2(g) CH2==CH2(g) H2O(g)
能量/ (kJ·mol-1) 0 -394 52 -242
1
2
3
4
5
6
7
8
9
10
3.氢气是主要的工业原料,也是最重要的工业气体和特种气体,可用作合成氨、合成甲醇的原料。相关化学键的键能数据如表所示。
化学键 H—H C—O C—H H—O C==O N—H N≡N
E/(kJ·mol-1) 436 351 412 462 745 391 946
(1)H2可与CO2生成甲醇和水,其反应过程如下。
反应Ⅰ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g)。
由表中化学键键能数据可知,反应Ⅰ的ΔH=_______ kJ·mol-1。
-350
1
2
3
4
5
6
7
8
9
10
ΔH=反应物的键能总和-生成物的键能总和。反应Ⅰ的ΔH=4E(C==O)+6E(H—H)-6E(C—H)-2E(C—O)-6E(H—O)=4×745 kJ·
mol-1+6×436 kJ·mol-1-6×412 kJ·mol-1-2×351 kJ·mol-1-6×462 kJ·mol-1=-350 kJ·mol-1。
1
2
3
4
5
6
7
8
9
10
化学键 H—H C—O C—H H—O C==O N—H N≡N
E/(kJ·mol-1) 436 351 412 462 745 391 946
(2)已知N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,则由表中化学键键能数据可知a=_______。
-92
根据ΔH=反应物的键能总和-生成物的键能总和可知,N2(g)+3H2(g) 2NH3(g)的ΔH=E(N≡N)+3E(H—H)-6E(N—H)=946 kJ·
mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1,则a=-92。
1
2
3
4
5
6
7
8
9
10
4.钌及其化合物在合成工业上有广泛用途,右
图是用钌(Ru)基催化剂催化合成甲酸的过程。
每生成92 g液态HCOOH放出62.4 kJ的热量。
根据图示写出该反应的热化学方程式:
______________________________________
_______________。
H2(g)+CO2(g)===HCOOH(l) ΔH=
-31.2 kJ·mol-1
1
2
3
4
5
6
7
根据整个流程图可知,CO2(g)和H2(g)为反应物,生成物为HCOOH(l),92 g
HCOOH的物质的量为 =2 mol,
所以生成1 mol HCOOH(l)放出31.2 kJ热
量,热化学方程式为H2(g)+CO2(g)===
HCOOH(l) ΔH=-31.2 kJ·mol-1。
8
9
10
1
2
3
4
5
6
7
5.在α-Fe(Ⅲ)铁原子簇表面,以N2和H2为原料合成氨的反应机理如下:
①H2(g)===2H(g) ΔH1
②N2(g)+2H(g) 2(NH)(g) ΔH2
③(NH)(g)+H(g) (NH2)(g) ΔH3
④(NH2)(g)+H(g) NH3(g) ΔH4
总反应:N2(g)+3H2(g) 2NH3(g) ΔH。则ΔH4=_________________
________(用含ΔH1、ΔH2、ΔH3、ΔH的式子表示)。
8
9
10
-2ΔH3)
1
2
3
4
5
6
7
6.实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:
①4KClO3(s)===3KClO4(s)+KCl(s)
②KClO4(s)===KCl(s)+2O2(g)
已知:
8
9
10
则反应4KClO3(s)===3KClO4(s)+KCl(s)的ΔH=________ kJ·mol-1。
-144
1
2
3
4
5
6
7
依据盖斯定律将①+③×3-②×4得到4KClO3(s)===3KClO4(s)+KCl(s)的ΔH=-144 kJ·mol-1。
8
9
10
1
2
3
4
5
6
7
7.1 mol CH4(g)完全燃烧生成气态水的能量变化和1 mol S(g)燃烧的能量变化如图所示。在催化剂作用下,CH4(g)可以还原SO2(g)生成单质S(g)、H2O(g)和CO2(g),写出该反应的热化学方程式:_____________________
___________________________________________。
8
9
10
CH4(g)+2SO2(g)===
2S(g)+CO2(g)+2H2O(g) ΔH=+352 kJ·mol-1
1
2
3
4
5
6
7
根据图像可知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=126 kJ·
mol-1-928 kJ·mol-1=-802 kJ·mol-1;
②S(g)+O2(g)===SO2(g) ΔH=-577 kJ·mol-1;
根据盖斯定律可知①-②×2可得CH4(g)+2SO2(g)===2S(g)+CO2(g)+2H2O(g) ΔH=+352 kJ·mol-1。
8
9
10
1
2
3
4
5
6
7
8.工业上利用甲酸的能量关系转换图如图所示:
8
9
10
反应CO2(g)+H2(g) HCOOH(g)的ΔH=________ kJ·mol-1。
-31.4
1
2
3
4
5
6
根据图示可得如下热化学方程式:①HCOOH(g) CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
7
8
9
10
1
2
3
4
5
6
由盖斯定律可得,将③-①-②得到反应CO2(g)+H2(g) HCOOH(g)的ΔH=ΔH3-ΔH1-ΔH2=-241.8 kJ·mol-1-(+72.6 kJ·mol-1)-
(-283.0 kJ·mol-1)=-31.4 kJ·mol-1。
7
8
9
10
1
2
3
4
5
6
9.硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下。
7
8
9
10
已知:
反应Ⅰ:2H2O(l)===2H2(g)+O2(g) ΔH1=+572 kJ·mol-1
反应Ⅱ:H2SO4(aq)===SO2(g)+H2O(l)+ O2(g) ΔH2=+327 kJ·mol-1
反应Ⅲ:2HI(aq)===H2(g)+I2(g) ΔH3=+172 kJ·mol-1
则反应SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH=
_______________。
-213 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
10.如图表示在CuO存在下HCl催化氧化的反应过程,则总反应的热化学
方程式为____________________________________________________。
7
8
9
10
2HCl(g)+ O2(g)===H2O(g)+Cl2(g) ΔH=ΔH1+ΔH2+ΔH3
1
2
3
4
5
6
7
8
9
10
本课结束
同课章节目录
