专题五 热化学 化学反应速率与平衡 选择题专攻 2.化学反应的方向、速率和限度综合判断(共31张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题五 热化学 化学反应速率与平衡 选择题专攻 2.化学反应的方向、速率和限度综合判断(共31张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:06:07 | ||
图片预览









文档简介
(共31张PPT)
选择题专攻
2.化学反应的方向、速率和限度综合判断
核心精讲
01
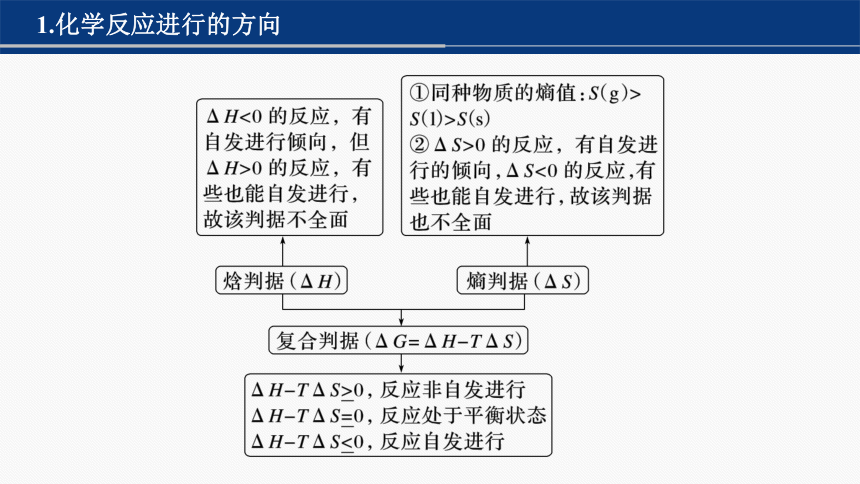
1.化学反应进行的方向
2.化学反应速率及影响因素
(2)比例式法:根据“化学反应速率之比等于化学计量数之比”进行计算。
(3)影响化学反应速率的因素
①内因:反应物本身的性质。
②外因:浓度、压强、催化剂等。
③气体反应体系中充入惰性气体(不参加反应)时对反应速率的影响
恒温恒容:充入“惰性气体”→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变。
恒温恒压:充入“惰性气体”→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减小。
3.化学平衡常数、平衡移动方向与反应速率的关系
aA(g)+bB(g) cC(g)+dD(g)
4.外界条件对化学平衡移动的影响规律
温度的 影响 升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动
浓度的 影响 增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动
压强的 影响 增大压强会使平衡向气体体积减小的方向移动;减小压强会使平衡向气体体积增大的方向移动
真题演练
02
1
2
3
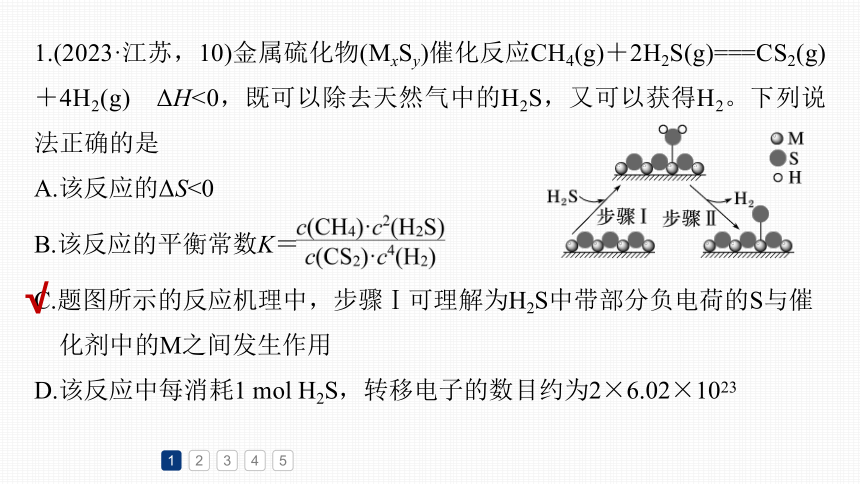
1.(2023·江苏,10)金属硫化物(MxSy)催化反应CH4(g)+2H2S(g)===CS2(g)+4H2(g) ΔH<0,既可以除去天然气中的H2S,又可以获得H2。下列说法正确的是
A.该反应的ΔS<0
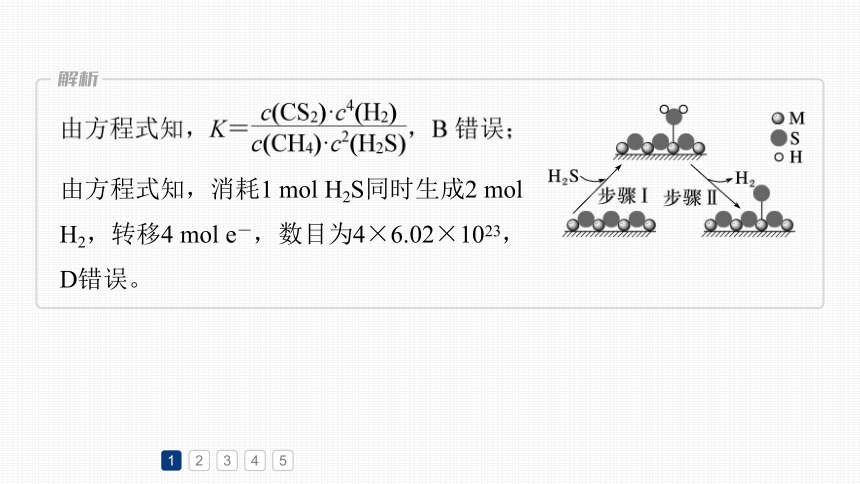
B.该反应的平衡常数K=
C.题图所示的反应机理中,步骤Ⅰ可理解为H2S中带部分负电荷的S与催
化剂中的M之间发生作用
D.该反应中每消耗1 mol H2S,转移电子的数目约为2×6.02×1023
√
4
5
1
2
3
由方程式知,消耗1 mol H2S同时生成2 mol
H2,转移4 mol e-,数目为4×6.02×1023,
D错误。
4
5
1
2
3
2.(2022·江苏,10)用尿素水解生成的NH3催化还原NO,是柴油机车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 4N2(g)+6H2O(g),下列说法正确的是
A.上述反应ΔS<0
B.上述反应平衡常数K=
C.上述反应中消耗1 mol NH3,转移电子的数目为2×6.02×1023
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染
程度越小
4
5
√
1
2
3
由化学方程式可知,该反应是一个气体分子数增大的反应,即熵增的反应,反应ΔS>0,故A错误;
由化学方程式可知,反应每消耗4 mol氨气,转移12 mol电子,则反应中消耗1 mol氨气转移电子的数目为3×6.02×1023,故C错误;
实际应用中,加入尿素的量越多,尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度增大,故D错误。
4
5
1
2
3
4
5
√
1
2
3
4
5
2NO(g)+O2(g)===2NO2(g) ΔH=-116.4 kJ·mol-1,反应气体物质的量减少,ΔS<0,故A正确;
使用高效催化剂,反应的焓变不变,故C错误;
1
2
3
4
5
4.(2022·海南,8)某温度下,反应CH2==CH2(g)+H2O(g)
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
A.增大压强,v正>v逆,平衡常数增大
B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大
C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动
D.恒容下,充入一定量的CH2==CH2(g),CH2==CH2(g)的平衡转化率增大
√
1
2
3
该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应,故v正>v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;
催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;
恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;
恒容下,充入一定量的CH2==CH2(g),平衡向正反应方向移动,但是CH2==CH2(g)的平衡转化率减小,D不正确。
4
5
1
2
3
5.(2022·广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1
√
4
5
1
2
由图可知,无催化剂时,随反应进行,生成物的
浓度也在增加,说明反应也在进行,故A错误;
由图可知,催化剂Ⅰ比催化剂Ⅱ催化效果好,
反应速率大,说明催化剂Ⅰ使反应活化能更低,
故B错误;
由图可知,使用催化剂Ⅱ时,在0~2 min内Y的浓度变化了2.0 mol·L-1,而a曲线表示的X的浓度变化了2.0 mol·L-1,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂Ⅱ时X的浓度随时间t的变化,故C错误;
3
4
5
1
2
3
4
5
考向预测
03
1
2
3
4
5
6
1.(2023·江苏高三年级第二学期五校联考)对于反应CuCl(s)+2Cl-(aq)
[CuCl3]2-(aq) ΔH<0,下列说法正确的是
A.该反应的ΔS>0
B.该反应的平衡常数K=
C.加水可使该平衡逆向移动
D.其他条件相同,增大CuCl的量,可加快生成[CuCl3]2-的速率
√
1
2
3
4
5
6
CuCl为固体,增大CuCl的量,不影响生成[CuCl3]2-的速率,D错误。
1
2
3
4
5
6
2.Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示为4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-116 kJ·mol-1。关于Deacon提出的制Cl2的反应,下列有关说法正确的是
A.该反应的ΔS>0
B.每生成标准状况下22.4 L Cl2,放出58 kJ的热量
C.升高温度,该反应v逆增大,v正减小,平衡向逆反应方向移动
D.断裂4 mol H—Cl的同时,有4 mol H—O形成,说明该反应达到平衡状态
√
1
2
3
4
5
6
该反应是气体体积减小的反应,所以该反应的熵减小,即ΔS<0,A项错误;
根据热化学方程式可知,每生成2 mol Cl2,放出116 kJ的热量,所以每生成标准状况下22.4 L(即1 mol) Cl2,放出58 kJ的热量,B项正确;
该反应的正反应是放热反应,升高温度平衡逆向移动,升高温度,正、逆反应速率都增大,C项错误;
HCl是反应物,H2O是生成物,断裂4 mol H—Cl的同时,一定有4 mol H—O形成,所以该说法不能说明该反应达到平衡状态,D项错误。
1
2
3
4
5
6
3.(2022·江苏省南京市、盐城市一模)2SO2(g)+O2(g) 2SO3(g) ΔH=
-196.6 kJ·mol-1。下列说法正确的是
A.该反应在任何条件下都能自发进行
B.反应达平衡后再通入O2,SO3的体积分数一定增加
C.反应在高温、催化剂条件下进行可提高SO2的平衡转化率
D.2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小
√
1
2
3
4
5
6
A项,该反应的熵减小,故不一定在任何条件均能自发,错误;
B项,当通入无穷大的O2时,参与反应的O2少,生成的SO3略有增多,但是由于没有反应的O2的量更多,则SO3的体积分数反而减少,错误;
C项,高温平衡逆向移动,催化剂不可以改变SO2的平衡转化率,错误。
1
2
3
4
5
6
4.对于可逆反应SO2(g)+NO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,下列说法正确的是
A.温度升高,化学平衡常数减小
B.NO2作还原剂被氧化
C.使用催化剂能增大SO2平衡转化率
D.在密闭容器中加入1 mol SO2和1 mol NO2,充分反应后放出41.8 kJ的热量
√
1
2
3
4
5
6
A项,该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小,正确;
B项,由化学方程式可知,反应中二氧化氮中氮元素的化合价降低被还原,是反应的氧化剂,错误;
C项,使用催化剂,化学平衡不移动,二氧化硫的平衡转化率不变,错误;
D项,该反应为可逆反应,可逆反应不可能完全反应,则密闭容器中1 mol二氧化硫和1 mol二氧化氮不可能完全反应,充分反应后放出的热量小于41.8 kJ,错误。
1
2
3
4
5
6
5.氯元素具有多种化合价,可形成Cl-、ClO-、 等离子,在一定条件下能发生相互转化。在新型催化剂RuO2作用下,O2氧化HCl可获得Cl2:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-116 kJ·
mol-1。对于反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),下列说法正确的是
A.使用高效催化剂可提高HCl的转化率
B.RuO2的使用能降低该反应的ΔH
C.反应中每消耗1 mol O2转移电子数约为4×6.02×1023
√
1
2
3
4
5
6
RuO2是该反应的催化剂,催化剂能改变反应途径,降低反应的活化能,但不能改变反应的ΔH,B错误;
该反应中O元素价态降低,Cl元素价态升高,反应中每消耗1 mol O2转移电子物质的量为4 mol,电子数约为4×6.02×1023,C正确;
该反应中H2O为气态,要代入平衡常数表达式,即该反应的平衡常
数可表示为K= ,D错误。
1
2
3
4
5
6
6.(2023·江苏高三上学期第二次大联考)下列关于2NO2(g)+NaCl(s)
NaNO3(s)+ClNO(g) ΔH<0的说法正确的是
B.升温有利于提高NO2的平衡转化率
C.反应达到平衡时增大压强,v正>v逆
D.NaCl晶胞(如图所示)中每个Na+周围有6个Na+
√
本课结束
选择题专攻
2.化学反应的方向、速率和限度综合判断
核心精讲
01
1.化学反应进行的方向
2.化学反应速率及影响因素
(2)比例式法:根据“化学反应速率之比等于化学计量数之比”进行计算。
(3)影响化学反应速率的因素
①内因:反应物本身的性质。
②外因:浓度、压强、催化剂等。
③气体反应体系中充入惰性气体(不参加反应)时对反应速率的影响
恒温恒容:充入“惰性气体”→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变。
恒温恒压:充入“惰性气体”→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减小。
3.化学平衡常数、平衡移动方向与反应速率的关系
aA(g)+bB(g) cC(g)+dD(g)
4.外界条件对化学平衡移动的影响规律
温度的 影响 升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动
浓度的 影响 增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动
压强的 影响 增大压强会使平衡向气体体积减小的方向移动;减小压强会使平衡向气体体积增大的方向移动
真题演练
02
1
2
3
1.(2023·江苏,10)金属硫化物(MxSy)催化反应CH4(g)+2H2S(g)===CS2(g)+4H2(g) ΔH<0,既可以除去天然气中的H2S,又可以获得H2。下列说法正确的是
A.该反应的ΔS<0
B.该反应的平衡常数K=
C.题图所示的反应机理中,步骤Ⅰ可理解为H2S中带部分负电荷的S与催
化剂中的M之间发生作用
D.该反应中每消耗1 mol H2S,转移电子的数目约为2×6.02×1023
√
4
5
1
2
3
由方程式知,消耗1 mol H2S同时生成2 mol
H2,转移4 mol e-,数目为4×6.02×1023,
D错误。
4
5
1
2
3
2.(2022·江苏,10)用尿素水解生成的NH3催化还原NO,是柴油机车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 4N2(g)+6H2O(g),下列说法正确的是
A.上述反应ΔS<0
B.上述反应平衡常数K=
C.上述反应中消耗1 mol NH3,转移电子的数目为2×6.02×1023
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染
程度越小
4
5
√
1
2
3
由化学方程式可知,该反应是一个气体分子数增大的反应,即熵增的反应,反应ΔS>0,故A错误;
由化学方程式可知,反应每消耗4 mol氨气,转移12 mol电子,则反应中消耗1 mol氨气转移电子的数目为3×6.02×1023,故C错误;
实际应用中,加入尿素的量越多,尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度增大,故D错误。
4
5
1
2
3
4
5
√
1
2
3
4
5
2NO(g)+O2(g)===2NO2(g) ΔH=-116.4 kJ·mol-1,反应气体物质的量减少,ΔS<0,故A正确;
使用高效催化剂,反应的焓变不变,故C错误;
1
2
3
4
5
4.(2022·海南,8)某温度下,反应CH2==CH2(g)+H2O(g)
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是
A.增大压强,v正>v逆,平衡常数增大
B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大
C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动
D.恒容下,充入一定量的CH2==CH2(g),CH2==CH2(g)的平衡转化率增大
√
1
2
3
该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应,故v正>v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;
催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;
恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;
恒容下,充入一定量的CH2==CH2(g),平衡向正反应方向移动,但是CH2==CH2(g)的平衡转化率减小,D不正确。
4
5
1
2
3
5.(2022·广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1
√
4
5
1
2
由图可知,无催化剂时,随反应进行,生成物的
浓度也在增加,说明反应也在进行,故A错误;
由图可知,催化剂Ⅰ比催化剂Ⅱ催化效果好,
反应速率大,说明催化剂Ⅰ使反应活化能更低,
故B错误;
由图可知,使用催化剂Ⅱ时,在0~2 min内Y的浓度变化了2.0 mol·L-1,而a曲线表示的X的浓度变化了2.0 mol·L-1,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂Ⅱ时X的浓度随时间t的变化,故C错误;
3
4
5
1
2
3
4
5
考向预测
03
1
2
3
4
5
6
1.(2023·江苏高三年级第二学期五校联考)对于反应CuCl(s)+2Cl-(aq)
[CuCl3]2-(aq) ΔH<0,下列说法正确的是
A.该反应的ΔS>0
B.该反应的平衡常数K=
C.加水可使该平衡逆向移动
D.其他条件相同,增大CuCl的量,可加快生成[CuCl3]2-的速率
√
1
2
3
4
5
6
CuCl为固体,增大CuCl的量,不影响生成[CuCl3]2-的速率,D错误。
1
2
3
4
5
6
2.Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示为4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-116 kJ·mol-1。关于Deacon提出的制Cl2的反应,下列有关说法正确的是
A.该反应的ΔS>0
B.每生成标准状况下22.4 L Cl2,放出58 kJ的热量
C.升高温度,该反应v逆增大,v正减小,平衡向逆反应方向移动
D.断裂4 mol H—Cl的同时,有4 mol H—O形成,说明该反应达到平衡状态
√
1
2
3
4
5
6
该反应是气体体积减小的反应,所以该反应的熵减小,即ΔS<0,A项错误;
根据热化学方程式可知,每生成2 mol Cl2,放出116 kJ的热量,所以每生成标准状况下22.4 L(即1 mol) Cl2,放出58 kJ的热量,B项正确;
该反应的正反应是放热反应,升高温度平衡逆向移动,升高温度,正、逆反应速率都增大,C项错误;
HCl是反应物,H2O是生成物,断裂4 mol H—Cl的同时,一定有4 mol H—O形成,所以该说法不能说明该反应达到平衡状态,D项错误。
1
2
3
4
5
6
3.(2022·江苏省南京市、盐城市一模)2SO2(g)+O2(g) 2SO3(g) ΔH=
-196.6 kJ·mol-1。下列说法正确的是
A.该反应在任何条件下都能自发进行
B.反应达平衡后再通入O2,SO3的体积分数一定增加
C.反应在高温、催化剂条件下进行可提高SO2的平衡转化率
D.2 mol SO2(g)和1 mol O2(g)所含键能总和比2 mol SO3(g)所含键能小
√
1
2
3
4
5
6
A项,该反应的熵减小,故不一定在任何条件均能自发,错误;
B项,当通入无穷大的O2时,参与反应的O2少,生成的SO3略有增多,但是由于没有反应的O2的量更多,则SO3的体积分数反而减少,错误;
C项,高温平衡逆向移动,催化剂不可以改变SO2的平衡转化率,错误。
1
2
3
4
5
6
4.对于可逆反应SO2(g)+NO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,下列说法正确的是
A.温度升高,化学平衡常数减小
B.NO2作还原剂被氧化
C.使用催化剂能增大SO2平衡转化率
D.在密闭容器中加入1 mol SO2和1 mol NO2,充分反应后放出41.8 kJ的热量
√
1
2
3
4
5
6
A项,该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小,正确;
B项,由化学方程式可知,反应中二氧化氮中氮元素的化合价降低被还原,是反应的氧化剂,错误;
C项,使用催化剂,化学平衡不移动,二氧化硫的平衡转化率不变,错误;
D项,该反应为可逆反应,可逆反应不可能完全反应,则密闭容器中1 mol二氧化硫和1 mol二氧化氮不可能完全反应,充分反应后放出的热量小于41.8 kJ,错误。
1
2
3
4
5
6
5.氯元素具有多种化合价,可形成Cl-、ClO-、 等离子,在一定条件下能发生相互转化。在新型催化剂RuO2作用下,O2氧化HCl可获得Cl2:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-116 kJ·
mol-1。对于反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),下列说法正确的是
A.使用高效催化剂可提高HCl的转化率
B.RuO2的使用能降低该反应的ΔH
C.反应中每消耗1 mol O2转移电子数约为4×6.02×1023
√
1
2
3
4
5
6
RuO2是该反应的催化剂,催化剂能改变反应途径,降低反应的活化能,但不能改变反应的ΔH,B错误;
该反应中O元素价态降低,Cl元素价态升高,反应中每消耗1 mol O2转移电子物质的量为4 mol,电子数约为4×6.02×1023,C正确;
该反应中H2O为气态,要代入平衡常数表达式,即该反应的平衡常
数可表示为K= ,D错误。
1
2
3
4
5
6
6.(2023·江苏高三上学期第二次大联考)下列关于2NO2(g)+NaCl(s)
NaNO3(s)+ClNO(g) ΔH<0的说法正确的是
B.升温有利于提高NO2的平衡转化率
C.反应达到平衡时增大压强,v正>v逆
D.NaCl晶胞(如图所示)中每个Na+周围有6个Na+
√
本课结束
同课章节目录
