专题六 选择题专攻 1.电离平衡、水解平衡及沉淀溶解平衡的分析应用(共45张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 选择题专攻 1.电离平衡、水解平衡及沉淀溶解平衡的分析应用(共45张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:08:29 | ||
图片预览








文档简介
(共45张PPT)
选择题专攻
1.电离平衡、水解平衡及沉淀溶解平衡的分析应用
核心精讲
01
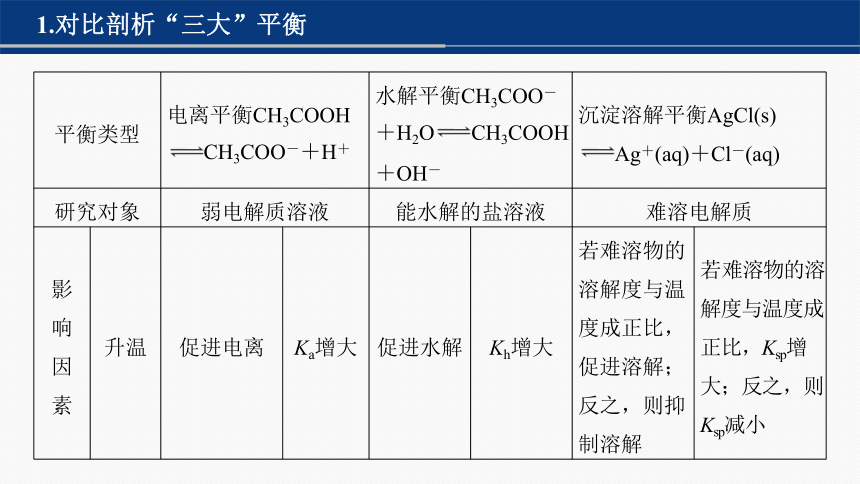
1.对比剖析“三大”平衡
平衡类型 电离平衡CH3COOH CH3COO-+H+ 水解平衡CH3COO-+H2O CH3COOH+OH- 沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq) 研究对象 弱电解质溶液 能水解的盐溶液 难溶电解质 影 响 因 素 升温 促进电离 Ka增大 促进水解 Kh增大 若难溶物的溶解度与温度成正比,促进溶解;反之,则抑制溶解 若难溶物的溶解度与温度成正比,Ksp增大;反之,则Ksp减小
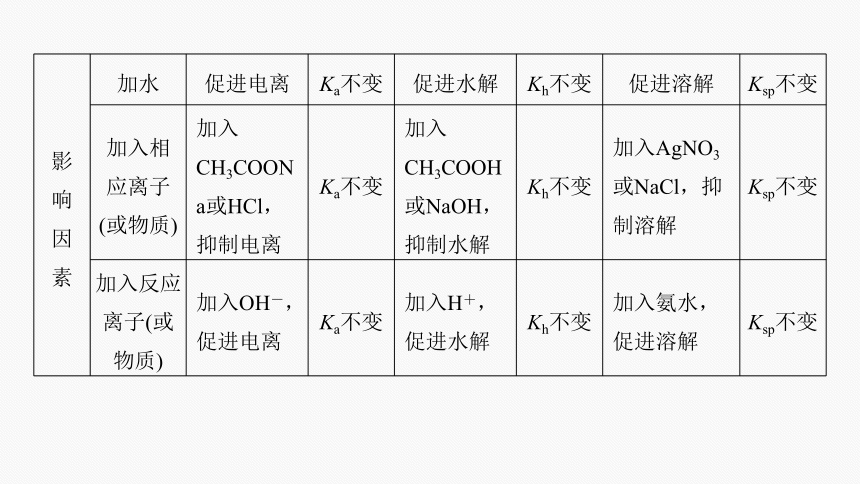
影 响 因 素 加水 促进电离 Ka不变 促进水解 Kh不变 促进溶解 Ksp不变
加入相 应离子 (或物质) 加入CH3COONa或HCl,抑制电离 Ka不变 加入CH3COOH或NaOH,抑制水解 Kh不变 加入AgNO3或NaCl,抑制溶解 Ksp不变
加入反应 离子(或 物质) 加入OH-,促进电离 Ka不变 加入H+,促进水解 Kh不变 加入氨水,促进溶解 Ksp不变
2.证明弱电解质的思维方法(以醋酸为例)
(1)测定常温下0.1 mol·L-1醋酸溶液的pH,pH>1,说明醋酸为弱酸。
(2)测定常温下CH3COONa溶液的pH,pH>7,说明醋酸为弱酸。
(3)同温度、同浓度的盐酸的导电性强于醋酸溶液的导电性,说明醋酸是弱酸。
(4)1 mol·L-1的醋酸溶液中c(H+)约为0.01 mol·L-1,说明醋酸为弱酸。
(5)取pH=3的醋酸1 mL,用蒸馏水稀释到100 mL,pH<5,说明醋酸为弱酸。
(6)向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONH4(水溶液呈中性)固体,溶液的pH变大,说明醋酸为弱酸。
3.走出溶液稀释、混合的误区
误区一:不能正确理解酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
误区二:不能正确理解弱酸、弱碱的稀释规律
溶液 稀释前 溶液pH 加水稀释 到原来体 积的10n倍 稀释后
溶液pH
酸 强酸 pH=a pH=a+n
弱酸 a碱 强碱 pH=b pH=b-n
弱碱 b-n误区三:不能正确掌握混合溶液的定性规律
常温下,pH=n(n<7)的强酸和pH=14-n的强碱溶液等体积混合,混合溶液pH=7;pH=n(n<7)的醋酸和pH=14-n的氢氧化钠溶液等体积混合,混合溶液pH<7;pH=n(n<7)的盐酸和pH=14-n的氨水等体积混合,混合溶液pH>7。
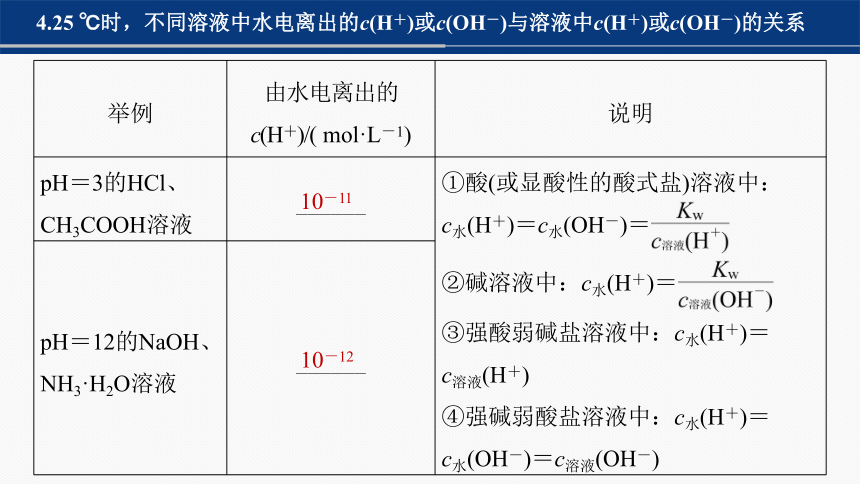
4.25 ℃时,不同溶液中水电离出的c(H+)或c(OH-)与溶液中c(H+)或c(OH-)的关系
举例 由水电离出的 c(H+)/( mol·L-1) 说明
pH=3的HCl、CH3COOH溶液 ______ ①酸(或显酸性的酸式盐)溶液中:
c水(H+)=c水(OH-)=
②碱溶液中:c水(H+)=
③强酸弱碱盐溶液中:c水(H+)=
c溶液(H+)
④强碱弱酸盐溶液中:c水(H+)=
c水(OH-)=c溶液(OH-)
pH=12的NaOH、NH3·H2O溶液 ______ 10-11
10-12
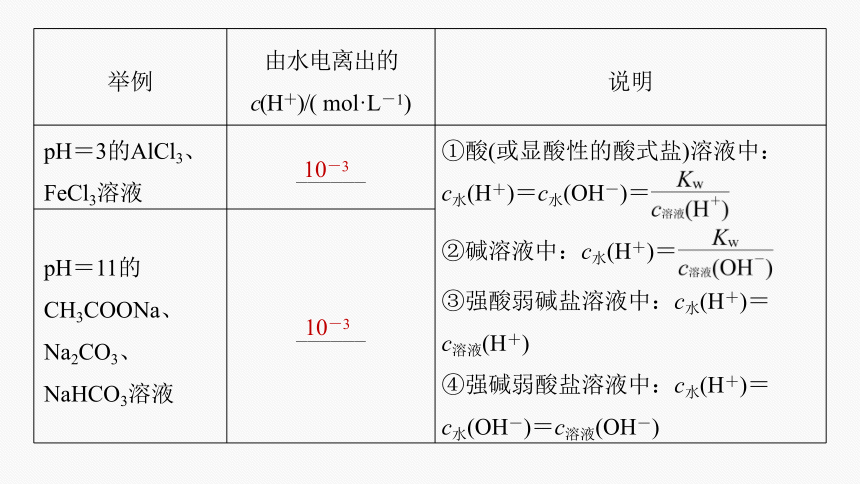
举例 由水电离出的 c(H+)/( mol·L-1) 说明
pH=3的AlCl3、FeCl3溶液 ______ ①酸(或显酸性的酸式盐)溶液中:
c水(H+)=c水(OH-)=
②碱溶液中:c水(H+)=
③强酸弱碱盐溶液中:c水(H+)=
c溶液(H+)
④强碱弱酸盐溶液中:c水(H+)=
c水(OH-)=c溶液(OH-)
pH=11的CH3COONa、Na2CO3、NaHCO3溶液 ______ 10-3
10-3
真题演练
02
1
2
3
1.(2022·全国乙卷,13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
4
5
6
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
√
1
2
3
常温下,溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 mol·
L-1,c(H+)<c(OH-)+c(A-),A错误;
4
5
6
根据题意,未电离的HA可自由穿过隔膜,
故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;
1
2
3
4
5
6
1
2
3
2.(2023·浙江1月选考,13)甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根离子的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4),下列说法不正确的是
A.活性成分R3N在水中存在平衡:
R3N+H2O R3NH++OH-
B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18
C.废水初始pH<2.4,随pH下降,甲酸的电离
被抑制,与R3NH+作用的HCOO-数目减少
D.废水初始pH>5,离子交换树脂活性成分主要以R3NH+形态存在
4
5
6
√
1
2
3
由图可知,工业废水中的甲酸及其盐,通
过离子交换树脂后,溶液pH增大,说明
R3N溶液呈碱性,溶液中存在如下平衡:
R3N+H2O R3NH++OH-,当废水初
始pH>5时,平衡向左移动,离子交换树
脂活性成分主要以R3N形态存在,故A正确、D错误;
4
5
6
1
2
3
由图可知,溶液pH=2.4时,废水中的甲酸及其盐回收率最高,当溶液中pH<2.4时,随溶液pH下降,溶液中氢离子浓度增大,甲酸的电离被抑制,溶液中HCOO-的浓度减小,与R3NH+作用的数目减小,故C正确。
4
5
6
1
2
3
3.(2023·北京,3)下列过程与水解反应无关的是
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
√
4
5
6
1
2
3
4
5
6
热的纯碱溶液因碳酸根离子水解显碱性,油脂在碱性条件下能水解生成易溶于水的高级脂肪酸盐和甘油,故可用热的纯碱溶液去除油脂,A不符合题意;
重油在高温、高压和催化剂作用下发生裂化或裂解反应生成小分子烃,与水解反应无关,B符合题意;
蛋白质在酶的作用下可以发生水解反应生成氨基酸,C不符合题意;
Fe3+能发生水解反应生成Fe(OH)3,加热能增大Fe3+的水解程度,D不符合题意。
1
2
3
4
5
6
4.(2018·北京,11)测定0.1 mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
1
2
3
4
5
6
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
下列说法不正确的是
A.Na2SO3溶液中存在水解平衡:
B.④的pH与①不同,是由 浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw值相等
√
1
2
3
4
5
6
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
1
2
3
4
5
6
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
(1)盐类水解易受温度、浓度、溶液的酸碱性等因素的影响。以氯化铁水解为例,当改变条件,如升温、通入HCl气体、加水、加铁粉、加碳酸氢钠等时,应从平衡移动方向、pH的变化、水解程度、现象等方面去归纳总结,加以分析掌握。
(2)多元弱酸的酸式盐问题。酸式盐一般既存在水解,又存在电离。如果酸式盐的电离程度大于其水解程度,溶液显酸性,如NaHSO3溶液;如果酸式盐的水解程度大于其电离程度,则溶液显碱性,如NaHCO3溶液。
规律探究
1
2
3
5.(2023·浙江1月选考,15)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
CaCO3(s) Ca2+(aq)+ (aq)[已知Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是
A.上层清液中存在c(Ca2+)=
B.上层清液中含碳微粒最主要以 形式存在
C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变
D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
4
5
6
√
1
2
上层清液为碳酸钙的饱和溶液,碳酸根离子水解生成碳酸氢根离子,因此c(Ca2+)> ,A错误;
3
4
5
6
1
2
由题干可知,Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,碳酸钙比硫酸钙更难溶,加入硫酸钠后碳酸钙不会转化成硫酸钙,D错误。
3
4
5
6
1
2
6.(2016·海南,5)向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
√
3
4
5
6
(1)沉淀溶解平衡与化学平衡、电离平衡一样,具有动态平衡的特征,平衡时溶液中各离子浓度保持恒定,平衡常数只受温度的影响,与浓度无关。
(2)溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关,相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。
反思归纳
考向预测
03
1
2
3
4
5
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
√
1
2
3
4
5
由图可知,a、b、c三点对应的平衡常数不
变,该曲线上的点温度相等,升高温度,
不能引起由c向b的变化,故A项错误;
b点c(H+)=c(OH-)=1.0×10-7 mol·L-1,
故Kw=1.0×10-14,故B项错误;
FeCl3为强酸弱碱盐,Fe3+结合水电离出的OH-,促进水的电离平衡右移,c(H+)增大,c(OH-)减小,可能引起由b向a的变化,故C项正确;
由c点到d点,水的离子积常数减小,但温度不变,Kw不变,则稀释溶液不能引起由c向d的变化,故D项错误。
1
2
3
4
5
2.某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是
A.稀释前溶液的浓度:c(HCl)<c(CH3COOH)
B.溶液中水的电离程度:b点<c点
C.从b点到d点,溶液中c(H+)·c(OH-)逐渐增大
D.溶液的导电能力:d点>e点
√
1
2
3
4
5
稀释前两溶液的pH相等,由于醋酸是弱酸,部分
电离,因此稀释前溶液的浓度:c(HCl)<
c(CH3COOH),故A正确;
b点pH小于c点pH,说明c点酸性弱,水的电离程度
大,因此溶液中水的电离程度:b点<c点,故B正确;
从b点到d点,由于溶液的温度不变,因此溶液中c(H+)·c(OH-)不变,故C错误。
1
2
3
4
5
3.实验测得0.10 mol·L-1 NaHCO3溶液的pH随温度变化如图。
下列说法正确的是
A.OM段随温度升高溶液的pH减小,原因
是 的水解被抑制
B.O点溶液和P点溶液中c(OH-)相等
C.将N点溶液恢复到25 ℃,pH可能大于8.62
D.Q点、M点溶液中均有
√
1
2
3
4
5
水解吸热,升高温度, 的水解平
衡向右移动,而根据图像可知,M点
之前升高温度,溶液pH减小,主要原
因是升温促进了水的电离,故A错误;
O点溶质只有NaHCO3,P点溶质有NaHCO3和Na2CO3,两点溶液水解程度不同,且温度不同,Kw不同,c(OH-)不相等,故B错误;
1
2
3
4
5
温度升高后,碳酸氢钠可能部分发生
分解得到碳酸钠,将N点溶液恢复到
25 ℃,由于碳酸钠的水解程度大于
碳酸氢钠,故溶液pH可能大于8.62,
故C正确;
1
2
3
4
5
4.BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是
A.酸浸工序中分次加入稀HNO3可降低反应的剧烈程度
B.转化工序中加入稀盐酸可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
√
1
2
3
4
5
硝酸为强氧化剂,可与金属铋反应,酸浸工序中分次加入稀HNO3,可降低反应的剧烈程度,A正确;
金属铋与硝酸反应生成的硝酸铋会发生水解反应生成BiONO3,水解的离子方程式为Bi3++ +H2O BiONO3+2H+,转化工序中加入稀盐酸,使氢离子浓度增大,硝酸铋的水解平衡左移,可抑制生成BiONO3,B正确;
1
2
3
4
5
氯化铋水解生成BiOCl的离子方程式为Bi3++Cl-+H2O BiOCl+2H+,水解工序中加入少量CH3COONa(s),醋酸根离子会结合氢离子生成弱电解质醋酸,使氢离子浓度减小,氯化铋水解平衡右移,促进Bi3+水解,C正确;
1
2
3
4
5
结合C项分析水解工序中加入少量NH4NO3(s),铵根离子水解生成氢离子,使氢离子浓度增大,氯化铋水解平衡左移,不利于生成BiOCl,且部分铋离子与硝酸根离子、水也会发生反应:Bi3++
+H2O BiONO3+2H+,也不利于生成BiOCl,D错误。
1
2
3
4
5
5.某同学设计下述实验检验[Ag(NH3)2]Cl溶液中的Ag+,实验如表:
下列说法不正确的是
A.Ⅰ中的c(Ag+)较小,不足以与
Cl-沉淀
B.Ⅱ中存在平衡:AgI(s)
Ag+(aq)+I-(aq)
C.Ⅲ说明NH3与H+的结合能力小于
与Ag+的结合能力
D.配离子与其他离子能否反应,其本质是平衡移动的问题
√
1
2
3
4
5
25 ℃时,Ksp(AgCl)>Ksp(AgI),
对比实验Ⅰ和Ⅱ,说明Ⅰ中的
c(Ag+)较小,不足以与Cl-沉
淀,故A正确;
Ⅱ中产生黄色沉淀即生成AgI
沉淀,AgI沉淀存在溶解平衡:
AgI(s) Ag+(aq)+I-(aq),故
B正确;
1
2
3
4
5
根据Ⅰ和Ⅲ的实验现象,说明
[Ag(NH3)2]Cl和氢离子反应,有大
量银离子生成,银离子和氯离子
反应生成AgCl沉淀,则Ⅲ中NH3
与H+的结合能力大于与Ag+的结
合能力,故C错误;
通过对比实验Ⅰ和Ⅲ可知,NH3与
H+的结合使[Ag(NH3)2]+(aq) Ag+(aq)+2NH3(aq)正向移动,即配离子与其他离子能否反应,其本质是平衡移动的问题,故D正确。
本课结束
选择题专攻
1.电离平衡、水解平衡及沉淀溶解平衡的分析应用
核心精讲
01
1.对比剖析“三大”平衡
平衡类型 电离平衡CH3COOH CH3COO-+H+ 水解平衡CH3COO-+H2O CH3COOH+OH- 沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq) 研究对象 弱电解质溶液 能水解的盐溶液 难溶电解质 影 响 因 素 升温 促进电离 Ka增大 促进水解 Kh增大 若难溶物的溶解度与温度成正比,促进溶解;反之,则抑制溶解 若难溶物的溶解度与温度成正比,Ksp增大;反之,则Ksp减小
影 响 因 素 加水 促进电离 Ka不变 促进水解 Kh不变 促进溶解 Ksp不变
加入相 应离子 (或物质) 加入CH3COONa或HCl,抑制电离 Ka不变 加入CH3COOH或NaOH,抑制水解 Kh不变 加入AgNO3或NaCl,抑制溶解 Ksp不变
加入反应 离子(或 物质) 加入OH-,促进电离 Ka不变 加入H+,促进水解 Kh不变 加入氨水,促进溶解 Ksp不变
2.证明弱电解质的思维方法(以醋酸为例)
(1)测定常温下0.1 mol·L-1醋酸溶液的pH,pH>1,说明醋酸为弱酸。
(2)测定常温下CH3COONa溶液的pH,pH>7,说明醋酸为弱酸。
(3)同温度、同浓度的盐酸的导电性强于醋酸溶液的导电性,说明醋酸是弱酸。
(4)1 mol·L-1的醋酸溶液中c(H+)约为0.01 mol·L-1,说明醋酸为弱酸。
(5)取pH=3的醋酸1 mL,用蒸馏水稀释到100 mL,pH<5,说明醋酸为弱酸。
(6)向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONH4(水溶液呈中性)固体,溶液的pH变大,说明醋酸为弱酸。
3.走出溶液稀释、混合的误区
误区一:不能正确理解酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
误区二:不能正确理解弱酸、弱碱的稀释规律
溶液 稀释前 溶液pH 加水稀释 到原来体 积的10n倍 稀释后
溶液pH
酸 强酸 pH=a pH=a+n
弱酸 a
弱碱 b-n
常温下,pH=n(n<7)的强酸和pH=14-n的强碱溶液等体积混合,混合溶液pH=7;pH=n(n<7)的醋酸和pH=14-n的氢氧化钠溶液等体积混合,混合溶液pH<7;pH=n(n<7)的盐酸和pH=14-n的氨水等体积混合,混合溶液pH>7。
4.25 ℃时,不同溶液中水电离出的c(H+)或c(OH-)与溶液中c(H+)或c(OH-)的关系
举例 由水电离出的 c(H+)/( mol·L-1) 说明
pH=3的HCl、CH3COOH溶液 ______ ①酸(或显酸性的酸式盐)溶液中:
c水(H+)=c水(OH-)=
②碱溶液中:c水(H+)=
③强酸弱碱盐溶液中:c水(H+)=
c溶液(H+)
④强碱弱酸盐溶液中:c水(H+)=
c水(OH-)=c溶液(OH-)
pH=12的NaOH、NH3·H2O溶液 ______ 10-11
10-12
举例 由水电离出的 c(H+)/( mol·L-1) 说明
pH=3的AlCl3、FeCl3溶液 ______ ①酸(或显酸性的酸式盐)溶液中:
c水(H+)=c水(OH-)=
②碱溶液中:c水(H+)=
③强酸弱碱盐溶液中:c水(H+)=
c溶液(H+)
④强碱弱酸盐溶液中:c水(H+)=
c水(OH-)=c溶液(OH-)
pH=11的CH3COONa、Na2CO3、NaHCO3溶液 ______ 10-3
10-3
真题演练
02
1
2
3
1.(2022·全国乙卷,13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
4
5
6
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
√
1
2
3
常温下,溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 mol·
L-1,c(H+)<c(OH-)+c(A-),A错误;
4
5
6
根据题意,未电离的HA可自由穿过隔膜,
故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;
1
2
3
4
5
6
1
2
3
2.(2023·浙江1月选考,13)甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根离子的物质的量分数)与废水初始pH关系如图(已知甲酸Ka=1.8×10-4),下列说法不正确的是
A.活性成分R3N在水中存在平衡:
R3N+H2O R3NH++OH-
B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18
C.废水初始pH<2.4,随pH下降,甲酸的电离
被抑制,与R3NH+作用的HCOO-数目减少
D.废水初始pH>5,离子交换树脂活性成分主要以R3NH+形态存在
4
5
6
√
1
2
3
由图可知,工业废水中的甲酸及其盐,通
过离子交换树脂后,溶液pH增大,说明
R3N溶液呈碱性,溶液中存在如下平衡:
R3N+H2O R3NH++OH-,当废水初
始pH>5时,平衡向左移动,离子交换树
脂活性成分主要以R3N形态存在,故A正确、D错误;
4
5
6
1
2
3
由图可知,溶液pH=2.4时,废水中的甲酸及其盐回收率最高,当溶液中pH<2.4时,随溶液pH下降,溶液中氢离子浓度增大,甲酸的电离被抑制,溶液中HCOO-的浓度减小,与R3NH+作用的数目减小,故C正确。
4
5
6
1
2
3
3.(2023·北京,3)下列过程与水解反应无关的是
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
√
4
5
6
1
2
3
4
5
6
热的纯碱溶液因碳酸根离子水解显碱性,油脂在碱性条件下能水解生成易溶于水的高级脂肪酸盐和甘油,故可用热的纯碱溶液去除油脂,A不符合题意;
重油在高温、高压和催化剂作用下发生裂化或裂解反应生成小分子烃,与水解反应无关,B符合题意;
蛋白质在酶的作用下可以发生水解反应生成氨基酸,C不符合题意;
Fe3+能发生水解反应生成Fe(OH)3,加热能增大Fe3+的水解程度,D不符合题意。
1
2
3
4
5
6
4.(2018·北京,11)测定0.1 mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
1
2
3
4
5
6
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
下列说法不正确的是
A.Na2SO3溶液中存在水解平衡:
B.④的pH与①不同,是由 浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw值相等
√
1
2
3
4
5
6
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
1
2
3
4
5
6
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
(1)盐类水解易受温度、浓度、溶液的酸碱性等因素的影响。以氯化铁水解为例,当改变条件,如升温、通入HCl气体、加水、加铁粉、加碳酸氢钠等时,应从平衡移动方向、pH的变化、水解程度、现象等方面去归纳总结,加以分析掌握。
(2)多元弱酸的酸式盐问题。酸式盐一般既存在水解,又存在电离。如果酸式盐的电离程度大于其水解程度,溶液显酸性,如NaHSO3溶液;如果酸式盐的水解程度大于其电离程度,则溶液显碱性,如NaHCO3溶液。
规律探究
1
2
3
5.(2023·浙江1月选考,15)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
CaCO3(s) Ca2+(aq)+ (aq)[已知Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是
A.上层清液中存在c(Ca2+)=
B.上层清液中含碳微粒最主要以 形式存在
C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变
D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
4
5
6
√
1
2
上层清液为碳酸钙的饱和溶液,碳酸根离子水解生成碳酸氢根离子,因此c(Ca2+)> ,A错误;
3
4
5
6
1
2
由题干可知,Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,碳酸钙比硫酸钙更难溶,加入硫酸钠后碳酸钙不会转化成硫酸钙,D错误。
3
4
5
6
1
2
6.(2016·海南,5)向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
√
3
4
5
6
(1)沉淀溶解平衡与化学平衡、电离平衡一样,具有动态平衡的特征,平衡时溶液中各离子浓度保持恒定,平衡常数只受温度的影响,与浓度无关。
(2)溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关,相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。
反思归纳
考向预测
03
1
2
3
4
5
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
√
1
2
3
4
5
由图可知,a、b、c三点对应的平衡常数不
变,该曲线上的点温度相等,升高温度,
不能引起由c向b的变化,故A项错误;
b点c(H+)=c(OH-)=1.0×10-7 mol·L-1,
故Kw=1.0×10-14,故B项错误;
FeCl3为强酸弱碱盐,Fe3+结合水电离出的OH-,促进水的电离平衡右移,c(H+)增大,c(OH-)减小,可能引起由b向a的变化,故C项正确;
由c点到d点,水的离子积常数减小,但温度不变,Kw不变,则稀释溶液不能引起由c向d的变化,故D项错误。
1
2
3
4
5
2.某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是
A.稀释前溶液的浓度:c(HCl)<c(CH3COOH)
B.溶液中水的电离程度:b点<c点
C.从b点到d点,溶液中c(H+)·c(OH-)逐渐增大
D.溶液的导电能力:d点>e点
√
1
2
3
4
5
稀释前两溶液的pH相等,由于醋酸是弱酸,部分
电离,因此稀释前溶液的浓度:c(HCl)<
c(CH3COOH),故A正确;
b点pH小于c点pH,说明c点酸性弱,水的电离程度
大,因此溶液中水的电离程度:b点<c点,故B正确;
从b点到d点,由于溶液的温度不变,因此溶液中c(H+)·c(OH-)不变,故C错误。
1
2
3
4
5
3.实验测得0.10 mol·L-1 NaHCO3溶液的pH随温度变化如图。
下列说法正确的是
A.OM段随温度升高溶液的pH减小,原因
是 的水解被抑制
B.O点溶液和P点溶液中c(OH-)相等
C.将N点溶液恢复到25 ℃,pH可能大于8.62
D.Q点、M点溶液中均有
√
1
2
3
4
5
水解吸热,升高温度, 的水解平
衡向右移动,而根据图像可知,M点
之前升高温度,溶液pH减小,主要原
因是升温促进了水的电离,故A错误;
O点溶质只有NaHCO3,P点溶质有NaHCO3和Na2CO3,两点溶液水解程度不同,且温度不同,Kw不同,c(OH-)不相等,故B错误;
1
2
3
4
5
温度升高后,碳酸氢钠可能部分发生
分解得到碳酸钠,将N点溶液恢复到
25 ℃,由于碳酸钠的水解程度大于
碳酸氢钠,故溶液pH可能大于8.62,
故C正确;
1
2
3
4
5
4.BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
下列说法错误的是
A.酸浸工序中分次加入稀HNO3可降低反应的剧烈程度
B.转化工序中加入稀盐酸可抑制生成BiONO3
C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度
D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
√
1
2
3
4
5
硝酸为强氧化剂,可与金属铋反应,酸浸工序中分次加入稀HNO3,可降低反应的剧烈程度,A正确;
金属铋与硝酸反应生成的硝酸铋会发生水解反应生成BiONO3,水解的离子方程式为Bi3++ +H2O BiONO3+2H+,转化工序中加入稀盐酸,使氢离子浓度增大,硝酸铋的水解平衡左移,可抑制生成BiONO3,B正确;
1
2
3
4
5
氯化铋水解生成BiOCl的离子方程式为Bi3++Cl-+H2O BiOCl+2H+,水解工序中加入少量CH3COONa(s),醋酸根离子会结合氢离子生成弱电解质醋酸,使氢离子浓度减小,氯化铋水解平衡右移,促进Bi3+水解,C正确;
1
2
3
4
5
结合C项分析水解工序中加入少量NH4NO3(s),铵根离子水解生成氢离子,使氢离子浓度增大,氯化铋水解平衡左移,不利于生成BiOCl,且部分铋离子与硝酸根离子、水也会发生反应:Bi3++
+H2O BiONO3+2H+,也不利于生成BiOCl,D错误。
1
2
3
4
5
5.某同学设计下述实验检验[Ag(NH3)2]Cl溶液中的Ag+,实验如表:
下列说法不正确的是
A.Ⅰ中的c(Ag+)较小,不足以与
Cl-沉淀
B.Ⅱ中存在平衡:AgI(s)
Ag+(aq)+I-(aq)
C.Ⅲ说明NH3与H+的结合能力小于
与Ag+的结合能力
D.配离子与其他离子能否反应,其本质是平衡移动的问题
√
1
2
3
4
5
25 ℃时,Ksp(AgCl)>Ksp(AgI),
对比实验Ⅰ和Ⅱ,说明Ⅰ中的
c(Ag+)较小,不足以与Cl-沉
淀,故A正确;
Ⅱ中产生黄色沉淀即生成AgI
沉淀,AgI沉淀存在溶解平衡:
AgI(s) Ag+(aq)+I-(aq),故
B正确;
1
2
3
4
5
根据Ⅰ和Ⅲ的实验现象,说明
[Ag(NH3)2]Cl和氢离子反应,有大
量银离子生成,银离子和氯离子
反应生成AgCl沉淀,则Ⅲ中NH3
与H+的结合能力大于与Ag+的结
合能力,故C错误;
通过对比实验Ⅰ和Ⅲ可知,NH3与
H+的结合使[Ag(NH3)2]+(aq) Ag+(aq)+2NH3(aq)正向移动,即配离子与其他离子能否反应,其本质是平衡移动的问题,故D正确。
本课结束
同课章节目录
