专题六 选择题专攻 3.中和滴定反应“突跃”曲线的分析应用(共34张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 选择题专攻 3.中和滴定反应“突跃”曲线的分析应用(共34张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:12:13 | ||
图片预览








文档简介
(共34张PPT)
选择题专攻
3.中和滴定反应“突跃”曲线的分析应用
核心精讲
01
1.强碱滴定强酸
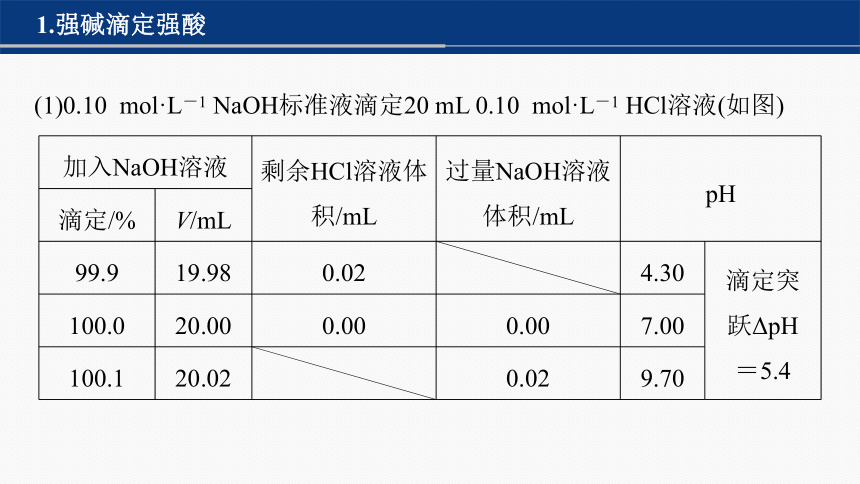
(1)0.10 mol·L-1 NaOH标准液滴定20 mL 0.10 mol·L-1 HCl溶液(如图)
加入NaOH溶液 剩余HCl溶液体积/mL 过量NaOH溶液体积/mL pH 滴定/% V/mL 99.9 19.98 0.02 4.30 滴定突
跃ΔpH
=5.4
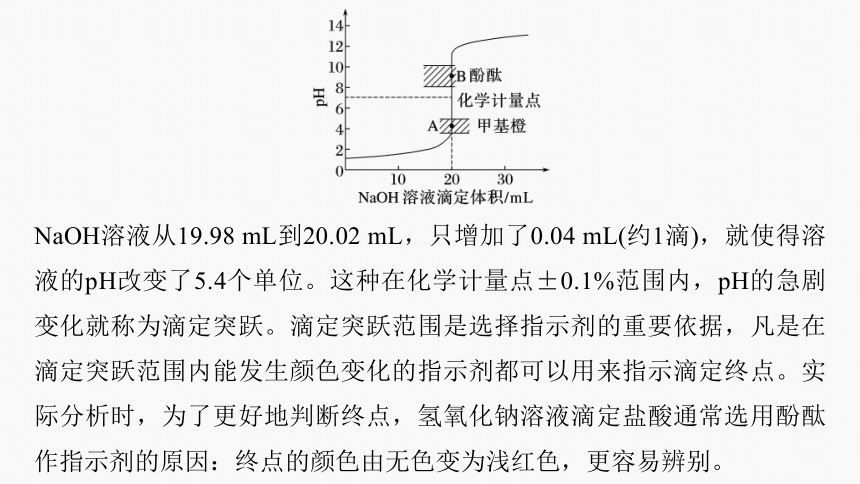
100.0 20.00 0.00 0.00 7.00 100.1 20.02 0.02 9.70 NaOH溶液从19.98 mL到20.02 mL,只增加了0.04 mL(约1滴),就使得溶液的pH改变了5.4个单位。这种在化学计量点±0.1%范围内,pH的急剧变化就称为滴定突跃。滴定突跃范围是选择指示剂的重要依据,凡是在滴定突跃范围内能发生颜色变化的指示剂都可以用来指示滴定终点。实际分析时,为了更好地判断终点,氢氧化钠溶液滴定盐酸通常选用酚酞作指示剂的原因:终点的颜色由无色变为浅红色,更容易辨别。
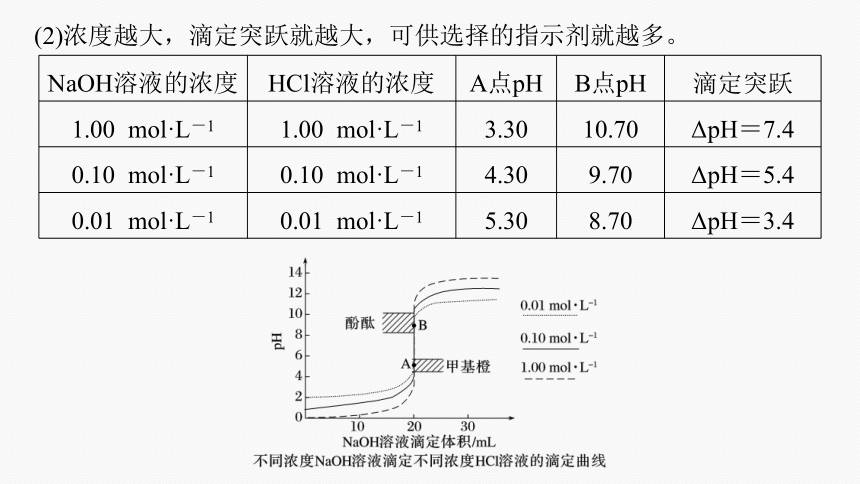
(2)浓度越大,滴定突跃就越大,可供选择的指示剂就越多。
NaOH溶液的浓度 HCl溶液的浓度 A点pH B点pH 滴定突跃
1.00 mol·L-1 1.00 mol·L-1 3.30 10.70 ΔpH=7.4
0.10 mol·L-1 0.10 mol·L-1 4.30 9.70 ΔpH=5.4
0.01 mol·L-1 0.01 mol·L-1 5.30 8.70 ΔpH=3.4
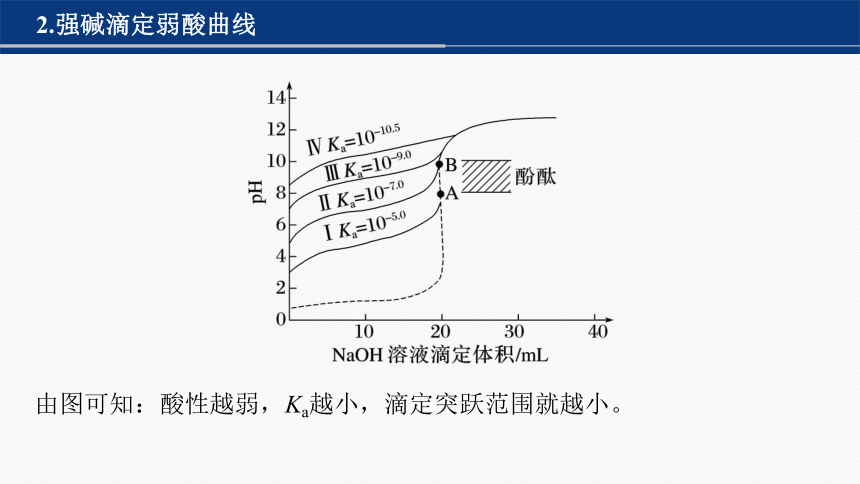
2.强碱滴定弱酸曲线
由图可知:酸性越弱,Ka越小,滴定突跃范围就越小。
3.巧抓“四点”,突破溶液中的粒子浓度关系
(1)抓反应“一半”点,判断是什么溶质的等量混合。
(2)抓“恰好”反应点,生成的溶质是什么?判断溶液的酸碱性。
(3)抓溶液的“中性”点,生成什么溶质,哪种物质过量或不足。
(4)抓反应的“过量”点,溶液中的溶质是什么?判断哪种物质过量。
实例分析:向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。
(注:a点为反应一半点,b点呈中性,c点恰好完全反应,d点NaOH过量一倍)
分析:
a点,溶质为 ,
离子浓度关系: ;
b点,溶质为 ,
离子浓度关系: ;
c点,溶质为 ,
离子浓度关系: ;
d点,溶质为 ,
离子浓度关系: 。
CH3COONa、CH3COOH
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
CH3COONa、CH3COOH
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
CH3COONa
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
CH3COONa、NaOH
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
真题演练
02
1
2
3
1.(2023·湖南,12)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中
溶液的pH随η[η= ]的变化曲线如图所示。下列说法错误的是
4
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+
c(CH3COOH)
C.点b:c(CH3COOH)D.水的电离程度:a√
1
2
3
点a溶液为等浓度的NaCl和CH3COOH混合溶液,存在元素质量守恒:c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-),故B正确;
4
1
2
3
点b溶液中含有NaCl及等浓度的CH3COOH
和CH3COONa,由于pH<7,溶液显酸性,
说明CH3COOH的电离程度大于CH3COO-
的水解程度,则c(CH3COOH)故C正确;
点c溶液中CH3COO-水解促进水的电离,点d碱过量,会抑制水的电离,则水的电离程度:c>d,故D错误。
4
1
2
3
2.(2021·湖南,9)常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)
=c(H+)-c(OH-)
4
√
1
2
3
NaX为强碱弱酸盐,在溶液中水解使溶液呈碱性,
则溶液中离子浓度的大小顺序为c(Na+)>c(X-)>
c(OH-)>c(H+),故A正确;
弱酸的酸性越弱,电离常数越小,分析可知,HX、
HY、HZ三种一元弱酸的酸性依次减弱,则三种一元弱酸的电离常数的大小顺序为Ka(HX)>Ka (HY)>Ka(HZ),故B正确;
当溶液pH为7时,酸越弱,向盐溶液中加入盐酸的体积越大,酸根离子的浓度越小,则三种盐溶液中酸根离子的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故C错误;
4
1
2
3
向三种盐溶液中分别滴加20.00 mL盐酸,三种盐都
完全反应,溶液中钠离子浓度等于氯离子浓度,将
三种溶液混合后溶液中存在电荷守恒关系c(Na+)+
c(H+)=c(X-)+c(Y-)+c(Z-)+c(Cl-)+c(OH-),
由c(Na+)=c(Cl-)可得:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),故D正确。
4
1
2
3
3.(2019·全国卷Ⅰ,11)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Kal=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
√
4
1
2
3
4
滴定至终点时发生反应:2NaOH+2KHA===
K2A+Na2A+2H2O。溶液导电能力与溶液中
离子浓度、离子种类有关,离子浓度越大、
所带电荷越多,其导电能力越强,A项正确;
图像中纵轴表示“相对导电能力”,随着NaOH溶液的滴加,溶液中c(K+)、c(HA-)逐渐减小,而Na+、A2-的物质的量逐渐增大,由题图可知,溶液的相对导电能力逐渐增强,说明Na+与A2-的导电能力之和大于HA-的,B项正确;
1
2
3
4
本实验默认在常温下进行,滴定终点时,溶
液中的溶质为邻苯二甲酸钠和邻苯二甲酸钾,
由于邻苯二甲酸是弱酸,所以溶液呈碱性,
pH>7,C项错误;
滴定终点时,c(K+)=c(Na+),a点到b点加入NaOH溶液的体积大于b点到c点的,故c点时c(K+)>c(OH-),所以c(Na+)>c(K+)>c(OH-),D项正确。
1
2
3
4
4.(2016·天津,6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示。下列判断错误的是
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>
c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
√
1
2
3
A项,根据图像知,在未滴加NaOH溶液时,
0.1 mol·L-1的三种酸(HA、HB和HD)溶液的
pH均大于1,说明三种酸均为弱酸,且HA的
pH最小、酸性最强,HD的pH最大、酸性最
弱,因酸性越强,电离常数越大,故KHA>
KHB>KHD,正确;
B项,滴定至P点时,溶液中未反应的HB与生成的NaB的浓度相等,且溶液呈酸性,说明HB的电离程度大于B-的水解程度,故c(B-)>
c(Na+)>c(HB)>c(H+)>c(OH-),正确;
4
1
2
3
C项,pH=7时,三种阴离子的浓度分别等于
c(Na+),然而三种溶液中阴离子水解程度不
同,加入的NaOH的体积不同,故三种阴离
子的浓度也不同,错误;
D项,根据质子守恒即可得出,三种溶液混
合后溶液的质子守恒关系:c(HA)+c(HB)+
c(HD)=c(OH-)-c(H+),正确。
4
考向预测
03
1
2
3
4
1.25 ℃时,向20.00 mL 0.10 mol·L-1 CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是
A.25 ℃时,CH3COOH的电离平衡常数Ka=1.0
×10-3
B.M点对应的NaOH溶液体积为20.0 mL
C.N点与Q点所示溶液中水的电离程度:N>Q
D.N点所示溶液(溶质只有CH3COONa)中c(Na+)
>c(OH-)>c(CH3COO-)>c(H+)
√
1
2
3
4
M点pH=7,若加入20 mL NaOH溶液,溶液
中溶质是CH3COONa,CH3COO-水解使溶
液显碱性,与题干的溶液显中性相违背,说明M点对应的NaOH溶液的体积小于20.00 mL,B项错误;
1
2
3
4
CH3COOH完全反应后,加入的NaOH越多,
OH-对水的电离抑制程度越大,故N点水的
电离程度比Q点大,C项正确;
N点所示溶液中醋酸与NaOH恰好中和,溶
液为CH3COONa溶液,CH3COO-发生水解
反应而消耗,所以c(Na+)>c(CH3COO-),CH3COO-发生水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),但盐水解程度是微弱的,水解产生的离子浓度远小于盐电离产生的离子浓度,因此c(CH3COO-)>c(OH-),故该溶液中离子浓度关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D项错误。
1
2
3
4
2.常温下,在20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液中逐滴滴加0.100 0 mol·
L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
√
1
2
3
4
①点时加入HCl溶液10 mL,得到等物质的量浓度的NH3·H2O、NH4Cl的混合液,溶液呈碱性,
>c(Cl-)>c(OH-)>c(H+),故A错误;
③点时酸碱恰好反应,生成氯化铵,氯化铵水解使溶液呈酸性,促进水的电离,①②两点有碱剩余,抑制水的电离,①②③三点所示的溶液中水的电离程度:③>②>①,故C错误;
1
2
3
4
3.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·
L-1的CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
A.两种一元弱酸的电离常数:Ka(CH3COOH)
B.溶液中水的电离程度:③>②>①
C.pH=7时,c(CH3COO-)=c(CN-)
D.滴定时均可选用甲基橙作指示剂,指示滴
定终点
√
1
2
3
4
同浓度的酸溶液,电离平衡常数越大,溶液酸性越强,起始时CH3COOH溶液pH较小,CH3COOH酸性较强,则室温下,电离平衡常数:Ka(CH3COOH)>Ka(HCN),A错误;
由图可知,①对应溶液显酸性,以CH3COOH
的电离为主,此时抑制水的电离,②对应溶液呈中性,对水的电离几乎无影响,③对应溶液中溶质为CH3COONa,CH3COO-水解促进水的电离,故溶液中水的电离程度:③>②>①,B正确;
1
2
3
4
根据电荷守恒可知,溶液中分别有:c(CN-)+c(OH-)=c1(Na+)+c(H+),c(CH3COO-)+c(OH-)=c2(Na+)+c(H+),pH=7时,则有c(CN-)=c1(Na+),c(CH3COO-)=c2(Na+),由图可知,c2(Na+)>c1(Na+),即c(CH3COO-)>c(CN-),C错误;
由图可知,滴定终点溶液均显碱性,故滴定时均应选酚酞作指示剂,不能选用甲基橙作指示剂指示滴定终点,D错误。
1
2
3
4
4.电位滴定是根据滴定过程中电极电位的变化来确定滴定终点的一种分析方法。在化学计量点附近,被测离子浓度发生突跃,电极电位也发生突跃,进而确定滴定终点。常温下利用盐酸滴定某溶液中Na2CO3的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是
√
1
2
3
4
因为是电位滴定,根据指示电极电位的突跃位置可以确定滴定终点,无需任何指示剂,A错误;
a点溶液的溶质为NaHCO3和NaCl,NaHCO3水解促进水的电离,b点溶液的溶质为H2CO3和NaCl,H2CO3抑制水的电离,水电离出的c水(H+):a点>b点,C错误;
1
2
3
4
本课结束
选择题专攻
3.中和滴定反应“突跃”曲线的分析应用
核心精讲
01
1.强碱滴定强酸
(1)0.10 mol·L-1 NaOH标准液滴定20 mL 0.10 mol·L-1 HCl溶液(如图)
加入NaOH溶液 剩余HCl溶液体积/mL 过量NaOH溶液体积/mL pH 滴定/% V/mL 99.9 19.98 0.02 4.30 滴定突
跃ΔpH
=5.4
100.0 20.00 0.00 0.00 7.00 100.1 20.02 0.02 9.70 NaOH溶液从19.98 mL到20.02 mL,只增加了0.04 mL(约1滴),就使得溶液的pH改变了5.4个单位。这种在化学计量点±0.1%范围内,pH的急剧变化就称为滴定突跃。滴定突跃范围是选择指示剂的重要依据,凡是在滴定突跃范围内能发生颜色变化的指示剂都可以用来指示滴定终点。实际分析时,为了更好地判断终点,氢氧化钠溶液滴定盐酸通常选用酚酞作指示剂的原因:终点的颜色由无色变为浅红色,更容易辨别。
(2)浓度越大,滴定突跃就越大,可供选择的指示剂就越多。
NaOH溶液的浓度 HCl溶液的浓度 A点pH B点pH 滴定突跃
1.00 mol·L-1 1.00 mol·L-1 3.30 10.70 ΔpH=7.4
0.10 mol·L-1 0.10 mol·L-1 4.30 9.70 ΔpH=5.4
0.01 mol·L-1 0.01 mol·L-1 5.30 8.70 ΔpH=3.4
2.强碱滴定弱酸曲线
由图可知:酸性越弱,Ka越小,滴定突跃范围就越小。
3.巧抓“四点”,突破溶液中的粒子浓度关系
(1)抓反应“一半”点,判断是什么溶质的等量混合。
(2)抓“恰好”反应点,生成的溶质是什么?判断溶液的酸碱性。
(3)抓溶液的“中性”点,生成什么溶质,哪种物质过量或不足。
(4)抓反应的“过量”点,溶液中的溶质是什么?判断哪种物质过量。
实例分析:向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。
(注:a点为反应一半点,b点呈中性,c点恰好完全反应,d点NaOH过量一倍)
分析:
a点,溶质为 ,
离子浓度关系: ;
b点,溶质为 ,
离子浓度关系: ;
c点,溶质为 ,
离子浓度关系: ;
d点,溶质为 ,
离子浓度关系: 。
CH3COONa、CH3COOH
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
CH3COONa、CH3COOH
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
CH3COONa
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
CH3COONa、NaOH
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
真题演练
02
1
2
3
1.(2023·湖南,12)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中
溶液的pH随η[η= ]的变化曲线如图所示。下列说法错误的是
4
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+
c(CH3COOH)
C.点b:c(CH3COOH)
1
2
3
点a溶液为等浓度的NaCl和CH3COOH混合溶液,存在元素质量守恒:c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-),故B正确;
4
1
2
3
点b溶液中含有NaCl及等浓度的CH3COOH
和CH3COONa,由于pH<7,溶液显酸性,
说明CH3COOH的电离程度大于CH3COO-
的水解程度,则c(CH3COOH)
点c溶液中CH3COO-水解促进水的电离,点d碱过量,会抑制水的电离,则水的电离程度:c>d,故D错误。
4
1
2
3
2.(2021·湖南,9)常温下,用0.100 0 mol·L-1的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L-1的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)
=c(H+)-c(OH-)
4
√
1
2
3
NaX为强碱弱酸盐,在溶液中水解使溶液呈碱性,
则溶液中离子浓度的大小顺序为c(Na+)>c(X-)>
c(OH-)>c(H+),故A正确;
弱酸的酸性越弱,电离常数越小,分析可知,HX、
HY、HZ三种一元弱酸的酸性依次减弱,则三种一元弱酸的电离常数的大小顺序为Ka(HX)>Ka (HY)>Ka(HZ),故B正确;
当溶液pH为7时,酸越弱,向盐溶液中加入盐酸的体积越大,酸根离子的浓度越小,则三种盐溶液中酸根离子的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故C错误;
4
1
2
3
向三种盐溶液中分别滴加20.00 mL盐酸,三种盐都
完全反应,溶液中钠离子浓度等于氯离子浓度,将
三种溶液混合后溶液中存在电荷守恒关系c(Na+)+
c(H+)=c(X-)+c(Y-)+c(Z-)+c(Cl-)+c(OH-),
由c(Na+)=c(Cl-)可得:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),故D正确。
4
1
2
3
3.(2019·全国卷Ⅰ,11)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Kal=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
√
4
1
2
3
4
滴定至终点时发生反应:2NaOH+2KHA===
K2A+Na2A+2H2O。溶液导电能力与溶液中
离子浓度、离子种类有关,离子浓度越大、
所带电荷越多,其导电能力越强,A项正确;
图像中纵轴表示“相对导电能力”,随着NaOH溶液的滴加,溶液中c(K+)、c(HA-)逐渐减小,而Na+、A2-的物质的量逐渐增大,由题图可知,溶液的相对导电能力逐渐增强,说明Na+与A2-的导电能力之和大于HA-的,B项正确;
1
2
3
4
本实验默认在常温下进行,滴定终点时,溶
液中的溶质为邻苯二甲酸钠和邻苯二甲酸钾,
由于邻苯二甲酸是弱酸,所以溶液呈碱性,
pH>7,C项错误;
滴定终点时,c(K+)=c(Na+),a点到b点加入NaOH溶液的体积大于b点到c点的,故c点时c(K+)>c(OH-),所以c(Na+)>c(K+)>c(OH-),D项正确。
1
2
3
4
4.(2016·天津,6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示。下列判断错误的是
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>
c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
√
1
2
3
A项,根据图像知,在未滴加NaOH溶液时,
0.1 mol·L-1的三种酸(HA、HB和HD)溶液的
pH均大于1,说明三种酸均为弱酸,且HA的
pH最小、酸性最强,HD的pH最大、酸性最
弱,因酸性越强,电离常数越大,故KHA>
KHB>KHD,正确;
B项,滴定至P点时,溶液中未反应的HB与生成的NaB的浓度相等,且溶液呈酸性,说明HB的电离程度大于B-的水解程度,故c(B-)>
c(Na+)>c(HB)>c(H+)>c(OH-),正确;
4
1
2
3
C项,pH=7时,三种阴离子的浓度分别等于
c(Na+),然而三种溶液中阴离子水解程度不
同,加入的NaOH的体积不同,故三种阴离
子的浓度也不同,错误;
D项,根据质子守恒即可得出,三种溶液混
合后溶液的质子守恒关系:c(HA)+c(HB)+
c(HD)=c(OH-)-c(H+),正确。
4
考向预测
03
1
2
3
4
1.25 ℃时,向20.00 mL 0.10 mol·L-1 CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是
A.25 ℃时,CH3COOH的电离平衡常数Ka=1.0
×10-3
B.M点对应的NaOH溶液体积为20.0 mL
C.N点与Q点所示溶液中水的电离程度:N>Q
D.N点所示溶液(溶质只有CH3COONa)中c(Na+)
>c(OH-)>c(CH3COO-)>c(H+)
√
1
2
3
4
M点pH=7,若加入20 mL NaOH溶液,溶液
中溶质是CH3COONa,CH3COO-水解使溶
液显碱性,与题干的溶液显中性相违背,说明M点对应的NaOH溶液的体积小于20.00 mL,B项错误;
1
2
3
4
CH3COOH完全反应后,加入的NaOH越多,
OH-对水的电离抑制程度越大,故N点水的
电离程度比Q点大,C项正确;
N点所示溶液中醋酸与NaOH恰好中和,溶
液为CH3COONa溶液,CH3COO-发生水解
反应而消耗,所以c(Na+)>c(CH3COO-),CH3COO-发生水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),但盐水解程度是微弱的,水解产生的离子浓度远小于盐电离产生的离子浓度,因此c(CH3COO-)>c(OH-),故该溶液中离子浓度关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D项错误。
1
2
3
4
2.常温下,在20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液中逐滴滴加0.100 0 mol·
L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
√
1
2
3
4
①点时加入HCl溶液10 mL,得到等物质的量浓度的NH3·H2O、NH4Cl的混合液,溶液呈碱性,
>c(Cl-)>c(OH-)>c(H+),故A错误;
③点时酸碱恰好反应,生成氯化铵,氯化铵水解使溶液呈酸性,促进水的电离,①②两点有碱剩余,抑制水的电离,①②③三点所示的溶液中水的电离程度:③>②>①,故C错误;
1
2
3
4
3.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·
L-1的CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
A.两种一元弱酸的电离常数:Ka(CH3COOH)
C.pH=7时,c(CH3COO-)=c(CN-)
D.滴定时均可选用甲基橙作指示剂,指示滴
定终点
√
1
2
3
4
同浓度的酸溶液,电离平衡常数越大,溶液酸性越强,起始时CH3COOH溶液pH较小,CH3COOH酸性较强,则室温下,电离平衡常数:Ka(CH3COOH)>Ka(HCN),A错误;
由图可知,①对应溶液显酸性,以CH3COOH
的电离为主,此时抑制水的电离,②对应溶液呈中性,对水的电离几乎无影响,③对应溶液中溶质为CH3COONa,CH3COO-水解促进水的电离,故溶液中水的电离程度:③>②>①,B正确;
1
2
3
4
根据电荷守恒可知,溶液中分别有:c(CN-)+c(OH-)=c1(Na+)+c(H+),c(CH3COO-)+c(OH-)=c2(Na+)+c(H+),pH=7时,则有c(CN-)=c1(Na+),c(CH3COO-)=c2(Na+),由图可知,c2(Na+)>c1(Na+),即c(CH3COO-)>c(CN-),C错误;
由图可知,滴定终点溶液均显碱性,故滴定时均应选酚酞作指示剂,不能选用甲基橙作指示剂指示滴定终点,D错误。
1
2
3
4
4.电位滴定是根据滴定过程中电极电位的变化来确定滴定终点的一种分析方法。在化学计量点附近,被测离子浓度发生突跃,电极电位也发生突跃,进而确定滴定终点。常温下利用盐酸滴定某溶液中Na2CO3的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是
√
1
2
3
4
因为是电位滴定,根据指示电极电位的突跃位置可以确定滴定终点,无需任何指示剂,A错误;
a点溶液的溶质为NaHCO3和NaCl,NaHCO3水解促进水的电离,b点溶液的溶质为H2CO3和NaCl,H2CO3抑制水的电离,水电离出的c水(H+):a点>b点,C错误;
1
2
3
4
本课结束
同课章节目录
