专题六 选择题专攻 4.中和滴定反应中“分布系数图像”的分析应用(共44张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 选择题专攻 4.中和滴定反应中“分布系数图像”的分析应用(共44张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:13:20 | ||
图片预览









文档简介
(共44张PPT)
选择题专攻
4.中和滴定反应中“分布系数图像”的分析应用
核心精讲
01
1.CH3COOH溶液、CH3COONa溶液
CH3COOH电离:
CH3COOH CH3COO-+H+
CH3COONa水解:
CH3COO-+H2O CH3COOH+OH-
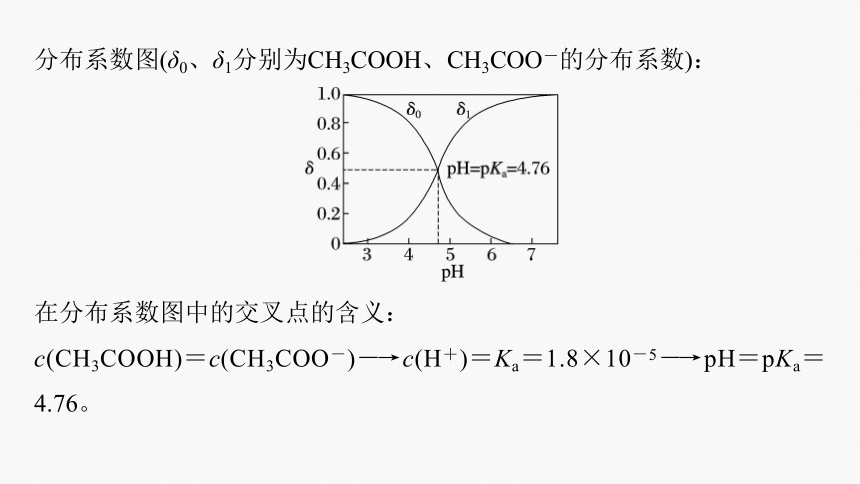
分布系数图(δ0、δ1分别为CH3COOH、CH3COO-的分布系数):
在分布系数图中的交叉点的含义:
c(CH3COOH)=c(CH3COO-)―→c(H+)=Ka=1.8×10-5―→pH=pKa=4.76。
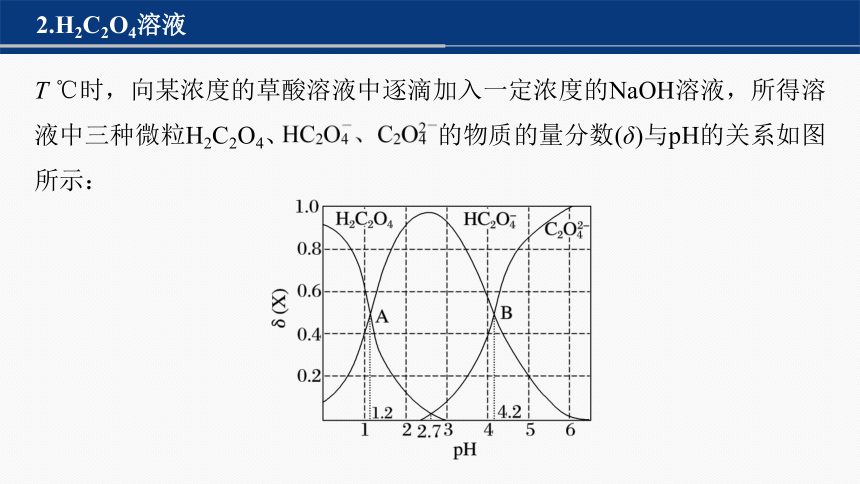
2.H2C2O4溶液
T ℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、 的物质的量分数(δ)与pH的关系如图所示:
回答下列问题:
(1)写出H2C2O4的电离方程式及电离平衡常数表达式:
① ,
Ka1= ;
② ,
Ka2= 。
(2)根据A点,得Ka1= ,根据B点,得Ka2= 。
10-1.2
10-4.2
(3)在pH=2.7的溶液中, =________。
1 000
(4)0.1 mol·L-1的NaHC2O4溶液呈______(填“酸”“碱”或“中”)性,其离子浓度从大到小的顺序为_____________________________________
_________。
酸
c(OH-)
(注:也可以根据图像观察)
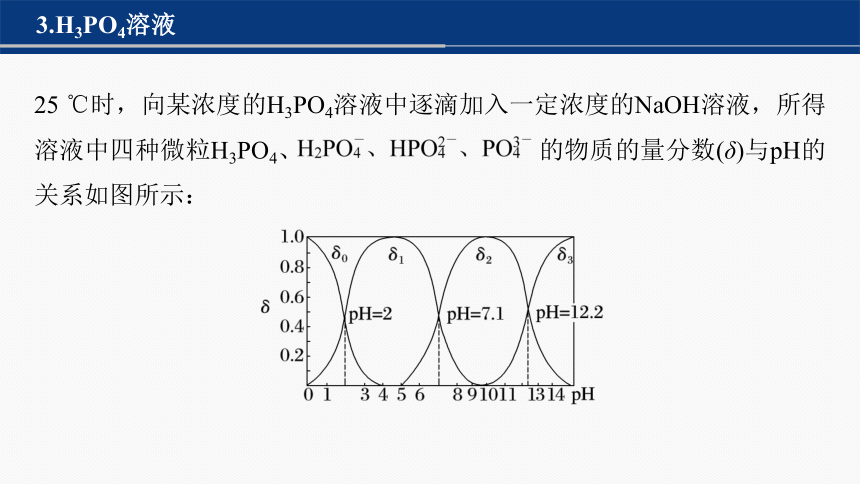
3.H3PO4溶液
25 ℃时,向某浓度的H3PO4溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中四种微粒H3PO4、 的物质的量分数(δ)与pH的关系如图所示:
回答下列问题:
(1)δ0、δ1、δ2、δ3分别代表的微粒是_______、_______、_______、_______。
(2)写出pH由1到14依次发生反应的离子方程式:_____________________
_______、____________________________、________________________
_______。
(3)Ka1=______,Ka2=_______,Ka3=________。
(4)常温下,试判断①0.1 mol·L-1NaH2PO4溶液;②0.1 mol·L-1Na2HPO4溶液的酸碱性。
①________;②________。
H3PO4
+H2O
+H2O
10-2
10-7.1
10-12.2
酸性
碱性
真题演练
02
1
2
3
1.(2023·湖北,14)H2L为某邻苯二酚类配体,其pKa1=7.46,pKa2=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)= ,已知lg 2≈0.30,lg 3≈0.48。下列说法正确的是
A.当pH=1时,体系中c(H2L)>c([FeL]+)>
c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的
lg K约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
4
√
1
2
3
由图可知,pH=1,即c(H+)=0.1 mol·
L-1时c([FeL]+)=1.0×10-4 mol·L-1,
又c0(H2L)=5.0×10-3 mol·L-1,根据
Fe3++H2L [FeL]++2H+知,此时
c(H2L)=(5.0-0.1)×10-3 mol·L-1=
4.9×10-3 mol·L-1,结合Ka1=
=10-7.46知,此时c(HL-)=10-7.46×4.9×10-3×10 mol·
L-1=4.9×10-9.46 mol·L-1,又pH=1时,c(OH-)=10-13 mol·L-1,故A错误;
4
1
2
3
4
1
2
3
4
1
2
3
2.(2022·湖北,15)如图是亚砷酸As(OH)3和酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·
L-1,总T为1.0×10-3mol·L-1)。下列说法错误的是
A.As(OH)3的lg Ka1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比
[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物
种为As(OH)3
4
√
1
2
3
4
1
2
3
4
由图可知As(OH)3的浓度为左坐标,浓度
的数量级为10-3,[As(OH)2T]-的浓度为
右坐标,浓度的数量级为10-6,所以pH
=3.1时,As(OH)3的浓度比[As(OH)2T]-
的高,C正确;
由已知条件,酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37),As(OH)3的lg Ka1为-9.1,即酒石酸的第一步电离常数远大于亚砷酸的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。
1
2
3
4
√
1
2
3
4
NH2CH2COOH中存在—NH2和—COOH,
所以甘氨酸既有酸性又有碱性,故A正确;
1
2
3
4
NH2CH2COOH中存在—NH2和—COOH,
所以甘氨酸既有酸性又有碱性,故A正确;
1
2
3
4
1
2
3
4
√
1
2
3
M点存在电荷守恒:c(R-)+c(OH-)+c(Cl-)=2c(H3R2+)+c(H2R+)+c(H+)+c(Na+),此时c(H3R2+)=c(H2R+),因此c(R-)+c(OH-)+c(Cl-)=3c(H2R+)+c(H+)+c(Na+),故B错误;
4
1
2
3
P点溶质为NaCl、HR、NaR,此时溶液呈碱性,因此c(OH-)>c(H+),溶质浓度大于水解和电离所产生的微粒浓度,因此c(Na+)>c(Cl-)>
c(OH-)>c(H+),故D正确。
4
考向预测
03
1.已知H3PO4是一种三元中强酸。25 ℃时,向某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示。下列说法正确的是
√
1
2
3
4
1
2
3
4
1
2
3
4
1
2
3
4
2.常温下,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的二元酸H2A溶液。溶液中分布系数δ[例如A2-的分布系数:δ(A2-)=
]随pH的变化关系如图所示。下列叙述正确的是
A.曲线①代表δ(H2A)
B.滴加NaOH溶液体积为30.00 mL时,溶液中
c(HA-)+2c(H+)=c(A2-)+2c(OH-)
C.A2-的水解常数Kh=1.0×10-2
D.a点时溶液中c(Na+)>2c(A2-)+c(HA-)+c(H2A)
√
1
2
3
4
在未加NaOH溶液时,曲线①的分布系数与曲
线②的分布系数之和等于1,且曲线①一直在
减小,曲线②一直在增加,说明H2A第一步完
全电离,第二步存在电离平衡,即H2A===H+
+HA-,HA- H++A2-,曲线①代表
δ(HA-),曲线②代表δ(A2-),故A错误;
1
2
3
4
由电荷守恒得:c(Na+)+c(H+)=2c(A2-)+
c(OH-)+c(HA-),滴加NaOH溶液体积为
30.00 mL时,根据元素质量守恒得:2c(Na+)
=3c(A2-)+3c(HA-),联立两式得:c(HA-)
+2c(H+)=c(A2-)+2c(OH-),故B正确;
A2-的水解常数Kh= ,结合图中a点数据可知此时c(HA-)=c(A2-),pH=2,c(OH-)=1.0×10-12 mol·L-1,Kh=1.0×10-12,故C错误;
1
2
3
4
a点时溶液中存在电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时溶液显酸性,则c(Na+)<2c(A2-)+c(HA-),c(H2A)=0,则c(Na+)<2c(A2-)+c(HA-)+c(H2A),故D错误。
1
2
3
4
3.已知pKa=-lg Ka,25 ℃时,H2R的pKa1=1.85,pKa2=7.22。用0.100 0 mol·
L-1 NaOH溶液滴定20.00 mL H2R溶液,溶液中H2R、HR-、R2-的分布
分数δ[如R2-分布分数:δ(R2-)= ]随pH变化曲线
及滴定曲线如图(忽略滴定过程中温度的变化)。下列说法错误的是
A.两次突变,应选用不同的指示剂
B.pH=8时:c(Na+)>c(R2-)>c(HR-)
C.b点溶液的pH约为4.54
D.c2(HR-)√
1
2
3
4
用0.100 0 mol·L-1NaOH溶液滴定20.00 mL H2R溶液,pH较大时,R-的分布分数较大,随着pH的减小,R2-的分布分数逐渐减小,HR-的分布分数逐渐增大,恰好生成NaHR之后,HR-的分布分数逐渐减小,H2R的分布分数逐渐增大,表示H2R、HR-、R2-的分布分数的
曲线如图所示 。
1
2
3
4
根据图像可知,第一次滴定突变时溶液呈酸性,
可以选择甲基橙作指示剂,第二次滴定突变时
溶液呈碱性,可以选择酚酞作指示剂,故A正确;
根据图像可知,pH=8时,溶液中含有Na2R和
NaHR,此时δ(R2-)>δ(HR-),则c(Na+)>c(R2-)
>c(HR-),故B正确;
1
2
3
4
1
2
3
4
1
2
3
4
√
1
2
3
4
1
2
3
4
1
2
3
4
本课结束
选择题专攻
4.中和滴定反应中“分布系数图像”的分析应用
核心精讲
01
1.CH3COOH溶液、CH3COONa溶液
CH3COOH电离:
CH3COOH CH3COO-+H+
CH3COONa水解:
CH3COO-+H2O CH3COOH+OH-
分布系数图(δ0、δ1分别为CH3COOH、CH3COO-的分布系数):
在分布系数图中的交叉点的含义:
c(CH3COOH)=c(CH3COO-)―→c(H+)=Ka=1.8×10-5―→pH=pKa=4.76。
2.H2C2O4溶液
T ℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、 的物质的量分数(δ)与pH的关系如图所示:
回答下列问题:
(1)写出H2C2O4的电离方程式及电离平衡常数表达式:
① ,
Ka1= ;
② ,
Ka2= 。
(2)根据A点,得Ka1= ,根据B点,得Ka2= 。
10-1.2
10-4.2
(3)在pH=2.7的溶液中, =________。
1 000
(4)0.1 mol·L-1的NaHC2O4溶液呈______(填“酸”“碱”或“中”)性,其离子浓度从大到小的顺序为_____________________________________
_________。
酸
c(OH-)
(注:也可以根据图像观察)
3.H3PO4溶液
25 ℃时,向某浓度的H3PO4溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中四种微粒H3PO4、 的物质的量分数(δ)与pH的关系如图所示:
回答下列问题:
(1)δ0、δ1、δ2、δ3分别代表的微粒是_______、_______、_______、_______。
(2)写出pH由1到14依次发生反应的离子方程式:_____________________
_______、____________________________、________________________
_______。
(3)Ka1=______,Ka2=_______,Ka3=________。
(4)常温下,试判断①0.1 mol·L-1NaH2PO4溶液;②0.1 mol·L-1Na2HPO4溶液的酸碱性。
①________;②________。
H3PO4
+H2O
+H2O
10-2
10-7.1
10-12.2
酸性
碱性
真题演练
02
1
2
3
1.(2023·湖北,14)H2L为某邻苯二酚类配体,其pKa1=7.46,pKa2=12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)= ,已知lg 2≈0.30,lg 3≈0.48。下列说法正确的是
A.当pH=1时,体系中c(H2L)>c([FeL]+)>
c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的
lg K约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
4
√
1
2
3
由图可知,pH=1,即c(H+)=0.1 mol·
L-1时c([FeL]+)=1.0×10-4 mol·L-1,
又c0(H2L)=5.0×10-3 mol·L-1,根据
Fe3++H2L [FeL]++2H+知,此时
c(H2L)=(5.0-0.1)×10-3 mol·L-1=
4.9×10-3 mol·L-1,结合Ka1=
=10-7.46知,此时c(HL-)=10-7.46×4.9×10-3×10 mol·
L-1=4.9×10-9.46 mol·L-1,又pH=1时,c(OH-)=10-13 mol·L-1,故A错误;
4
1
2
3
4
1
2
3
4
1
2
3
2.(2022·湖北,15)如图是亚砷酸As(OH)3和酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·
L-1,总T为1.0×10-3mol·L-1)。下列说法错误的是
A.As(OH)3的lg Ka1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比
[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物
种为As(OH)3
4
√
1
2
3
4
1
2
3
4
由图可知As(OH)3的浓度为左坐标,浓度
的数量级为10-3,[As(OH)2T]-的浓度为
右坐标,浓度的数量级为10-6,所以pH
=3.1时,As(OH)3的浓度比[As(OH)2T]-
的高,C正确;
由已知条件,酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37),As(OH)3的lg Ka1为-9.1,即酒石酸的第一步电离常数远大于亚砷酸的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。
1
2
3
4
√
1
2
3
4
NH2CH2COOH中存在—NH2和—COOH,
所以甘氨酸既有酸性又有碱性,故A正确;
1
2
3
4
NH2CH2COOH中存在—NH2和—COOH,
所以甘氨酸既有酸性又有碱性,故A正确;
1
2
3
4
1
2
3
4
√
1
2
3
M点存在电荷守恒:c(R-)+c(OH-)+c(Cl-)=2c(H3R2+)+c(H2R+)+c(H+)+c(Na+),此时c(H3R2+)=c(H2R+),因此c(R-)+c(OH-)+c(Cl-)=3c(H2R+)+c(H+)+c(Na+),故B错误;
4
1
2
3
P点溶质为NaCl、HR、NaR,此时溶液呈碱性,因此c(OH-)>c(H+),溶质浓度大于水解和电离所产生的微粒浓度,因此c(Na+)>c(Cl-)>
c(OH-)>c(H+),故D正确。
4
考向预测
03
1.已知H3PO4是一种三元中强酸。25 ℃时,向某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示。下列说法正确的是
√
1
2
3
4
1
2
3
4
1
2
3
4
1
2
3
4
2.常温下,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的二元酸H2A溶液。溶液中分布系数δ[例如A2-的分布系数:δ(A2-)=
]随pH的变化关系如图所示。下列叙述正确的是
A.曲线①代表δ(H2A)
B.滴加NaOH溶液体积为30.00 mL时,溶液中
c(HA-)+2c(H+)=c(A2-)+2c(OH-)
C.A2-的水解常数Kh=1.0×10-2
D.a点时溶液中c(Na+)>2c(A2-)+c(HA-)+c(H2A)
√
1
2
3
4
在未加NaOH溶液时,曲线①的分布系数与曲
线②的分布系数之和等于1,且曲线①一直在
减小,曲线②一直在增加,说明H2A第一步完
全电离,第二步存在电离平衡,即H2A===H+
+HA-,HA- H++A2-,曲线①代表
δ(HA-),曲线②代表δ(A2-),故A错误;
1
2
3
4
由电荷守恒得:c(Na+)+c(H+)=2c(A2-)+
c(OH-)+c(HA-),滴加NaOH溶液体积为
30.00 mL时,根据元素质量守恒得:2c(Na+)
=3c(A2-)+3c(HA-),联立两式得:c(HA-)
+2c(H+)=c(A2-)+2c(OH-),故B正确;
A2-的水解常数Kh= ,结合图中a点数据可知此时c(HA-)=c(A2-),pH=2,c(OH-)=1.0×10-12 mol·L-1,Kh=1.0×10-12,故C错误;
1
2
3
4
a点时溶液中存在电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时溶液显酸性,则c(Na+)<2c(A2-)+c(HA-),c(H2A)=0,则c(Na+)<2c(A2-)+c(HA-)+c(H2A),故D错误。
1
2
3
4
3.已知pKa=-lg Ka,25 ℃时,H2R的pKa1=1.85,pKa2=7.22。用0.100 0 mol·
L-1 NaOH溶液滴定20.00 mL H2R溶液,溶液中H2R、HR-、R2-的分布
分数δ[如R2-分布分数:δ(R2-)= ]随pH变化曲线
及滴定曲线如图(忽略滴定过程中温度的变化)。下列说法错误的是
A.两次突变,应选用不同的指示剂
B.pH=8时:c(Na+)>c(R2-)>c(HR-)
C.b点溶液的pH约为4.54
D.c2(HR-)
1
2
3
4
用0.100 0 mol·L-1NaOH溶液滴定20.00 mL H2R溶液,pH较大时,R-的分布分数较大,随着pH的减小,R2-的分布分数逐渐减小,HR-的分布分数逐渐增大,恰好生成NaHR之后,HR-的分布分数逐渐减小,H2R的分布分数逐渐增大,表示H2R、HR-、R2-的分布分数的
曲线如图所示 。
1
2
3
4
根据图像可知,第一次滴定突变时溶液呈酸性,
可以选择甲基橙作指示剂,第二次滴定突变时
溶液呈碱性,可以选择酚酞作指示剂,故A正确;
根据图像可知,pH=8时,溶液中含有Na2R和
NaHR,此时δ(R2-)>δ(HR-),则c(Na+)>c(R2-)
>c(HR-),故B正确;
1
2
3
4
1
2
3
4
1
2
3
4
√
1
2
3
4
1
2
3
4
1
2
3
4
本课结束
同课章节目录
