专题六 选择题专攻 5.中和滴定反应中“对数图像”的分析应用(共34张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 选择题专攻 5.中和滴定反应中“对数图像”的分析应用(共34张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:14:38 | ||
图片预览


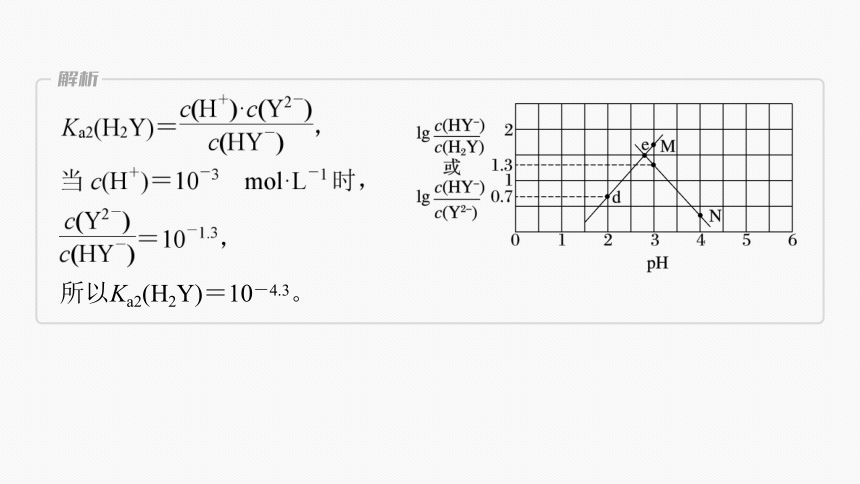




文档简介
(共34张PPT)
选择题专攻
5.中和滴定反应中“对数图像”的分析应用
核心精讲
01
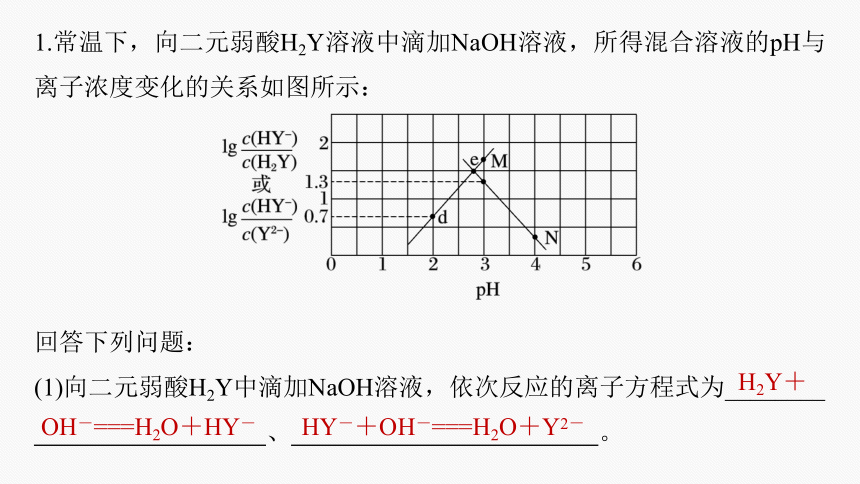
1.常温下,向二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
回答下列问题:
(1)向二元弱酸H2Y中滴加NaOH溶液,依次反应的离子方程式为________
、 。
H2Y+
OH-===H2O+HY-
HY-+OH-===H2O+Y2-
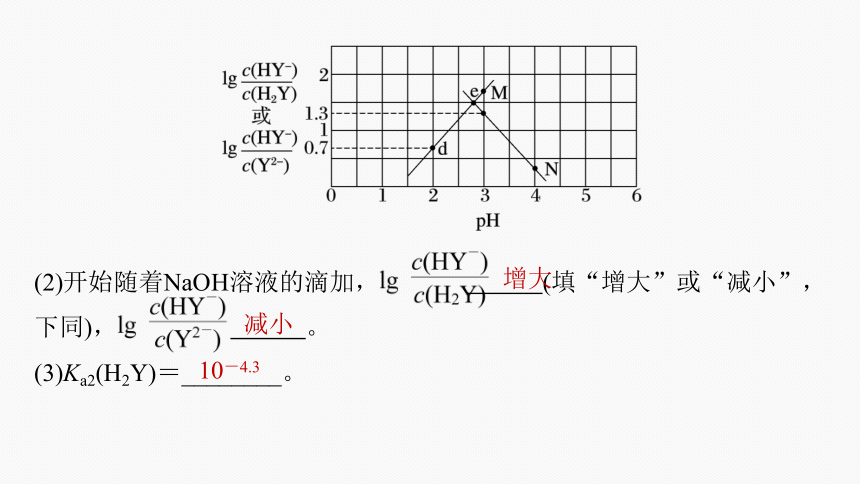
(2)开始随着NaOH溶液的滴加, (填“增大”或“减小”,下同), 。
(3)Ka2(H2Y)=________。
增大
减小
10-4.3
所以Ka2(H2Y)=10-4.3。
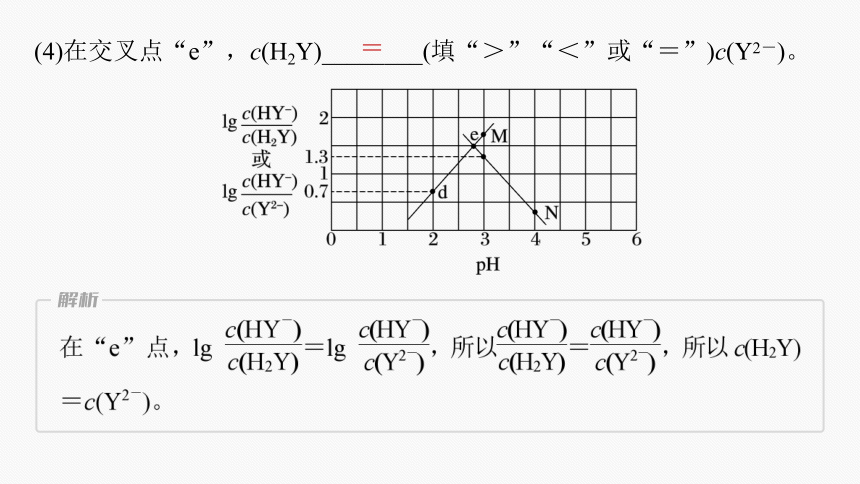
(4)在交叉点“e”,c(H2Y)________(填“>”“<”或“=”)c(Y2-)。
=
M
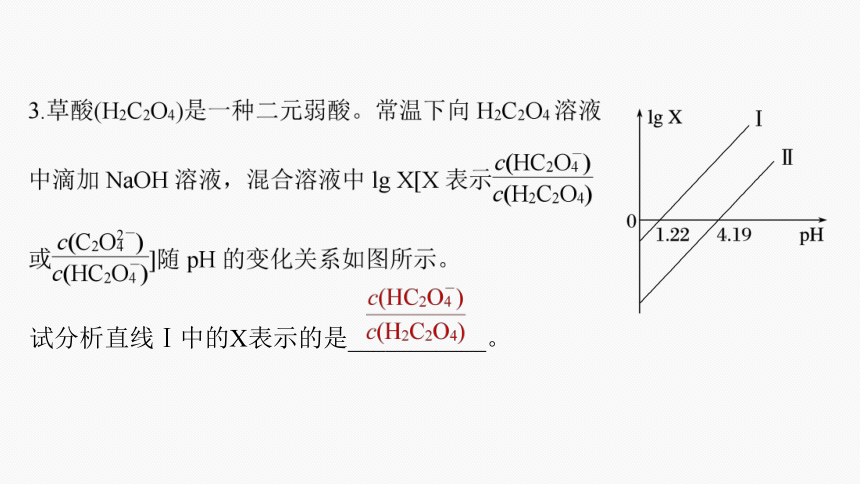
试分析直线Ⅰ中的X表示的是___________。
真题演练
02
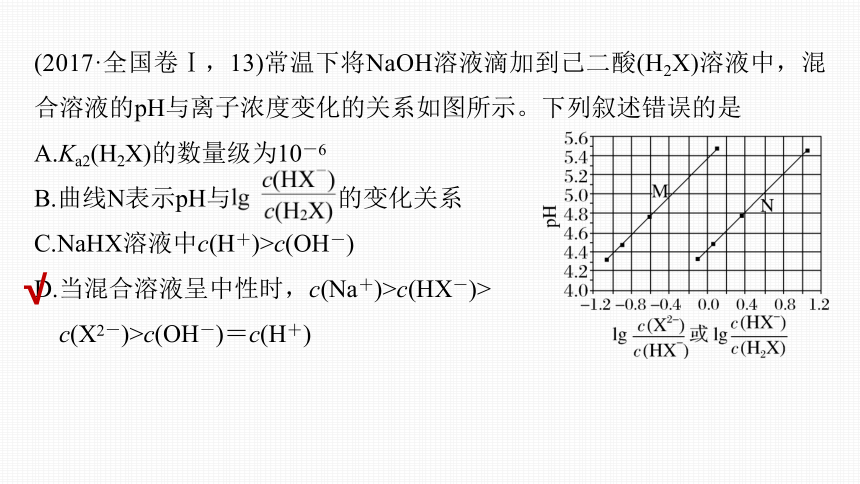
(2017·全国卷Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>
c(X2-)>c(OH-)=c(H+)
√
横坐标取0时,曲线M对应pH约为5.4,曲线N对应pH约为4.4,因为是NaOH滴定H2X溶液,所以在酸性较强的溶液中会存在c(HX-)=c(H2X),所以曲线N表示pH与
的变化关系,B项正确;
考向预测
03
1
2
3
4
1.常温下,向某浓度H2A溶液中缓慢加入NaOH(s),保持溶液体积和温度不变,测得pH与-lg c(H2A)、-lg c(A2-)、-lg [ ]变化如图所示。
下列说法正确的是
A.a到b的滴定过程水的电离程度逐
渐减小
B.常温下,H2A的电离平衡常数Ka1
为10-0.8
C.a点溶液中c(A2-)>c(HA-)>c(H+)>c(OH-)
D.NaHA溶液中c(Na+)>c(HA-)>c(H2A)>c(A2-)
√
1
2
3
4
向某浓度 H2A溶液中加入NaOH(s)
时,由于二者发生反应,所以H2A
逐渐减少,-lg c(H2A)会逐渐增大,
所以图中呈上升趋势的曲线为
-lg c(H2A)与pH的变化关系,标①;
H2A H++HA-,HA- H++A2-,A2-会逐渐增大,-lg c(A2-)
会逐渐减小,但是不会等于 0,所以呈下降趋势且与横坐标无交点的曲线为-lg c(A2-)与pH的变化关系,标②,
1
2
3
4
另一条曲线则是 与
pH的变化关系,标③,以此解题。
a到b的滴定过程-lg c(A2-)逐渐减
小,则c(A2-)逐渐增大,A2-对水
电离起促进作用,c(A2-)越大,水的电离程度越大,a到b过程中水的电离程度逐渐增大,故A错误;
1
2
3
4
1
2
3
4
1
2
3
4
2.25 ℃时,向二元弱酸H2X溶液中滴加NaOH溶液(忽略温度变化),所得混合溶液的pH与粒子浓度变化如图所示。下列说法错误的是
A.随着NaOH溶液的滴加,
逐渐增大
B.溶液中水的电离程度:a>b>c
C.b点对应的溶液中:2c(H2X)+
c(HX-)>c(Na+)
D.当溶液的pH=4时,c(H2X)∶c(HX-)∶c(X2-)=1∶10m+2∶10m+n-3
√
1
2
3
4
H2X→Na2X的过程中,溶液由酸性变为碱性,该过程中随pH增大水的电离程度逐渐增大,溶液中水的电离程度:a>b>c,故B正确;
1
2
3
4
1
2
3
4
3.谷氨酸( ,用H2A表示)在生物体内的蛋白质代谢过程中占重要
地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1 mol·
L-1 HCl溶液滴定20.00 mL 0.1 mol·L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lg c(OH-)],下列叙述正确的是
A.曲线X表示pOH与 的关系
B.Na2A溶液中,c(Na+)+c(H+)=2c(A2-)
+c(HA-)+c(OH-)
C.溶液显中性时,c(H2A)>c(A2-)
D.当V(HCl)=10 mL时,c(HA-)+2c(H2A)
+3c(H3A+)+c(H+)=c(OH-)+c(Cl-)
1
2
3
4
√
1
2
3
4
H2A、HA-、A2-与水反应的程度依次增大,Kh(H2A)、Kh(HA-)、Kh(A2-)依次增大,
1
2
3
4
1
2
3
4
Na2A溶液中存在电荷守恒关系:c(Na+)
+c(H+)+c(H3A+)=2c(A2-)+c(HA-)
+c(OH-),故B错误;
1
2
3
4
HCl溶液体积为10 mL时,反应得到等
浓度的Na2A、NaHA、NaCl的混合溶
液,溶液中存在电荷守恒关系:c(Na+)
+c(H+)+c(H3A+)=2c(A2-)+c(HA-)
+c(OH-)+c(Cl-)和元素质量守恒关系:
c(Na+)=2c(HA-)+2c(H2A)+2c(H3A+)+2c(A2-),整合两式可得c(HA-)+2c(H2A)+3c(H3A+)+c(H+)=c(OH-)+c(Cl-),故D正确。
1
2
3
4
√
1
2
3
4
1
2
3
4
滴入20 mL 等浓度的HM溶液后,根据元素质量守恒可得c(HM)+c(M-)=c(HN)+c(N-);根据电荷守恒可得c(Na+)+c(H+)=c(M-)+c(N-)+c(OH-),两式相加,整理可得关系式c(HN)+c(OH-)+2c(N-)=c(HM)+c(Na+)+c(H+),D正确。
1
2
3
4
本课结束
选择题专攻
5.中和滴定反应中“对数图像”的分析应用
核心精讲
01
1.常温下,向二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
回答下列问题:
(1)向二元弱酸H2Y中滴加NaOH溶液,依次反应的离子方程式为________
、 。
H2Y+
OH-===H2O+HY-
HY-+OH-===H2O+Y2-
(2)开始随着NaOH溶液的滴加, (填“增大”或“减小”,下同), 。
(3)Ka2(H2Y)=________。
增大
减小
10-4.3
所以Ka2(H2Y)=10-4.3。
(4)在交叉点“e”,c(H2Y)________(填“>”“<”或“=”)c(Y2-)。
=
M
试分析直线Ⅰ中的X表示的是___________。
真题演练
02
(2017·全国卷Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>
c(X2-)>c(OH-)=c(H+)
√
横坐标取0时,曲线M对应pH约为5.4,曲线N对应pH约为4.4,因为是NaOH滴定H2X溶液,所以在酸性较强的溶液中会存在c(HX-)=c(H2X),所以曲线N表示pH与
的变化关系,B项正确;
考向预测
03
1
2
3
4
1.常温下,向某浓度H2A溶液中缓慢加入NaOH(s),保持溶液体积和温度不变,测得pH与-lg c(H2A)、-lg c(A2-)、-lg [ ]变化如图所示。
下列说法正确的是
A.a到b的滴定过程水的电离程度逐
渐减小
B.常温下,H2A的电离平衡常数Ka1
为10-0.8
C.a点溶液中c(A2-)>c(HA-)>c(H+)>c(OH-)
D.NaHA溶液中c(Na+)>c(HA-)>c(H2A)>c(A2-)
√
1
2
3
4
向某浓度 H2A溶液中加入NaOH(s)
时,由于二者发生反应,所以H2A
逐渐减少,-lg c(H2A)会逐渐增大,
所以图中呈上升趋势的曲线为
-lg c(H2A)与pH的变化关系,标①;
H2A H++HA-,HA- H++A2-,A2-会逐渐增大,-lg c(A2-)
会逐渐减小,但是不会等于 0,所以呈下降趋势且与横坐标无交点的曲线为-lg c(A2-)与pH的变化关系,标②,
1
2
3
4
另一条曲线则是 与
pH的变化关系,标③,以此解题。
a到b的滴定过程-lg c(A2-)逐渐减
小,则c(A2-)逐渐增大,A2-对水
电离起促进作用,c(A2-)越大,水的电离程度越大,a到b过程中水的电离程度逐渐增大,故A错误;
1
2
3
4
1
2
3
4
1
2
3
4
2.25 ℃时,向二元弱酸H2X溶液中滴加NaOH溶液(忽略温度变化),所得混合溶液的pH与粒子浓度变化如图所示。下列说法错误的是
A.随着NaOH溶液的滴加,
逐渐增大
B.溶液中水的电离程度:a>b>c
C.b点对应的溶液中:2c(H2X)+
c(HX-)>c(Na+)
D.当溶液的pH=4时,c(H2X)∶c(HX-)∶c(X2-)=1∶10m+2∶10m+n-3
√
1
2
3
4
H2X→Na2X的过程中,溶液由酸性变为碱性,该过程中随pH增大水的电离程度逐渐增大,溶液中水的电离程度:a>b>c,故B正确;
1
2
3
4
1
2
3
4
3.谷氨酸( ,用H2A表示)在生物体内的蛋白质代谢过程中占重要
地位,在水溶液中有4种分布形式(H3A+、H2A、HA-和A2-),常温下,用0.1 mol·
L-1 HCl溶液滴定20.00 mL 0.1 mol·L-1的Na2A溶液,溶液中pOH与离子浓度变化的关系如图所示[pOH=-lg c(OH-)],下列叙述正确的是
A.曲线X表示pOH与 的关系
B.Na2A溶液中,c(Na+)+c(H+)=2c(A2-)
+c(HA-)+c(OH-)
C.溶液显中性时,c(H2A)>c(A2-)
D.当V(HCl)=10 mL时,c(HA-)+2c(H2A)
+3c(H3A+)+c(H+)=c(OH-)+c(Cl-)
1
2
3
4
√
1
2
3
4
H2A、HA-、A2-与水反应的程度依次增大,Kh(H2A)、Kh(HA-)、Kh(A2-)依次增大,
1
2
3
4
1
2
3
4
Na2A溶液中存在电荷守恒关系:c(Na+)
+c(H+)+c(H3A+)=2c(A2-)+c(HA-)
+c(OH-),故B错误;
1
2
3
4
HCl溶液体积为10 mL时,反应得到等
浓度的Na2A、NaHA、NaCl的混合溶
液,溶液中存在电荷守恒关系:c(Na+)
+c(H+)+c(H3A+)=2c(A2-)+c(HA-)
+c(OH-)+c(Cl-)和元素质量守恒关系:
c(Na+)=2c(HA-)+2c(H2A)+2c(H3A+)+2c(A2-),整合两式可得c(HA-)+2c(H2A)+3c(H3A+)+c(H+)=c(OH-)+c(Cl-),故D正确。
1
2
3
4
√
1
2
3
4
1
2
3
4
滴入20 mL 等浓度的HM溶液后,根据元素质量守恒可得c(HM)+c(M-)=c(HN)+c(N-);根据电荷守恒可得c(Na+)+c(H+)=c(M-)+c(N-)+c(OH-),两式相加,整理可得关系式c(HN)+c(OH-)+2c(N-)=c(HM)+c(Na+)+c(H+),D正确。
1
2
3
4
本课结束
同课章节目录
