专题六 选择题专攻 6.沉淀溶解平衡曲线的分析应用(共42张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 选择题专攻 6.沉淀溶解平衡曲线的分析应用(共42张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:16:10 | ||
图片预览





文档简介
(共42张PPT)
选择题专攻
6.沉淀溶解平衡曲线的分析应用
核心精讲
01
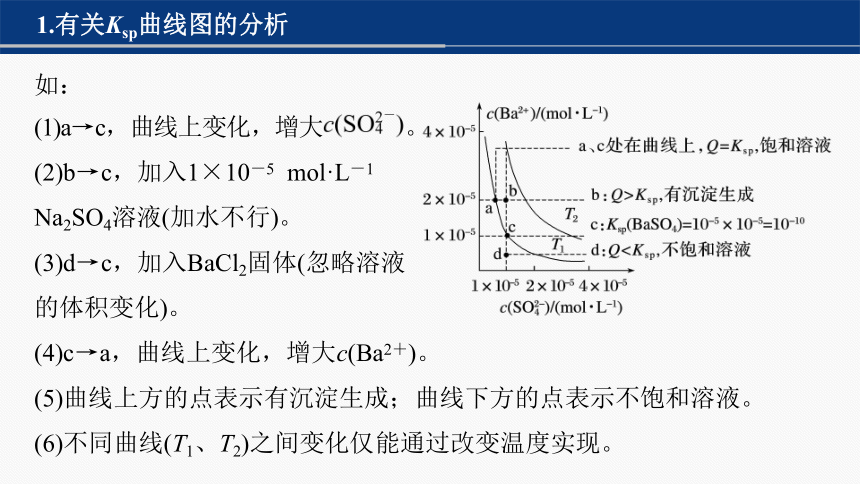
1.有关Ksp曲线图的分析
如:
(1)a→c,曲线上变化,增大 。
(2)b→c,加入1×10-5 mol·L-1
Na2SO4溶液(加水不行)。
(3)d→c,加入BaCl2固体(忽略溶液
的体积变化)。
(4)c→a,曲线上变化,增大c(Ba2+)。
(5)曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。
(6)不同曲线(T1、T2)之间变化仅能通过改变温度实现。
2.有关沉淀溶解平衡对数直线图的分析
如:
(2)纵坐标数值越大,c(M)越小。
(3)直线上方的点为不饱和溶液。
(4)直线上的点为饱和溶液。
(5)直线下方的点表示有沉淀生成。
(6)直线上任意点,坐标数值越大,其对应的离子浓度越小。
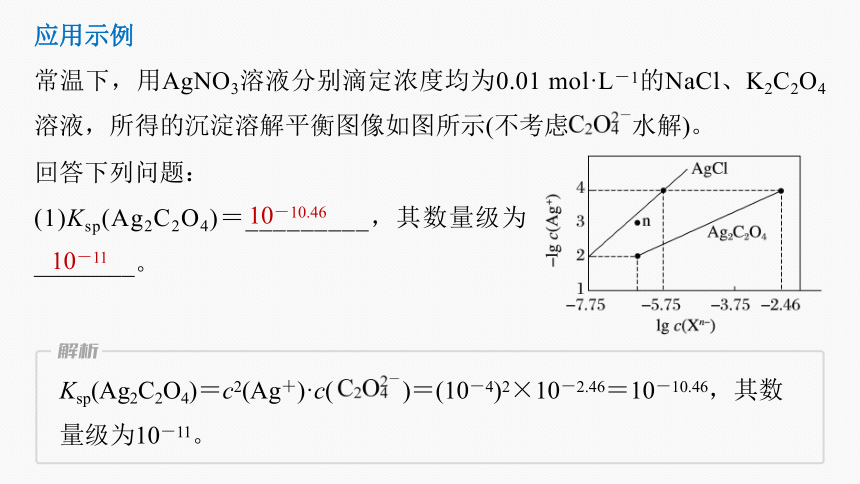
应用示例
常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的NaCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 水解)。
回答下列问题:
(1)Ksp(Ag2C2O4)=_________,其数量级为________。
10-10.46
10-11
Ksp(Ag2C2O4)=c2(Ag+)·c( )=(10-4)2×10-2.46=10-10.46,其数
量级为10-11。
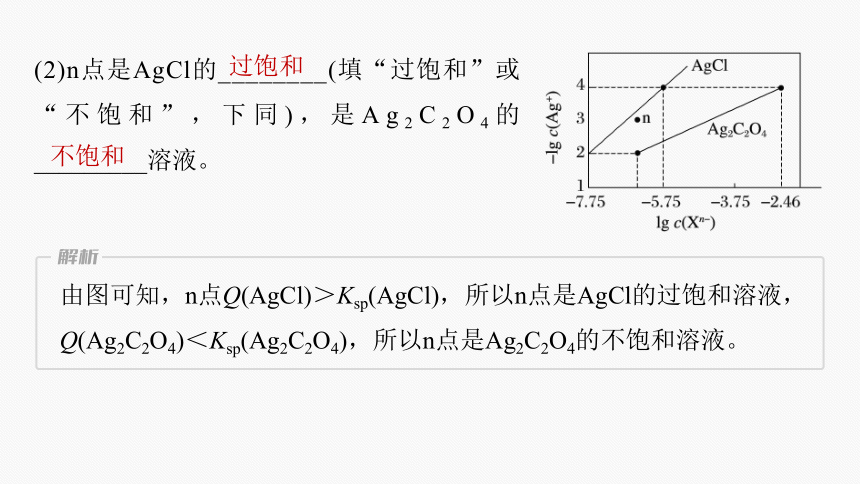
(2)n点是AgCl的________(填“过饱和”或“不饱和”,下同),是Ag2C2O4的_________溶液。
过饱和
不饱和
由图可知,n点Q(AgCl)>Ksp(AgCl),所以n点是AgCl的过饱和溶液,Q(Ag2C2O4)<Ksp(Ag2C2O4),所以n点是Ag2C2O4的不饱和溶液。
真题演练
02
1
2
3
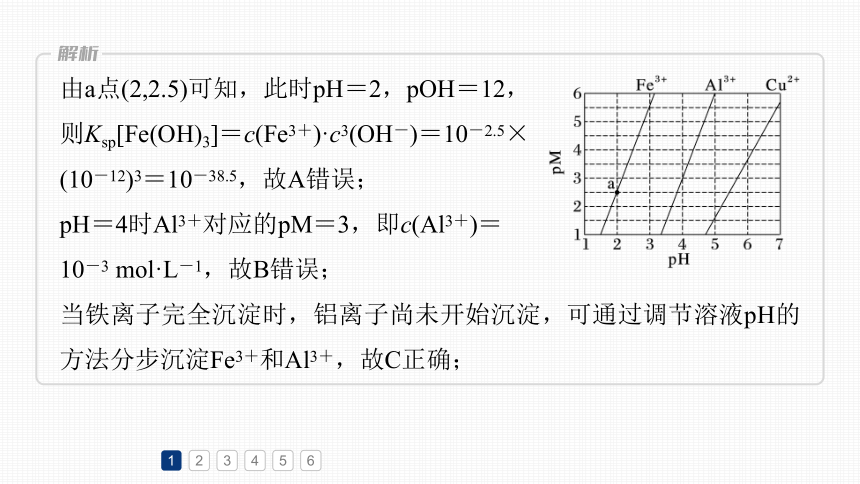
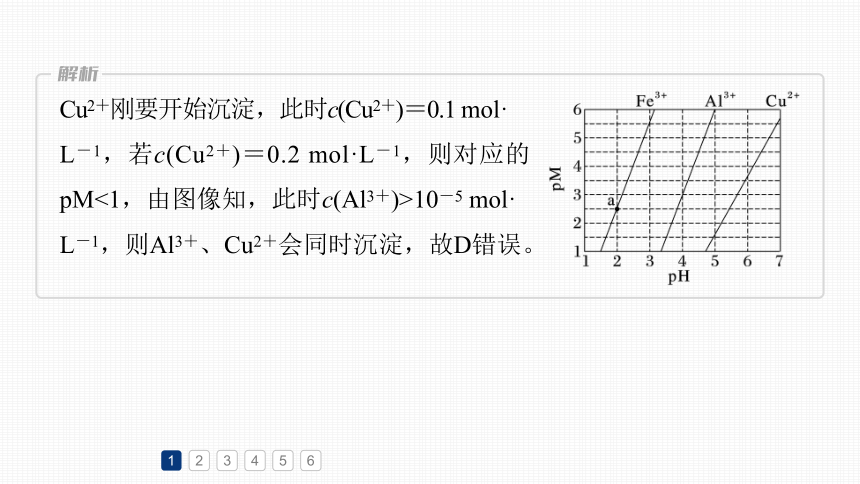
1.(2023·全国甲卷,13)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全)。下列叙述正确的是
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分
步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
√
4
5
6
1
2
3
由a点(2,2.5)可知,此时pH=2,pOH=12,
则Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=10-2.5×
(10-12)3=10-38.5,故A错误;
pH=4时Al3+对应的pM=3,即c(Al3+)=
10-3 mol·L-1,故B错误;
当铁离子完全沉淀时,铝离子尚未开始沉淀,可通过调节溶液pH的方法分步沉淀Fe3+和Al3+,故C正确;
4
5
6
1
2
3
Cu2+刚要开始沉淀,此时c(Cu2+)=0.1 mol·
L-1,若c(Cu2+)=0.2 mol·L-1,则对应的pM<1,由图像知,此时c(Al3+)>10-5 mol·
L-1,则Al3+、Cu2+会同时沉淀,故D错误。
4
5
6
1
2
3
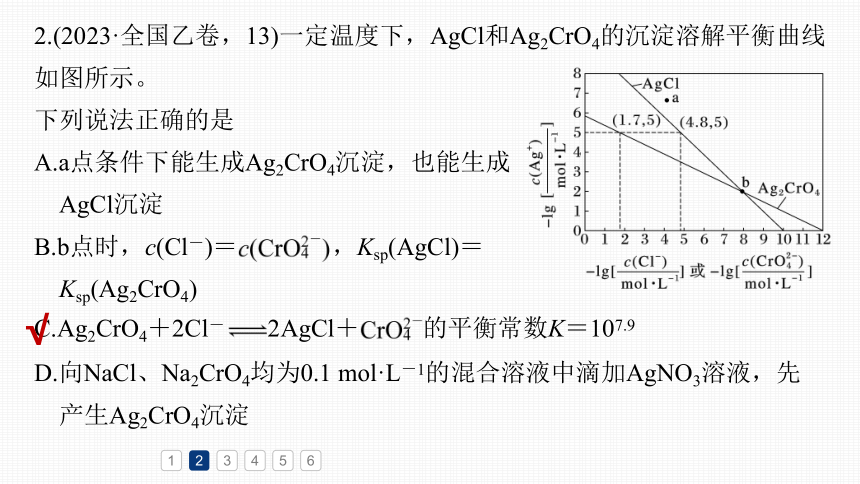
2.(2023·全国乙卷,13)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成
AgCl沉淀
B.b点时,c(Cl-)= ,Ksp(AgCl)=
Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+ 的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先
产生Ag2CrO4沉淀
√
4
5
6
1
2
3
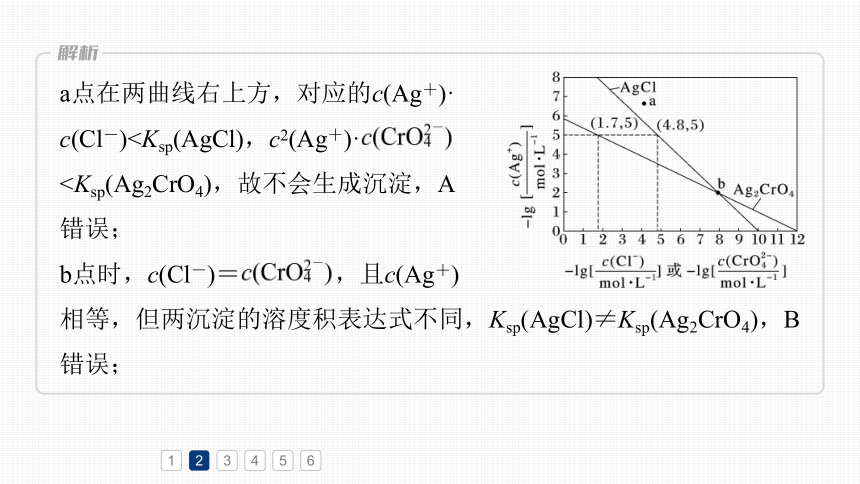
a点在两曲线右上方,对应的c(Ag+)·
c(Cl-)错误;
b点时,c(Cl-)= ,且c(Ag+)
相等,但两沉淀的溶度积表达式不同,Ksp(AgCl)≠Ksp(Ag2CrO4),B错误;
4
5
6
1
2
3
向NaCl、Na2CrO4均为0.1 mol·L-1的混合
溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8 mol·L-1和10-5.35 mol·L-1,说明此时沉淀Cl-需要的银离子浓度更低,先产生AgCl沉淀,D错误。
4
5
6
1
2
3
3.(2023·新课标卷,13)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+,lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。
4
5
6
1
2
3
下列说法错误的是
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化
曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=
10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的
平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
4
5
6
√
1
2
3
4
5
6
AgCl饱和溶液中存在AgCl(s) Ag+(aq)
+Cl-(aq),当滴入的氨水非常少时,可
以认为Ag+浓度和Cl-浓度相等,随着氨
水的滴入,Ag+浓度减小,AgCl的沉淀
溶解平衡正向移动,Cl-浓度增大,AgCl
的溶解度也增大,故曲线Ⅲ表示Ag+,曲
线Ⅳ表示Cl-,曲线Ⅳ也可视为AgCl的溶解度随NH3浓度的变化曲线,A错误;
1
2
3
4
5
6
AgCl的溶度积常数Ksp仅与温度有关,由
图可知,当c(NH3)=10-1 mol·L-1时,
c(Cl-)=10-2.35 mol·L-1,c(Ag+)=
10-7.40 mol·L-1,Ksp(AgCl)=c(Cl-)·
c(Ag+)=10-2.35×10-7.40=10-9.75,B正确;
随着氨水的滴入,Ag+先转化为[Ag(NH3)]+,
[Ag(NH3)]+再转化为[Ag(NH3)2]+,所以开始时,[Ag(NH3)2]+浓度比[Ag(NH3)]+浓度小,
1
2
3
4
5
6
结合上述分析及图知,当c(NH3)=0.01 mol·
L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),D正确。
1
2
3
4
5
6
4.(2023·北京,14)利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:i.图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ii.图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c( )=Ksp(MgCO3)[注:起始c(Na2CO3)
=0.1 mol·L-1,不同pH下c( )由图1得到]。
1
2
3
4
5
6
√
1
2
3
从图1可以看出pH=10.25时,碳酸氢根离子与碳
酸根离子浓度相同,A项正确;
从图2可以看出初始状态pH=11、lg[c(Mg2+)]=
-6时,该点位于曲线Ⅰ和曲线Ⅱ的下方,不会
产生碳酸镁沉淀或氢氧化镁沉淀,B项正确;
从图2可以看出初始状态pH=9、lg[c(Mg2+)]=
-2时,该点位于曲线Ⅱ的上方,会生成碳酸镁
沉淀,根据元素质量守恒,溶液中c(H2CO3)+
<0.1 mol·L-1,C项错误;
4
5
6
1
2
3
pH=8时,溶液中主要含碳微粒是 ,pH=8,lg[c(Mg2+)]=-1时,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,因此反应的离子方程式为Mg2++2 ===MgCO3↓+H2O+CO2↑,D项正确。
4
5
6
1
2
3
5.(2023·辽宁,15)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·
L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.Ka1(H2S)=10-8.1
D.Ka2(H2S)=10-14.7
√
4
5
6
1
2
分析可知,曲线①代表Cd2+、③代表S2-,由图示曲线①③交点可知,此时c(Cd2+)=c(S2-)=10-13 mol·L-1,则有Ksp(CdS)=c(Cd2+)·c(S2-)
=10-13×10-13=10-26,A、B错误;
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
√
1
2
含HgI2的溶液中各反应达到平衡后,增大c(I-),平衡HgI2(aq)
HgI++I-、HgI2(aq) Hg2++2I-逆向移动,c(HgI+)、c(Hg2+)减小,且开始时c(HgI+)3
4
5
6
1
2
HgI2(s) HgI2(aq)的化学平衡常数K0=
c[HgI2(aq)],温度不变平衡常数不变,故
随c(I-)增大,c[HgI2(aq)]始终保持不变,
B错误;
需要外加I-调节,则I元素与Hg元素的物质的量之比无法确定,D正确。
3
4
5
6
考向预测
03
1
2
3
4
1.T ℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是
A.曲线Ⅰ是CdCO3的沉淀溶解平衡曲线
B.加热可使溶液由X点变到Z点
C.Y点对应的Cd(OH)2溶液是过饱和溶液
D.T ℃,在CdCO3(s)+2OH-(aq) Cd(OH)2(s)+
(aq)平衡体系中,平衡常数K=102
√
1
2
3
4
Cd(OH)2的沉淀溶解平衡为Cd(OH)2(s) Cd2+(aq)
+2OH-(aq),即Ksp[Cd(OH)2]=c(Cd2+)·c2(OH-),
则pKsp[Cd(OH)2]=pCd2++2pOH-。
根据斜率可知,曲线Ⅰ为Cd(OH)2的沉淀溶解平衡曲线,曲线Ⅱ为CdCO3的沉淀溶解平衡曲线,A错误;
1
2
3
4
曲线Ⅰ为Cd(OH)2的沉淀溶解平衡曲线,加热,
Cd(OH)2的溶解度会增大,溶液中的Cd2+和OH-
浓度均增大,阴、阳离子的负对数均发生改变,
B错误;
Y点在Cd(OH)2的沉淀溶解平衡曲线的上方,pCd2+
=4,即c(Cd2+)=10-4 mol·L-1;pOH-=6,即c(OH-)=10-6 mol·L-1,则Q=c(Cd2+)·c2(OH-)=10-4×(10-6)2=10-161
2
3
4
1
2
3
4
2.草酸钙具有优异光学性能,在水中的沉淀溶解平衡曲线如图所示(T1<T2)。已知T1时Ksp(CaC2O4)=6.7×10-4。下列说法错误的是
A.图中a的数量级为10-2
B.升高温度,m点的饱和溶液的组成由m沿mq线
向q方向移动
C.恒温条件下,向m点的溶液加入少量Na2C2O4
固体,溶液组成由m沿曲线向n方向移动
D.T1时,将浓度均为0.03 mol·L-1的草酸钠和氯化钙溶液等体积混合,不
能观察到沉淀
√
1
2
3
4
Ksp(CaC2O4)=c(Ca2+)·c( )=6.7×10-4,则图中a的数量级为10-2,A正确;
m点c(Ca2+)=c( ),升高温度,则m点的饱和溶液的组成由m沿Om线向远离O点方向移动,B错误;
恒温条件下,向m点的溶液加入少量Na2C2O4固体,c( )浓度增大,温度未变,Ksp(CaC2O4)不变,则溶液组成由m沿曲线向n方向移动,C正确;
1
2
3
4
T1时,将浓度均为0.03 mol·L-1的草酸钠和氯化钙溶液等体积混合,c(Ca2+)=c( )=
0.015 mol·L-1,Q=0.015×0.015=2.25×10-4
<Ksp(CaC2O4),不能观察到沉淀,D正确。
1
2
3
4
3.常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知p(Ca2+)=-lg c(Ca2+),p(酸根离子)=-lg c(酸根离子)。下列说法不正确的是
A.曲线Ⅱ为CaSO4沉淀溶解平衡曲线
B.加入适量的氯化钙固体,可使溶液由c点变到a点
C.b点对应的硫酸钙溶液不饱和
D.向碳酸钙饱和溶液中通入CO2气体,溶液中
c(Ca2+)不变
√
1
2
3
4
b点Q向碳酸钙饱和溶液中通入CO2气体,发生反
应生成碳酸氢钙,但c(Ca2+)不变,D正确。
1
2
3
4
4.溶洞水体中的H2CO3与空气中的CO2保持平衡。现测得溶洞水体中
lg c(X)(X为H2CO3、 或Ca2+)与pH的关系如图所示,
Ksp(CaCO3)=2.8×10-9。下列说法错误的是
√
1
2
3
4
1
2
3
4
本课结束
选择题专攻
6.沉淀溶解平衡曲线的分析应用
核心精讲
01
1.有关Ksp曲线图的分析
如:
(1)a→c,曲线上变化,增大 。
(2)b→c,加入1×10-5 mol·L-1
Na2SO4溶液(加水不行)。
(3)d→c,加入BaCl2固体(忽略溶液
的体积变化)。
(4)c→a,曲线上变化,增大c(Ba2+)。
(5)曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。
(6)不同曲线(T1、T2)之间变化仅能通过改变温度实现。
2.有关沉淀溶解平衡对数直线图的分析
如:
(2)纵坐标数值越大,c(M)越小。
(3)直线上方的点为不饱和溶液。
(4)直线上的点为饱和溶液。
(5)直线下方的点表示有沉淀生成。
(6)直线上任意点,坐标数值越大,其对应的离子浓度越小。
应用示例
常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的NaCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 水解)。
回答下列问题:
(1)Ksp(Ag2C2O4)=_________,其数量级为________。
10-10.46
10-11
Ksp(Ag2C2O4)=c2(Ag+)·c( )=(10-4)2×10-2.46=10-10.46,其数
量级为10-11。
(2)n点是AgCl的________(填“过饱和”或“不饱和”,下同),是Ag2C2O4的_________溶液。
过饱和
不饱和
由图可知,n点Q(AgCl)>Ksp(AgCl),所以n点是AgCl的过饱和溶液,Q(Ag2C2O4)<Ksp(Ag2C2O4),所以n点是Ag2C2O4的不饱和溶液。
真题演练
02
1
2
3
1.(2023·全国甲卷,13)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全)。下列叙述正确的是
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分
步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
√
4
5
6
1
2
3
由a点(2,2.5)可知,此时pH=2,pOH=12,
则Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=10-2.5×
(10-12)3=10-38.5,故A错误;
pH=4时Al3+对应的pM=3,即c(Al3+)=
10-3 mol·L-1,故B错误;
当铁离子完全沉淀时,铝离子尚未开始沉淀,可通过调节溶液pH的方法分步沉淀Fe3+和Al3+,故C正确;
4
5
6
1
2
3
Cu2+刚要开始沉淀,此时c(Cu2+)=0.1 mol·
L-1,若c(Cu2+)=0.2 mol·L-1,则对应的pM<1,由图像知,此时c(Al3+)>10-5 mol·
L-1,则Al3+、Cu2+会同时沉淀,故D错误。
4
5
6
1
2
3
2.(2023·全国乙卷,13)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成
AgCl沉淀
B.b点时,c(Cl-)= ,Ksp(AgCl)=
Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl- 2AgCl+ 的平衡常数K=107.9
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先
产生Ag2CrO4沉淀
√
4
5
6
1
2
3
a点在两曲线右上方,对应的c(Ag+)·
c(Cl-)
b点时,c(Cl-)= ,且c(Ag+)
相等,但两沉淀的溶度积表达式不同,Ksp(AgCl)≠Ksp(Ag2CrO4),B错误;
4
5
6
1
2
3
向NaCl、Na2CrO4均为0.1 mol·L-1的混合
溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8 mol·L-1和10-5.35 mol·L-1,说明此时沉淀Cl-需要的银离子浓度更低,先产生AgCl沉淀,D错误。
4
5
6
1
2
3
3.(2023·新课标卷,13)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+,lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。
4
5
6
1
2
3
下列说法错误的是
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化
曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=
10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的
平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
4
5
6
√
1
2
3
4
5
6
AgCl饱和溶液中存在AgCl(s) Ag+(aq)
+Cl-(aq),当滴入的氨水非常少时,可
以认为Ag+浓度和Cl-浓度相等,随着氨
水的滴入,Ag+浓度减小,AgCl的沉淀
溶解平衡正向移动,Cl-浓度增大,AgCl
的溶解度也增大,故曲线Ⅲ表示Ag+,曲
线Ⅳ表示Cl-,曲线Ⅳ也可视为AgCl的溶解度随NH3浓度的变化曲线,A错误;
1
2
3
4
5
6
AgCl的溶度积常数Ksp仅与温度有关,由
图可知,当c(NH3)=10-1 mol·L-1时,
c(Cl-)=10-2.35 mol·L-1,c(Ag+)=
10-7.40 mol·L-1,Ksp(AgCl)=c(Cl-)·
c(Ag+)=10-2.35×10-7.40=10-9.75,B正确;
随着氨水的滴入,Ag+先转化为[Ag(NH3)]+,
[Ag(NH3)]+再转化为[Ag(NH3)2]+,所以开始时,[Ag(NH3)2]+浓度比[Ag(NH3)]+浓度小,
1
2
3
4
5
6
结合上述分析及图知,当c(NH3)=0.01 mol·
L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),D正确。
1
2
3
4
5
6
4.(2023·北京,14)利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:i.图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ii.图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c( )=Ksp(MgCO3)[注:起始c(Na2CO3)
=0.1 mol·L-1,不同pH下c( )由图1得到]。
1
2
3
4
5
6
√
1
2
3
从图1可以看出pH=10.25时,碳酸氢根离子与碳
酸根离子浓度相同,A项正确;
从图2可以看出初始状态pH=11、lg[c(Mg2+)]=
-6时,该点位于曲线Ⅰ和曲线Ⅱ的下方,不会
产生碳酸镁沉淀或氢氧化镁沉淀,B项正确;
从图2可以看出初始状态pH=9、lg[c(Mg2+)]=
-2时,该点位于曲线Ⅱ的上方,会生成碳酸镁
沉淀,根据元素质量守恒,溶液中c(H2CO3)+
<0.1 mol·L-1,C项错误;
4
5
6
1
2
3
pH=8时,溶液中主要含碳微粒是 ,pH=8,lg[c(Mg2+)]=-1时,该点位于曲线Ⅱ的上方,会生成碳酸镁沉淀,因此反应的离子方程式为Mg2++2 ===MgCO3↓+H2O+CO2↑,D项正确。
4
5
6
1
2
3
5.(2023·辽宁,15)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·
L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
C.Ka1(H2S)=10-8.1
D.Ka2(H2S)=10-14.7
√
4
5
6
1
2
分析可知,曲线①代表Cd2+、③代表S2-,由图示曲线①③交点可知,此时c(Cd2+)=c(S2-)=10-13 mol·L-1,则有Ksp(CdS)=c(Cd2+)·c(S2-)
=10-13×10-13=10-26,A、B错误;
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
√
1
2
含HgI2的溶液中各反应达到平衡后,增大c(I-),平衡HgI2(aq)
HgI++I-、HgI2(aq) Hg2++2I-逆向移动,c(HgI+)、c(Hg2+)减小,且开始时c(HgI+)
4
5
6
1
2
HgI2(s) HgI2(aq)的化学平衡常数K0=
c[HgI2(aq)],温度不变平衡常数不变,故
随c(I-)增大,c[HgI2(aq)]始终保持不变,
B错误;
需要外加I-调节,则I元素与Hg元素的物质的量之比无法确定,D正确。
3
4
5
6
考向预测
03
1
2
3
4
1.T ℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是
A.曲线Ⅰ是CdCO3的沉淀溶解平衡曲线
B.加热可使溶液由X点变到Z点
C.Y点对应的Cd(OH)2溶液是过饱和溶液
D.T ℃,在CdCO3(s)+2OH-(aq) Cd(OH)2(s)+
(aq)平衡体系中,平衡常数K=102
√
1
2
3
4
Cd(OH)2的沉淀溶解平衡为Cd(OH)2(s) Cd2+(aq)
+2OH-(aq),即Ksp[Cd(OH)2]=c(Cd2+)·c2(OH-),
则pKsp[Cd(OH)2]=pCd2++2pOH-。
根据斜率可知,曲线Ⅰ为Cd(OH)2的沉淀溶解平衡曲线,曲线Ⅱ为CdCO3的沉淀溶解平衡曲线,A错误;
1
2
3
4
曲线Ⅰ为Cd(OH)2的沉淀溶解平衡曲线,加热,
Cd(OH)2的溶解度会增大,溶液中的Cd2+和OH-
浓度均增大,阴、阳离子的负对数均发生改变,
B错误;
Y点在Cd(OH)2的沉淀溶解平衡曲线的上方,pCd2+
=4,即c(Cd2+)=10-4 mol·L-1;pOH-=6,即c(OH-)=10-6 mol·L-1,则Q=c(Cd2+)·c2(OH-)=10-4×(10-6)2=10-16
2
3
4
1
2
3
4
2.草酸钙具有优异光学性能,在水中的沉淀溶解平衡曲线如图所示(T1<T2)。已知T1时Ksp(CaC2O4)=6.7×10-4。下列说法错误的是
A.图中a的数量级为10-2
B.升高温度,m点的饱和溶液的组成由m沿mq线
向q方向移动
C.恒温条件下,向m点的溶液加入少量Na2C2O4
固体,溶液组成由m沿曲线向n方向移动
D.T1时,将浓度均为0.03 mol·L-1的草酸钠和氯化钙溶液等体积混合,不
能观察到沉淀
√
1
2
3
4
Ksp(CaC2O4)=c(Ca2+)·c( )=6.7×10-4,则图中a的数量级为10-2,A正确;
m点c(Ca2+)=c( ),升高温度,则m点的饱和溶液的组成由m沿Om线向远离O点方向移动,B错误;
恒温条件下,向m点的溶液加入少量Na2C2O4固体,c( )浓度增大,温度未变,Ksp(CaC2O4)不变,则溶液组成由m沿曲线向n方向移动,C正确;
1
2
3
4
T1时,将浓度均为0.03 mol·L-1的草酸钠和氯化钙溶液等体积混合,c(Ca2+)=c( )=
0.015 mol·L-1,Q=0.015×0.015=2.25×10-4
<Ksp(CaC2O4),不能观察到沉淀,D正确。
1
2
3
4
3.常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知p(Ca2+)=-lg c(Ca2+),p(酸根离子)=-lg c(酸根离子)。下列说法不正确的是
A.曲线Ⅱ为CaSO4沉淀溶解平衡曲线
B.加入适量的氯化钙固体,可使溶液由c点变到a点
C.b点对应的硫酸钙溶液不饱和
D.向碳酸钙饱和溶液中通入CO2气体,溶液中
c(Ca2+)不变
√
1
2
3
4
b点Q
应生成碳酸氢钙,但c(Ca2+)不变,D正确。
1
2
3
4
4.溶洞水体中的H2CO3与空气中的CO2保持平衡。现测得溶洞水体中
lg c(X)(X为H2CO3、 或Ca2+)与pH的关系如图所示,
Ksp(CaCO3)=2.8×10-9。下列说法错误的是
√
1
2
3
4
1
2
3
4
本课结束
同课章节目录
