专题六 主观题突破 2.化工生产中物质转化条件的控制(共65张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 主观题突破 2.化工生产中物质转化条件的控制(共65张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:19:42 | ||
图片预览











文档简介
(共65张PPT)
选择题专攻
2.化工生产中物质转化条件的控制
核心精讲
01
1.反应条件的控制
条件控制 目的
固体原料 粉碎或研磨 减小颗粒直径,增大反应物接触面积,增大浸取时的反应速率,提高浸取率
煅烧或 灼烧 ①除去硫、碳单质;②有机物转化、除去有机物;③高温下原料与空气中氧气反应;④除去热不稳定的杂质等
酸浸 ①溶解转变成可溶物进入溶液中,以达到与难溶物分离的目的;②去氧化物(膜)
条件控制 目的
碱溶 ①除去金属表面的油污;②溶解铝、氧化铝等
加热 ①加快反应速率或溶解速率;②促进平衡向吸热反应方向移动;③除杂,除去热不稳定的杂质,如NaHCO3、Ca(HCO3)2、KMnO4、NH4Cl等物质;④使沸点相对较低或易升华的原料气化;⑤煮沸时促进溶液中的气体(如氧气)挥发逸出等
条件控制 目的
反应物用 量或浓度 ①酸浸时提高酸的浓度可提高矿石中某金属元素的浸取率;②增大便宜、易得的反应物的浓度,可以提高其他物质的利用率,使反应充分进行;③增大物质浓度可以加快反应速率,使平衡发生移动等
控温(常用 水浴、冰浴 或油浴) ①控制反应速率(升温加快反应速率)、适宜的温度使催化剂的活性最大,防止副反应的发生;②控制化学反应进行的方向,使化学平衡移动;③升温:使溶液中的气体逸出,使易挥发物质挥发,使易分解的物质分解;煮沸:使气体逸出;促进水解,聚沉后利于过滤分离;④控制固体的溶解与结晶
条件控制 目的
加入氧化剂 (或还原剂) ①转化为目标产物的价态;②除去杂质离子[如把Fe2+氧化成Fe3+,而后调溶液的pH,使其转化为Fe(OH)3沉淀除去]
加入 沉淀剂 ①生成硫化物沉淀(如加入硫化钠、硫化铵、硫化亚铁等);②加入可溶性碳酸盐,生成碳酸盐沉淀;③加入氟化钠,除去Ca2+、Mg2+
条件控制 目的
pH控制 ①使某种或几种金属离子转化为氢氧化物沉淀,而目标离子不生成沉淀,以达到分离的目的(常利用题给金属离子开始沉淀和完全沉淀的pH信息,选择pH范围,使杂质离子以氢氧化物沉淀出来);②“酸作用”还可以除去氧化物(膜)、抑制某些金属离子的水解等;③“碱作用”还可以除去油污、除去铝片表面的氧化铝、溶解铝等;④金属离子的萃取率与溶液的pH密切相关;⑤调节溶液pH常用试剂:a.调节溶液呈酸性:稀盐酸、稀硫酸、稀硝酸(注意氧化性)、金属氧化物、酸性气体(二氧化硫)等。b.调节溶液呈碱性:氢氧化钠、氨水、碳酸钠、碳酸氢铵等
2.可循环物质的判断
(1)流程图中回头箭头的物质。
(2)生产流程中后面新生成或新分离的物质(不要忽视结晶后的母液),可能是前面某一步反应的相关物质。
①从流程需要加入的物质去找
先观察流程中需要加入的物质,再研究后面的流程中有没有生成此物质。
②从能构成可逆反应的物质去找
可逆反应的反应物不能完全转化,应该回收再利用。
③从过滤后的母液中寻找
析出晶体经过过滤后的溶液称为母液,母液是该晶体溶质的饱和溶液,应该循环再利用。
对点训练
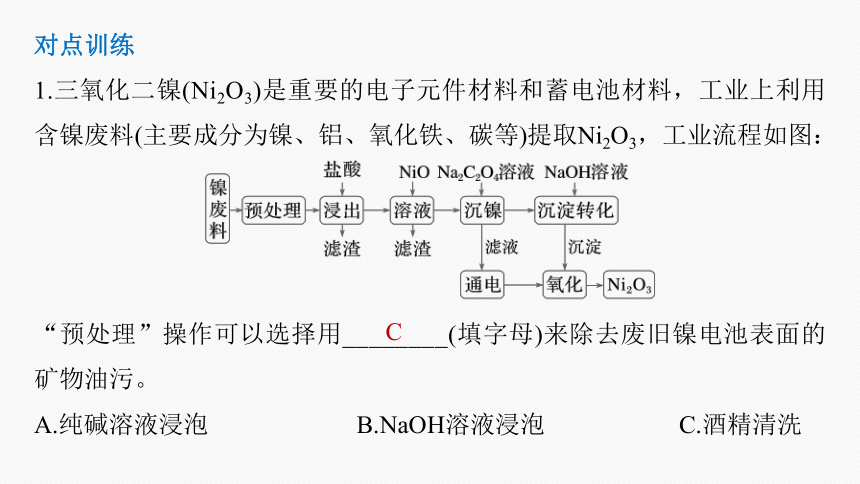
1.三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工业流程如图:
“预处理”操作可以选择用________(填字母)来除去废旧镍电池表面的矿物油污。
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
C
2.一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:
“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_____________________________。
温度过高,H2O2分解放出氧气
3.已知下列物质开始沉淀和沉淀完全时的pH如下表所示:
物质 开始沉淀pH 沉淀完全pH
Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Mn(OH)2 8.3 9.8
若要除去Mn2+溶液中含有的Fe2+,应该怎样做?
答案 先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH至3.7~8.3。
4.以软锰矿(主要成分为MnO2,含少量铁的氧化物)制备高纯MnCO3。流程如图:
(1)酸溶还原时,MnO2发生反应的离子方程式为_____________________
____________________。
MnO2+2Fe2++4H+===
Mn2++2Fe3++2H2O
酸溶还原时,MnO2将亚铁离子氧化为铁离子,自身被还原为二价锰离子。
(2)在常温下,已知:Ksp[Mn(OH)2]=2×10-13、Ksp[Fe(OH)3]=1×10-39。工业上,当某离子浓度小于1×10-6 mol·L-1时,认为该离子已除净。氧化后所得溶液中c(Mn2+)=0.2 mol·L-1,为使溶液中Fe3+除净,调节pH的范围应为___________。
3≤pH<8
(1)调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH增大;②不引入新杂质。例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH。
(2)调节溶液的pH:酸作用还可以除去氧化物(膜);碱作用还可以除去油污、除去铝片氧化物、溶解铝和二氧化硅。
(3)调节pH的试剂选取:①选取流程中出现的物质;②未学习过的物质且题目又无信息提示的一般不做考虑;③已学的常见酸、碱(如HNO3、HCl、H2SO4、NH3·H2O、NaOH等)。
特别提醒
5.粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料,制取氧化铝的部分工艺流程如图:
上述流程中,可以循环利用的物质是_____________。
HCl(或盐酸)
粉煤灰加浓盐酸酸浸,Al2O3和Fe2O3溶解、SiO2不溶,过滤得滤渣,主要成分是SiO2,向滤液中加入NH4HCO3,溶液中的Fe3+与 发生相互促进的水解反应使铁元素沉淀,向滤液中通入HCl气体,使Al3+形成AlCl3·6H2O晶体析出,煅烧AlCl3·6H2O,由于HCl大量挥发,促进了Al3+水解,煅烧最终生成了Al2O3。题述流程中,可以循环利用的物质是HCl或盐酸。
6.硒和碲在工业上有重要用途。在铜、镍、铅等电解工艺的阳极泥中硒、碲主要以硒化物、碲化物及单质状态存在。一种从阳极泥中提取Se和Te的工艺流程如下:
已知:碲酸钠(Na2H4TeO6)难溶,碲酸(H6TeO6)可溶。
工艺路线中可以循环利用的物质有_______、_______。
H2SO4
NaOH
根据流程中既为生成物又为反应原料的物质可作为循环利用的物质,则工艺路线中可以循环利用的物质有H2SO4和NaOH。
真题演练
02
1
2
1.(2022·辽宁,16)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
1
2
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
1
2
回答下列问题:
(1)为提高焙烧效率,可采取的
措施为______。
a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
ab
1
2
联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,选项a符合题意;鼓入适当过量的空气有利于矿石充分反应,选项b符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,选项c不符合题意。
1
2
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为___________
_______________________。
2Bi2S3+
1
2
Bi2S3在空气中单独焙烧生成Bi2O3,根据原子守恒可知还应生成SO2,结合得失电子守恒,反应的化学方程式为2Bi2S3+9O2 2Bi2O3+6SO2。
1
2
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;②______
______________。
抑制
金属离子水解
1
2
加入浓盐酸后,溶液中含有的离子主要为Bi3+、Fe3+、Mn2+、H+、Cl-,而酸浸后取滤液进行转化,故要防止金属离子水解生成沉淀,使BiOCl的产率降低。
1
2
(4)滤渣的主要成分为_______(填化学式)。
SiO2
1
2
(5)生成气体A的离子方程式为_____________________________________
_______。
Mn2O3+6H++2Cl-===2Mn2++Cl2↑+
3H2O
1
2
因Mn2O3有氧化性,会与浓盐酸发生氧化还原反应:Mn2O3+6H++2Cl-===
2Mn2++Cl2↑+3H2O。
1
2
(6)加入金属Bi的目的是__________________。
将Fe3+转化为Fe2+
1
2
由已知信息③知,调pH=2.6时,Fe3+会水解生成Fe(OH)3沉淀,但Fe2+还没开始沉淀,故要将Fe3+转化为Fe2+,调pH后获得含FeCl2的滤液,为了不引入新的杂质,加入金属Bi作还原剂。
1
2
(7)将100 kg辉铋矿进行联合焙烧,转化时消耗1.1 kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32 kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为________。
24.02%
1
2
辉铋矿中Bi元素的质量分数
为 ×
100%=24.02%。
1
2
2.[2021·全国乙卷,26(2)(3)(4)(5)(6)]磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
1
2
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
1
2
回答下列问题:
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是___________________。
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
Fe3+、Al3+、Mg2+
1
2
由题给金属离子开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀,然后是铝离子、镁离子,钙离子没有沉淀。
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0× 10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
1
2
(3)“母液①”中Mg2+浓度为___________ mol·L-1。
1.0×10-6
由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10-5×(1×10-2.9)2=1×10-10.8,当溶液pH为11.6时,溶液中镁离子的浓度为 mol·L-1=1×10-6 mol·L-1。
1
2
(4)“水浸渣”在160 ℃“酸溶”,最适合的酸是______,“酸溶渣”的成分是______________。
硫酸
SiO2、CaSO4
1
2
增大溶液中硫酸根离子的浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少TiOSO4溶液中含有的硫酸钙的量,应加入浓硫酸加热
到160 ℃酸溶;
由分析可知,二氧化硅
和硫酸钙与硫酸不反应,
则酸溶渣的主要成分为
二氧化硅和硫酸钙。
1
2
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是_________________________________________。
TiO2++(x+1)H2O TiO2·xH2O↓+2H+
1
2
酸溶后将TiOSO4溶液适当稀释并加热,能使TiOSO4完全水解生成TiO2·xH2O沉淀和硫酸,反应的离子方程式为TiO2++(x+1)H2O
TiO2·xH2O↓+2H+。
1
2
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得____________,循环利用。
(NH4)2SO4
尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫酸铵溶液,可以循环使用。
考向预测
03
1
2
1.研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如下:
1
2
回答下列问题:
(1)反应釜中,溶液的pH、温度(T)与生成沉淀的关系如图,图中区域分别表示铁的化合物稳定存在的区域。则制备FeOOH适宜的pH和温度分别为________(填字母)。
a.2,80 ℃ b.4,90 ℃
c.5,160 ℃ d.6,25 ℃
b
1
2
(2)制备磁性纳米铁棒时,加入NaBH4前先通入N2的作用是____________
________________________________________。
排出设备中
的空气,防止磁性纳米铁棒和NaBH4被氧化
1
2
磁性纳米铁棒和NaBH4都容易被氧化,所以在加入NaBH4之前需通入N2排出反应容器中的空气。
1
2
(3)常温下,若在含Cd2+、Te4+滤液中加入NaOH溶液调节pH为7,溶液中c(Cd2+)的最大值为______________(已知:Ksp[Cd(OH)2]=5.3×10-15)。
0.53 mol·L-1
1
2
1
2
(4)从 溶液得到“吸附Te”,利用了纳米铁棒的性质有________、________。
吸附性
还原性
1
2
含 的溶液和磁性纳米铁棒作用,Te的化合价降低,被纳米铁棒还原,磁性纳米铁棒还能吸附Te,故在得到Te的过程中,磁性纳米铁棒呈现了还原性和吸附性。
1
2
2.锗是现代高科技产业重要的基础材料。用含氧化锌烟尘(杂质主要有PbO、GeO2、SiO2、FeO、Ag2O等)为主要原料制备氧化锌和高纯度单质锗的一种工艺流程如图所示。
1
2
已知:①单宁酸是一种只含C、H、O元素的有机化合物;
②pKsp=-lg Ksp,常温下pKsp[Pb(OH)2]=19.8,pKsp[Zn(OH)2]=16.2,pKsp[Fe(OH)2]=16.4,pKsp[Fe(OH)3]=38.6;
③当溶液中某离子的物质的量浓度不大于1.0×10-5 mol·L-1时,该离子沉淀完全。
1
2
(1)“酸浸”后所得的滤渣主要成分除SiO2外,还含有________________
(填化学式)。
Ag2SO4、PbSO4
1
2
(2)如图所示,“酸浸”过程中浓硫酸用量超过理论量会导致锗的浸出率降低,其可能的原因为___________________________________________
_______________________。
生成的Ag2SO4、PbSO4沉淀附着在反应物表面,
阻碍了反应的进一步进行
1
2
(3)“调pH”所用试剂X为______(填化学式),若“酸浸”后溶液中c(Zn2+)
=0.1 mol·L-1,则应调控pH的范围为__________。
ZnO
2.8~6.4
1
2
含氧化锌烟尘加入浓硫酸,生成
硫酸铅、硫酸银沉淀,二氧化硅
不与浓H2SO4反应,三者成为滤渣;
过滤所得滤液中加入氧化锌消耗
溶液中氢离子,调节溶液的pH将铁转化为沉淀,过滤所得滤液加入单宁酸沉锗,滤渣灼烧后加入浓盐酸氯化蒸馏,水解、电解得到单质锗;
沉锗后所得滤液加入碳酸氢铵沉锌,灼烧得到氧化锌。
1
2
由分析可知,“调pH”所用试剂
X为ZnO;
1
2
故应调控pH的范围为2.8~6.4。
1
2
(4)若“沉锌”的产物为Zn2(OH)2CO3,则反应的离子方程式为_________
_______________________________________。
2Zn2++
1
2
若“沉锌”的产物为Zn2(OH)2CO3,则锌离子和碳酸氢根离子反应生成Zn2(OH)2CO3、水和二氧化碳,离子方程式为2Zn2++
===Zn2(OH)2CO3↓+3CO2↑+H2O。
本课结束
选择题专攻
2.化工生产中物质转化条件的控制
核心精讲
01
1.反应条件的控制
条件控制 目的
固体原料 粉碎或研磨 减小颗粒直径,增大反应物接触面积,增大浸取时的反应速率,提高浸取率
煅烧或 灼烧 ①除去硫、碳单质;②有机物转化、除去有机物;③高温下原料与空气中氧气反应;④除去热不稳定的杂质等
酸浸 ①溶解转变成可溶物进入溶液中,以达到与难溶物分离的目的;②去氧化物(膜)
条件控制 目的
碱溶 ①除去金属表面的油污;②溶解铝、氧化铝等
加热 ①加快反应速率或溶解速率;②促进平衡向吸热反应方向移动;③除杂,除去热不稳定的杂质,如NaHCO3、Ca(HCO3)2、KMnO4、NH4Cl等物质;④使沸点相对较低或易升华的原料气化;⑤煮沸时促进溶液中的气体(如氧气)挥发逸出等
条件控制 目的
反应物用 量或浓度 ①酸浸时提高酸的浓度可提高矿石中某金属元素的浸取率;②增大便宜、易得的反应物的浓度,可以提高其他物质的利用率,使反应充分进行;③增大物质浓度可以加快反应速率,使平衡发生移动等
控温(常用 水浴、冰浴 或油浴) ①控制反应速率(升温加快反应速率)、适宜的温度使催化剂的活性最大,防止副反应的发生;②控制化学反应进行的方向,使化学平衡移动;③升温:使溶液中的气体逸出,使易挥发物质挥发,使易分解的物质分解;煮沸:使气体逸出;促进水解,聚沉后利于过滤分离;④控制固体的溶解与结晶
条件控制 目的
加入氧化剂 (或还原剂) ①转化为目标产物的价态;②除去杂质离子[如把Fe2+氧化成Fe3+,而后调溶液的pH,使其转化为Fe(OH)3沉淀除去]
加入 沉淀剂 ①生成硫化物沉淀(如加入硫化钠、硫化铵、硫化亚铁等);②加入可溶性碳酸盐,生成碳酸盐沉淀;③加入氟化钠,除去Ca2+、Mg2+
条件控制 目的
pH控制 ①使某种或几种金属离子转化为氢氧化物沉淀,而目标离子不生成沉淀,以达到分离的目的(常利用题给金属离子开始沉淀和完全沉淀的pH信息,选择pH范围,使杂质离子以氢氧化物沉淀出来);②“酸作用”还可以除去氧化物(膜)、抑制某些金属离子的水解等;③“碱作用”还可以除去油污、除去铝片表面的氧化铝、溶解铝等;④金属离子的萃取率与溶液的pH密切相关;⑤调节溶液pH常用试剂:a.调节溶液呈酸性:稀盐酸、稀硫酸、稀硝酸(注意氧化性)、金属氧化物、酸性气体(二氧化硫)等。b.调节溶液呈碱性:氢氧化钠、氨水、碳酸钠、碳酸氢铵等
2.可循环物质的判断
(1)流程图中回头箭头的物质。
(2)生产流程中后面新生成或新分离的物质(不要忽视结晶后的母液),可能是前面某一步反应的相关物质。
①从流程需要加入的物质去找
先观察流程中需要加入的物质,再研究后面的流程中有没有生成此物质。
②从能构成可逆反应的物质去找
可逆反应的反应物不能完全转化,应该回收再利用。
③从过滤后的母液中寻找
析出晶体经过过滤后的溶液称为母液,母液是该晶体溶质的饱和溶液,应该循环再利用。
对点训练
1.三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工业流程如图:
“预处理”操作可以选择用________(填字母)来除去废旧镍电池表面的矿物油污。
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
C
2.一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:
“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_____________________________。
温度过高,H2O2分解放出氧气
3.已知下列物质开始沉淀和沉淀完全时的pH如下表所示:
物质 开始沉淀pH 沉淀完全pH
Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Mn(OH)2 8.3 9.8
若要除去Mn2+溶液中含有的Fe2+,应该怎样做?
答案 先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH至3.7~8.3。
4.以软锰矿(主要成分为MnO2,含少量铁的氧化物)制备高纯MnCO3。流程如图:
(1)酸溶还原时,MnO2发生反应的离子方程式为_____________________
____________________。
MnO2+2Fe2++4H+===
Mn2++2Fe3++2H2O
酸溶还原时,MnO2将亚铁离子氧化为铁离子,自身被还原为二价锰离子。
(2)在常温下,已知:Ksp[Mn(OH)2]=2×10-13、Ksp[Fe(OH)3]=1×10-39。工业上,当某离子浓度小于1×10-6 mol·L-1时,认为该离子已除净。氧化后所得溶液中c(Mn2+)=0.2 mol·L-1,为使溶液中Fe3+除净,调节pH的范围应为___________。
3≤pH<8
(1)调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH增大;②不引入新杂质。例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH。
(2)调节溶液的pH:酸作用还可以除去氧化物(膜);碱作用还可以除去油污、除去铝片氧化物、溶解铝和二氧化硅。
(3)调节pH的试剂选取:①选取流程中出现的物质;②未学习过的物质且题目又无信息提示的一般不做考虑;③已学的常见酸、碱(如HNO3、HCl、H2SO4、NH3·H2O、NaOH等)。
特别提醒
5.粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料,制取氧化铝的部分工艺流程如图:
上述流程中,可以循环利用的物质是_____________。
HCl(或盐酸)
粉煤灰加浓盐酸酸浸,Al2O3和Fe2O3溶解、SiO2不溶,过滤得滤渣,主要成分是SiO2,向滤液中加入NH4HCO3,溶液中的Fe3+与 发生相互促进的水解反应使铁元素沉淀,向滤液中通入HCl气体,使Al3+形成AlCl3·6H2O晶体析出,煅烧AlCl3·6H2O,由于HCl大量挥发,促进了Al3+水解,煅烧最终生成了Al2O3。题述流程中,可以循环利用的物质是HCl或盐酸。
6.硒和碲在工业上有重要用途。在铜、镍、铅等电解工艺的阳极泥中硒、碲主要以硒化物、碲化物及单质状态存在。一种从阳极泥中提取Se和Te的工艺流程如下:
已知:碲酸钠(Na2H4TeO6)难溶,碲酸(H6TeO6)可溶。
工艺路线中可以循环利用的物质有_______、_______。
H2SO4
NaOH
根据流程中既为生成物又为反应原料的物质可作为循环利用的物质,则工艺路线中可以循环利用的物质有H2SO4和NaOH。
真题演练
02
1
2
1.(2022·辽宁,16)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
1
2
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
1
2
回答下列问题:
(1)为提高焙烧效率,可采取的
措施为______。
a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
ab
1
2
联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,选项a符合题意;鼓入适当过量的空气有利于矿石充分反应,选项b符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,选项c不符合题意。
1
2
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为___________
_______________________。
2Bi2S3+
1
2
Bi2S3在空气中单独焙烧生成Bi2O3,根据原子守恒可知还应生成SO2,结合得失电子守恒,反应的化学方程式为2Bi2S3+9O2 2Bi2O3+6SO2。
1
2
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;②______
______________。
抑制
金属离子水解
1
2
加入浓盐酸后,溶液中含有的离子主要为Bi3+、Fe3+、Mn2+、H+、Cl-,而酸浸后取滤液进行转化,故要防止金属离子水解生成沉淀,使BiOCl的产率降低。
1
2
(4)滤渣的主要成分为_______(填化学式)。
SiO2
1
2
(5)生成气体A的离子方程式为_____________________________________
_______。
Mn2O3+6H++2Cl-===2Mn2++Cl2↑+
3H2O
1
2
因Mn2O3有氧化性,会与浓盐酸发生氧化还原反应:Mn2O3+6H++2Cl-===
2Mn2++Cl2↑+3H2O。
1
2
(6)加入金属Bi的目的是__________________。
将Fe3+转化为Fe2+
1
2
由已知信息③知,调pH=2.6时,Fe3+会水解生成Fe(OH)3沉淀,但Fe2+还没开始沉淀,故要将Fe3+转化为Fe2+,调pH后获得含FeCl2的滤液,为了不引入新的杂质,加入金属Bi作还原剂。
1
2
(7)将100 kg辉铋矿进行联合焙烧,转化时消耗1.1 kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32 kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为________。
24.02%
1
2
辉铋矿中Bi元素的质量分数
为 ×
100%=24.02%。
1
2
2.[2021·全国乙卷,26(2)(3)(4)(5)(6)]磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
1
2
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
1
2
回答下列问题:
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是___________________。
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
Fe3+、Al3+、Mg2+
1
2
由题给金属离子开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀,然后是铝离子、镁离子,钙离子没有沉淀。
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0× 10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
1
2
(3)“母液①”中Mg2+浓度为___________ mol·L-1。
1.0×10-6
由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10-5×(1×10-2.9)2=1×10-10.8,当溶液pH为11.6时,溶液中镁离子的浓度为 mol·L-1=1×10-6 mol·L-1。
1
2
(4)“水浸渣”在160 ℃“酸溶”,最适合的酸是______,“酸溶渣”的成分是______________。
硫酸
SiO2、CaSO4
1
2
增大溶液中硫酸根离子的浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少TiOSO4溶液中含有的硫酸钙的量,应加入浓硫酸加热
到160 ℃酸溶;
由分析可知,二氧化硅
和硫酸钙与硫酸不反应,
则酸溶渣的主要成分为
二氧化硅和硫酸钙。
1
2
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是_________________________________________。
TiO2++(x+1)H2O TiO2·xH2O↓+2H+
1
2
酸溶后将TiOSO4溶液适当稀释并加热,能使TiOSO4完全水解生成TiO2·xH2O沉淀和硫酸,反应的离子方程式为TiO2++(x+1)H2O
TiO2·xH2O↓+2H+。
1
2
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得____________,循环利用。
(NH4)2SO4
尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫酸铵溶液,可以循环使用。
考向预测
03
1
2
1.研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如下:
1
2
回答下列问题:
(1)反应釜中,溶液的pH、温度(T)与生成沉淀的关系如图,图中区域分别表示铁的化合物稳定存在的区域。则制备FeOOH适宜的pH和温度分别为________(填字母)。
a.2,80 ℃ b.4,90 ℃
c.5,160 ℃ d.6,25 ℃
b
1
2
(2)制备磁性纳米铁棒时,加入NaBH4前先通入N2的作用是____________
________________________________________。
排出设备中
的空气,防止磁性纳米铁棒和NaBH4被氧化
1
2
磁性纳米铁棒和NaBH4都容易被氧化,所以在加入NaBH4之前需通入N2排出反应容器中的空气。
1
2
(3)常温下,若在含Cd2+、Te4+滤液中加入NaOH溶液调节pH为7,溶液中c(Cd2+)的最大值为______________(已知:Ksp[Cd(OH)2]=5.3×10-15)。
0.53 mol·L-1
1
2
1
2
(4)从 溶液得到“吸附Te”,利用了纳米铁棒的性质有________、________。
吸附性
还原性
1
2
含 的溶液和磁性纳米铁棒作用,Te的化合价降低,被纳米铁棒还原,磁性纳米铁棒还能吸附Te,故在得到Te的过程中,磁性纳米铁棒呈现了还原性和吸附性。
1
2
2.锗是现代高科技产业重要的基础材料。用含氧化锌烟尘(杂质主要有PbO、GeO2、SiO2、FeO、Ag2O等)为主要原料制备氧化锌和高纯度单质锗的一种工艺流程如图所示。
1
2
已知:①单宁酸是一种只含C、H、O元素的有机化合物;
②pKsp=-lg Ksp,常温下pKsp[Pb(OH)2]=19.8,pKsp[Zn(OH)2]=16.2,pKsp[Fe(OH)2]=16.4,pKsp[Fe(OH)3]=38.6;
③当溶液中某离子的物质的量浓度不大于1.0×10-5 mol·L-1时,该离子沉淀完全。
1
2
(1)“酸浸”后所得的滤渣主要成分除SiO2外,还含有________________
(填化学式)。
Ag2SO4、PbSO4
1
2
(2)如图所示,“酸浸”过程中浓硫酸用量超过理论量会导致锗的浸出率降低,其可能的原因为___________________________________________
_______________________。
生成的Ag2SO4、PbSO4沉淀附着在反应物表面,
阻碍了反应的进一步进行
1
2
(3)“调pH”所用试剂X为______(填化学式),若“酸浸”后溶液中c(Zn2+)
=0.1 mol·L-1,则应调控pH的范围为__________。
ZnO
2.8~6.4
1
2
含氧化锌烟尘加入浓硫酸,生成
硫酸铅、硫酸银沉淀,二氧化硅
不与浓H2SO4反应,三者成为滤渣;
过滤所得滤液中加入氧化锌消耗
溶液中氢离子,调节溶液的pH将铁转化为沉淀,过滤所得滤液加入单宁酸沉锗,滤渣灼烧后加入浓盐酸氯化蒸馏,水解、电解得到单质锗;
沉锗后所得滤液加入碳酸氢铵沉锌,灼烧得到氧化锌。
1
2
由分析可知,“调pH”所用试剂
X为ZnO;
1
2
故应调控pH的范围为2.8~6.4。
1
2
(4)若“沉锌”的产物为Zn2(OH)2CO3,则反应的离子方程式为_________
_______________________________________。
2Zn2++
1
2
若“沉锌”的产物为Zn2(OH)2CO3,则锌离子和碳酸氢根离子反应生成Zn2(OH)2CO3、水和二氧化碳,离子方程式为2Zn2++
===Zn2(OH)2CO3↓+3CO2↑+H2O。
本课结束
同课章节目录
