专题六 主观题突破 3.化工流程中物质的分离与提纯(共44张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 主观题突破 3.化工流程中物质的分离与提纯(共44张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:20:50 | ||
图片预览









文档简介
(共44张PPT)
主观题突破
3.化工流程中物质的分离与提纯
核心精讲
01
1.化工生产过程中分离、提纯、除杂
化工生产过程中分离、提纯、除杂等环节,与高中化学基本实验的原理紧密联系,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,或蒸馏、萃取、分液等基本实验操作及原理,并要熟悉所用到的相关仪器。
2.常考分离、提纯的操作
(1)从滤液中提取一般晶体(溶解度随温度升高而增大)的方法:蒸发浓缩(至少有晶膜出现)、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗等)、干燥。
(2)从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体的方法:蒸发浓缩、趁热过滤(如果温度下降,杂质也会以晶体的形式析出来)、洗涤、干燥。
(3)减压蒸发的原因:减压蒸发降低了蒸发温度,可以防止某物质分解(如H2O2、浓硝酸、NH4HCO3)或失去结晶水(如题目要求制备结晶水合物产品)。
(4)洗涤
洗涤试剂 适用范围 目的
蒸 馏 水 冷水 产物不溶于水 除去固体表面吸附着的××杂质,可适当降低固体因为溶解而造成的损失
热水 有特殊的物质其溶解度随着温度升高而下降 除去固体表面吸附着的××杂质,可适当降低固体因为温度变化溶解而造成的损失
洗涤试剂 适用范围 目的
有机溶剂 (酒精、丙 酮等) 固体易溶于水、难溶于有机溶剂 减少固体溶解;利用有机溶剂的挥发性除去固体表面的水分,产品易干燥
饱和溶液 对纯度要求不高的产品 减少固体溶解
酸、碱溶液 产物不溶于酸、碱 除去固体表面吸附着的可溶于酸、碱的杂质;减少固体溶解
洗涤试剂 适用范围 目的
洗涤沉淀的方法:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次 检验沉淀是否洗涤干净的方法:取少量最后一次的洗涤液于试管中,向其中滴入某试剂,若未出现特征反应现象,则沉淀洗涤干净 (5)萃取与反萃取
①萃取:利用物质在两种互不相溶的溶剂中的溶解度不同,将物质从一种溶剂转移到另一种溶剂的过程。如用CCl4萃取溴水中的Br2。
②反萃取:用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。
(6)其他
①蒸发时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解。
②减压蒸馏的原因:减小压强,使液体沸点降低,防止受热分解、氧化等。
3.根据溶解度曲线判断结晶的方法
(1)溶解度受温度影响较小的(如NaCl)采取蒸发结晶的方法。
(2)溶解度受温度影响较大的采取蒸发浓缩、冷却结晶的方法。
(3)带有结晶水的盐,一般采取蒸发浓缩、冷却结晶的方法。
应用示例
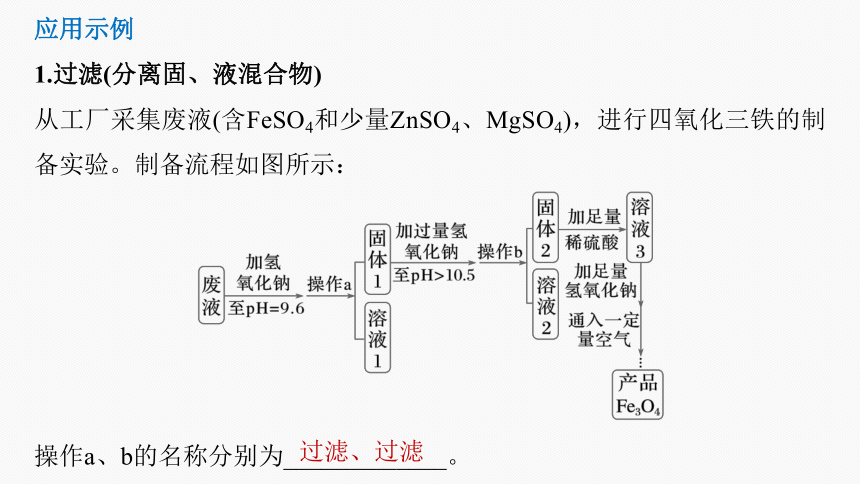
1.过滤(分离固、液混合物)
从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。制备流程如图所示:
操作a、b的名称分别为_____________。
过滤、过滤
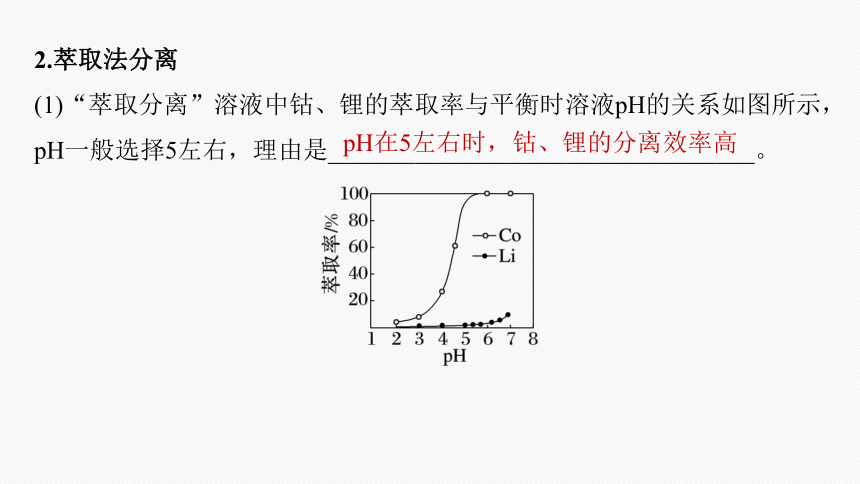
2.萃取法分离
(1)“萃取分离”溶液中钴、锂的萃取率与平衡时溶液pH的关系如图所示,pH一般选择5左右,理由是__________________________________。
pH在5左右时,钴、锂的分离效率高
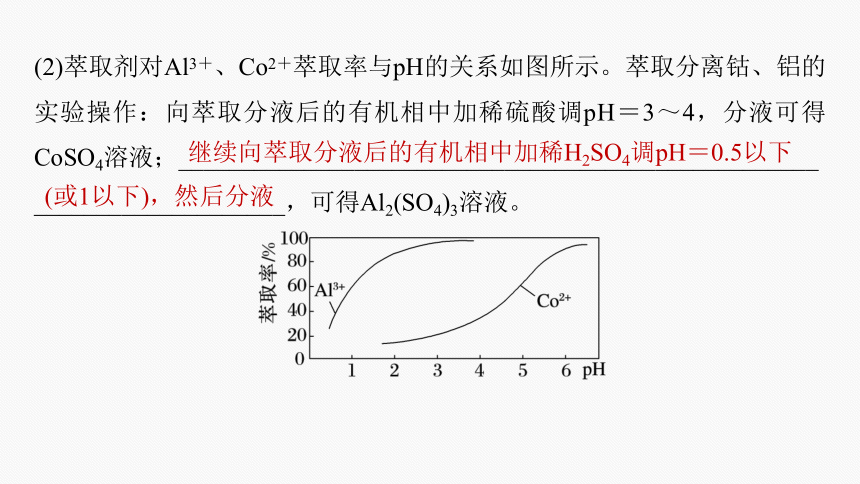
(2)萃取剂对Al3+、Co2+萃取率与pH的关系如图所示。萃取分离钴、铝的实验操作:向萃取分液后的有机相中加稀硫酸调pH=3~4,分液可得CoSO4溶液;___________________________________________________
____________________,可得Al2(SO4)3溶液。
继续向萃取分液后的有机相中加稀H2SO4调pH=0.5以下
(或1以下),然后分液
(3)已知萃取剂A、B中pH对钴离子、锰离子萃取率的影响如图所示,为了除去Mn2+,应选择萃取剂________(填“A”或“B”)。
B
3.反萃取分离
(1)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图所示。
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式:_________________________________。
该操作将I2还原为I-的目的是__________________________。
使四氯化碳中的碘进入水层
(2)钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图:
已知:①VOSO4能溶于水,VO2+
与Fe不能反应;
②有机溶剂H2R对VO2+及Fe3+萃
取率高,但不能萃取Fe2+。
“溶剂萃取与反萃取”可表示为
VO2++H2R VOR+2H+。
为了提高VO2+的产率,反萃取剂可选用________(填字母)。
a.NaCl b.NaOH c.H2SO4
c
(3)钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:
“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是_______________________________________
_________。
富集钼酸根离子(或将钼酸根离子和其他杂
质分离)
4.结晶与过滤
从溶液中得到晶体的过程:蒸发浓缩→冷却结晶→过滤→洗涤、干燥。
需要加热得到的晶体(或物质):蒸发结晶、趁热过滤。
需要冷却得到的晶体(或物质):蒸发浓缩、冷却结晶。
(1)制备MnSO4·H2O晶体。已知溶解度曲线如图1所示,MnSO4·H2O晶体在曲线拐点右侧。
操作方法:滴加稀硫酸酸化,温度______(填“高
于”“低于”或“等于”)40 ℃,______结晶、
_______过滤,酒精洗涤,低温干燥。
高于
蒸发
趁热
(2)制备FeSO4·7H2O晶体。已知溶解度曲线如图2所示,FeSO4·7H2O晶体在曲线拐点左侧。
操作方法:加热________,得到_______ ℃饱和溶液,冷却至_____ ℃结晶,过滤,少量冰水洗涤,低温干燥。
浓缩
60
0
(3)由图3和图4,确定以下物质的制备方法:
①制备KNO3:__________、__________、过滤、洗涤、干燥。
②制备KCl:蒸发_______、__________、洗涤、干燥。
③制备无水Na2SO3:在______(填“高于”“低于”或“等于”)34 ℃条件下,__________、__________、洗涤、干燥。
蒸发浓缩
冷却结晶
结晶
趁热过滤
高于
蒸发结晶
趁热过滤
真题演练
02
[2017·全国卷Ⅲ,27(4)]重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________(填字母)得到的K2Cr2O7固体产品最多。
a.80 ℃ b.60 ℃
c.40 ℃ d.10 ℃
步骤⑤的反应类型是_____________。
d
复分解反应
考向预测
03
1
2
1.(1)碘化亚铜(CuI)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。
①步骤a中Cu2S被转化为Cu,同时有大气污染物A生成,相关反应的化学
方程式为__________________________。
熔渣B主要成分为黑色磁性物质,其化学式为________。
Fe3O4
1
2
步骤a中Cu2S与空气中的氧气在1 200 ℃条件下反应生成Cu和二氧化硫,反应的化学方程式为Cu2S+O2 2Cu+SO2;
由熔渣B的主要成分为黑色磁性物质可知,FeS与空气中的氧气在1 200 ℃条件下反应生成四氧化三铁和二氧化硫。
1
2
②步骤b中H2O2的作用是_________________________________;步骤c中加入过量NaI涉及的主要反应的离子方程式为_________________________。
作氧化剂,将Cu2O和Cu氧化为Cu2+
2Cu2++4I-===2CuI↓+I2
步骤b的反应为在硫酸作用下,H2O2作氧化剂,将氧化亚铜、铜氧化生成硫酸铜;步骤c的反应为硫酸铜溶液与过量的NaI溶液反应得到CuI沉淀。
1
2
③步骤d用乙醇洗涤的优点是__________________________;检验沉淀是否洗涤干净的方法是_____________________________________________
___________________________。
洗去残余水分且可快速晾干
蘸取最后一次洗涤液进行焰色试验,如果火焰无黄
色则已洗净(或其他合理答案)
步骤d用乙醇洗涤可以洗去固体表面的水,同时由于乙醇易挥发可达到快速晾干的目的;洗涤液中含有钠离子、硫酸根离子,可以用焰色试验或酸化的氯化钡溶液检验沉淀是否洗涤干净。
1
2
(2)下图是Na2SO4和Na2SO4·10H2O的溶解度曲线,则由Na2SO4溶液得到Na2SO4固体的操作是__________→__________→用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是_____________________________________
____________________________。
蒸发结晶
趁热过滤
防止Na2SO4固体转化为Na2SO4·10H2O,
并防止Na2SO4因溶于水而损耗
1
2
由图像溶解度曲线变化可知,Na2SO4的溶解度在温度较高时,随温度升高而降低,而Na2SO4·10H2O的溶解度随温度升高而增大,欲得到Na2SO4固体,应采取加热蒸发溶剂使Na2SO4结晶析出,并趁热过滤;因Na2SO4难溶于乙醇,所以用乙醇洗涤
既能防止Na2SO4和水作用生成Na2SO4·10H2O,
又能防止Na2SO4因溶于水而损耗。
1
2
2.磷精矿主要成分为Ca5F(PO4)3,含少量REPO4、FeO、Fe2O3、SiO2,其中RE代表稀土元素。从磷精矿分离稀土元素的工业流程如下。
(1)RE属于第ⅢB族,其中Sc的基态原子核外电子排布式为________________________________。
1s22s22p63s23p63d14s2(或[Ar]3d14s2)
1
2
(2)“酸浸”过程HNO3与Ca5F(PO4)3反应的化学方程式如下,请补充完整。
1
10
5
3
H3PO4
1
1
2
(3)“萃取”的目的是富集RE,但其他元素也会按一定比例进入萃取剂中。
①通过3ROH+POCl3 (RO)3PO+3HCl制得有机磷萃取剂(RO)3PO,其中—R代表烃基,—R对(RO)3PO产率的影响如下表。
—R —CH2CH3 —CH2CH2CH3 —CH2CH2CH2CH3
(RO)3PO 产率/% 82 62 20
由表可知,随着碳原子数增加,烃基________(填“推电子”或“吸电子”)能力增强,O—H更难断裂,(RO)3PO产率降低。
推电子
1
2
磷精矿加入硝酸酸浸,二氧化硅不反应得到滤渣1,稀土元素、铁、钙元素进入滤液,加入萃取剂萃取出稀土元素,然后加入亚硫酸钠将三价铁转化为二价铁,通入氨气,调节pH分离出含有稀土的固相,再加入硝酸溶解,加入硫酸除去钙元素得到滤渣2硫酸钙,滤液加入草酸分离出草酸稀土。
由表可知,烃基为推电子基团,随着碳原子数增加,烃基推电子能力增强,O—H更难断裂,(RO)3PO产率降低。
1
2
②“萃取”过程使用的萃取剂(C4H9O)3PO的结构如图,与RE3+配位的能力:1号O原子________(填“>”“<”或“=”)2号O原子。
<
1
2
由随着碳原子数增加,烃基推电子能力增强可知,烃基导致1号位氧更难与RE3+配位,故与RE3+配位的能力:1号O原子<2号O原子。
1
2
(4)“反萃取”的目的是分离RE和Fe元素。向“萃取液”中通入NH3,Fe2+、Fe3+、RE3+的沉淀率随pH变化如图。
①试剂X为________(填“Na2SO3”或“NaClO”),应调节pH为____。
Na2SO3
2
1
2
由图可知,亚铁离子与RE的分离效果更好,则试剂X为将铁离子转化为亚铁离子的物质,故应选择Na2SO3;
结合图像可知,应调节pH为2,此时RE几乎完全沉淀,而亚铁离子几乎没有沉淀,分离效果好。
1
2
②通入NH3得到REPO4沉淀的过程:
ⅰ.H3PO4+3NH3===(NH4)3PO4;
ⅱ.___________________________________________(写出该过程的化学方程式)。
(NH4)3PO4+RE(NO3)3===REPO4↓+3NH4NO3
1
2
总反应为通入NH3得到REPO4沉淀,反应ⅰ.H3PO4+3NH3===(NH4)3PO4,则反应ⅱ为(NH4)3PO4和稀土的硝酸盐转化为REPO4沉淀的反应:(NH4)3PO4+RE(NO3)3===REPO4↓+3NH4NO3。
1
2
③若萃取剂改用三丁基氧化膦[(C4H9)3PO]会导致“反萃取”RE产率降低,其原因为_______________________________________________________
__________________________。
—C4H9有较强的推电子作用,导致稀土与萃取剂形成的配位键
牢固,难以断裂实现反萃取
1
2
(5)若略去“净化”过程,则制得的草酸稀土会混有____________(填化学式)杂质。
(6)在整个工艺中,可从副产物中提取______________(填名称),用于生产氮肥。
CaC2O4
硝酸铵、硝酸
1
2
在整个工艺中,通入氨气生成的硝酸铵,以及酸溶加入的硝酸均含有氮元素,故可从副产物中提取硝酸铵、硝酸用于生产氮肥。
本课结束
主观题突破
3.化工流程中物质的分离与提纯
核心精讲
01
1.化工生产过程中分离、提纯、除杂
化工生产过程中分离、提纯、除杂等环节,与高中化学基本实验的原理紧密联系,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,或蒸馏、萃取、分液等基本实验操作及原理,并要熟悉所用到的相关仪器。
2.常考分离、提纯的操作
(1)从滤液中提取一般晶体(溶解度随温度升高而增大)的方法:蒸发浓缩(至少有晶膜出现)、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗等)、干燥。
(2)从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体的方法:蒸发浓缩、趁热过滤(如果温度下降,杂质也会以晶体的形式析出来)、洗涤、干燥。
(3)减压蒸发的原因:减压蒸发降低了蒸发温度,可以防止某物质分解(如H2O2、浓硝酸、NH4HCO3)或失去结晶水(如题目要求制备结晶水合物产品)。
(4)洗涤
洗涤试剂 适用范围 目的
蒸 馏 水 冷水 产物不溶于水 除去固体表面吸附着的××杂质,可适当降低固体因为溶解而造成的损失
热水 有特殊的物质其溶解度随着温度升高而下降 除去固体表面吸附着的××杂质,可适当降低固体因为温度变化溶解而造成的损失
洗涤试剂 适用范围 目的
有机溶剂 (酒精、丙 酮等) 固体易溶于水、难溶于有机溶剂 减少固体溶解;利用有机溶剂的挥发性除去固体表面的水分,产品易干燥
饱和溶液 对纯度要求不高的产品 减少固体溶解
酸、碱溶液 产物不溶于酸、碱 除去固体表面吸附着的可溶于酸、碱的杂质;减少固体溶解
洗涤试剂 适用范围 目的
洗涤沉淀的方法:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次 检验沉淀是否洗涤干净的方法:取少量最后一次的洗涤液于试管中,向其中滴入某试剂,若未出现特征反应现象,则沉淀洗涤干净 (5)萃取与反萃取
①萃取:利用物质在两种互不相溶的溶剂中的溶解度不同,将物质从一种溶剂转移到另一种溶剂的过程。如用CCl4萃取溴水中的Br2。
②反萃取:用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。
(6)其他
①蒸发时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解。
②减压蒸馏的原因:减小压强,使液体沸点降低,防止受热分解、氧化等。
3.根据溶解度曲线判断结晶的方法
(1)溶解度受温度影响较小的(如NaCl)采取蒸发结晶的方法。
(2)溶解度受温度影响较大的采取蒸发浓缩、冷却结晶的方法。
(3)带有结晶水的盐,一般采取蒸发浓缩、冷却结晶的方法。
应用示例
1.过滤(分离固、液混合物)
从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。制备流程如图所示:
操作a、b的名称分别为_____________。
过滤、过滤
2.萃取法分离
(1)“萃取分离”溶液中钴、锂的萃取率与平衡时溶液pH的关系如图所示,pH一般选择5左右,理由是__________________________________。
pH在5左右时,钴、锂的分离效率高
(2)萃取剂对Al3+、Co2+萃取率与pH的关系如图所示。萃取分离钴、铝的实验操作:向萃取分液后的有机相中加稀硫酸调pH=3~4,分液可得CoSO4溶液;___________________________________________________
____________________,可得Al2(SO4)3溶液。
继续向萃取分液后的有机相中加稀H2SO4调pH=0.5以下
(或1以下),然后分液
(3)已知萃取剂A、B中pH对钴离子、锰离子萃取率的影响如图所示,为了除去Mn2+,应选择萃取剂________(填“A”或“B”)。
B
3.反萃取分离
(1)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图所示。
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式:_________________________________。
该操作将I2还原为I-的目的是__________________________。
使四氯化碳中的碘进入水层
(2)钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图:
已知:①VOSO4能溶于水,VO2+
与Fe不能反应;
②有机溶剂H2R对VO2+及Fe3+萃
取率高,但不能萃取Fe2+。
“溶剂萃取与反萃取”可表示为
VO2++H2R VOR+2H+。
为了提高VO2+的产率,反萃取剂可选用________(填字母)。
a.NaCl b.NaOH c.H2SO4
c
(3)钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:
“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是_______________________________________
_________。
富集钼酸根离子(或将钼酸根离子和其他杂
质分离)
4.结晶与过滤
从溶液中得到晶体的过程:蒸发浓缩→冷却结晶→过滤→洗涤、干燥。
需要加热得到的晶体(或物质):蒸发结晶、趁热过滤。
需要冷却得到的晶体(或物质):蒸发浓缩、冷却结晶。
(1)制备MnSO4·H2O晶体。已知溶解度曲线如图1所示,MnSO4·H2O晶体在曲线拐点右侧。
操作方法:滴加稀硫酸酸化,温度______(填“高
于”“低于”或“等于”)40 ℃,______结晶、
_______过滤,酒精洗涤,低温干燥。
高于
蒸发
趁热
(2)制备FeSO4·7H2O晶体。已知溶解度曲线如图2所示,FeSO4·7H2O晶体在曲线拐点左侧。
操作方法:加热________,得到_______ ℃饱和溶液,冷却至_____ ℃结晶,过滤,少量冰水洗涤,低温干燥。
浓缩
60
0
(3)由图3和图4,确定以下物质的制备方法:
①制备KNO3:__________、__________、过滤、洗涤、干燥。
②制备KCl:蒸发_______、__________、洗涤、干燥。
③制备无水Na2SO3:在______(填“高于”“低于”或“等于”)34 ℃条件下,__________、__________、洗涤、干燥。
蒸发浓缩
冷却结晶
结晶
趁热过滤
高于
蒸发结晶
趁热过滤
真题演练
02
[2017·全国卷Ⅲ,27(4)]重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________(填字母)得到的K2Cr2O7固体产品最多。
a.80 ℃ b.60 ℃
c.40 ℃ d.10 ℃
步骤⑤的反应类型是_____________。
d
复分解反应
考向预测
03
1
2
1.(1)碘化亚铜(CuI)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。
①步骤a中Cu2S被转化为Cu,同时有大气污染物A生成,相关反应的化学
方程式为__________________________。
熔渣B主要成分为黑色磁性物质,其化学式为________。
Fe3O4
1
2
步骤a中Cu2S与空气中的氧气在1 200 ℃条件下反应生成Cu和二氧化硫,反应的化学方程式为Cu2S+O2 2Cu+SO2;
由熔渣B的主要成分为黑色磁性物质可知,FeS与空气中的氧气在1 200 ℃条件下反应生成四氧化三铁和二氧化硫。
1
2
②步骤b中H2O2的作用是_________________________________;步骤c中加入过量NaI涉及的主要反应的离子方程式为_________________________。
作氧化剂,将Cu2O和Cu氧化为Cu2+
2Cu2++4I-===2CuI↓+I2
步骤b的反应为在硫酸作用下,H2O2作氧化剂,将氧化亚铜、铜氧化生成硫酸铜;步骤c的反应为硫酸铜溶液与过量的NaI溶液反应得到CuI沉淀。
1
2
③步骤d用乙醇洗涤的优点是__________________________;检验沉淀是否洗涤干净的方法是_____________________________________________
___________________________。
洗去残余水分且可快速晾干
蘸取最后一次洗涤液进行焰色试验,如果火焰无黄
色则已洗净(或其他合理答案)
步骤d用乙醇洗涤可以洗去固体表面的水,同时由于乙醇易挥发可达到快速晾干的目的;洗涤液中含有钠离子、硫酸根离子,可以用焰色试验或酸化的氯化钡溶液检验沉淀是否洗涤干净。
1
2
(2)下图是Na2SO4和Na2SO4·10H2O的溶解度曲线,则由Na2SO4溶液得到Na2SO4固体的操作是__________→__________→用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是_____________________________________
____________________________。
蒸发结晶
趁热过滤
防止Na2SO4固体转化为Na2SO4·10H2O,
并防止Na2SO4因溶于水而损耗
1
2
由图像溶解度曲线变化可知,Na2SO4的溶解度在温度较高时,随温度升高而降低,而Na2SO4·10H2O的溶解度随温度升高而增大,欲得到Na2SO4固体,应采取加热蒸发溶剂使Na2SO4结晶析出,并趁热过滤;因Na2SO4难溶于乙醇,所以用乙醇洗涤
既能防止Na2SO4和水作用生成Na2SO4·10H2O,
又能防止Na2SO4因溶于水而损耗。
1
2
2.磷精矿主要成分为Ca5F(PO4)3,含少量REPO4、FeO、Fe2O3、SiO2,其中RE代表稀土元素。从磷精矿分离稀土元素的工业流程如下。
(1)RE属于第ⅢB族,其中Sc的基态原子核外电子排布式为________________________________。
1s22s22p63s23p63d14s2(或[Ar]3d14s2)
1
2
(2)“酸浸”过程HNO3与Ca5F(PO4)3反应的化学方程式如下,请补充完整。
1
10
5
3
H3PO4
1
1
2
(3)“萃取”的目的是富集RE,但其他元素也会按一定比例进入萃取剂中。
①通过3ROH+POCl3 (RO)3PO+3HCl制得有机磷萃取剂(RO)3PO,其中—R代表烃基,—R对(RO)3PO产率的影响如下表。
—R —CH2CH3 —CH2CH2CH3 —CH2CH2CH2CH3
(RO)3PO 产率/% 82 62 20
由表可知,随着碳原子数增加,烃基________(填“推电子”或“吸电子”)能力增强,O—H更难断裂,(RO)3PO产率降低。
推电子
1
2
磷精矿加入硝酸酸浸,二氧化硅不反应得到滤渣1,稀土元素、铁、钙元素进入滤液,加入萃取剂萃取出稀土元素,然后加入亚硫酸钠将三价铁转化为二价铁,通入氨气,调节pH分离出含有稀土的固相,再加入硝酸溶解,加入硫酸除去钙元素得到滤渣2硫酸钙,滤液加入草酸分离出草酸稀土。
由表可知,烃基为推电子基团,随着碳原子数增加,烃基推电子能力增强,O—H更难断裂,(RO)3PO产率降低。
1
2
②“萃取”过程使用的萃取剂(C4H9O)3PO的结构如图,与RE3+配位的能力:1号O原子________(填“>”“<”或“=”)2号O原子。
<
1
2
由随着碳原子数增加,烃基推电子能力增强可知,烃基导致1号位氧更难与RE3+配位,故与RE3+配位的能力:1号O原子<2号O原子。
1
2
(4)“反萃取”的目的是分离RE和Fe元素。向“萃取液”中通入NH3,Fe2+、Fe3+、RE3+的沉淀率随pH变化如图。
①试剂X为________(填“Na2SO3”或“NaClO”),应调节pH为____。
Na2SO3
2
1
2
由图可知,亚铁离子与RE的分离效果更好,则试剂X为将铁离子转化为亚铁离子的物质,故应选择Na2SO3;
结合图像可知,应调节pH为2,此时RE几乎完全沉淀,而亚铁离子几乎没有沉淀,分离效果好。
1
2
②通入NH3得到REPO4沉淀的过程:
ⅰ.H3PO4+3NH3===(NH4)3PO4;
ⅱ.___________________________________________(写出该过程的化学方程式)。
(NH4)3PO4+RE(NO3)3===REPO4↓+3NH4NO3
1
2
总反应为通入NH3得到REPO4沉淀,反应ⅰ.H3PO4+3NH3===(NH4)3PO4,则反应ⅱ为(NH4)3PO4和稀土的硝酸盐转化为REPO4沉淀的反应:(NH4)3PO4+RE(NO3)3===REPO4↓+3NH4NO3。
1
2
③若萃取剂改用三丁基氧化膦[(C4H9)3PO]会导致“反萃取”RE产率降低,其原因为_______________________________________________________
__________________________。
—C4H9有较强的推电子作用,导致稀土与萃取剂形成的配位键
牢固,难以断裂实现反萃取
1
2
(5)若略去“净化”过程,则制得的草酸稀土会混有____________(填化学式)杂质。
(6)在整个工艺中,可从副产物中提取______________(填名称),用于生产氮肥。
CaC2O4
硝酸铵、硝酸
1
2
在整个工艺中,通入氨气生成的硝酸铵,以及酸溶加入的硝酸均含有氮元素,故可从副产物中提取硝酸铵、硝酸用于生产氮肥。
本课结束
同课章节目录
