专题六 主观题突破 4.化工流程中化学方程式的书写及有关计算 课件(共57张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题六 主观题突破 4.化工流程中化学方程式的书写及有关计算 课件(共57张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:21:51 | ||
图片预览







文档简介
(共57张PPT)
主观题突破
4.化工流程中化学方程式的书写及有关计算
核心精讲
01
(一)化工流程中化学方程式的书写
1.书写思路
首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:
(1)元素化合价无变化则为非氧化还原反应,遵循质量守恒定律;
(2)元素化合价有变化则为氧化还原反应,既遵循质量守恒定律,又遵循得失电子守恒规律。
2.流程中陌生的氧化还原反应的书写流程
(1)首先根据题给材料中的信息确定氧化剂(或还原剂)与还原产物(或氧化产物),结合已学知识根据加入的还原剂(或氧化剂)判断氧化产物(或还原产物)。
(2)根据得失电子守恒配平氧化还原反应。
(3)根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。
(4)根据质量守恒配平反应方程式。
(二)化工流程中的有关计算
1.Ksp计算
(1)判断能否沉淀。
(2)判断能否沉淀完全。
(3)计算某一离子的浓度。
(4)沉淀生成和沉淀完全时pH的计算。
2.产率、纯度的计算
(1)计算公式
(2)计算的关键在于运用守恒或关系式法结合实验原理找到计算的关系,确定数量关系。
对点训练
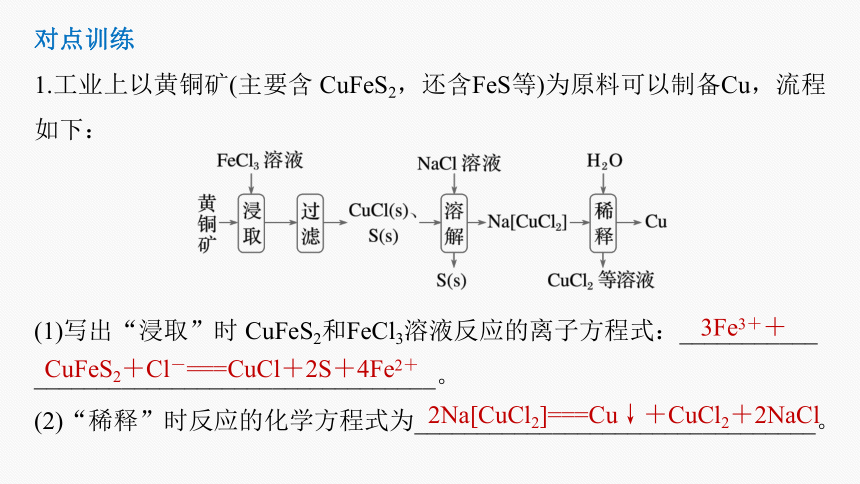
1.工业上以黄铜矿(主要含 CuFeS2,还含FeS等)为原料可以制备Cu,流程如下:
(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:___________
________________________________。
(2)“稀释”时反应的化学方程式为________________________________。
3Fe3++
CuFeS2+Cl-===CuCl+2S+4Fe2+
2Na[CuCl2]===Cu↓+CuCl2+2NaCl
根据该工艺流程图中信息可知,“浸取”时是将黄铜矿与FeCl3溶液充分反应,化学方程式为3FeCl3+CuFeS2===CuCl+2S+4FeCl2,2FeCl3+FeS===3FeCl2+S,过滤得到CuCl和S的混合物,洗涤,向洗涤后的固体中加入NaCl溶液,“溶解”时发生的反应为NaCl+CuCl===Na[CuCl2],过滤出S,得到滤液,向滤液中加水稀释得到Cu和CuCl2、NaCl,“稀
释”时的反应为2Na[CuCl2]===
Cu↓+CuCl2+2NaCl。
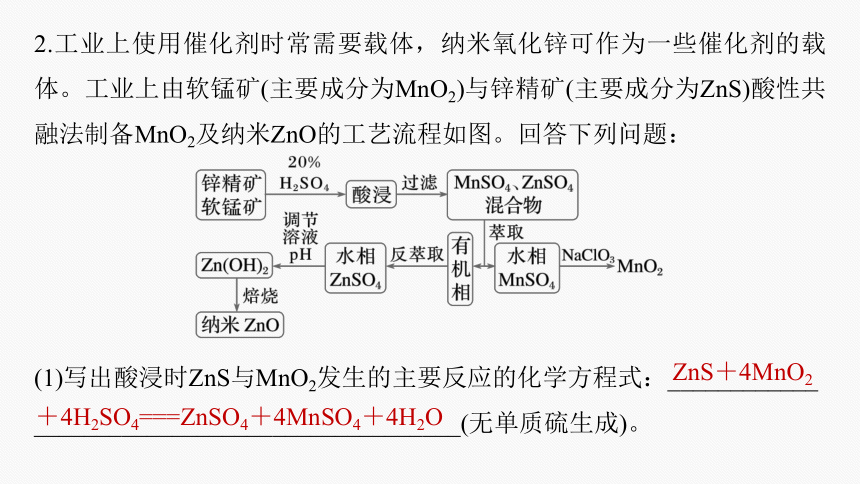
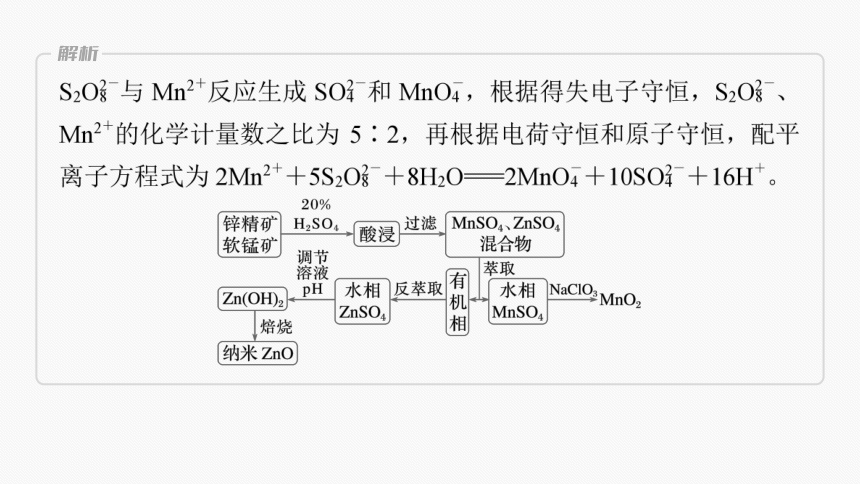
2.工业上使用催化剂时常需要载体,纳米氧化锌可作为一些催化剂的载体。工业上由软锰矿(主要成分为MnO2)与锌精矿(主要成分为ZnS)酸性共融法制备MnO2及纳米ZnO的工艺流程如图。回答下列问题:
(1)写出酸浸时ZnS与MnO2发生的主要反应的化学方程式:____________
__________________________________(无单质硫生成)。
ZnS+4MnO2
+4H2SO4===ZnSO4+4MnSO4+4H2O
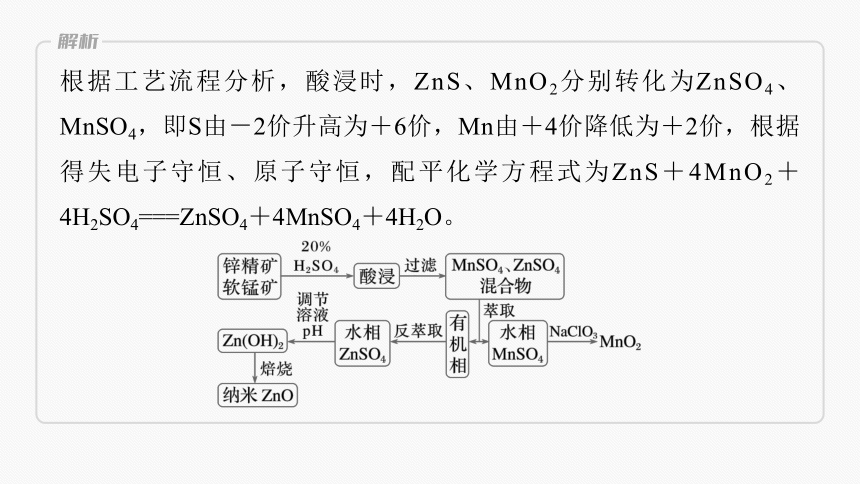
根据工艺流程分析,酸浸时,ZnS、MnO2分别转化为ZnSO4、MnSO4,即S由-2价升高为+6价,Mn由+4价降低为+2价,根据得失电子守恒、原子守恒,配平化学方程式为ZnS+4MnO2+4H2SO4===ZnSO4+4MnSO4+4H2O。
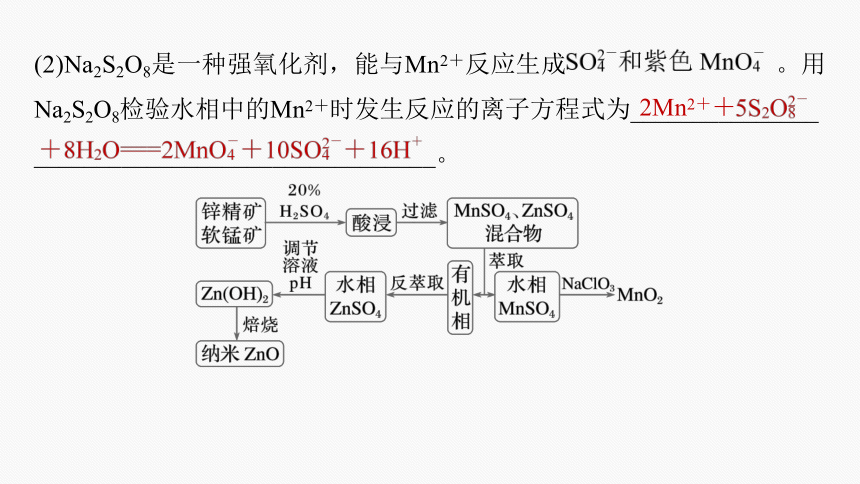
(2)Na2S2O8是一种强氧化剂,能与Mn2+反应生成 。用Na2S2O8检验水相中的Mn2+时发生反应的离子方程式为_______________
________________________________。
2Mn2++
3.将等体积的4×10-3 mol·L-1的AgNO3溶液和4×10-3mol·L-1 K2CrO4溶液混合,有无Ag2CrO4沉淀产生?[已知:Ksp (Ag2CrO4)=1.12×10-12]
答案 有
真题演练
02
1
2
1.(2022·广东,18)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
1
2
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
1
2
(1)“氧化调pH”中,化合价有变化的金属离子是_______。
Fe2+
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
1
2
由分析可知,“氧化调pH”的目的是除去含铁、铝等元素的离子,需要将Fe2+氧化为Fe3+,以便后续除杂,所以化合价有变化的金属离子是Fe2+。
1
2
(2)“过滤1”前,用NaOH溶液调pH至_____________的范围内,该过程中Al3+发生反应的离子方程式为__________________________。
4.7≤pH<6.2
Al3++3OH-===Al(OH)3↓
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
由表中数据可知,Al3+沉淀完全时的pH为4.7,而RE3+开始沉淀时的pH为6.2,所以为保证Fe3+、Al3+沉淀完全,且RE3+不沉淀,要用NaOH溶液调pH至4.7≤pH<6.2的范围内,该过程中Al3+发生反应的离子方程式为Al3++3OH-===Al(OH)3↓。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于__________ mol·L-1(保留两位有效数字)。
4.0×10-4
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
滤液2中Mg2+浓度为2.7 g·L-1,即0.112 5 mol·L-1,根据Ksp[(C11H23COO)2Mg]=c(Mg2+)·c2(C11H23COO-),若要加入月桂酸钠后只生成(C11H23COO)3RE,而不产生(C11H23COO)2Mg,
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是________
__________________。
②“操作X”的过程为先__________,再固液分离。
加热搅
拌可加快反应速率
冷却结晶
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
“操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)的熔点为44 ℃,故“操作X”的过程为先冷却结晶,再固液分离。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(5)该工艺中,可再生循环利用的物质有________(写化学式)。
MgSO4
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移____ mol电子。
15
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
YCl3中Y为+3价,PtCl4中Pt为+4价,而Pt3Y中金属均为0价,所以还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移15 mol电子。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为________________________。
O2+4e-+2H2O===4OH-
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O2+4e-+2H2O===4OH-。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
2.[2021·河北,15(1)(2)(3)(6)(7)]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
1
2
回答下列问题:
(1)高温连续氧化工序中被氧化的元素
是________(填元素符号)。
(2)工序①的名称为__________。
Fe、Cr
溶解浸出
工序①为将氧化后的固体加水溶解浸出可溶性物质。
1
2
(3)滤渣Ⅰ的主要成分是______________(填化学式)。
MgO、Fe2O3
1
2
(6)热解工序产生的混合气体最适宜返回工序_____(填“①”“②”“③”或“④”)参与内循环。
②
热解工序产生的混合气体为二氧化碳和水蒸气,将混合气体通入滤渣Ⅰ中可以将氧化镁转化为碳酸氢镁溶液,则混合气体最适宜返回的工序为工序②。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为__________(通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全;Al(OH)3+OH-
K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33)。
8.37
1
2
1
2
1
2
考向预测
03
1
2
3
1.金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2。采用以下工艺流程制备V2O5。
(1)“焙烧”过程中被氧化的元素为________,写出V2O3与Na2CO3反应的
化学方程式_____________________________________。
V、Fe
1
2
3
加入碳酸钠焙烧后,V2O3、Al2O3、SiO2分别生成NaVO3、NaAlO2、Na2SiO3,FeO被氧化为Fe2O3,加水进行水溶,只有Fe2O3不溶,则沉淀1为Fe2O3,加入盐酸调节pH=2~3,将硅元素转化为硅酸,则沉淀2为硅酸,用NaOH调节pH,生成氢氧化铝和氢氧化铁沉淀,溶液中只含NaVO3,加
入(NH4)2CO3 “沉钒”
析出NH4VO3,煅烧
NH4VO3得到V2O5。
1
2
3
由上述分析可知,“焙烧”过程中被氧化的元素为V、Fe;焙烧时,V2O3与Na2CO3、O2反应生成NaVO3和二氧化碳,反应的化学方程式为Na2CO3+V2O3+O2 2NaVO3+CO2。
1
2
3
(2)“沉淀1”的成分是________。
(3)“滤液1”中铝元素所发生反应的离子方程式为
__________________________。
Fe2O3
1
2
3
(4)“沉淀2”加热分解后固体产物的用途为_______________________(任写一种)。
(5)该工艺流程中可回收再循环利用的物质有__________。
光导纤维(或制单质硅等)
Na2CO3
1
2
3
2.Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:
(1)若净化后的溶液中Cu2+浓度为1×10-12mol·L-1,则净化后溶液中Zn2+浓度为______________[已知:室温下Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]。
0.25 mol·L-1
1
2
3
(2)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·
6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为
_________________________________________________________。
测热分解后产品中ZnFe2O4的质量分数方法如下:取a g产品用硫酸溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c mol·
L-1 Na2S2O3标准溶液滴定,用去此标准溶液V mL时,刚好达到滴定终点,则此产品中ZnFe2O4的质量分数为
_________(用a、c、V表示)。(已
知:I2+ )
1
2
3
1
2
3
1
2
3
3.磁性氧化铁是电讯器材的重要原料,以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
1
2
3
已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100 g H2O)如表:
温度/℃ 0 20 30 40 100
NH4Fe(SO4)2 70.6 75.4 78.3 81.0 102.1
NH4Al(SO4)2 2.1 5.0 7.7 10.9 26.7
1
2
3
(1)写出“焙烧Ⅱ”中Fe2O3发生反应的化学方程式:__________________
__________________________________。
(2)从滤液中获得NH4Al(SO4)2的操作是______________________________
__________。
Fe2O3+4(NH4)2SO4
蒸发浓缩、冷却结晶、过滤、洗
涤、干燥
1
2
3
(3)“反应Ⅲ”在隔绝空气条件下进行,参与反应的n(FeS2)∶n(Fe2O3)=__________。
1∶16
1
2
3
根据流程图,焙烧Ⅱ中氧化铁和
氧化铝与硫酸铵反应,发生非氧
化还原反应,
1
2
3
气体Ⅱ为氨气,反应Ⅲ中发生反应:FeS2+Fe2O3―→SO2↑+Fe3O4,据此分析。
反应Ⅲ中发生反应:FeS2+Fe2O3―→SO2↑+Fe3O4,令FeS2物质的量为a mol,Fe2O3物质的量为b mol,
1
2
3
(4)为测定Al2O3产品的纯度(Al2O3的质量分数),称量m g样品溶解于足量稀硫酸,配成100.00 mL溶液,取出20.00 mL溶液,加入c1 mol·L-1 EDTA标准溶液V1 mL,调节溶液pH并煮沸,冷却后用c2 mol·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。则制得的Al2O3的纯度为
______________________________________(用代数式表示)。
1
2
3
Al3+、Cu2+与EDTA反应的化学计量比均为1∶1,n(Al3+)+n(Cu2+)=n(EDTA),n(Al3+)=n(EDTA)-n(Cu2+)=V1×10-3 L×c1 mol·L-1
-V2×10-3 L×c2 mol·L-1,
本课结束
主观题突破
4.化工流程中化学方程式的书写及有关计算
核心精讲
01
(一)化工流程中化学方程式的书写
1.书写思路
首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:
(1)元素化合价无变化则为非氧化还原反应,遵循质量守恒定律;
(2)元素化合价有变化则为氧化还原反应,既遵循质量守恒定律,又遵循得失电子守恒规律。
2.流程中陌生的氧化还原反应的书写流程
(1)首先根据题给材料中的信息确定氧化剂(或还原剂)与还原产物(或氧化产物),结合已学知识根据加入的还原剂(或氧化剂)判断氧化产物(或还原产物)。
(2)根据得失电子守恒配平氧化还原反应。
(3)根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。
(4)根据质量守恒配平反应方程式。
(二)化工流程中的有关计算
1.Ksp计算
(1)判断能否沉淀。
(2)判断能否沉淀完全。
(3)计算某一离子的浓度。
(4)沉淀生成和沉淀完全时pH的计算。
2.产率、纯度的计算
(1)计算公式
(2)计算的关键在于运用守恒或关系式法结合实验原理找到计算的关系,确定数量关系。
对点训练
1.工业上以黄铜矿(主要含 CuFeS2,还含FeS等)为原料可以制备Cu,流程如下:
(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:___________
________________________________。
(2)“稀释”时反应的化学方程式为________________________________。
3Fe3++
CuFeS2+Cl-===CuCl+2S+4Fe2+
2Na[CuCl2]===Cu↓+CuCl2+2NaCl
根据该工艺流程图中信息可知,“浸取”时是将黄铜矿与FeCl3溶液充分反应,化学方程式为3FeCl3+CuFeS2===CuCl+2S+4FeCl2,2FeCl3+FeS===3FeCl2+S,过滤得到CuCl和S的混合物,洗涤,向洗涤后的固体中加入NaCl溶液,“溶解”时发生的反应为NaCl+CuCl===Na[CuCl2],过滤出S,得到滤液,向滤液中加水稀释得到Cu和CuCl2、NaCl,“稀
释”时的反应为2Na[CuCl2]===
Cu↓+CuCl2+2NaCl。
2.工业上使用催化剂时常需要载体,纳米氧化锌可作为一些催化剂的载体。工业上由软锰矿(主要成分为MnO2)与锌精矿(主要成分为ZnS)酸性共融法制备MnO2及纳米ZnO的工艺流程如图。回答下列问题:
(1)写出酸浸时ZnS与MnO2发生的主要反应的化学方程式:____________
__________________________________(无单质硫生成)。
ZnS+4MnO2
+4H2SO4===ZnSO4+4MnSO4+4H2O
根据工艺流程分析,酸浸时,ZnS、MnO2分别转化为ZnSO4、MnSO4,即S由-2价升高为+6价,Mn由+4价降低为+2价,根据得失电子守恒、原子守恒,配平化学方程式为ZnS+4MnO2+4H2SO4===ZnSO4+4MnSO4+4H2O。
(2)Na2S2O8是一种强氧化剂,能与Mn2+反应生成 。用Na2S2O8检验水相中的Mn2+时发生反应的离子方程式为_______________
________________________________。
2Mn2++
3.将等体积的4×10-3 mol·L-1的AgNO3溶液和4×10-3mol·L-1 K2CrO4溶液混合,有无Ag2CrO4沉淀产生?[已知:Ksp (Ag2CrO4)=1.12×10-12]
答案 有
真题演练
02
1
2
1.(2022·广东,18)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
1
2
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
1
2
(1)“氧化调pH”中,化合价有变化的金属离子是_______。
Fe2+
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
1
2
由分析可知,“氧化调pH”的目的是除去含铁、铝等元素的离子,需要将Fe2+氧化为Fe3+,以便后续除杂,所以化合价有变化的金属离子是Fe2+。
1
2
(2)“过滤1”前,用NaOH溶液调pH至_____________的范围内,该过程中Al3+发生反应的离子方程式为__________________________。
4.7≤pH<6.2
Al3++3OH-===Al(OH)3↓
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
由表中数据可知,Al3+沉淀完全时的pH为4.7,而RE3+开始沉淀时的pH为6.2,所以为保证Fe3+、Al3+沉淀完全,且RE3+不沉淀,要用NaOH溶液调pH至4.7≤pH<6.2的范围内,该过程中Al3+发生反应的离子方程式为Al3++3OH-===Al(OH)3↓。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于__________ mol·L-1(保留两位有效数字)。
4.0×10-4
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
滤液2中Mg2+浓度为2.7 g·L-1,即0.112 5 mol·L-1,根据Ksp[(C11H23COO)2Mg]=c(Mg2+)·c2(C11H23COO-),若要加入月桂酸钠后只生成(C11H23COO)3RE,而不产生(C11H23COO)2Mg,
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是________
__________________。
②“操作X”的过程为先__________,再固液分离。
加热搅
拌可加快反应速率
冷却结晶
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
“操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)的熔点为44 ℃,故“操作X”的过程为先冷却结晶,再固液分离。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(5)该工艺中,可再生循环利用的物质有________(写化学式)。
MgSO4
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移____ mol电子。
15
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
YCl3中Y为+3价,PtCl4中Pt为+4价,而Pt3Y中金属均为0价,所以还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移15 mol电子。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为________________________。
O2+4e-+2H2O===4OH-
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O2+4e-+2H2O===4OH-。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀 时的pH 8.8 1.5 3.6 6.2~
7.4
沉淀完全 时的pH / 3.2 4.7 /
1
2
2.[2021·河北,15(1)(2)(3)(6)(7)]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
1
2
回答下列问题:
(1)高温连续氧化工序中被氧化的元素
是________(填元素符号)。
(2)工序①的名称为__________。
Fe、Cr
溶解浸出
工序①为将氧化后的固体加水溶解浸出可溶性物质。
1
2
(3)滤渣Ⅰ的主要成分是______________(填化学式)。
MgO、Fe2O3
1
2
(6)热解工序产生的混合气体最适宜返回工序_____(填“①”“②”“③”或“④”)参与内循环。
②
热解工序产生的混合气体为二氧化碳和水蒸气,将混合气体通入滤渣Ⅰ中可以将氧化镁转化为碳酸氢镁溶液,则混合气体最适宜返回的工序为工序②。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为__________(通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全;Al(OH)3+OH-
K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33)。
8.37
1
2
1
2
1
2
考向预测
03
1
2
3
1.金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2。采用以下工艺流程制备V2O5。
(1)“焙烧”过程中被氧化的元素为________,写出V2O3与Na2CO3反应的
化学方程式_____________________________________。
V、Fe
1
2
3
加入碳酸钠焙烧后,V2O3、Al2O3、SiO2分别生成NaVO3、NaAlO2、Na2SiO3,FeO被氧化为Fe2O3,加水进行水溶,只有Fe2O3不溶,则沉淀1为Fe2O3,加入盐酸调节pH=2~3,将硅元素转化为硅酸,则沉淀2为硅酸,用NaOH调节pH,生成氢氧化铝和氢氧化铁沉淀,溶液中只含NaVO3,加
入(NH4)2CO3 “沉钒”
析出NH4VO3,煅烧
NH4VO3得到V2O5。
1
2
3
由上述分析可知,“焙烧”过程中被氧化的元素为V、Fe;焙烧时,V2O3与Na2CO3、O2反应生成NaVO3和二氧化碳,反应的化学方程式为Na2CO3+V2O3+O2 2NaVO3+CO2。
1
2
3
(2)“沉淀1”的成分是________。
(3)“滤液1”中铝元素所发生反应的离子方程式为
__________________________。
Fe2O3
1
2
3
(4)“沉淀2”加热分解后固体产物的用途为_______________________(任写一种)。
(5)该工艺流程中可回收再循环利用的物质有__________。
光导纤维(或制单质硅等)
Na2CO3
1
2
3
2.Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:
(1)若净化后的溶液中Cu2+浓度为1×10-12mol·L-1,则净化后溶液中Zn2+浓度为______________[已知:室温下Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]。
0.25 mol·L-1
1
2
3
(2)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·
6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为
_________________________________________________________。
测热分解后产品中ZnFe2O4的质量分数方法如下:取a g产品用硫酸溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c mol·
L-1 Na2S2O3标准溶液滴定,用去此标准溶液V mL时,刚好达到滴定终点,则此产品中ZnFe2O4的质量分数为
_________(用a、c、V表示)。(已
知:I2+ )
1
2
3
1
2
3
1
2
3
3.磁性氧化铁是电讯器材的重要原料,以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
1
2
3
已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100 g H2O)如表:
温度/℃ 0 20 30 40 100
NH4Fe(SO4)2 70.6 75.4 78.3 81.0 102.1
NH4Al(SO4)2 2.1 5.0 7.7 10.9 26.7
1
2
3
(1)写出“焙烧Ⅱ”中Fe2O3发生反应的化学方程式:__________________
__________________________________。
(2)从滤液中获得NH4Al(SO4)2的操作是______________________________
__________。
Fe2O3+4(NH4)2SO4
蒸发浓缩、冷却结晶、过滤、洗
涤、干燥
1
2
3
(3)“反应Ⅲ”在隔绝空气条件下进行,参与反应的n(FeS2)∶n(Fe2O3)=__________。
1∶16
1
2
3
根据流程图,焙烧Ⅱ中氧化铁和
氧化铝与硫酸铵反应,发生非氧
化还原反应,
1
2
3
气体Ⅱ为氨气,反应Ⅲ中发生反应:FeS2+Fe2O3―→SO2↑+Fe3O4,据此分析。
反应Ⅲ中发生反应:FeS2+Fe2O3―→SO2↑+Fe3O4,令FeS2物质的量为a mol,Fe2O3物质的量为b mol,
1
2
3
(4)为测定Al2O3产品的纯度(Al2O3的质量分数),称量m g样品溶解于足量稀硫酸,配成100.00 mL溶液,取出20.00 mL溶液,加入c1 mol·L-1 EDTA标准溶液V1 mL,调节溶液pH并煮沸,冷却后用c2 mol·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。则制得的Al2O3的纯度为
______________________________________(用代数式表示)。
1
2
3
Al3+、Cu2+与EDTA反应的化学计量比均为1∶1,n(Al3+)+n(Cu2+)=n(EDTA),n(Al3+)=n(EDTA)-n(Cu2+)=V1×10-3 L×c1 mol·L-1
-V2×10-3 L×c2 mol·L-1,
本课结束
同课章节目录
