专题七 选择题专攻 2.物质的分离、提纯及规范描述(共42张PPT)-2024年高考化学二轮复习
文档属性
| 名称 | 专题七 选择题专攻 2.物质的分离、提纯及规范描述(共42张PPT)-2024年高考化学二轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-13 23:22:11 | ||
图片预览






文档简介
(共42张PPT)
选择题专攻
2.物质的分离、提纯及规范描述
核心精讲
01
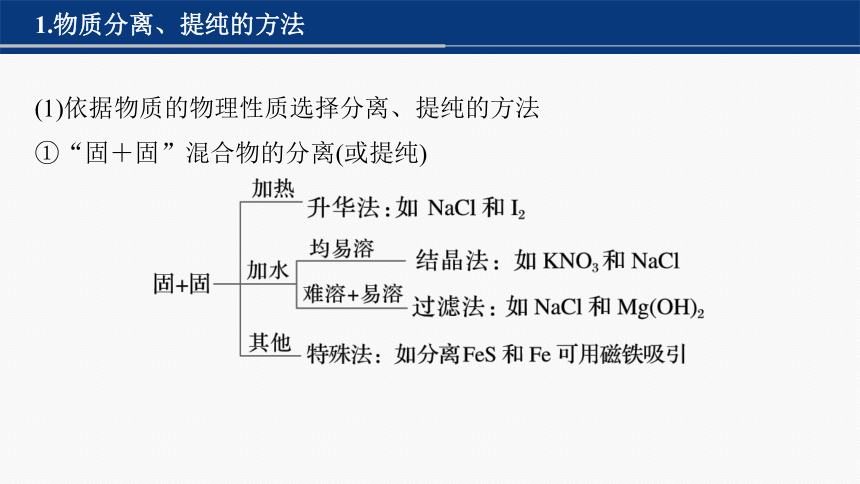
1.物质分离、提纯的方法
(1)依据物质的物理性质选择分离、提纯的方法
①“固+固”混合物的分离(或提纯)
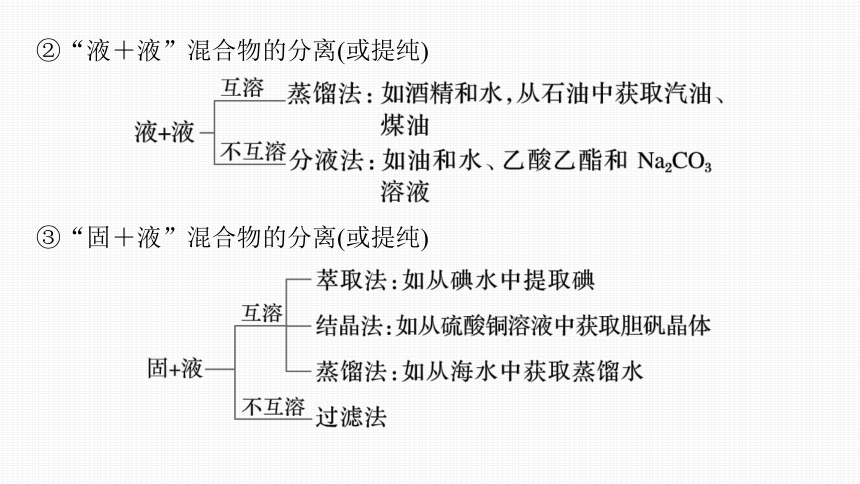
②“液+液”混合物的分离(或提纯)
③“固+液”混合物的分离(或提纯)
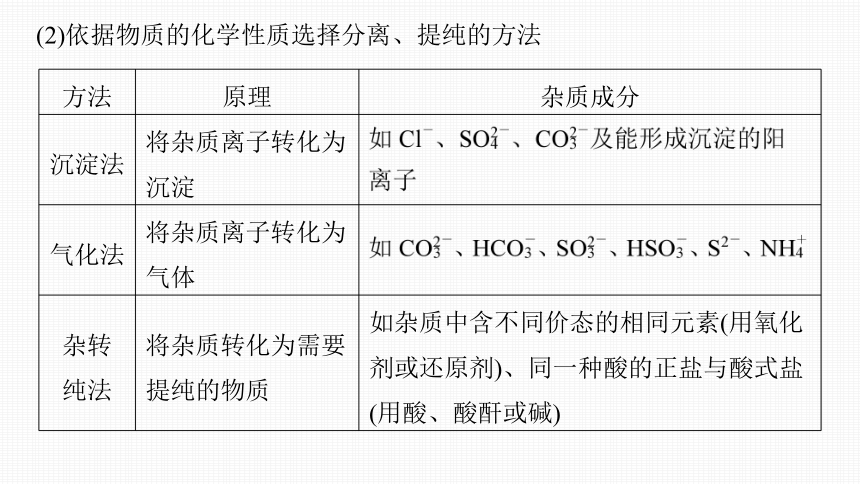
(2)依据物质的化学性质选择分离、提纯的方法
方法 原理 杂质成分
沉淀法 将杂质离子转化为沉淀
气化法 将杂质离子转化为气体
杂转 纯法 将杂质转化为需要提纯的物质 如杂质中含不同价态的相同元素(用氧化剂或还原剂)、同一种酸的正盐与酸式盐
(用酸、酸酐或碱)
方法 原理 杂质成分
氧化 还原法 用氧化剂(还原剂)除去具有还原性 (氧化性)的杂质 如用 溶液除去CO2中的SO2、用 除去N2中的O2
热分 解法 加热使不稳定的物质分解除去 如除去NaCl中的NH4Cl
酸碱 溶解法 利用物质与酸或碱溶液混合后的差异进行分离 如用过量的 溶液除去Fe2O3中的Al2O3
酸性KMnO4
灼热的铜网
NaOH
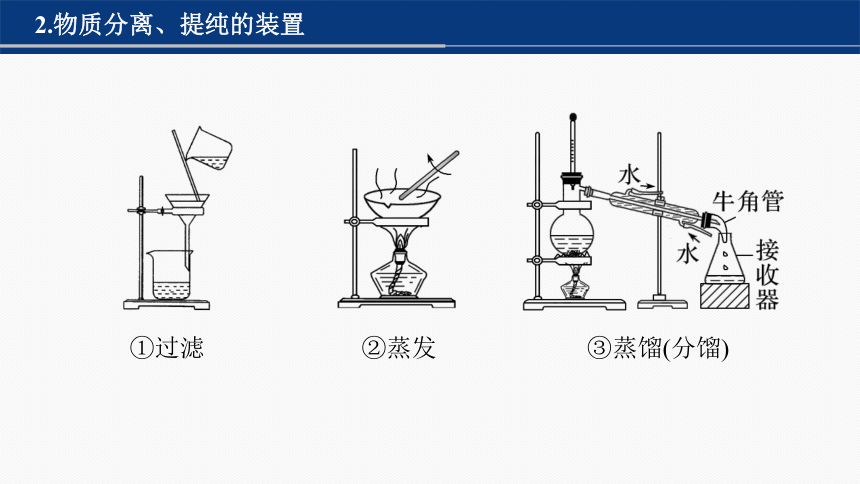
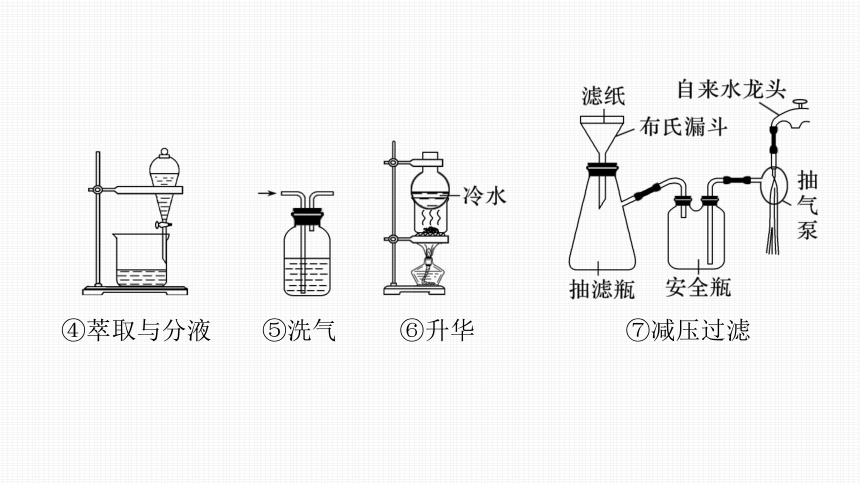
2.物质分离、提纯的装置
①过滤 ②蒸发 ③蒸馏(分馏)
④萃取与分液 ⑤洗气 ⑥升华 ⑦减压过滤
3.物质分离、提纯的精准描述
(1)粗盐的提纯
①实验室提纯粗盐的实验操作依次为取样、 、 、 、 、_____。
②若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液面高出滤纸边缘、玻璃棒靠在单层滤纸一边弄破了滤纸。
溶解
沉淀
过滤
蒸发
结晶
(2)从某物质稀溶液中结晶的实验操作
①物质溶解度受温度影响较小: 。
②物质溶解度受温度影响较大或带结晶水:
___________________________。
(3)沉淀剂是否过量的判断方法
①静置,取上层清液于一洁净的试管中,继续滴加少量 ,若无沉淀产生,则证明沉淀剂已过量,否则沉淀剂不过量。
②静置,取适量上层清液于一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,则证明沉淀剂已过量,否则沉淀剂不过量。
蒸发→结晶→过滤
蒸发浓缩→冷却结晶→过滤
沉淀剂
(4)洗涤沉淀的操作
将蒸馏水沿着玻璃棒注入 中至浸没沉淀,静置,待水 ,重复操作2~3次即可。
(5)判断沉淀是否洗净的操作
取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。
过滤器
自然流下
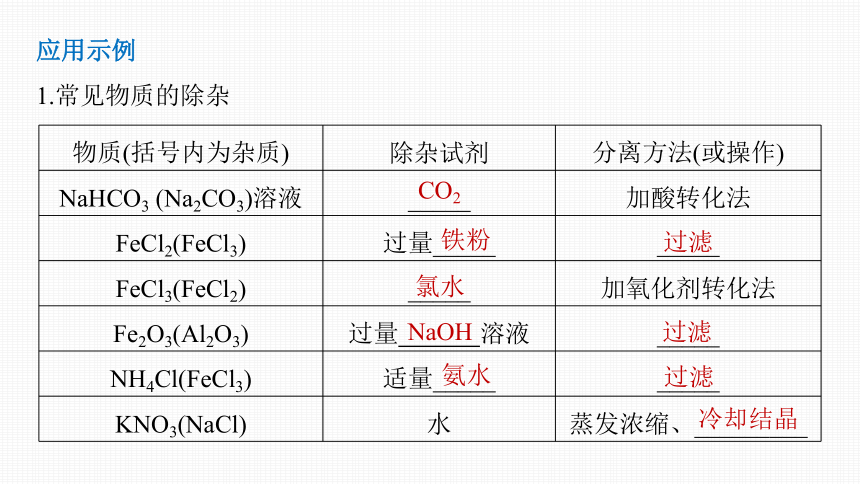
物质(括号内为杂质) 除杂试剂 分离方法(或操作)
NaHCO3 (Na2CO3)溶液 _____ 加酸转化法
FeCl2(FeCl3) 过量_____ _____
FeCl3(FeCl2) _____ 加氧化剂转化法
Fe2O3(Al2O3) 过量 溶液 _____
NH4Cl(FeCl3) 适量_____ _____
KNO3(NaCl) 水 蒸发浓缩、_________
应用示例
1.常见物质的除杂
CO2
铁粉
过滤
氯水
NaOH
过滤
氨水
过滤
冷却结晶
物质(括号内为杂质) 除杂试剂 分离方法(或操作)
NaCl(KNO3) 水 蒸发结晶、_________
炭粉(CuO) _____ _____
Fe(Al)粉 过量 溶液 _____
乙醇(水) CaO _____
乙酸乙酯(乙酸) 饱和 溶液 分液
趁热过滤
盐酸
过滤
NaOH
过滤
蒸馏
Na2CO3
混合气体(括号内为杂质) 除杂试剂 分离方法
H2(NH3) _______ 洗气
Cl2(HCl) ______________ 洗气
CO2(HCl) _________________ 洗气
CO2(SO2) _________________ 洗气
CO2(CO) __________ -
CO(CO2) ___________________ 洗气
2.常见混合气体的除杂
浓硫酸
饱和NaCl溶液
饱和NaHCO3溶液
饱和NaHCO3溶液
灼热CuO
石灰乳或NaOH溶液
混合气体(括号内为杂质) 除杂试剂 分离方法
NO(NO2) ___ 洗气
N2(O2) ___________ -
CH4(C2H4) _____ 洗气
_________________________ 水
灼热的铜网
溴水
酸性高锰酸钾溶液和石灰乳
注 常见气体除杂装置
图Ⅳ为冷凝除杂,如除去SO2中的SO3气体,CO2中的H2C2O4气体等。
真题演练
02
1.(2023·全国甲卷,9)实验室将粗盐提纯并配制0.100 0 mol·L-1的NaCl溶液。下列仪器中,本实验必须用到的有
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥ B.①④⑤⑥
C.②③⑦⑧ D.①⑤⑥⑧
√
1
2
3
4
5
6
7
粗盐提纯涉及的操作及使用的仪器有溶解(⑥烧杯和玻璃棒)、除杂、过滤(漏斗、玻璃棒、⑥烧杯)、蒸发结晶(蒸发皿、⑧酒精灯、玻璃棒)。配制0.100 0 mol·L-1的NaCl溶液的操作步骤及使用的仪器是称量(①天平)→溶解(⑥烧杯和玻璃棒)→移液(⑥烧杯、玻璃棒、⑤容量瓶)→定容(胶头滴管),故本题选D。
1
2
3
4
5
6
7
2.(2022·广东,4)实验室进行粗盐提纯时,需除去Ca2+、Mg2+和 所用试剂包括BaCl2以及
A.Na2CO3、NaOH、HCl B.Na2CO3、HCl、KOH
C.K2CO3、HNO3、NaOH D.Na2CO3、NaOH、HNO3
√
1
2
3
4
5
6
7
A B C D
3.(2021·湖北,7)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)
√
1
2
3
4
5
6
7
依题意,制备产品需要“搅拌、加热回流”,A项正确;
副产物氯化氢极易溶于氢氧化钠溶液,不能直接将尾气通入氢氧化钠溶液中,这样易发生倒吸现象,B项错误;
分液收集二氯甲烷层需用到分液漏斗,振荡时需将分液漏斗倒转过来放气,避免分液漏斗内气压过大,发生危险,C项正确;
蒸馏时需要用温度计指示温度,冷凝水从下口进、上口出,提高冷凝效率,D项正确。
1
2
3
4
5
6
7
A.过滤 B.排空气法收集CO2 C.混合浓硫酸和乙醇 D.溶液的转移
4.(2022·海南,3)下列实验操作规范的是
√
1
2
3
4
5
6
7
过滤时,漏斗下端应紧靠烧杯内壁,A操作不规范;
CO2的密度大于空气且不与空气中的成分反应,可用向上排空气法收集,B操作规范;
混合浓硫酸和乙醇时,应将浓硫酸缓慢倒入乙醇中,并用玻璃棒不断搅拌,C操作不规范;
转移溶液时,应使用玻璃棒引流,D操作不规范。
1
2
3
4
5
6
7
酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
选项 气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
5.(2020·全国卷Ⅰ,9)下列气体去除杂质的方法中,不能实现目的的是
√
1
2
3
4
5
6
7
根据文中描述,将海水倒在锅中加热煮沸,看见白色的固体出现,就得到盐,操作方法为浓缩结晶,故D正确。
6.(2020·海南,2)古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液 C.常压蒸馏 D.浓缩结晶
√
1
2
3
4
5
6
7
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
√
7.(2020·山东,8)实验室分离Fe3+和Al3+的流程如下:
1
2
3
4
5
6
7
萃取振荡时,分液漏斗下口应倾斜向上,A项错误;
分液时先将下层液体从下口放出,B项正确;
水相为无色说明黄色配离子基本被萃取出来,C项正确;
直形冷凝管有利于液体流出,故蒸馏时选用直形冷凝管,D项正确。
1
2
3
4
5
6
7
物质分离与提纯的思维模型
思维建模
考向预测
03
选项 物质(括号内为杂质) 除杂试剂 分离方法
A O2(N2) Mg粉 加热
B CO2(SO2) 饱和Na2CO3溶液 洗气
C Fe2O3(Al2O3) 盐酸 过滤
D Cl2(HCl) 饱和食盐水 洗气
√
1.下列除杂试剂和分离方法都正确的是
1
2
3
4
5
加热条件下镁和N2、O2均能反应,A错误;
二氧化碳也可以和饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液洗气,B错误;
氧化铁也可以和盐酸反应,应用NaOH溶液除杂,C错误;
氯气难溶于饱和食盐水,HCl极易溶于水,可以用饱和食盐水除去氯气中的HCl气体,D正确。
1
2
3
4
5
选项 气体(杂质) 方法
A SO2(HCl) 通过饱和亚硫酸钠溶液
B O2(NH3) 通过浓硫酸
C CO(CO2) 通过氯化钡溶液
D Cl2(H2O) 通过过氧化钠固体
2.下列气体去除杂质的方法中,能实现目的的是
√
1
2
3
4
5
SO2和HCl都可以和饱和亚硫酸钠溶液反应,故A不能实现目的;
氨气为碱性气体,能被浓硫酸吸收,氧气不能被浓硫酸吸收,故B能实现目的;
二氧化碳不能和氯化钡溶液反应,故C不能实现目的;
水能和过氧化钠固体反应生成氧气,引入新杂质,故D不能实现目的。
1
2
3
4
5
3.下列实验能达到目的的是
A.除去Na2CO3溶液中混有的NaHCO3,可用加热法
B.除去乙烷中混有的乙烯,可将混合气体依次通入酸性KMnO4溶液、浓
硫酸
C.除去CO2中混有的SO2,可通过饱和NaHCO3溶液
D.除去乙醇中混有的乙酸,可用蒸馏法
√
1
2
3
4
5
除去Na2CO3固体中的NaHCO3可用加热法,溶液不能用加热法,A项错误;
乙烯会被酸性高锰酸钾溶液氧化为二氧化碳,引入新的杂质,B项错误;
乙醇和乙酸会形成共沸物,不能直接蒸馏分离,可以先加入氧化钙与乙酸反应,再进行蒸馏分离,D项错误。
1
2
3
4
5
4.工业电解精炼铜的溶液中含有Zn2+、Cu2+等离子,实验室设计分离出Zn2+并制取胆矾的流程如下:
已知:Zn2+与NaOH的反应与Al3+类似。下列说法错误的是
A.滤液1与过量硫酸反应的离子方程式为
B.操作①和②中用到的玻璃仪器完全相同
C.系列操作②包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用无水乙醇洗涤胆矾晶体,除去表面的杂质
√
1
2
3
4
5
操作①是过滤,需要的玻璃仪器是漏斗、烧杯、玻璃棒;系列操作②包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,需要的玻璃仪器是漏斗、烧杯、玻璃棒、酒精灯,故B错误、C正确;
用无水乙醇洗涤晶体最主要的原因是除去晶体表面的水及杂质,而且不溶解晶体,同时易挥发,故D正确。
1
2
3
4
5
5.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
下列说法不正确的是
A.固体Ⅰ中含有SiO2,固体
Ⅱ中含有Fe(OH)3、Al(OH)3
B.加入石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为
C.试剂a选用盐酸,从溶液Ⅲ得到CaCl2·6H2O产品的过程中,应控制条件防止
其分解
D.若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经
蒸发浓缩、冷却结晶也可得到纯净的CaCl2·6H2O
√
1
2
3
4
5
向工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)中加足量酸,得到二氧化硅沉淀,所以固体Ⅰ中含有SiO2,溶液Ⅰ中加石灰水,控制pH,可以得到Al(OH)3、Fe(OH)3沉淀,即为固体Ⅱ,A项正确;
1
2
3
4
5
试剂a为盐酸,CaCl2·6H2O易分解,所以从溶液中获得氯化钙晶体时,要控制条件防止其分解,C项正确;
若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液中含有氯化铵杂质,D项错误。
1
2
3
4
5
本课结束
选择题专攻
2.物质的分离、提纯及规范描述
核心精讲
01
1.物质分离、提纯的方法
(1)依据物质的物理性质选择分离、提纯的方法
①“固+固”混合物的分离(或提纯)
②“液+液”混合物的分离(或提纯)
③“固+液”混合物的分离(或提纯)
(2)依据物质的化学性质选择分离、提纯的方法
方法 原理 杂质成分
沉淀法 将杂质离子转化为沉淀
气化法 将杂质离子转化为气体
杂转 纯法 将杂质转化为需要提纯的物质 如杂质中含不同价态的相同元素(用氧化剂或还原剂)、同一种酸的正盐与酸式盐
(用酸、酸酐或碱)
方法 原理 杂质成分
氧化 还原法 用氧化剂(还原剂)除去具有还原性 (氧化性)的杂质 如用 溶液除去CO2中的SO2、用 除去N2中的O2
热分 解法 加热使不稳定的物质分解除去 如除去NaCl中的NH4Cl
酸碱 溶解法 利用物质与酸或碱溶液混合后的差异进行分离 如用过量的 溶液除去Fe2O3中的Al2O3
酸性KMnO4
灼热的铜网
NaOH
2.物质分离、提纯的装置
①过滤 ②蒸发 ③蒸馏(分馏)
④萃取与分液 ⑤洗气 ⑥升华 ⑦减压过滤
3.物质分离、提纯的精准描述
(1)粗盐的提纯
①实验室提纯粗盐的实验操作依次为取样、 、 、 、 、_____。
②若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液面高出滤纸边缘、玻璃棒靠在单层滤纸一边弄破了滤纸。
溶解
沉淀
过滤
蒸发
结晶
(2)从某物质稀溶液中结晶的实验操作
①物质溶解度受温度影响较小: 。
②物质溶解度受温度影响较大或带结晶水:
___________________________。
(3)沉淀剂是否过量的判断方法
①静置,取上层清液于一洁净的试管中,继续滴加少量 ,若无沉淀产生,则证明沉淀剂已过量,否则沉淀剂不过量。
②静置,取适量上层清液于一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,则证明沉淀剂已过量,否则沉淀剂不过量。
蒸发→结晶→过滤
蒸发浓缩→冷却结晶→过滤
沉淀剂
(4)洗涤沉淀的操作
将蒸馏水沿着玻璃棒注入 中至浸没沉淀,静置,待水 ,重复操作2~3次即可。
(5)判断沉淀是否洗净的操作
取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。
过滤器
自然流下
物质(括号内为杂质) 除杂试剂 分离方法(或操作)
NaHCO3 (Na2CO3)溶液 _____ 加酸转化法
FeCl2(FeCl3) 过量_____ _____
FeCl3(FeCl2) _____ 加氧化剂转化法
Fe2O3(Al2O3) 过量 溶液 _____
NH4Cl(FeCl3) 适量_____ _____
KNO3(NaCl) 水 蒸发浓缩、_________
应用示例
1.常见物质的除杂
CO2
铁粉
过滤
氯水
NaOH
过滤
氨水
过滤
冷却结晶
物质(括号内为杂质) 除杂试剂 分离方法(或操作)
NaCl(KNO3) 水 蒸发结晶、_________
炭粉(CuO) _____ _____
Fe(Al)粉 过量 溶液 _____
乙醇(水) CaO _____
乙酸乙酯(乙酸) 饱和 溶液 分液
趁热过滤
盐酸
过滤
NaOH
过滤
蒸馏
Na2CO3
混合气体(括号内为杂质) 除杂试剂 分离方法
H2(NH3) _______ 洗气
Cl2(HCl) ______________ 洗气
CO2(HCl) _________________ 洗气
CO2(SO2) _________________ 洗气
CO2(CO) __________ -
CO(CO2) ___________________ 洗气
2.常见混合气体的除杂
浓硫酸
饱和NaCl溶液
饱和NaHCO3溶液
饱和NaHCO3溶液
灼热CuO
石灰乳或NaOH溶液
混合气体(括号内为杂质) 除杂试剂 分离方法
NO(NO2) ___ 洗气
N2(O2) ___________ -
CH4(C2H4) _____ 洗气
_________________________ 水
灼热的铜网
溴水
酸性高锰酸钾溶液和石灰乳
注 常见气体除杂装置
图Ⅳ为冷凝除杂,如除去SO2中的SO3气体,CO2中的H2C2O4气体等。
真题演练
02
1.(2023·全国甲卷,9)实验室将粗盐提纯并配制0.100 0 mol·L-1的NaCl溶液。下列仪器中,本实验必须用到的有
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥ B.①④⑤⑥
C.②③⑦⑧ D.①⑤⑥⑧
√
1
2
3
4
5
6
7
粗盐提纯涉及的操作及使用的仪器有溶解(⑥烧杯和玻璃棒)、除杂、过滤(漏斗、玻璃棒、⑥烧杯)、蒸发结晶(蒸发皿、⑧酒精灯、玻璃棒)。配制0.100 0 mol·L-1的NaCl溶液的操作步骤及使用的仪器是称量(①天平)→溶解(⑥烧杯和玻璃棒)→移液(⑥烧杯、玻璃棒、⑤容量瓶)→定容(胶头滴管),故本题选D。
1
2
3
4
5
6
7
2.(2022·广东,4)实验室进行粗盐提纯时,需除去Ca2+、Mg2+和 所用试剂包括BaCl2以及
A.Na2CO3、NaOH、HCl B.Na2CO3、HCl、KOH
C.K2CO3、HNO3、NaOH D.Na2CO3、NaOH、HNO3
√
1
2
3
4
5
6
7
A B C D
3.(2021·湖北,7)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)
√
1
2
3
4
5
6
7
依题意,制备产品需要“搅拌、加热回流”,A项正确;
副产物氯化氢极易溶于氢氧化钠溶液,不能直接将尾气通入氢氧化钠溶液中,这样易发生倒吸现象,B项错误;
分液收集二氯甲烷层需用到分液漏斗,振荡时需将分液漏斗倒转过来放气,避免分液漏斗内气压过大,发生危险,C项正确;
蒸馏时需要用温度计指示温度,冷凝水从下口进、上口出,提高冷凝效率,D项正确。
1
2
3
4
5
6
7
A.过滤 B.排空气法收集CO2 C.混合浓硫酸和乙醇 D.溶液的转移
4.(2022·海南,3)下列实验操作规范的是
√
1
2
3
4
5
6
7
过滤时,漏斗下端应紧靠烧杯内壁,A操作不规范;
CO2的密度大于空气且不与空气中的成分反应,可用向上排空气法收集,B操作规范;
混合浓硫酸和乙醇时,应将浓硫酸缓慢倒入乙醇中,并用玻璃棒不断搅拌,C操作不规范;
转移溶液时,应使用玻璃棒引流,D操作不规范。
1
2
3
4
5
6
7
酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
选项 气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
5.(2020·全国卷Ⅰ,9)下列气体去除杂质的方法中,不能实现目的的是
√
1
2
3
4
5
6
7
根据文中描述,将海水倒在锅中加热煮沸,看见白色的固体出现,就得到盐,操作方法为浓缩结晶,故D正确。
6.(2020·海南,2)古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液 C.常压蒸馏 D.浓缩结晶
√
1
2
3
4
5
6
7
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
√
7.(2020·山东,8)实验室分离Fe3+和Al3+的流程如下:
1
2
3
4
5
6
7
萃取振荡时,分液漏斗下口应倾斜向上,A项错误;
分液时先将下层液体从下口放出,B项正确;
水相为无色说明黄色配离子基本被萃取出来,C项正确;
直形冷凝管有利于液体流出,故蒸馏时选用直形冷凝管,D项正确。
1
2
3
4
5
6
7
物质分离与提纯的思维模型
思维建模
考向预测
03
选项 物质(括号内为杂质) 除杂试剂 分离方法
A O2(N2) Mg粉 加热
B CO2(SO2) 饱和Na2CO3溶液 洗气
C Fe2O3(Al2O3) 盐酸 过滤
D Cl2(HCl) 饱和食盐水 洗气
√
1.下列除杂试剂和分离方法都正确的是
1
2
3
4
5
加热条件下镁和N2、O2均能反应,A错误;
二氧化碳也可以和饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液洗气,B错误;
氧化铁也可以和盐酸反应,应用NaOH溶液除杂,C错误;
氯气难溶于饱和食盐水,HCl极易溶于水,可以用饱和食盐水除去氯气中的HCl气体,D正确。
1
2
3
4
5
选项 气体(杂质) 方法
A SO2(HCl) 通过饱和亚硫酸钠溶液
B O2(NH3) 通过浓硫酸
C CO(CO2) 通过氯化钡溶液
D Cl2(H2O) 通过过氧化钠固体
2.下列气体去除杂质的方法中,能实现目的的是
√
1
2
3
4
5
SO2和HCl都可以和饱和亚硫酸钠溶液反应,故A不能实现目的;
氨气为碱性气体,能被浓硫酸吸收,氧气不能被浓硫酸吸收,故B能实现目的;
二氧化碳不能和氯化钡溶液反应,故C不能实现目的;
水能和过氧化钠固体反应生成氧气,引入新杂质,故D不能实现目的。
1
2
3
4
5
3.下列实验能达到目的的是
A.除去Na2CO3溶液中混有的NaHCO3,可用加热法
B.除去乙烷中混有的乙烯,可将混合气体依次通入酸性KMnO4溶液、浓
硫酸
C.除去CO2中混有的SO2,可通过饱和NaHCO3溶液
D.除去乙醇中混有的乙酸,可用蒸馏法
√
1
2
3
4
5
除去Na2CO3固体中的NaHCO3可用加热法,溶液不能用加热法,A项错误;
乙烯会被酸性高锰酸钾溶液氧化为二氧化碳,引入新的杂质,B项错误;
乙醇和乙酸会形成共沸物,不能直接蒸馏分离,可以先加入氧化钙与乙酸反应,再进行蒸馏分离,D项错误。
1
2
3
4
5
4.工业电解精炼铜的溶液中含有Zn2+、Cu2+等离子,实验室设计分离出Zn2+并制取胆矾的流程如下:
已知:Zn2+与NaOH的反应与Al3+类似。下列说法错误的是
A.滤液1与过量硫酸反应的离子方程式为
B.操作①和②中用到的玻璃仪器完全相同
C.系列操作②包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用无水乙醇洗涤胆矾晶体,除去表面的杂质
√
1
2
3
4
5
操作①是过滤,需要的玻璃仪器是漏斗、烧杯、玻璃棒;系列操作②包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥,需要的玻璃仪器是漏斗、烧杯、玻璃棒、酒精灯,故B错误、C正确;
用无水乙醇洗涤晶体最主要的原因是除去晶体表面的水及杂质,而且不溶解晶体,同时易挥发,故D正确。
1
2
3
4
5
5.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
下列说法不正确的是
A.固体Ⅰ中含有SiO2,固体
Ⅱ中含有Fe(OH)3、Al(OH)3
B.加入石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为
C.试剂a选用盐酸,从溶液Ⅲ得到CaCl2·6H2O产品的过程中,应控制条件防止
其分解
D.若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经
蒸发浓缩、冷却结晶也可得到纯净的CaCl2·6H2O
√
1
2
3
4
5
向工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)中加足量酸,得到二氧化硅沉淀,所以固体Ⅰ中含有SiO2,溶液Ⅰ中加石灰水,控制pH,可以得到Al(OH)3、Fe(OH)3沉淀,即为固体Ⅱ,A项正确;
1
2
3
4
5
试剂a为盐酸,CaCl2·6H2O易分解,所以从溶液中获得氯化钙晶体时,要控制条件防止其分解,C项正确;
若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液中含有氯化铵杂质,D项错误。
1
2
3
4
5
本课结束
同课章节目录
