第五单元化学方程式作业设计-2023-2024学年九年级化学人教版上册
文档属性
| 名称 | 第五单元化学方程式作业设计-2023-2024学年九年级化学人教版上册 |  | |
| 格式 | docx | ||
| 文件大小 | 793.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-14 22:39:11 | ||
图片预览


文档简介
第五单元化学方程式作业整体设计
目 录
单元信息 2
单元内容分析 2
单元目标分析 4
单元整体设计思路 5
课题 1 质量守恒定律 (第 1 课时) 6
课题 1 质量守恒定律 (第 2 课时) 12
课题 2 如何正确书写化学方程式 18
课题 3 利用化学方程式进行简单计算 23
单元作业 29
附往届学生思维导图 34
第五单元 质量守恒定律 单元作业整体设计
1
(
一、单元信息
)
基本 信息 学科 年级 学期 教材版本 单元名称
化学 九年级 第一学期 人教版 第五单元 化学方程式
单元 组织方式 自然单元 重组单元
课时信息 序号 课时名称 对应教材内容
1 质量守恒定律 5.1 质量守恒定律
2 化学方程式 5.1 质量守恒定律
3 如何正确书写化学方程式 5.2 如何正确书写化学方程式
4 利用化学方程式进行简单计算 5.3 利用化学方程式进行简单计算
5 单元作业
(
二、单元内容分
析
)
(一) 教材分析
本单元是初中化学重要的启蒙教学内容,融合了结构与原理、概念和定律、 化学语言、科学探究、定量分析等内容。本单元设置了 3 个课题,课题 1 质量守 恒定律是义务教育阶段学生开始从定量的角度认识和研究化学反应,教材通过一 系列的科学实验总结出质量守恒定律的内容,是学生书写化学方程式和进行化学 计算的理论基础,也是本单元的基础。教材以质量守恒定律和化学式为依托,将 学生已学过的化学反应用化学方程式进行科学、定量的描述。课题 2 介绍了书写 化学方程式的原则、方法和步骤,是对课题 1 中化学方程式的深入介绍,也是对第 三单元“物质构成的奥秘”、第四单元“化学式与化合价”等知识进一步的延伸 和应用,有助于学生对已学过的化学反应和化学用语进行复习和巩固,是本单元 的中心。课题 3 根据化学方程式的简单计算是从反应物、生成物的质量关系来研 究物质的变化,需要以正确书写化学方程式为基础,是化学方程式在化学计算中 的具体应用。同时也是学生应用化学知识解决实际问题的初步尝试,有利于学生 进一步了解化学在实际生产、生活中的应用。
第五单元 质量守恒定律 单元作业整体设计
2
(
基
本原理和概念
) (
利
用化学方程式的计算
) (
应
用定律
) (
课
题
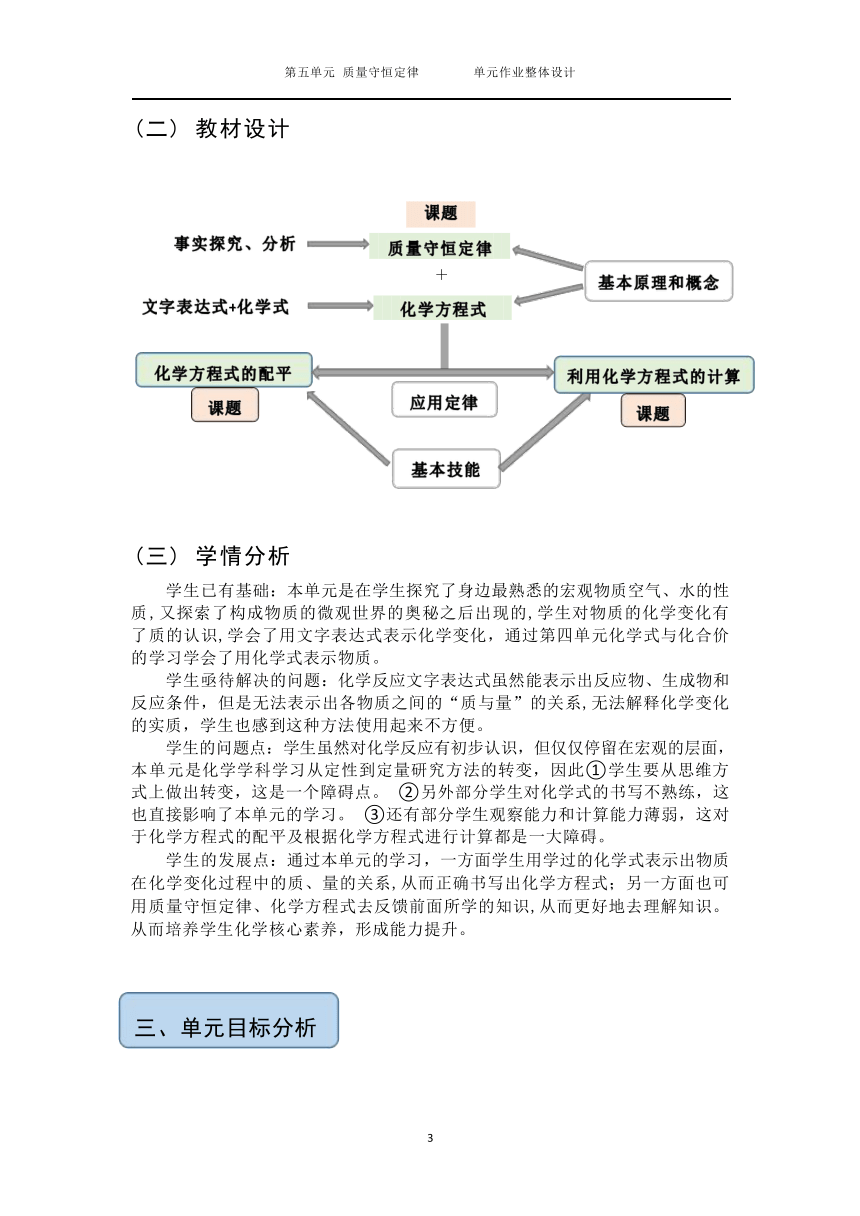
)(二) 教材设计
课题
事实探究、分析 质量守恒定律
+
文字表达式+化学式 化学方程式
(
化
学方程式的配平
)
(
课
题
)
(
基
本技能
)
(三) 学情分析
学生已有基础:本单元是在学生探究了身边最熟悉的宏观物质空气、水的性 质,又探索了构成物质的微观世界的奥秘之后出现的,学生对物质的化学变化有 了质的认识,学会了用文字表达式表示化学变化,通过第四单元化学式与化合价 的学习学会了用化学式表示物质。
学生亟待解决的问题:化学反应文字表达式虽然能表示出反应物、生成物和 反应条件,但是无法表示出各物质之间的“质与量”的关系,无法解释化学变化 的实质,学生也感到这种方法使用起来不方便。
学生的问题点:学生虽然对化学反应有初步认识,但仅仅停留在宏观的层面, 本单元是化学学科学习从定性到定量研究方法的转变,因此①学生要从思维方 式上做出转变,这是一个障碍点。 ②另外部分学生对化学式的书写不熟练,这 也直接影响了本单元的学习。 ③还有部分学生观察能力和计算能力薄弱,这对 于化学方程式的配平及根据化学方程式进行计算都是一大障碍。
学生的发展点:通过本单元的学习,一方面学生用学过的化学式表示出物质 在化学变化过程中的质、量的关系,从而正确书写出化学方程式;另一方面也可 用质量守恒定律、化学方程式去反馈前面所学的知识,从而更好地去理解知识。 从而培养学生化学核心素养,形成能力提升。
(
三
、单元目标分析
)
第五单元 质量守恒定律 单元作业整体设计
3
(
课题
1 质量守恒定律
第 1 课时质量守恒
定
) (
质 量 守 恒 定
律
) (
课题
1 质量守恒定律
第
2 课时化学方程式
) (
课
题 2 如何正确书写
化学方程
式
) (
课题
3 利用化学方程
式进行简单计
算
)
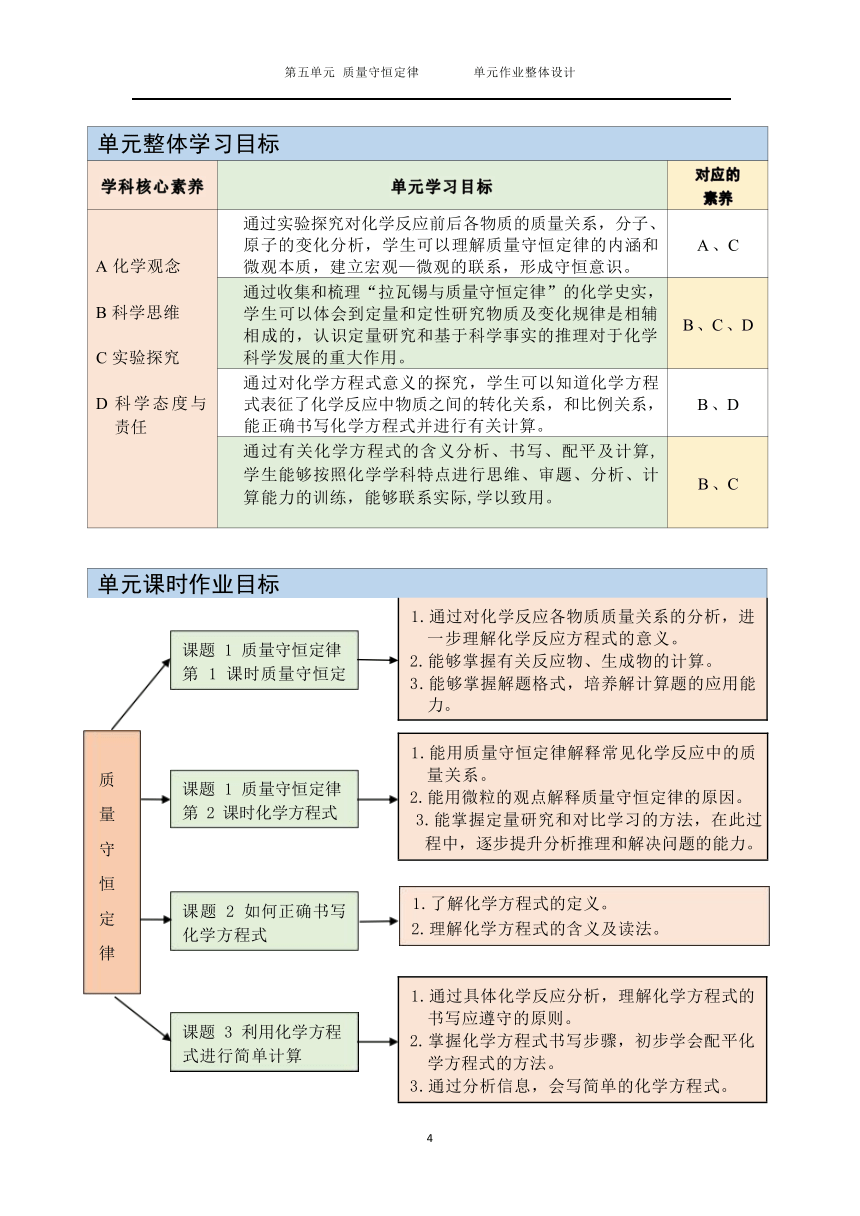
单元整体学习目标
学科核心素养 单元学习目标 对应的 素养
A 化学观念 B 科学思维 C 实验探究 D 科学态度与 责任 通过实验探究对化学反应前后各物质的质量关系,分子、 原子的变化分析,学生可以理解质量守恒定律的内涵和 微观本质,建立宏观—微观的联系,形成守恒意识。 A 、C
通过收集和梳理“拉瓦锡与质量守恒定律”的化学史实, 学生可以体会到定量和定性研究物质及变化规律是相辅 相成的,认识定量研究和基于科学事实的推理对于化学 科学发展的重大作用。 B 、C 、D
通过对化学方程式意义的探究,学生可以知道化学方程 式表征了化学反应中物质之间的转化关系,和比例关系, 能正确书写化学方程式并进行有关计算。 B 、D
通过有关化学方程式的含义分析、书写、配平及计算, 学生能够按照化学学科特点进行思维、审题、分析、计 算能力的训练,能够联系实际,学以致用。 B 、C
单元课时作业目标
1.通过对化学反应各物质质量关系的分析,进 一步理解化学反应方程式的意义。 2.能够掌握有关反应物、生成物的计算。 3.能够掌握解题格式,培养解计算题的应用能 力。
1.能用质量守恒定律解释常见化学反应中的质 量关系。 2.能用微粒的观点解释质量守恒定律的原因。 3.能掌握定量研究和对比学习的方法,在此过 程中,逐步提升分析推理和解决问题的能力。
(
1
.了解化学方程式的定义。
2.理解化学方程式的含义及读法
。
)
1.通过具体化学反应分析,理解化学方程式的 书写应遵守的原则。 2.掌握化学方程式书写步骤,初步学会配平化 学方程式的方法。 3.通过分析信息,会写简单的化学方程式。
第五单元 质量守恒定律 单元作业整体设计
4
(
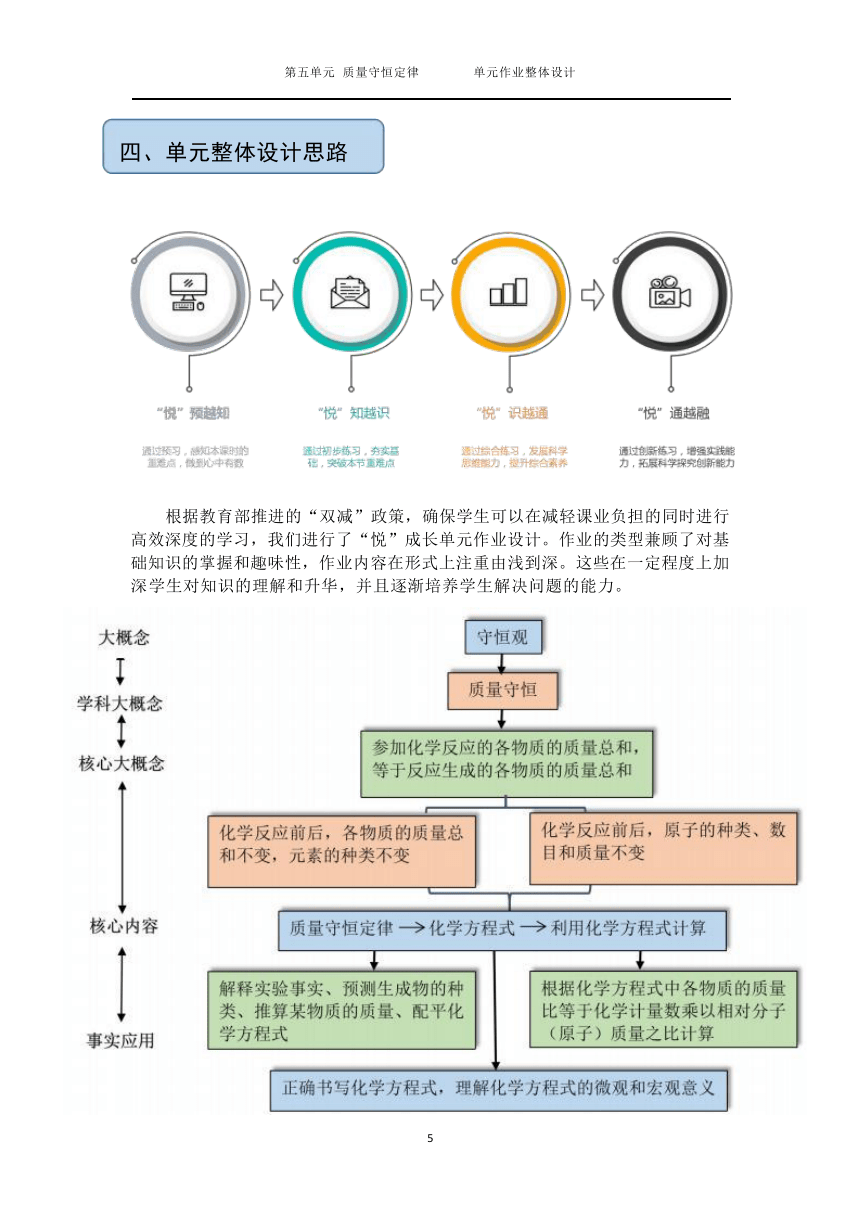
四、单元整体设计思路
)
根据教育部推进的“双减”政策,确保学生可以在减轻课业负担的同时进行 高效深度的学习,我们进行了“悦”成长单元作业设计。作业的类型兼顾了对基 础知识的掌握和趣味性,作业内容在形式上注重由浅到深。这些在一定程度上加 深学生对知识的理解和升华,并且逐渐培养学生解决问题的能力。
第五单元 质量守恒定律 单元作业整体设计
5
(
五
、单元课时作业
)
课题 1 质量守恒定律
第 1 课时 质量守恒定律
在化学变化中,物质的“量”如何变化呢?早在 17 世纪初,人们就利用化学实验开始了 相关的求证,最终,一个基于“量”的秘密---质量守恒定律被确认,这是自然界中重要的规 律之一。试一试,完成作业,了解自己对质量守恒定律又多了几分理解?
学生信息
学校 姓名 班级 学号
作业信息
学习内容 质量守恒定律 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
1. 质量守恒定律的内容: 化学反应的各物质 的 ,等于反应后生成的各物质的 。 2.微观解释质量守恒的原因:化学反应前后, 没 有改变, 没有增减, 也没有改 变 (原子的“三不变”) 。 温馨提示: 1.质量守恒定律只适用于化学变化,不适用于物理变化; 2.没有参加反应的物质质量及不是反应生成的物质质量不能计 入“总和”中; 3.要考虑空气中的物质是否参加反应,或物质 (如气体) 有无遗 漏; 4.质量守恒:质量守恒定律只是研究化学反应的质量变化, 热量、体积变化等不在研究范围之内。 通过学生自主预 习,初步了解质 量守恒定律的内 容 以 及 微 观 解 释。 通过温馨提示, 进一步加深对知 识的理解。
1.在化学变化中,下列说法正确的是 ①原子的种类、元素的种类均不变 ( ) 通过练习,巩固 所学知识,同时 将理论与实际相 结合,使学生学
②原子的数目、分子的数目均不变 ③原子的质量、元素的质量、物质的总质量均不变
第五单元 质量守恒定律 单元作业整体设计
6
第五单元 质量守恒定律 单元作业整体设计
④分子的种类、物质的种类均不变 A. ①② B. ①③ C. ③④ D. ②④ 2.下列现象不能用质量守恒定律来解释的是 ( ) A.高锰酸钾受热后固体质量减少 B. 10g 冰融化后变成 10g 水 C.蜡烛燃烧后,变得越来越短 D.细铁丝在氧气中燃烧,其固体质量增加 (
【
思路引导】
根据质量守恒定律,在化学反应中参加反应前各物质的质
量
总和等于反应后生成各物质的质量总和,掌握化学变化和
物
理
变化的判别是解题的关键。
) 3.将 25gA 与 15gB 在一定条件下恰好完全反应,生成 20gC 和一 定量的 D ,则 A 和 D 的质量比为 。 4.根据质量守恒定律解释以下现象: (1)氯酸钾受热分解后,剩余的固体质量减少。 (2)镁在空气中燃烧,质量增加。 会用理论知识解 答实际问题。 培养学生综合运 用知识解决问题 的能力。 培养学生对化学 理论内涵挖掘的 能力。
5.在密闭容器中有以下四种物质,它们在一定条件下充分反应, 已知反应前后的质量如下表所示, 初步培养学生定 量分析观点,引 导学生层层递进 的对数据进行分 析,最终得出科 学结论。
物质甲乙丙丁反应前质量14362011反应后质量342016待测
(
(
)
)下列说法正确的是 A.该反应是分解反应 B. 甲一定是氧化物 C.待测值是 0 D.参加反应的乙、丙质量之比是 4:1
7
第五单元 质量守恒定律 单元作业整体设计
(
【
思路引导】
先
根据质量守恒定律反应前后总质量不变,求出
X
,再根据
表
格
数据,比较反应前后物质质量,质量增加的为反应物,
质量减少为生成物
。
) 6.下图形象地表示了某反应前后分子及数目的变化,下列关于反 (
应前、后的说法正
确的是
)( ) A.反应前后原子、分子的数目不变 B.参加反应的分子个数比为 1 :1 C.该反应是化合反应 D.反应物和生成物都是一种单质和一种化合物 7.2022 年 4 月 26 日“探索二号”科考船搭载着“深海勇士号” 返航。“深海勇士号”是中国第二台深海载人潜水器。潜水器 中可用“氧烛”来快速提供氧气。氧烛中含有氯酸钠(NaClO3 )、 金属粉末 (Al 、Mg 、Fe 等) 和催化剂。 (1) 氧烛放出的氧气来自于上述物质中的 ,判断的依据 是 。 (2) 氧烛中的金属粉末均能与稀盐酸反应,其中铁与稀盐酸反 应的化学方程式为:Fe + 2HCl = X + H2 ↑ ,则 X 的化学式为 。 【思路引导】 根据反应前后元素的种类不变,原子的种类和数目不变。 通过练习,使学 生能灵活运用质 量守恒定律解决 一些实际问题, 加深对质量守恒 定律的理解。 深化学以致用的 原则,培养学生 应用理论知识解 决问题的能力, 同时检测学生对 本节课知识的掌 握程度。
8.某化学兴趣小组为探究质量守恒定律,在老师的指导下进行了 如下两组实验: (1) 图甲中反应后天平的指针 (“偏左”“偏右”“不变”), 原因是 ,该反应是否遵守质量 守恒定律? 。 (2) 图乙中锥形瓶底放层细沙的目的是 ;
8
第五单元 质量守恒定律 单元作业整体设计
玻璃管上方系一瘪气球的目的是 。 白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡, 小组同学马上有人提出该反应不遵守质量守恒定律。你是否 同意该同学的看法? , 理由是 。
9.实验设计:某实验小组为验证质量守恒定律,设计了如图所示小 实验。 请同学们根据以上小实验,尝试设计实验,观察现象,解释原 因 (分组完成) 。 拓展学生对质量 守 恒 定 律 的 理 解,提升对所学 知 识 的 应 用能 力。培养学生设 计实验的能力以 及合作意识,激 发学生实验探究 的兴趣。
评价内容 A 优秀 B 合格 C 不合格
会设计 能设计出完整、正确的 实验方案,方案可行且 科学。 基本能设计出可行的实 验方案,但表述不完整。 设计的实验方案不可行 或不会设计实验方案。
会实验 能按照设计的方案选择 合适的试剂和用品进行 实验,现象明显,结论 正确。 能基本按照设计的方案 选择合适的试剂和用品 进行实验,现象较明显, 结论基本正确。 不会选择合适的试剂和 用品完成实验。
9
第五单元 质量守恒定律 单元作业整体设计
会合作 能与小组成员积极合 作、交流,发言积极。 能参与小组成员之间的 交流、合作,但发言不积 极。 能参与小组活动,但不交 流、不发言。
会展示 根据自己设计的实验方 案,展示实验装置,实 验现象和结论表述完 整、正确。 根据自己设计的实验方 案,展示实验装置,实验 现象和结论表述不太完 整、正确。 不能展示实验装置,不会 表述实验现象和结论。
学生自我评价 与反思 (等级+评语)
小组评价 (等级+评语)
教师评价 (等级+评语)
参考答案 课题 1 质量守恒定律 (第 1 课时) 【 “悦”预越知】 1.参加 质量总和 质量总和 2.原子的种类 原子的数目 原子的质量 【 “悦”知越识】 1.B 2.B 3.5:4 4. (1) 因为氯酸钾受热分解后的产物是氯化钾和氧气,根据质量守恒定律,氯酸钾的质量等于 氯化钾和氧气的质量之和,反应中氧气逸出,所以剩余的质量比原反应物的质量小。 (2) 因为镁条在空气中燃烧,是镁和空气中的氧气发生反应生成氧化镁的过程,根据质量 守恒定律,氧化镁的质量=镁条的质量+参与反应的氧气质量.所以生成的白色粉末的 质量比原来镁条的质量增加。 【 “悦”识越通】 6. D 7. C 8.氯酸钠 (NaClO3 ) 化学反应前后元素种类不变 FeCl2 9. (1) 偏右 反应生成的二氧化碳气体逸散在空气中 符合 (2) 防止白磷燃烧放热使锥形瓶底部受热不均匀而炸裂 缓冲作用,防止橡皮塞冲出 不 同意 白磷燃烧放热,气球膨胀所受空气浮力会明显增加导致天平不平衡。
10
第五单元 质量守恒定律 单元作业整体设计
课时作业评价反馈
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①知道质量守恒定律的内容并理解其内涵。 ②能从微观角度解释质量守恒定律,理解化学反应中的定量关系。 ③能用质量守恒定律解释一些现象。 ④能运用质量守恒定律解决一些实际问题。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
“悦”通越融
辅 导 与 建 议
作业 订正
11
第 2 课时 化学方程式
怎样用规范通用科学的化学用语来准确的描述和诠释化学变化呢?从元素符号到化学方 程式,化学用语羽翼日丰。通过本节的学习,你就能真正读懂化学方程式承载的丰富信息,完 成作业,了解自己的学习达成度。
学生信息
学校 姓名 班级 学号
作业信息
学习内容 化学方程式 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
1.定义:用 表示的式子叫做化学方程式。 2.意义: 通过学生自主预 习,初步了解什么 是化学方程式以 及化学方程式的 意义和读法,提 高学生独立思考 的能力。
表示意义 实例:2H2 + O2 2H2O
质 的 方 面 表示 、 和 。 反应物是 和氧气 ,生成物 是 ,条件是 。
量 的 方 面 表示各物质之间的 之比。 2H2 + O2 2H2O 4 ∶ ∶
表示各物质之间粒 子的 之比。(化 学计量数之比) 2H2 + O2 2H2O 2 ∶ ∶
3.读法 (以 2H2 + O2 2H2O 为例) : (1) 质的方面: 和 在 的条件下反应 生成 。 (2) 量的方面: ①宏观:在点燃条件下,每 份质量的氢气和 份 质量的氧气完全反应,生成 份质量的水。 ②微观:在点燃条件下,每 个氢分子和 个氧分子
第五单元 质量守恒定律 单元作业整体设计
12
第五单元 质量守恒定律 单元作业整体设计
反应,生成 个水分子。 温馨提示: 化学方程式中,“+”“= ”不是简单的数值累加,一定不能 读作“加”和“等于”。
1.化学方程式是学习化学的重要工具之一。根据化学方程式不能 获取的信息是 ( ) A.反应物和生成物的状态 B.反应发生的条件 C.反应中各物质的质量关系 D.化学反应的快慢 2.对化学方程式“4P+5O22P2O5 ”的读法错误的是 ( ) A.磷与氧气在点燃的条件下反应生成五氧化二磷 B.4 个磷与 5 个氧气在点燃的条件下反应生成 1 个五氧化二磷 C.每 124份质量的磷与 160份质量的氧气在点燃的条件下反应 生成 284 份质量的五氧化二磷 D.每 4 个磷原子与 5 个氧分子在点燃的条件下反应生成 2 个 五氧化二磷分子 (
【
思路引导】根据化学方程式的读法和意义解答。
) 初步培养学生从 宏观和微观的角 度去理解化学方 程式的能力,培 养学生思维的有 序性和严密性。 通过练习, 比较反 思化学方程式所 表达的信息,初 步了解化学方程 式的意义。 通过有关训练, 巩固本节课的重 难点知识,加深 学生对知识的理 解和应用。
3.如图是四位同学正在讨论某一化学方程式表示的意义,他们描
述的化学方程式是 ( )
A.2Mg+O2==2MgO B. H2+Cl2==2HCl C. N2+3H2高压2NH3 D. 2CO+O2==2CO2
4.质量守恒定律是帮助我们学习认识化学反应实质的重要理论, 在化学反应 aA+bB==cC+dD 中,下列说法正确的是 ( ) A.反应物 A 和 B 的质量比一定等于生成物 C 和 D 的质量比 B.反应物 A 和 B 的相对分子质量之和一定等于生成物 C 和 D 的相对分子质量之和 C.化学计量数 a 与 b 之和一定等于 c 与 d 之和 D.若取xgA 和xgB 反应,生成 C 和 D 的质量总和不一定等 于 2xg
13
第五单元 质量守恒定律 单元作业整体设计
5.为及时发现煤气是否泄漏,常在煤气中加入少量有特殊气味的 乙硫醇 (C2H5 SH) ,乙硫醇燃烧的化学方程式为 2C2H5 SH+9O24CO2+2X+6H2O 。下列关于 X 的说法正确 的是 ( ) A. X 由碳、硫、氧三种元素组成 B. X 中硫元素和氧元素的质量比为 1:2 C. X 中硫元素的质量分数为 50% D. X 中含有氧分子 (
【
思
路引导】根据反应前后元素的种类不变、元素的质量不变。
) 6.下图表示两种气体发生化学反应的微观示意图,其中相同的球 代表同种原子,下列说法正确的是 ( ) A. 反应物中包含两种化合物 B. 发生反应的分子个数比为 1:1 C. 该反应有三种新物质生成 D .反应前后原子的种类不变 (
【
思路引导】
根
据
反应的微观示意图及微粒的变化,正确判断变化中的物
质构成,判断参加反应的两种分子的个数比
。
) 7.一定质量的某化合物完全燃烧,需要 3.2 g 氧气,生成 4.4 g 二氧化碳和 1.8 g 水。下列判断错误的是 ( ) A .该化合物的质量为 3.0 g B .该化合物一定含有碳、氢、氧三种元素 C .该化合物中碳、氢、氧的原子个数比为 2 ∶4 ∶ 1 D .该化合物中碳元素的质量分数是40% (
【
思路引导】
先
由
质量守恒定律,求出该化合物的质量;再根据反应前后
元素的质量不变,求出水中氢元素的质量和二氧化碳中碳
元
素的质量,判断化合物中是否含氧元素
。
) 通 过 练 习 , 引 导 学生对化学反应 的 认 识 — — 由 “质” 到“量” 的过渡,也为之 后化学方程式的 书写和计算做好 准备。 深化学以致用的 原则,培养学生 分析能力和计算 能力,培养学生 应用所学理论知 识解决问题的能 力。 通过比较加深对 知识的理解和应 用,训练学生的 发散思维能力。
8.观察、比较与归纳是学习化学的重要方法,对于以下三个化学 方程式:
2Mg+O22MgO 2H2+O22H2O
14
第五单元 质量守恒定律 单元作业整体设计
2CO+O22CO2 (1) 通过比较,发现它们有许多共同点,请你写出其中的三点: ① ; ② ; ③ 。 (2) 以上化学方程式也有许多不同之处,请你写出一点其中一 个与另外两个的不同之处: 。 (3) 某同学课外学习 Cu2(OH)2CO3====2CuO+H2O+CO2 ↑ , 他发现这个反应和上述三个反应也有相似之处,其相似之处 是 。 【思路引导】 可以根据反应类型、反应条件、反应物和生成物的类型进行 正确的分析。 9.化学在科技、生活和社会发展中都起到了重要的作用。 (1) 2021 年 3 月全国两会期间,“碳中和”成为热词。我国科 学家研制了全球首套捕集二氧化碳合成甲醇 (CH3OH) 的 装置,有利于实现“碳中和” 。甲醇分子中 C 、H 、O 元素 的质量比为: 。 (2) 2021 年 5 月 22 日,“祝融号”火星车成功登陆火星表面, 该车的车身使用了新型铝基碳化硅复合材料。碳化硅能与 熔融的氢氧化钠发生反应 SiC+2NaOH+2O2=X+CO2+H2O , 其中 X 的化学式为 ,SiC 中碳元素的化合价 为 。 课外延伸阅读:宫崎骏的魔幻星 http://www./u51/v_MTQxNjA5NzI4.html 通 过 练 习 , 让 学 生新旧知识的联 系体现学生的认 知过程。
参考答案 课题 1 质量守恒定律 (第 2 课时) 【 “悦”预越知】 1. 反应物 生成物 反应条件 2. 氢气 水 点燃 32 36 数目 1 2 3. (1) 氢气 氧气 点燃 水 (2) 4 32 36 (3) 2 1 2
15
第五单元 质量守恒定律 单元作业整体设计
【 “悦”知越识】 1.D 2.B 3.B 4.D 【 “悦”识越通】 5.C 6.D 7.C 8. (1) ①都是化合反应; ②反应条件都是点燃; ③都是放热反应; ④生成物都是氧化物。 (2) 生成物都是氧化物。 (
(
2)
Na
2
SiO
3
,
4
)9. (1) 3:1:4
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①知道化学方程式的定义、表示的意义,了解化学方程式的读法。 ②能求出化学方程式中各物质的质量比。 ③通过对具体化学反应的分析,能从宏观和微观的角度去理解化学方程式。 ④能利用质量守恒定律和化学方程式的意义解决一些实际问题。
你有什么收获或疑问?还想探究什么问题?
16
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
辅 导 与 建 议
作业 订正
第五单元 质量守恒定律 单元作业整体设计
17
课题 2 如何正确书写化学方程式
怎样正确书写化学方程式?配平的方法你掌握了几种? 完成下面作业,试试你的达成度吧?
学生信息
学校 姓名 班级 学号
作业信息
学习内容 如何正确书写化学方程式 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
一、化学方程式的书写原则 1.必须以 为基础,不能凭空臆造不存在的化学反 应。 2.要遵守 定律,等号两边各原子的 和 必须相等。 二、化学方程式的书写 1.化学方程式的配平 在化学式前配上适当的 ,使得每一种元素的原子 数目 。 注意:配平时,只能改动化学式前的化学计量数,不能改动化 学式中元素符号右下角的下标数字。 2.书写步骤 写 ——根据实验事实,在“”的左右两边写出反应物和 生成物的 。 配 ——配平化学方程式,即调整化学式前的化学计量数, 使每种元素的原子 相等,使化学反应方程 式遵守质量守恒定律。 注 — — 注 明化 学反应 发 生 的 , 标 出 生成物 的 ,再把“ ”改为“=”。 查 ——检查化学方程式的书写是否正确。 通过预习,学生可 初步了解本课题 内容的重难点,做 到有的放矢。
第五单元 质量守恒定律 单元作业整体设计
18
第五单元 质量守恒定律 单元作业整体设计
3. 符号使用及注意事项 (1) 用“ Δ ”表示 , (2) “无气生气标气升,无固生固标固降。 ”——若反应物中 没有气体,生成物中的气体物质化学式的右边标 , 溶液中的反应,若反应物中没有固体,生成物中的固体物 质化学式的右边标 。 (3) 要正确区分反应条件和反应现象的不同,如“点燃”和“燃 烧” ,“通电”和“电解”等。
1. (1) 学完化学方程式后,化学小组的同学随机抽取班级同学 书写的化学方程式进行诊断,请帮他们完成研究报告: (1) 通过对化学 方程式书写细节 的再现,考察学生 对正确书写化学 方程式的原则与 步骤的认知。 (2) 通过自主将 所学过的化学反 应用化学方程式 表示,巩固了化学 方程式书写的原 则和一般步骤。 通过配平化学方 程式,进一步巩固 对观察法、最小公 倍数法等常用配 平方法的掌握,培 养学生的守恒观, 提升学生变化观 念和守恒思想的 核心素养。
(
①
C
+
O
2
③
H
2
O
) (
CO
2
H
2
↑+O
2
↑
)②P+O2 PO2 ④2KClO3 2KCl+3O2 (i) 不符合客观事实的是 ,正确书写是 。 (ii) 反应条件错误的是 ,正确书写是 。 (iii) “ ↑ ”漏标的是 ,正确书写是 。 (iv ) 违背质量守恒定律的是 ,正确书写是 。 (2) 请按正确的书写步骤,将所学过的化学反应用化学方程式 表示: (写一个即可) 2.X 是一种黄绿色到橙黄色的物质,是国际上公认为安全、无 毒的绿色饮用水消毒剂。其制备反应为:2KClO3 + SO2 = 2X + K2SO4 ,关于此反应的说法不正确的是 ( ) A.X 的化学式为 ClO2 B.反应前后元素种类发生变化 C.反应前后氧元素化合价发生变化 D.反应前后物质的总质量不发生变化 (
【思路引导】 由质量守恒的原因可推测该化合物的化学式
。
) 3.按要求完成下列化学方程式: (1)将下列化学方程式补充完整 NaHCO3 Na2CO3+ CO2 ↑+ H2O Al+ H2 SO4= Al2(SO4)3+ H2 ↑ (2) 写一个分解反应,生成物中既有单质又有化合物 。 【思路引导】 可根据反应前后原子的种类、数目不变,结合配平方法配平。 4.小青和同学们一起完成了氢气燃烧的实验,并绘制了该反应的
19
第五单元 质量守恒定律 单元作业整体设计
微观示意图 (如下图所示) 。请你和她一起讨论下列问题: (1) 图中方框内表示纯净物的是 (填字母) 。 (2) 图中①的微观实质是 , ②的微观实质是 。 (2) 写出图中相关反应的化学方程式: 。 (
【
思路引导】
通
过
微观示意图所给的信息得出化学反应的本质和化学方程
式的意义。
) 通过分析微粒模 型,在能准确表示 化学式的基础上, 考查了物质的分 类,运用质量守恒 定律中的原子守 恒,进一步加深理 解化学变化的微 观实质,强化了学 生书写化学方程 式的技能 。培养 “宏观-微观-符 号”三重表征的化 学思想,提升学生 变化观念与守恒 思想的核心素养。
5.今年由于新冠疫情,我们在家经常要消毒,衣服要及时清洗。 下表是几种家用清洁剂和消毒剂的功能和有效成分。根据表 中信息,回答下列问题。 清洁剂 洁厕灵 彩漂液 84 消毒液 功能清除污 垢,除异 味漂洗衣物, 使色彩鲜艳 消毒有效成分HClH2O2NaClO
(1) 84 消毒液中次氯酸钠自身没有消毒作用,有消毒作用的是 次氯酸钠与空气中二氧化碳反应得到次氯酸 (HClO) ,反应 中还产生碳酸钠,写出反应的化学方程式 。 (2) 在盛有少量“彩漂液”的试管中,加少量二氧化锰,观察 到的现象是 ,其反应的化学方程 式 。 (3) “洁厕灵”与“84 消毒液”不能混用。二者若混合其有效 成分之间能发生化学反应,产生氯化钠、水和有毒的气体 单质 X ,X 的化学式为 。 (
【
思路引导】
由
题
干信息,弄清楚反应物是什么,生成了什么物质。确定
反
应
物和生成物后,再按题目所给条件,正确书写化学定方
程式
。
) 关注与化学有关 的热点问题,培养 学生的社会责任 感。 运用所学的化学 方程式书写原则 和步骤,学会书写 简单的化学方程 式,让学生意识到 化学知识的实用 性。
20
第五单元 质量守恒定律 单元作业整体设计
【课外阅读】 初中化学方程式如何配平?掌握这几种方法就够了。 http://www./a/151453173_544856
参考答案 课题 2 如何正确书写化学方程式 【 “悦”预越知】 一、1.客观事实 2.质量守恒 种类 数目 二、1.化学计量数 相等 2.化学式 数目 反应条件 状态 3. (1) 加热 (2) ↑ ↓ 【 “悦”知越识】 1. (1) (i) ② 4P+5O22P2O5 (ii) ① C+O2CO2 (iii) ④ 2KClO32KCl+3O2 ↑ (iv ) ③ 2H2O2H2 ↑+O2 ↑ (2) (参考答案略) 2.B 3. (1) 2 1 1 1 ;2 3 1 3 (2) 2KClO32KCl+3O2 ↑ (合理即可) 4. (1) C (2) 氢分子分裂为氢原子,氧分子分裂为氧原子;氢原子与氧原子重新结合为水分子。 (3) 2H2+O22H2O 【 “悦”识越通】 5. (1) 2NaClO+CO2+H2O==2HClO+Na2CO3 (2) 产生大量气泡 2H2O2 2H2O+O2 ↑ (3) Cl2
21
第五单元 质量守恒定律 单元作业整体设计
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①通过具体化学反应的分析,知道并理解化学方程式的书写原则。 ②掌握书写化学方程式步骤。 ③掌握配平化学方程式的方法,能自己配平一些常见的化学方程式。 ④通过分析信息,会写简单的化学方程式。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
辅 导 与 建 议
作业 订正
22
课题 3 利用化学方程式的简单计算
如何将化学方程式蕴含的物质之间“量”的意义变为解决现实问题的武器?根据相对质 量之比等于实际质量之比这一奇妙的桥梁一切问题便迎刃而解,完成下面的作业,试试你的达 成度吧?
学生信息
学校 姓名 班级 学号
作业信息
学习内容 利用化学方程式的简单计算 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
1.根据化学方程计算的依据 化学方程式中各物质间的质量比恒定不变, 即为 和 乘积之比。 2.根据化学方程式计算的步骤 (1) 设:跟根据题意设 。 (2) 写:正确写出反应的 。 (3) 标:根据化学方程式写出相关物质的 与化学式 前面的化学计量数的积,并标在化学式的下面;把题目中相 关物质的已知量和未知量写在相应物质的下面。 (4) 列:列比例式,求解。 (5) 答:简明的写出答案。 通过自主预习, 初 步 了 解 利 用 化 学 方 程 式 计 算 的 依 据 以 及 步骤,为准确把 握 计 算 过 程 的 细节做好准备。
1.下列数据和实验事实相符的是 ( ) A. 16g 碳在 6g 氧气中完全燃烧生 22g 二氧化碳 B.2g 碳在 14g 氧气中完全燃烧生成 16g 二氧化碳 C.3g 碳在 8g 氧气中完全燃烧生成 11g 二氧化碳 D.4g 碳在 12g 氧气中完全燃烧生成 16g 二氧化碳 (
【
思路引导】
该
题涉及对质量守恒定律的宏观应用以及化学方程式中各物
质
之
间的质量关系。依据参加化学反应的各物质的质量总和,
) 通过初步练习, 加 深 理 解 利 用 化 学 方 程 式 计 算的依据。
第五单元 质量守恒定律 单元作业整体设计
23
第五单元 质量守恒定律 单元作业整体设计
(
等
于反应生成的各物质的质量总和根据化学方程式中各物
质
:
化学方程式中各物质的质量比等于其相对分子质量与化
学
计量数乘积之比。
) 2.在 4A+5B=4C+6D 的反应中,已知 34g 的 A 和 80g 的 B 完全反 应,生成了 54gD ,若已知 C 的相对分子质量为 30,则 A 的相 对分子质量为 ( ) A.69 B.84 C.32 D. 17 (
【
思路引导】
该题是对质量守恒定律和化学方程式中各物质的质量比等
于
其
相对分子质量与化学计量数乘积之比的逆向应用,已知
A
、
B
、
D
的质量,依据参加化学反应的各物质的质量总和,等
于
反应生成
的各物质的质量总可求出 C 的质量;再由A 和 C 的质
量
比
等于其相对分子质量与化学计量数乘积之比推算出
A
的
相对分子质量。
) 通 过 根 据 化 学 方 程 式 计 算 理 论 依 据 的 逆 向 应用,加深对化 学 方 程 式 各 物 质 质 量 比 的 理 解。 通 过 补 充 计 算 步骤,加深对步 骤的记忆,准确 掌 握 未 知 数 设 置方式,数据的 书写位置,规范 化 学 计 算 题 步 骤。
3.氢气在氧气中燃烧生成水,写出该反应的化学方程式,并计算 燃烧 8g 氢气需要氧气的质量是多少?请将下列计算步骤补充 完整。 解:设燃烧 10g 氢气需要氧气的质量为 。
(
H
2
O
)2H2 + O2 点燃 (
32
)8g x 8g = x= 32 x
答: 。
4.实验室用高锰酸钾固体粉末加热制取氧气,记录产生氧气的质 量与加热时间的关系如图 1 所示,请回答下列问题: 请根据图中数据计算参加反应的高锰酸钾的质量 ; 学生通过练习, 已 经 掌 握 计 算 步骤的书写,但 尚 未 完 成 对 不 同题型的应用, 通 过 间 接 获 得 已 知 量 进 行 计 算 等 题 型 的 训 练,通过化学反 应图像的分析,
24
第五单元 质量守恒定律 单元作业整体设计
(
【
思路引导】
根
据化学方程式中各物质的质量比等于其相对分子质量与化
学
计量数乘积之比,已知氧气的质量求算高锰酸钾的质量,注
意步骤规范完整
。
) 建 立 数 形 结 合 的观念,培养学 生 科 学 观 念 的 核心素养。
5.人类从未停止向宇宙探寻的脚步, 2021 年 10 月 16 日,神舟十三号载 人飞船顺利 与空间站组合体快速 交会对接,我国三位 航天员翟志 刚、王亚平、叶光富进驻天和核心 舱,中国空间站开启有人长期驻留 时代。 关 注 生 活 的 热 点问题,培养学 生 的 社 会 责 任 感。 进 一 步 完 善 学 生 对 化 学 计 算 题的认知,并利 用 计 算 解 决 学 习 及 生 活 中 的 实际问题。
(1) 要想在宇宙生存,首先要考虑解决呼吸问题。载人航天器 如何供氧?最常用的就是电解水的方法供氧。资料显示每一 名航天员每天需要消耗 0.83kg 氧气,则乘员 3 人的载人航天
器一天约需消耗多少千克水?
(2) 航天员呼吸消耗氧气的同时会产生二氧化碳,在密闭环境 中如果不加以清除会导致二氧化碳浓度越来越高,对人体造 成伤害。如何除去产生的二氧化碳呢?科学家选用了超氧化 钾这种物质,它能和二氧化碳发生反应,请先补齐反应的化 学方程式:4KO2+ 2CO2 = 2 + 3O2 ,并请给出一条 理由说明这个反应优点: 。 (3) 氧气的供给和二氧化碳的吸收系统是航天员在空间站最基 本的生命保障,但如果生命保障系统出现问题时如何紧急供 氧?若科学家采用以下两种方法紧急供氧: LiClO4 一定条件 LiCl+2O2 ↑ 2NaClO3 一定条件 2NaCl+3O2 ↑ 请从质量的角度考虑,等质量的两种制氧剂哪种产生的氧气 更多?
25
第五单元 质量守恒定律 单元作业整体设计
(
【
思路引导】
根
据
化学方程式中各物质的质量比等于其相对分子质量与化
学
计量数乘积之比。
)
6.请以红磷燃烧为知识背景设计一题利用化学方程式进行计算的 题目,并写出解题过程及答案。 (红磷的质量为 24.8g) 在 熟 练 掌 握 根 据 化 学 方 程 式 进 行 计 算 的 基 础上,学生自主 编写题目,培养 学 生 逻 辑 思 维 和创造能力。
题目设计综合评价 (9)
评价内容 A 优秀 B 合格 C 不合格
会查阅 资料全面真实可靠。 资料比较全面。 资料不可信。
会思考 能认真思考,创设红磷 有关的情景,提出相关 问题。 能创设红磷有关的情 景。 提出的问题不是很当。 不能创设红磷有关的情 景,不能提出相关问题。
会作答 数据设置合理,方程式, 计算等均无错误,步骤 书写完整,干净整洁。 数据计算正确,计算结 果无误;未知量 X 带了 单位。 步骤书写完整,数据对应 整齐,但结果计算有误。
会展示 能较好地讲解设计背 景,设计意图,解题过 程,呈现简洁完整。 能 较 好 地 讲 解 设 计 背 景,但设计意图表述不 清,解题过程完整。 题 目背景设计不符合客 观事实,解题过程不够完 整。
学生自我评价与 反思 (等级+评语)
小组评价 (等级+评语)
教师评价 (等级+评语)
26
第五单元 质量守恒定律 单元作业整体设计
(
通
电
) (
2
H
2
↑ +O
2
↑
32
0
.83
kg
) (
X
) (
0.83
kg
X
=0.9
3
kg
)参考答案 课题 3 利用化学方程式进行简单计算 【 “悦”预越知】 1、化学计量数 2、未知数 化学方程式 相对分子质量 【 “悦”知越识】 1.D 2.C 4.2 、4 、4 、64 【 “悦”识越通】 5.解:设高锰酸钾的质量为 X。 2KMnO4====K2MnO4+MnO2+O2 ↑ (
31
6
X
)32 9.6g (
X
9
.6
g
)316 X=94.8g 32 答:高锰酸钾的质量为 94.8g。 6.( 1)解:设需消耗水的质量为 X。 (
2
H
2
O
36
X
36
32
) 答:需要消耗水的质量为 0.93kg。 (2) K2CO3 实现资源循环利用 (3) 等质量的制氧剂 LiClO4 产生的氧气更多。
27
第五单元 质量守恒定律 单元作业整体设计
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①能理解化学方程式中各物质间质量比例关系计算方法。 ②能利用化学方程式进行简单的计算,完整书写计算步骤。 ③能运用质量守恒定律分析题中已知量,并利用化学方程式进行有关计算。 ④能掌握数形结合的分析思路,熟练进行有关计算。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
“悦”通越融
辅 导 与 建 议
作业 订正
28
单元作业
学习了本单元,相信你一定会对质量守恒定律有了深刻的理解。不知你是否对质量守恒定律、 化学方程式、利用化学方程式进行计算三个模块建立了完整的认知结构呢?通过单元作业练习试 一试吧!
学生信息
学校 姓名 班级 学号
作业信息
学习内容 单元质量检测 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节及 完成时间 作业内容 设计意图
学完本单元,和同学一起讨论,绘制本单元的思维导图吧! 通过对知识进 行 总 结 和 回 顾,使知识形 成脉络,构建 一个相对完整 的知识网络体 系,对知识点 理 解 的 更 透 彻。 通过交流、合 作,让学生对 同一个问题进 行 多 角 度 思 考,每一位学 生都有自己独 特的角度,每 一个参与者的 思想都会迸出 火花,学习者 的发散思维也 得到了发掘。
第五单元 质量守恒定律 单元作业整体设计
29
第五单元 质量守恒定律 单元作业整体设计
评价内容 A 优秀 B 合格 C 不合格
会设计 能设计出完整、正确的 思维导图,导图科学、 合理。 基本能设计出可行的思 维导图,但表述不完整。 设计的思维导图不科学 或不会设计思维导图。
会合作 能与小组成员积极合 作、交流,发言积极。 能参与小组成员之间的 交流、合作,但发言不积 极。 能参与小组活动,但不交 流、不发言。
会展示 思维导图内容认识深 刻,重难点把握精准, 知识结构完整。 思维导图内容认识不够 深刻,重难点把握欠妥, 知识结构比较完整。 思维导图简单完成,本单 元知识结构不完整,重难 点把握失准。
学生自我评价 与反思 (等级+评语)
小组评价 (等级+评语)
教师评价 (等级+评语)
1.下列有关质量守恒定律的认识,正确的是 ( ) A.质量守恒定律是指反应物的质量总和等于生成物的质量总和 B.质量守恒定律揭示了化学变化中宏观物质之间的质量关系, 与微观过程无关 C. 自然界中的所有变化都遵循质量守恒定律 D.通过化学变化,只能改变世界上物质的种类不能改变物质的 总质量 2.建立基本的化学观念可以让我们更好地理解化学,如形成守恒 观念 ,可以更好地理解质量守恒定律 。下列表述正确的是 ( ) A. 1 个 C 原子和 1 个 O2 分子反应,生成 2 个 CO2 分子 B.32 g S 与 32 g O2 完全反应,生成 64 g SO2 C. 高锰酸钾加热后固体质量减少,故质量守恒定律不是普遍规 律 D.根据:蜡烛+氧气二氧化碳+水,则蜡烛中一定含有 C 、H、 O 三种元素 3.为了验证质量守恒定律。 甲、乙、丙三位同学各做了一个实验 通过练习,可 检查学生对 “双基”知识 的掌握和能力 的形成情况, 进一步夯实基 础,巩固所学 内容,培养学 生综合运用能 力。
30
第五单元 质量守恒定律 单元作业整体设计
(1) 甲同学做实验测定的数据有:木炭和坩埚的总质量为mg; 其燃烧后灰烬和坩埚的总质量为 ng 。m 和 n 的关系为 m n (填“<”“>”或“=”) 。 (2) 乙同学做实验测定的数据有:光亮的铁钉的质量为 xg ,其 生锈后的质量为 yg 。x 和 y 的关系为 x y (填“<”“>” 或“=”) 。 (3) 丙同学实验测定的数据有:铁、硫酸铜溶液和烧杯的总质量 为 ag ,其反应后的混合物和烧杯的总质量为 bg 。a 与 b 的关 系为 a b (填“<”“>”或“=”) 。 (4) 通过对三个实验的分析,你认为用有气体参加和生成的化学 反应来验证质量守恒定律时,应 ,才能判 定参加化学反应的反应物总质量和生成物总质量是否相等。 (5) 在用白磷 (白磷与红磷组成相同,着火点为 40℃) 探究质 量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端 放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞 紧,并引燃白磷,实验过程如图所示。请回答下列问题: 实验中观察到 B 中气球变大,产生此现象的原因是: ; 其反应的化学方程式为 。 (
【
思路引导】
该
题
为质量守恒定律的实验验证,根据质量守恒定律的内容分
析
,
参加化学反应的各物质的质量总和等于反应后生成的各物
质
的
质量总和。因此,对于有气体参加或有气体生成的反应,
需
在
密闭容器中进行,这样才能判断参加化学反应的反应物的
总
质
量和生成物的总质量是否相等。
) 4.实验室用 68 g 过氧化氢溶液和 2 g 二氧化锰制取氧气,实验中 非气态物质的总质量随时间变化如图所示。回答下列问题: ( 1)反应中二氧化锰的作用是 。 (2)计算过氧化氢溶液中过氧化氢的质量。(写出计算过程) (
【
思路引导】
可
根
据质量守恒定律得出生成的氧气的质量,再根据对应的化
学
方程式算过氧化氢的质量。
) 根据题中信息 进行整合与升 华,使学生在 认知程度上得 到提高,变单 纯的训练模式 为开发模式。 通过练习,开 阔思路,提高 解题技巧,加 深对化学知识 的 认 知 和 理 解。
31
第五单元 质量守恒定律 单元作业整体设计
参考答案 单元作业 【 “悦”融越汇】 1.D 2.B 3. (1) > (2) <; (3) =; (4) 在密闭容器中进行; (5) 空气受热膨胀导致。 内部压强增大;4P+5O22P2O5。 4. (1) 催化作用 (2) 解:根据质量守恒定律,反应产生氧气的质量=68 g+2 g-66.8 g=3.2 g 设产生 3.2 g 氧气需要 H2O2 的质量为 x。 (
2
H
2
O
2
6
8
x
=
)2H2O+O2 ↑ 32 3.2 g 解得:x=6.8 g 答:过氧化氢溶液中过氧化氢的质量为 6.8 g。
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
32
第五单元 质量守恒定律 单元作业整体设计
反思 ①认识质量守恒定律,并能说明化学反应中的质量关系。 ②能应用质量守恒定律解释一些现象。 ③了解化学方程式的涵义。 ④了解书写化学方程式应遵循的原则。
⑥会用化学方程式正确表达一些重要的化学反应。 ⑦懂得质量守恒定律是根据化学方程式计算的依据,会利用化学方程式进行简 单计算。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”通越融
“悦”融越汇
辅 导 与 建 议
作业 订正
35
目 录
单元信息 2
单元内容分析 2
单元目标分析 4
单元整体设计思路 5
课题 1 质量守恒定律 (第 1 课时) 6
课题 1 质量守恒定律 (第 2 课时) 12
课题 2 如何正确书写化学方程式 18
课题 3 利用化学方程式进行简单计算 23
单元作业 29
附往届学生思维导图 34
第五单元 质量守恒定律 单元作业整体设计
1
(
一、单元信息
)
基本 信息 学科 年级 学期 教材版本 单元名称
化学 九年级 第一学期 人教版 第五单元 化学方程式
单元 组织方式 自然单元 重组单元
课时信息 序号 课时名称 对应教材内容
1 质量守恒定律 5.1 质量守恒定律
2 化学方程式 5.1 质量守恒定律
3 如何正确书写化学方程式 5.2 如何正确书写化学方程式
4 利用化学方程式进行简单计算 5.3 利用化学方程式进行简单计算
5 单元作业
(
二、单元内容分
析
)
(一) 教材分析
本单元是初中化学重要的启蒙教学内容,融合了结构与原理、概念和定律、 化学语言、科学探究、定量分析等内容。本单元设置了 3 个课题,课题 1 质量守 恒定律是义务教育阶段学生开始从定量的角度认识和研究化学反应,教材通过一 系列的科学实验总结出质量守恒定律的内容,是学生书写化学方程式和进行化学 计算的理论基础,也是本单元的基础。教材以质量守恒定律和化学式为依托,将 学生已学过的化学反应用化学方程式进行科学、定量的描述。课题 2 介绍了书写 化学方程式的原则、方法和步骤,是对课题 1 中化学方程式的深入介绍,也是对第 三单元“物质构成的奥秘”、第四单元“化学式与化合价”等知识进一步的延伸 和应用,有助于学生对已学过的化学反应和化学用语进行复习和巩固,是本单元 的中心。课题 3 根据化学方程式的简单计算是从反应物、生成物的质量关系来研 究物质的变化,需要以正确书写化学方程式为基础,是化学方程式在化学计算中 的具体应用。同时也是学生应用化学知识解决实际问题的初步尝试,有利于学生 进一步了解化学在实际生产、生活中的应用。
第五单元 质量守恒定律 单元作业整体设计
2
(
基
本原理和概念
) (
利
用化学方程式的计算
) (
应
用定律
) (
课
题
)(二) 教材设计
课题
事实探究、分析 质量守恒定律
+
文字表达式+化学式 化学方程式
(
化
学方程式的配平
)
(
课
题
)
(
基
本技能
)
(三) 学情分析
学生已有基础:本单元是在学生探究了身边最熟悉的宏观物质空气、水的性 质,又探索了构成物质的微观世界的奥秘之后出现的,学生对物质的化学变化有 了质的认识,学会了用文字表达式表示化学变化,通过第四单元化学式与化合价 的学习学会了用化学式表示物质。
学生亟待解决的问题:化学反应文字表达式虽然能表示出反应物、生成物和 反应条件,但是无法表示出各物质之间的“质与量”的关系,无法解释化学变化 的实质,学生也感到这种方法使用起来不方便。
学生的问题点:学生虽然对化学反应有初步认识,但仅仅停留在宏观的层面, 本单元是化学学科学习从定性到定量研究方法的转变,因此①学生要从思维方 式上做出转变,这是一个障碍点。 ②另外部分学生对化学式的书写不熟练,这 也直接影响了本单元的学习。 ③还有部分学生观察能力和计算能力薄弱,这对 于化学方程式的配平及根据化学方程式进行计算都是一大障碍。
学生的发展点:通过本单元的学习,一方面学生用学过的化学式表示出物质 在化学变化过程中的质、量的关系,从而正确书写出化学方程式;另一方面也可 用质量守恒定律、化学方程式去反馈前面所学的知识,从而更好地去理解知识。 从而培养学生化学核心素养,形成能力提升。
(
三
、单元目标分析
)
第五单元 质量守恒定律 单元作业整体设计
3
(
课题
1 质量守恒定律
第 1 课时质量守恒
定
) (
质 量 守 恒 定
律
) (
课题
1 质量守恒定律
第
2 课时化学方程式
) (
课
题 2 如何正确书写
化学方程
式
) (
课题
3 利用化学方程
式进行简单计
算
)
单元整体学习目标
学科核心素养 单元学习目标 对应的 素养
A 化学观念 B 科学思维 C 实验探究 D 科学态度与 责任 通过实验探究对化学反应前后各物质的质量关系,分子、 原子的变化分析,学生可以理解质量守恒定律的内涵和 微观本质,建立宏观—微观的联系,形成守恒意识。 A 、C
通过收集和梳理“拉瓦锡与质量守恒定律”的化学史实, 学生可以体会到定量和定性研究物质及变化规律是相辅 相成的,认识定量研究和基于科学事实的推理对于化学 科学发展的重大作用。 B 、C 、D
通过对化学方程式意义的探究,学生可以知道化学方程 式表征了化学反应中物质之间的转化关系,和比例关系, 能正确书写化学方程式并进行有关计算。 B 、D
通过有关化学方程式的含义分析、书写、配平及计算, 学生能够按照化学学科特点进行思维、审题、分析、计 算能力的训练,能够联系实际,学以致用。 B 、C
单元课时作业目标
1.通过对化学反应各物质质量关系的分析,进 一步理解化学反应方程式的意义。 2.能够掌握有关反应物、生成物的计算。 3.能够掌握解题格式,培养解计算题的应用能 力。
1.能用质量守恒定律解释常见化学反应中的质 量关系。 2.能用微粒的观点解释质量守恒定律的原因。 3.能掌握定量研究和对比学习的方法,在此过 程中,逐步提升分析推理和解决问题的能力。
(
1
.了解化学方程式的定义。
2.理解化学方程式的含义及读法
。
)
1.通过具体化学反应分析,理解化学方程式的 书写应遵守的原则。 2.掌握化学方程式书写步骤,初步学会配平化 学方程式的方法。 3.通过分析信息,会写简单的化学方程式。
第五单元 质量守恒定律 单元作业整体设计
4
(
四、单元整体设计思路
)
根据教育部推进的“双减”政策,确保学生可以在减轻课业负担的同时进行 高效深度的学习,我们进行了“悦”成长单元作业设计。作业的类型兼顾了对基 础知识的掌握和趣味性,作业内容在形式上注重由浅到深。这些在一定程度上加 深学生对知识的理解和升华,并且逐渐培养学生解决问题的能力。
第五单元 质量守恒定律 单元作业整体设计
5
(
五
、单元课时作业
)
课题 1 质量守恒定律
第 1 课时 质量守恒定律
在化学变化中,物质的“量”如何变化呢?早在 17 世纪初,人们就利用化学实验开始了 相关的求证,最终,一个基于“量”的秘密---质量守恒定律被确认,这是自然界中重要的规 律之一。试一试,完成作业,了解自己对质量守恒定律又多了几分理解?
学生信息
学校 姓名 班级 学号
作业信息
学习内容 质量守恒定律 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
1. 质量守恒定律的内容: 化学反应的各物质 的 ,等于反应后生成的各物质的 。 2.微观解释质量守恒的原因:化学反应前后, 没 有改变, 没有增减, 也没有改 变 (原子的“三不变”) 。 温馨提示: 1.质量守恒定律只适用于化学变化,不适用于物理变化; 2.没有参加反应的物质质量及不是反应生成的物质质量不能计 入“总和”中; 3.要考虑空气中的物质是否参加反应,或物质 (如气体) 有无遗 漏; 4.质量守恒:质量守恒定律只是研究化学反应的质量变化, 热量、体积变化等不在研究范围之内。 通过学生自主预 习,初步了解质 量守恒定律的内 容 以 及 微 观 解 释。 通过温馨提示, 进一步加深对知 识的理解。
1.在化学变化中,下列说法正确的是 ①原子的种类、元素的种类均不变 ( ) 通过练习,巩固 所学知识,同时 将理论与实际相 结合,使学生学
②原子的数目、分子的数目均不变 ③原子的质量、元素的质量、物质的总质量均不变
第五单元 质量守恒定律 单元作业整体设计
6
第五单元 质量守恒定律 单元作业整体设计
④分子的种类、物质的种类均不变 A. ①② B. ①③ C. ③④ D. ②④ 2.下列现象不能用质量守恒定律来解释的是 ( ) A.高锰酸钾受热后固体质量减少 B. 10g 冰融化后变成 10g 水 C.蜡烛燃烧后,变得越来越短 D.细铁丝在氧气中燃烧,其固体质量增加 (
【
思路引导】
根据质量守恒定律,在化学反应中参加反应前各物质的质
量
总和等于反应后生成各物质的质量总和,掌握化学变化和
物
理
变化的判别是解题的关键。
) 3.将 25gA 与 15gB 在一定条件下恰好完全反应,生成 20gC 和一 定量的 D ,则 A 和 D 的质量比为 。 4.根据质量守恒定律解释以下现象: (1)氯酸钾受热分解后,剩余的固体质量减少。 (2)镁在空气中燃烧,质量增加。 会用理论知识解 答实际问题。 培养学生综合运 用知识解决问题 的能力。 培养学生对化学 理论内涵挖掘的 能力。
5.在密闭容器中有以下四种物质,它们在一定条件下充分反应, 已知反应前后的质量如下表所示, 初步培养学生定 量分析观点,引 导学生层层递进 的对数据进行分 析,最终得出科 学结论。
物质甲乙丙丁反应前质量14362011反应后质量342016待测
(
(
)
)下列说法正确的是 A.该反应是分解反应 B. 甲一定是氧化物 C.待测值是 0 D.参加反应的乙、丙质量之比是 4:1
7
第五单元 质量守恒定律 单元作业整体设计
(
【
思路引导】
先
根据质量守恒定律反应前后总质量不变,求出
X
,再根据
表
格
数据,比较反应前后物质质量,质量增加的为反应物,
质量减少为生成物
。
) 6.下图形象地表示了某反应前后分子及数目的变化,下列关于反 (
应前、后的说法正
确的是
)( ) A.反应前后原子、分子的数目不变 B.参加反应的分子个数比为 1 :1 C.该反应是化合反应 D.反应物和生成物都是一种单质和一种化合物 7.2022 年 4 月 26 日“探索二号”科考船搭载着“深海勇士号” 返航。“深海勇士号”是中国第二台深海载人潜水器。潜水器 中可用“氧烛”来快速提供氧气。氧烛中含有氯酸钠(NaClO3 )、 金属粉末 (Al 、Mg 、Fe 等) 和催化剂。 (1) 氧烛放出的氧气来自于上述物质中的 ,判断的依据 是 。 (2) 氧烛中的金属粉末均能与稀盐酸反应,其中铁与稀盐酸反 应的化学方程式为:Fe + 2HCl = X + H2 ↑ ,则 X 的化学式为 。 【思路引导】 根据反应前后元素的种类不变,原子的种类和数目不变。 通过练习,使学 生能灵活运用质 量守恒定律解决 一些实际问题, 加深对质量守恒 定律的理解。 深化学以致用的 原则,培养学生 应用理论知识解 决问题的能力, 同时检测学生对 本节课知识的掌 握程度。
8.某化学兴趣小组为探究质量守恒定律,在老师的指导下进行了 如下两组实验: (1) 图甲中反应后天平的指针 (“偏左”“偏右”“不变”), 原因是 ,该反应是否遵守质量 守恒定律? 。 (2) 图乙中锥形瓶底放层细沙的目的是 ;
8
第五单元 质量守恒定律 单元作业整体设计
玻璃管上方系一瘪气球的目的是 。 白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡, 小组同学马上有人提出该反应不遵守质量守恒定律。你是否 同意该同学的看法? , 理由是 。
9.实验设计:某实验小组为验证质量守恒定律,设计了如图所示小 实验。 请同学们根据以上小实验,尝试设计实验,观察现象,解释原 因 (分组完成) 。 拓展学生对质量 守 恒 定 律 的 理 解,提升对所学 知 识 的 应 用能 力。培养学生设 计实验的能力以 及合作意识,激 发学生实验探究 的兴趣。
评价内容 A 优秀 B 合格 C 不合格
会设计 能设计出完整、正确的 实验方案,方案可行且 科学。 基本能设计出可行的实 验方案,但表述不完整。 设计的实验方案不可行 或不会设计实验方案。
会实验 能按照设计的方案选择 合适的试剂和用品进行 实验,现象明显,结论 正确。 能基本按照设计的方案 选择合适的试剂和用品 进行实验,现象较明显, 结论基本正确。 不会选择合适的试剂和 用品完成实验。
9
第五单元 质量守恒定律 单元作业整体设计
会合作 能与小组成员积极合 作、交流,发言积极。 能参与小组成员之间的 交流、合作,但发言不积 极。 能参与小组活动,但不交 流、不发言。
会展示 根据自己设计的实验方 案,展示实验装置,实 验现象和结论表述完 整、正确。 根据自己设计的实验方 案,展示实验装置,实验 现象和结论表述不太完 整、正确。 不能展示实验装置,不会 表述实验现象和结论。
学生自我评价 与反思 (等级+评语)
小组评价 (等级+评语)
教师评价 (等级+评语)
参考答案 课题 1 质量守恒定律 (第 1 课时) 【 “悦”预越知】 1.参加 质量总和 质量总和 2.原子的种类 原子的数目 原子的质量 【 “悦”知越识】 1.B 2.B 3.5:4 4. (1) 因为氯酸钾受热分解后的产物是氯化钾和氧气,根据质量守恒定律,氯酸钾的质量等于 氯化钾和氧气的质量之和,反应中氧气逸出,所以剩余的质量比原反应物的质量小。 (2) 因为镁条在空气中燃烧,是镁和空气中的氧气发生反应生成氧化镁的过程,根据质量 守恒定律,氧化镁的质量=镁条的质量+参与反应的氧气质量.所以生成的白色粉末的 质量比原来镁条的质量增加。 【 “悦”识越通】 6. D 7. C 8.氯酸钠 (NaClO3 ) 化学反应前后元素种类不变 FeCl2 9. (1) 偏右 反应生成的二氧化碳气体逸散在空气中 符合 (2) 防止白磷燃烧放热使锥形瓶底部受热不均匀而炸裂 缓冲作用,防止橡皮塞冲出 不 同意 白磷燃烧放热,气球膨胀所受空气浮力会明显增加导致天平不平衡。
10
第五单元 质量守恒定律 单元作业整体设计
课时作业评价反馈
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①知道质量守恒定律的内容并理解其内涵。 ②能从微观角度解释质量守恒定律,理解化学反应中的定量关系。 ③能用质量守恒定律解释一些现象。 ④能运用质量守恒定律解决一些实际问题。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
“悦”通越融
辅 导 与 建 议
作业 订正
11
第 2 课时 化学方程式
怎样用规范通用科学的化学用语来准确的描述和诠释化学变化呢?从元素符号到化学方 程式,化学用语羽翼日丰。通过本节的学习,你就能真正读懂化学方程式承载的丰富信息,完 成作业,了解自己的学习达成度。
学生信息
学校 姓名 班级 学号
作业信息
学习内容 化学方程式 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
1.定义:用 表示的式子叫做化学方程式。 2.意义: 通过学生自主预 习,初步了解什么 是化学方程式以 及化学方程式的 意义和读法,提 高学生独立思考 的能力。
表示意义 实例:2H2 + O2 2H2O
质 的 方 面 表示 、 和 。 反应物是 和氧气 ,生成物 是 ,条件是 。
量 的 方 面 表示各物质之间的 之比。 2H2 + O2 2H2O 4 ∶ ∶
表示各物质之间粒 子的 之比。(化 学计量数之比) 2H2 + O2 2H2O 2 ∶ ∶
3.读法 (以 2H2 + O2 2H2O 为例) : (1) 质的方面: 和 在 的条件下反应 生成 。 (2) 量的方面: ①宏观:在点燃条件下,每 份质量的氢气和 份 质量的氧气完全反应,生成 份质量的水。 ②微观:在点燃条件下,每 个氢分子和 个氧分子
第五单元 质量守恒定律 单元作业整体设计
12
第五单元 质量守恒定律 单元作业整体设计
反应,生成 个水分子。 温馨提示: 化学方程式中,“+”“= ”不是简单的数值累加,一定不能 读作“加”和“等于”。
1.化学方程式是学习化学的重要工具之一。根据化学方程式不能 获取的信息是 ( ) A.反应物和生成物的状态 B.反应发生的条件 C.反应中各物质的质量关系 D.化学反应的快慢 2.对化学方程式“4P+5O22P2O5 ”的读法错误的是 ( ) A.磷与氧气在点燃的条件下反应生成五氧化二磷 B.4 个磷与 5 个氧气在点燃的条件下反应生成 1 个五氧化二磷 C.每 124份质量的磷与 160份质量的氧气在点燃的条件下反应 生成 284 份质量的五氧化二磷 D.每 4 个磷原子与 5 个氧分子在点燃的条件下反应生成 2 个 五氧化二磷分子 (
【
思路引导】根据化学方程式的读法和意义解答。
) 初步培养学生从 宏观和微观的角 度去理解化学方 程式的能力,培 养学生思维的有 序性和严密性。 通过练习, 比较反 思化学方程式所 表达的信息,初 步了解化学方程 式的意义。 通过有关训练, 巩固本节课的重 难点知识,加深 学生对知识的理 解和应用。
3.如图是四位同学正在讨论某一化学方程式表示的意义,他们描
述的化学方程式是 ( )
A.2Mg+O2==2MgO B. H2+Cl2==2HCl C. N2+3H2高压2NH3 D. 2CO+O2==2CO2
4.质量守恒定律是帮助我们学习认识化学反应实质的重要理论, 在化学反应 aA+bB==cC+dD 中,下列说法正确的是 ( ) A.反应物 A 和 B 的质量比一定等于生成物 C 和 D 的质量比 B.反应物 A 和 B 的相对分子质量之和一定等于生成物 C 和 D 的相对分子质量之和 C.化学计量数 a 与 b 之和一定等于 c 与 d 之和 D.若取xgA 和xgB 反应,生成 C 和 D 的质量总和不一定等 于 2xg
13
第五单元 质量守恒定律 单元作业整体设计
5.为及时发现煤气是否泄漏,常在煤气中加入少量有特殊气味的 乙硫醇 (C2H5 SH) ,乙硫醇燃烧的化学方程式为 2C2H5 SH+9O24CO2+2X+6H2O 。下列关于 X 的说法正确 的是 ( ) A. X 由碳、硫、氧三种元素组成 B. X 中硫元素和氧元素的质量比为 1:2 C. X 中硫元素的质量分数为 50% D. X 中含有氧分子 (
【
思
路引导】根据反应前后元素的种类不变、元素的质量不变。
) 6.下图表示两种气体发生化学反应的微观示意图,其中相同的球 代表同种原子,下列说法正确的是 ( ) A. 反应物中包含两种化合物 B. 发生反应的分子个数比为 1:1 C. 该反应有三种新物质生成 D .反应前后原子的种类不变 (
【
思路引导】
根
据
反应的微观示意图及微粒的变化,正确判断变化中的物
质构成,判断参加反应的两种分子的个数比
。
) 7.一定质量的某化合物完全燃烧,需要 3.2 g 氧气,生成 4.4 g 二氧化碳和 1.8 g 水。下列判断错误的是 ( ) A .该化合物的质量为 3.0 g B .该化合物一定含有碳、氢、氧三种元素 C .该化合物中碳、氢、氧的原子个数比为 2 ∶4 ∶ 1 D .该化合物中碳元素的质量分数是40% (
【
思路引导】
先
由
质量守恒定律,求出该化合物的质量;再根据反应前后
元素的质量不变,求出水中氢元素的质量和二氧化碳中碳
元
素的质量,判断化合物中是否含氧元素
。
) 通 过 练 习 , 引 导 学生对化学反应 的 认 识 — — 由 “质” 到“量” 的过渡,也为之 后化学方程式的 书写和计算做好 准备。 深化学以致用的 原则,培养学生 分析能力和计算 能力,培养学生 应用所学理论知 识解决问题的能 力。 通过比较加深对 知识的理解和应 用,训练学生的 发散思维能力。
8.观察、比较与归纳是学习化学的重要方法,对于以下三个化学 方程式:
2Mg+O22MgO 2H2+O22H2O
14
第五单元 质量守恒定律 单元作业整体设计
2CO+O22CO2 (1) 通过比较,发现它们有许多共同点,请你写出其中的三点: ① ; ② ; ③ 。 (2) 以上化学方程式也有许多不同之处,请你写出一点其中一 个与另外两个的不同之处: 。 (3) 某同学课外学习 Cu2(OH)2CO3====2CuO+H2O+CO2 ↑ , 他发现这个反应和上述三个反应也有相似之处,其相似之处 是 。 【思路引导】 可以根据反应类型、反应条件、反应物和生成物的类型进行 正确的分析。 9.化学在科技、生活和社会发展中都起到了重要的作用。 (1) 2021 年 3 月全国两会期间,“碳中和”成为热词。我国科 学家研制了全球首套捕集二氧化碳合成甲醇 (CH3OH) 的 装置,有利于实现“碳中和” 。甲醇分子中 C 、H 、O 元素 的质量比为: 。 (2) 2021 年 5 月 22 日,“祝融号”火星车成功登陆火星表面, 该车的车身使用了新型铝基碳化硅复合材料。碳化硅能与 熔融的氢氧化钠发生反应 SiC+2NaOH+2O2=X+CO2+H2O , 其中 X 的化学式为 ,SiC 中碳元素的化合价 为 。 课外延伸阅读:宫崎骏的魔幻星 http://www./u51/v_MTQxNjA5NzI4.html 通 过 练 习 , 让 学 生新旧知识的联 系体现学生的认 知过程。
参考答案 课题 1 质量守恒定律 (第 2 课时) 【 “悦”预越知】 1. 反应物 生成物 反应条件 2. 氢气 水 点燃 32 36 数目 1 2 3. (1) 氢气 氧气 点燃 水 (2) 4 32 36 (3) 2 1 2
15
第五单元 质量守恒定律 单元作业整体设计
【 “悦”知越识】 1.D 2.B 3.B 4.D 【 “悦”识越通】 5.C 6.D 7.C 8. (1) ①都是化合反应; ②反应条件都是点燃; ③都是放热反应; ④生成物都是氧化物。 (2) 生成物都是氧化物。 (
(
2)
Na
2
SiO
3
,
4
)9. (1) 3:1:4
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①知道化学方程式的定义、表示的意义,了解化学方程式的读法。 ②能求出化学方程式中各物质的质量比。 ③通过对具体化学反应的分析,能从宏观和微观的角度去理解化学方程式。 ④能利用质量守恒定律和化学方程式的意义解决一些实际问题。
你有什么收获或疑问?还想探究什么问题?
16
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
辅 导 与 建 议
作业 订正
第五单元 质量守恒定律 单元作业整体设计
17
课题 2 如何正确书写化学方程式
怎样正确书写化学方程式?配平的方法你掌握了几种? 完成下面作业,试试你的达成度吧?
学生信息
学校 姓名 班级 学号
作业信息
学习内容 如何正确书写化学方程式 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
一、化学方程式的书写原则 1.必须以 为基础,不能凭空臆造不存在的化学反 应。 2.要遵守 定律,等号两边各原子的 和 必须相等。 二、化学方程式的书写 1.化学方程式的配平 在化学式前配上适当的 ,使得每一种元素的原子 数目 。 注意:配平时,只能改动化学式前的化学计量数,不能改动化 学式中元素符号右下角的下标数字。 2.书写步骤 写 ——根据实验事实,在“”的左右两边写出反应物和 生成物的 。 配 ——配平化学方程式,即调整化学式前的化学计量数, 使每种元素的原子 相等,使化学反应方程 式遵守质量守恒定律。 注 — — 注 明化 学反应 发 生 的 , 标 出 生成物 的 ,再把“ ”改为“=”。 查 ——检查化学方程式的书写是否正确。 通过预习,学生可 初步了解本课题 内容的重难点,做 到有的放矢。
第五单元 质量守恒定律 单元作业整体设计
18
第五单元 质量守恒定律 单元作业整体设计
3. 符号使用及注意事项 (1) 用“ Δ ”表示 , (2) “无气生气标气升,无固生固标固降。 ”——若反应物中 没有气体,生成物中的气体物质化学式的右边标 , 溶液中的反应,若反应物中没有固体,生成物中的固体物 质化学式的右边标 。 (3) 要正确区分反应条件和反应现象的不同,如“点燃”和“燃 烧” ,“通电”和“电解”等。
1. (1) 学完化学方程式后,化学小组的同学随机抽取班级同学 书写的化学方程式进行诊断,请帮他们完成研究报告: (1) 通过对化学 方程式书写细节 的再现,考察学生 对正确书写化学 方程式的原则与 步骤的认知。 (2) 通过自主将 所学过的化学反 应用化学方程式 表示,巩固了化学 方程式书写的原 则和一般步骤。 通过配平化学方 程式,进一步巩固 对观察法、最小公 倍数法等常用配 平方法的掌握,培 养学生的守恒观, 提升学生变化观 念和守恒思想的 核心素养。
(
①
C
+
O
2
③
H
2
O
) (
CO
2
H
2
↑+O
2
↑
)②P+O2 PO2 ④2KClO3 2KCl+3O2 (i) 不符合客观事实的是 ,正确书写是 。 (ii) 反应条件错误的是 ,正确书写是 。 (iii) “ ↑ ”漏标的是 ,正确书写是 。 (iv ) 违背质量守恒定律的是 ,正确书写是 。 (2) 请按正确的书写步骤,将所学过的化学反应用化学方程式 表示: (写一个即可) 2.X 是一种黄绿色到橙黄色的物质,是国际上公认为安全、无 毒的绿色饮用水消毒剂。其制备反应为:2KClO3 + SO2 = 2X + K2SO4 ,关于此反应的说法不正确的是 ( ) A.X 的化学式为 ClO2 B.反应前后元素种类发生变化 C.反应前后氧元素化合价发生变化 D.反应前后物质的总质量不发生变化 (
【思路引导】 由质量守恒的原因可推测该化合物的化学式
。
) 3.按要求完成下列化学方程式: (1)将下列化学方程式补充完整 NaHCO3 Na2CO3+ CO2 ↑+ H2O Al+ H2 SO4= Al2(SO4)3+ H2 ↑ (2) 写一个分解反应,生成物中既有单质又有化合物 。 【思路引导】 可根据反应前后原子的种类、数目不变,结合配平方法配平。 4.小青和同学们一起完成了氢气燃烧的实验,并绘制了该反应的
19
第五单元 质量守恒定律 单元作业整体设计
微观示意图 (如下图所示) 。请你和她一起讨论下列问题: (1) 图中方框内表示纯净物的是 (填字母) 。 (2) 图中①的微观实质是 , ②的微观实质是 。 (2) 写出图中相关反应的化学方程式: 。 (
【
思路引导】
通
过
微观示意图所给的信息得出化学反应的本质和化学方程
式的意义。
) 通过分析微粒模 型,在能准确表示 化学式的基础上, 考查了物质的分 类,运用质量守恒 定律中的原子守 恒,进一步加深理 解化学变化的微 观实质,强化了学 生书写化学方程 式的技能 。培养 “宏观-微观-符 号”三重表征的化 学思想,提升学生 变化观念与守恒 思想的核心素养。
5.今年由于新冠疫情,我们在家经常要消毒,衣服要及时清洗。 下表是几种家用清洁剂和消毒剂的功能和有效成分。根据表 中信息,回答下列问题。 清洁剂 洁厕灵 彩漂液 84 消毒液 功能清除污 垢,除异 味漂洗衣物, 使色彩鲜艳 消毒有效成分HClH2O2NaClO
(1) 84 消毒液中次氯酸钠自身没有消毒作用,有消毒作用的是 次氯酸钠与空气中二氧化碳反应得到次氯酸 (HClO) ,反应 中还产生碳酸钠,写出反应的化学方程式 。 (2) 在盛有少量“彩漂液”的试管中,加少量二氧化锰,观察 到的现象是 ,其反应的化学方程 式 。 (3) “洁厕灵”与“84 消毒液”不能混用。二者若混合其有效 成分之间能发生化学反应,产生氯化钠、水和有毒的气体 单质 X ,X 的化学式为 。 (
【
思路引导】
由
题
干信息,弄清楚反应物是什么,生成了什么物质。确定
反
应
物和生成物后,再按题目所给条件,正确书写化学定方
程式
。
) 关注与化学有关 的热点问题,培养 学生的社会责任 感。 运用所学的化学 方程式书写原则 和步骤,学会书写 简单的化学方程 式,让学生意识到 化学知识的实用 性。
20
第五单元 质量守恒定律 单元作业整体设计
【课外阅读】 初中化学方程式如何配平?掌握这几种方法就够了。 http://www./a/151453173_544856
参考答案 课题 2 如何正确书写化学方程式 【 “悦”预越知】 一、1.客观事实 2.质量守恒 种类 数目 二、1.化学计量数 相等 2.化学式 数目 反应条件 状态 3. (1) 加热 (2) ↑ ↓ 【 “悦”知越识】 1. (1) (i) ② 4P+5O22P2O5 (ii) ① C+O2CO2 (iii) ④ 2KClO32KCl+3O2 ↑ (iv ) ③ 2H2O2H2 ↑+O2 ↑ (2) (参考答案略) 2.B 3. (1) 2 1 1 1 ;2 3 1 3 (2) 2KClO32KCl+3O2 ↑ (合理即可) 4. (1) C (2) 氢分子分裂为氢原子,氧分子分裂为氧原子;氢原子与氧原子重新结合为水分子。 (3) 2H2+O22H2O 【 “悦”识越通】 5. (1) 2NaClO+CO2+H2O==2HClO+Na2CO3 (2) 产生大量气泡 2H2O2 2H2O+O2 ↑ (3) Cl2
21
第五单元 质量守恒定律 单元作业整体设计
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①通过具体化学反应的分析,知道并理解化学方程式的书写原则。 ②掌握书写化学方程式步骤。 ③掌握配平化学方程式的方法,能自己配平一些常见的化学方程式。 ④通过分析信息,会写简单的化学方程式。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
辅 导 与 建 议
作业 订正
22
课题 3 利用化学方程式的简单计算
如何将化学方程式蕴含的物质之间“量”的意义变为解决现实问题的武器?根据相对质 量之比等于实际质量之比这一奇妙的桥梁一切问题便迎刃而解,完成下面的作业,试试你的达 成度吧?
学生信息
学校 姓名 班级 学号
作业信息
学习内容 利用化学方程式的简单计算 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节 及完成时 间 作业内容 设计意图
1.根据化学方程计算的依据 化学方程式中各物质间的质量比恒定不变, 即为 和 乘积之比。 2.根据化学方程式计算的步骤 (1) 设:跟根据题意设 。 (2) 写:正确写出反应的 。 (3) 标:根据化学方程式写出相关物质的 与化学式 前面的化学计量数的积,并标在化学式的下面;把题目中相 关物质的已知量和未知量写在相应物质的下面。 (4) 列:列比例式,求解。 (5) 答:简明的写出答案。 通过自主预习, 初 步 了 解 利 用 化 学 方 程 式 计 算 的 依 据 以 及 步骤,为准确把 握 计 算 过 程 的 细节做好准备。
1.下列数据和实验事实相符的是 ( ) A. 16g 碳在 6g 氧气中完全燃烧生 22g 二氧化碳 B.2g 碳在 14g 氧气中完全燃烧生成 16g 二氧化碳 C.3g 碳在 8g 氧气中完全燃烧生成 11g 二氧化碳 D.4g 碳在 12g 氧气中完全燃烧生成 16g 二氧化碳 (
【
思路引导】
该
题涉及对质量守恒定律的宏观应用以及化学方程式中各物
质
之
间的质量关系。依据参加化学反应的各物质的质量总和,
) 通过初步练习, 加 深 理 解 利 用 化 学 方 程 式 计 算的依据。
第五单元 质量守恒定律 单元作业整体设计
23
第五单元 质量守恒定律 单元作业整体设计
(
等
于反应生成的各物质的质量总和根据化学方程式中各物
质
:
化学方程式中各物质的质量比等于其相对分子质量与化
学
计量数乘积之比。
) 2.在 4A+5B=4C+6D 的反应中,已知 34g 的 A 和 80g 的 B 完全反 应,生成了 54gD ,若已知 C 的相对分子质量为 30,则 A 的相 对分子质量为 ( ) A.69 B.84 C.32 D. 17 (
【
思路引导】
该题是对质量守恒定律和化学方程式中各物质的质量比等
于
其
相对分子质量与化学计量数乘积之比的逆向应用,已知
A
、
B
、
D
的质量,依据参加化学反应的各物质的质量总和,等
于
反应生成
的各物质的质量总可求出 C 的质量;再由A 和 C 的质
量
比
等于其相对分子质量与化学计量数乘积之比推算出
A
的
相对分子质量。
) 通 过 根 据 化 学 方 程 式 计 算 理 论 依 据 的 逆 向 应用,加深对化 学 方 程 式 各 物 质 质 量 比 的 理 解。 通 过 补 充 计 算 步骤,加深对步 骤的记忆,准确 掌 握 未 知 数 设 置方式,数据的 书写位置,规范 化 学 计 算 题 步 骤。
3.氢气在氧气中燃烧生成水,写出该反应的化学方程式,并计算 燃烧 8g 氢气需要氧气的质量是多少?请将下列计算步骤补充 完整。 解:设燃烧 10g 氢气需要氧气的质量为 。
(
H
2
O
)2H2 + O2 点燃 (
32
)8g x 8g = x= 32 x
答: 。
4.实验室用高锰酸钾固体粉末加热制取氧气,记录产生氧气的质 量与加热时间的关系如图 1 所示,请回答下列问题: 请根据图中数据计算参加反应的高锰酸钾的质量 ; 学生通过练习, 已 经 掌 握 计 算 步骤的书写,但 尚 未 完 成 对 不 同题型的应用, 通 过 间 接 获 得 已 知 量 进 行 计 算 等 题 型 的 训 练,通过化学反 应图像的分析,
24
第五单元 质量守恒定律 单元作业整体设计
(
【
思路引导】
根
据化学方程式中各物质的质量比等于其相对分子质量与化
学
计量数乘积之比,已知氧气的质量求算高锰酸钾的质量,注
意步骤规范完整
。
) 建 立 数 形 结 合 的观念,培养学 生 科 学 观 念 的 核心素养。
5.人类从未停止向宇宙探寻的脚步, 2021 年 10 月 16 日,神舟十三号载 人飞船顺利 与空间站组合体快速 交会对接,我国三位 航天员翟志 刚、王亚平、叶光富进驻天和核心 舱,中国空间站开启有人长期驻留 时代。 关 注 生 活 的 热 点问题,培养学 生 的 社 会 责 任 感。 进 一 步 完 善 学 生 对 化 学 计 算 题的认知,并利 用 计 算 解 决 学 习 及 生 活 中 的 实际问题。
(1) 要想在宇宙生存,首先要考虑解决呼吸问题。载人航天器 如何供氧?最常用的就是电解水的方法供氧。资料显示每一 名航天员每天需要消耗 0.83kg 氧气,则乘员 3 人的载人航天
器一天约需消耗多少千克水?
(2) 航天员呼吸消耗氧气的同时会产生二氧化碳,在密闭环境 中如果不加以清除会导致二氧化碳浓度越来越高,对人体造 成伤害。如何除去产生的二氧化碳呢?科学家选用了超氧化 钾这种物质,它能和二氧化碳发生反应,请先补齐反应的化 学方程式:4KO2+ 2CO2 = 2 + 3O2 ,并请给出一条 理由说明这个反应优点: 。 (3) 氧气的供给和二氧化碳的吸收系统是航天员在空间站最基 本的生命保障,但如果生命保障系统出现问题时如何紧急供 氧?若科学家采用以下两种方法紧急供氧: LiClO4 一定条件 LiCl+2O2 ↑ 2NaClO3 一定条件 2NaCl+3O2 ↑ 请从质量的角度考虑,等质量的两种制氧剂哪种产生的氧气 更多?
25
第五单元 质量守恒定律 单元作业整体设计
(
【
思路引导】
根
据
化学方程式中各物质的质量比等于其相对分子质量与化
学
计量数乘积之比。
)
6.请以红磷燃烧为知识背景设计一题利用化学方程式进行计算的 题目,并写出解题过程及答案。 (红磷的质量为 24.8g) 在 熟 练 掌 握 根 据 化 学 方 程 式 进 行 计 算 的 基 础上,学生自主 编写题目,培养 学 生 逻 辑 思 维 和创造能力。
题目设计综合评价 (9)
评价内容 A 优秀 B 合格 C 不合格
会查阅 资料全面真实可靠。 资料比较全面。 资料不可信。
会思考 能认真思考,创设红磷 有关的情景,提出相关 问题。 能创设红磷有关的情 景。 提出的问题不是很当。 不能创设红磷有关的情 景,不能提出相关问题。
会作答 数据设置合理,方程式, 计算等均无错误,步骤 书写完整,干净整洁。 数据计算正确,计算结 果无误;未知量 X 带了 单位。 步骤书写完整,数据对应 整齐,但结果计算有误。
会展示 能较好地讲解设计背 景,设计意图,解题过 程,呈现简洁完整。 能 较 好 地 讲 解 设 计 背 景,但设计意图表述不 清,解题过程完整。 题 目背景设计不符合客 观事实,解题过程不够完 整。
学生自我评价与 反思 (等级+评语)
小组评价 (等级+评语)
教师评价 (等级+评语)
26
第五单元 质量守恒定律 单元作业整体设计
(
通
电
) (
2
H
2
↑ +O
2
↑
32
0
.83
kg
) (
X
) (
0.83
kg
X
=0.9
3
kg
)参考答案 课题 3 利用化学方程式进行简单计算 【 “悦”预越知】 1、化学计量数 2、未知数 化学方程式 相对分子质量 【 “悦”知越识】 1.D 2.C 4.2 、4 、4 、64 【 “悦”识越通】 5.解:设高锰酸钾的质量为 X。 2KMnO4====K2MnO4+MnO2+O2 ↑ (
31
6
X
)32 9.6g (
X
9
.6
g
)316 X=94.8g 32 答:高锰酸钾的质量为 94.8g。 6.( 1)解:设需消耗水的质量为 X。 (
2
H
2
O
36
X
36
32
) 答:需要消耗水的质量为 0.93kg。 (2) K2CO3 实现资源循环利用 (3) 等质量的制氧剂 LiClO4 产生的氧气更多。
27
第五单元 质量守恒定律 单元作业整体设计
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
反思 ①能理解化学方程式中各物质间质量比例关系计算方法。 ②能利用化学方程式进行简单的计算,完整书写计算步骤。 ③能运用质量守恒定律分析题中已知量,并利用化学方程式进行有关计算。 ④能掌握数形结合的分析思路,熟练进行有关计算。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”预越知
“悦”知越识
“悦”识越通
“悦”通越融
辅 导 与 建 议
作业 订正
28
单元作业
学习了本单元,相信你一定会对质量守恒定律有了深刻的理解。不知你是否对质量守恒定律、 化学方程式、利用化学方程式进行计算三个模块建立了完整的认知结构呢?通过单元作业练习试 一试吧!
学生信息
学校 姓名 班级 学号
作业信息
学习内容 单元质量检测 作业时间 约 15 分钟
作业类型 课时作业 单元作业 学期作业
作业功能 课前预习 课中练习 课后练习
作业设计
作业环节及 完成时间 作业内容 设计意图
学完本单元,和同学一起讨论,绘制本单元的思维导图吧! 通过对知识进 行 总 结 和 回 顾,使知识形 成脉络,构建 一个相对完整 的知识网络体 系,对知识点 理 解 的 更 透 彻。 通过交流、合 作,让学生对 同一个问题进 行 多 角 度 思 考,每一位学 生都有自己独 特的角度,每 一个参与者的 思想都会迸出 火花,学习者 的发散思维也 得到了发掘。
第五单元 质量守恒定律 单元作业整体设计
29
第五单元 质量守恒定律 单元作业整体设计
评价内容 A 优秀 B 合格 C 不合格
会设计 能设计出完整、正确的 思维导图,导图科学、 合理。 基本能设计出可行的思 维导图,但表述不完整。 设计的思维导图不科学 或不会设计思维导图。
会合作 能与小组成员积极合 作、交流,发言积极。 能参与小组成员之间的 交流、合作,但发言不积 极。 能参与小组活动,但不交 流、不发言。
会展示 思维导图内容认识深 刻,重难点把握精准, 知识结构完整。 思维导图内容认识不够 深刻,重难点把握欠妥, 知识结构比较完整。 思维导图简单完成,本单 元知识结构不完整,重难 点把握失准。
学生自我评价 与反思 (等级+评语)
小组评价 (等级+评语)
教师评价 (等级+评语)
1.下列有关质量守恒定律的认识,正确的是 ( ) A.质量守恒定律是指反应物的质量总和等于生成物的质量总和 B.质量守恒定律揭示了化学变化中宏观物质之间的质量关系, 与微观过程无关 C. 自然界中的所有变化都遵循质量守恒定律 D.通过化学变化,只能改变世界上物质的种类不能改变物质的 总质量 2.建立基本的化学观念可以让我们更好地理解化学,如形成守恒 观念 ,可以更好地理解质量守恒定律 。下列表述正确的是 ( ) A. 1 个 C 原子和 1 个 O2 分子反应,生成 2 个 CO2 分子 B.32 g S 与 32 g O2 完全反应,生成 64 g SO2 C. 高锰酸钾加热后固体质量减少,故质量守恒定律不是普遍规 律 D.根据:蜡烛+氧气二氧化碳+水,则蜡烛中一定含有 C 、H、 O 三种元素 3.为了验证质量守恒定律。 甲、乙、丙三位同学各做了一个实验 通过练习,可 检查学生对 “双基”知识 的掌握和能力 的形成情况, 进一步夯实基 础,巩固所学 内容,培养学 生综合运用能 力。
30
第五单元 质量守恒定律 单元作业整体设计
(1) 甲同学做实验测定的数据有:木炭和坩埚的总质量为mg; 其燃烧后灰烬和坩埚的总质量为 ng 。m 和 n 的关系为 m n (填“<”“>”或“=”) 。 (2) 乙同学做实验测定的数据有:光亮的铁钉的质量为 xg ,其 生锈后的质量为 yg 。x 和 y 的关系为 x y (填“<”“>” 或“=”) 。 (3) 丙同学实验测定的数据有:铁、硫酸铜溶液和烧杯的总质量 为 ag ,其反应后的混合物和烧杯的总质量为 bg 。a 与 b 的关 系为 a b (填“<”“>”或“=”) 。 (4) 通过对三个实验的分析,你认为用有气体参加和生成的化学 反应来验证质量守恒定律时,应 ,才能判 定参加化学反应的反应物总质量和生成物总质量是否相等。 (5) 在用白磷 (白磷与红磷组成相同,着火点为 40℃) 探究质 量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端 放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞 紧,并引燃白磷,实验过程如图所示。请回答下列问题: 实验中观察到 B 中气球变大,产生此现象的原因是: ; 其反应的化学方程式为 。 (
【
思路引导】
该
题
为质量守恒定律的实验验证,根据质量守恒定律的内容分
析
,
参加化学反应的各物质的质量总和等于反应后生成的各物
质
的
质量总和。因此,对于有气体参加或有气体生成的反应,
需
在
密闭容器中进行,这样才能判断参加化学反应的反应物的
总
质
量和生成物的总质量是否相等。
) 4.实验室用 68 g 过氧化氢溶液和 2 g 二氧化锰制取氧气,实验中 非气态物质的总质量随时间变化如图所示。回答下列问题: ( 1)反应中二氧化锰的作用是 。 (2)计算过氧化氢溶液中过氧化氢的质量。(写出计算过程) (
【
思路引导】
可
根
据质量守恒定律得出生成的氧气的质量,再根据对应的化
学
方程式算过氧化氢的质量。
) 根据题中信息 进行整合与升 华,使学生在 认知程度上得 到提高,变单 纯的训练模式 为开发模式。 通过练习,开 阔思路,提高 解题技巧,加 深对化学知识 的 认 知 和 理 解。
31
第五单元 质量守恒定律 单元作业整体设计
参考答案 单元作业 【 “悦”融越汇】 1.D 2.B 3. (1) > (2) <; (3) =; (4) 在密闭容器中进行; (5) 空气受热膨胀导致。 内部压强增大;4P+5O22P2O5。 4. (1) 催化作用 (2) 解:根据质量守恒定律,反应产生氧气的质量=68 g+2 g-66.8 g=3.2 g 设产生 3.2 g 氧气需要 H2O2 的质量为 x。 (
2
H
2
O
2
6
8
x
=
)2H2O+O2 ↑ 32 3.2 g 解得:x=6.8 g 答:过氧化氢溶液中过氧化氢的质量为 6.8 g。
课时作业评价
学生 评价 时间 15 分钟以内 15—20 分钟 20 分钟以上
过程 独立完成 同伴互助 请教师长
32
第五单元 质量守恒定律 单元作业整体设计
反思 ①认识质量守恒定律,并能说明化学反应中的质量关系。 ②能应用质量守恒定律解释一些现象。 ③了解化学方程式的涵义。 ④了解书写化学方程式应遵循的原则。
⑥会用化学方程式正确表达一些重要的化学反应。 ⑦懂得质量守恒定律是根据化学方程式计算的依据,会利用化学方程式进行简 单计算。
你有什么收获或疑问?还想探究什么问题?
教师 评价 分析 作业环节 正确题数 错误题数 空白题数
“悦”通越融
“悦”融越汇
辅 导 与 建 议
作业 订正
35
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
