人教版高中化学选择性必修二第二章分子结构与性质章末复习(44张ppt)
文档属性
| 名称 | 人教版高中化学选择性必修二第二章分子结构与性质章末复习(44张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 11:14:47 | ||
图片预览











文档简介
(共44张PPT)
人教版化学选择性必修二
第二章 分子结构与性质
章末复习
主题一 共价键类型的判断
【例1】 下列模型分别表示 、 、 的结构,下列说法正确的是( ) 。
C
A. 分子中含有 键
B. 是由非极性键构成的分子
C. 分子中有 键和 键
D. 分子中不含非极性键
[解析] 分子中含有 键,因此 分子中所含 键为
,A项错误;根据 的结构模型可知, 是由 极性键
构成的,B项错误; 分子中所含的碳碳三键是非极性键,D项错误。
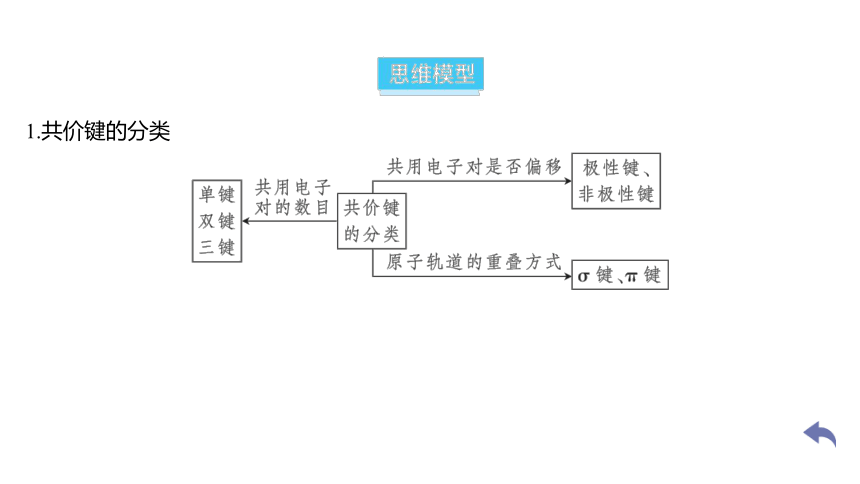
1.共价键的分类
2.共价键类型的判断
(1)根据成键元素判断:同种元素的原子之间形成的是非极性键,不同种元素的原子之间形成的是极性键。
(2)根据原子间共用电子对数目判断单键、双键或三键。
(3)根据共价键规律判断 键、 键及其个数;原子间形成单键,则为 键;形
成双键,则含有一个 键和一个 键;形成三键,则含有一个 键和两个 键。
【针对训练1】 下列物质的分子中既有 键又有 键的是( ) 。
D
A.①②③ B.③④⑤⑥ C.①③⑥ D.③⑤⑥
[解析] 当两个原子间能形成多个共用电子对时,先形成一个 键,另外的原子轨道只
能形成 键。 中只有一个 键; 含有两个 键; 含有两
个 键和一个 键; 中含有三键:一个为 键,两个为 键;
中碳原子与碳原子之间有双键,一个为 键,一个为 键,另外有四个
键; 中碳原子与碳原子之间有三键,一个为 键,两个为 键,另外
有两个 键。
【针对训练2】 根据要求回答下列问题:
(1)甲、乙、丙三种有机物的结构如下:
甲:&1& 乙:&2& (光气)
丙:
①甲分子中有___个 键,___个 键,____(填“有”或“没有”)非极性键。
8
2
有
[解析] 甲分子中有3个 键,2个 键,2个 键,1个
键; 和 中分别有1个 键;一般来说,同种元素的原子之间形成的共价键
是非极性键,甲分子中有 、 非极性键。
②乙分子中碳原子形成___个 键,___个 键。
3
1
[解析] 乙分子中,C与 原子之间形成1个 键和1个 键,C与两个 原子之间分别
形成1个 键。
③丙分子中 键与 键的数目之比为______。
2∶1
[解析] 丙分子的结构简式为 ,其中含有1个 、1个 、3
个 和1个 ,故丙分子中共有6个 键和3个 键。
(2) 中 与 的结构相似, 的电子式可表示为__________;
中含有的 键数目为_ ____( 表示阿伏加德罗常数的值)。
[解析] 中,两个C原子之间以三键结合, 与其结构相似,则 中也存在三
键, 中有 键,数目为 。
主题二 杂化轨道类型的判断
【例2】 完成下列各小题。
(1) 中C原子的杂化轨道类型为_ _________。
[解析] 分子中, 和 上的碳原子的杂化轨道类型分别是
和 。
(2)甲醛 在 催化作用下加氢可得甲醇 。甲醛、甲醇分子内C原子
的杂化方式分别为_ ___、____。
[解析] 甲醛分子内C原子的杂化方式为 杂化,甲醇分子内C原子的价层电子对数为
4,所以C原子的杂化方式为 杂化。
(3) 中 原子的杂化方式为_ ___。
(4) 的结构简式为 , 分子中碳原子轨道的杂化类型
分别为_ ___和___。
(5)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别为
____、_ ___。
[解析] 乙二胺中 形成3个单键,含有1个孤电子对,属于 杂化;C形成4个单键,
不存在孤电子对,也是 杂化。
(6)抗坏血酸的分子结构如图所示,分子中碳原子的杂化轨道类型
为_ _________。
[解析] 形成四个单键的碳原子为 杂化,形成双键的碳原子为
杂化。
(7)甘氨酸 是最简单的氨基酸,甘氨酸中 原子的杂化轨道类型为
____,C原子的杂化轨道类型为_ _________。
[解析] 分子中羧基中的碳原子形成两个单键和一个双键,故其杂化类型
为 ;另一个C原子结合的原子数为4,无孤电子对,则其杂化轨道数为4,故采用的
杂化类型为 。
(8)铁能与三氮唑( ,结构如图所示)形成多种配合物。 中碳原子杂化方
式为_ ___。
[解析] 碳原子有3个 键,无孤电子对,碳原子杂化类型为 。
&5& 杂化轨道类型的判断
1.根据杂化轨道数目判断
杂化轨道数目 键电子对数目 中心原子的孤电子对数目。杂化轨道数目为2、3、
4对应的杂化类型分别为 、 、 。
2.根据杂化轨道的空间分布判断
空间分布 正四面体或三角锥形 平面三角形 直线形
杂化类型
3.有机物中碳原子杂化类型的判断
饱和碳原子采取 杂化,连接双键的碳原子采取 杂化,连接三键的碳原子采取
杂化。
【针对训练3】 根据题目要求,回答下列问题。
(1) 和 中心原子的杂化方式分别为_ ___和____。
[解析] 分子中心原子的价层电子对数为3,是平面三角形分子,B原子采用 杂
化; 分子中心原子的价层电子对数为4,是三角锥形分子, 原子采用 杂化。
(2) 分子中氧原子的杂化方式是_ ___; 分子中氮原子的杂化方式是____。
[解析] 的电子式为 , 原子最外层有2对成键电子和2对未成键电子,
原子采用 杂化。 可看作 分子中有1个 原子被氨基 取代,
其分子中 原子的杂化方式和 分子中的 原子一样,都是 杂化。
(3) 单质的常见形式为 ,其环状结构如图所示, 原子杂化方式
是_ ___。
[解析] 分子中,每个 原子与两个 原子形成单键, 原子的价层电子对数为4,采
用 杂化。
(4)甲醛( )在 催化作用下加氢可得甲醇 。甲醛分子内C原子
的杂化方式为____,甲醇分子内的 键角______(填“大于”、“等于”或“小于”)
甲醛分子内的 键角。
小于
[解析] 中,C原子与 原子形成一个双键,C原子采用 杂化,故甲醛分子
是平面三角形结构。 分子中,C原子的价层电子对数为4,没有未成键电子对,
C原子采用 杂化,是四面体结构。通过比较平面三角形和正四面体的键角,可知
分子内的 键角小于 分子内的 键角。
主题三 分子或离子空间结构的判断
【例3】 完成下列各小题。
(1) 的 模型为__________,分子的空间结构为__________。
四面体形
三角锥形
(2) 的空间结构是____________; 的空间结构是____________; 的
空间结构是____________。
平面三角形
平面三角形
正四面体形
[解析] 中心原子的价层电子对数为3,无孤电子对,为平面三角形; 的中心
原子 的成键电子对数为4,无孤电子对,为正四面体结构。
(3) 和过量 作用可生成 , 的空间构型为____________。
正四面体形
(4)麻醉剂的发现和使用是人类医学史上一项了不起的成就。“笑气” 是人类最
早应用于医疗的麻醉剂之一。已知 分子中氧原子只与一个氮原子相连,其分子空
间结构是______形。另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气
,光气 分子的空间结构是__________形。
直线
平面三角
[解析] 中间氮原子价层电子对数为2,孤电子对数为0,故 为直线形; 的结
构式为 ,碳原子形成1个 键和3个 键,故碳原子采取 杂化, 为
平面三角形分子。
(5)分析下列分子或离子的空间结构,将序号填入表格中: , ,
, , , , , 。
直线形 形 平面三角形 三角锥形 正四面体形
____ ______ ______ ______ ____
①
③⑧
④⑦
②⑤
⑥
[解析] , 键电子对数为2,孤电子对数为0,空间结构为直线形; ,
键电子对数为3,孤电子对数为1,空间结构为三角锥形; , 键电子对数为2,
孤电子对数为2,空间结构为 形; , 键电子对数为3,孤电子对数为0,空
间结构为平面三角形; , 键电子对数为3,孤电子对数为1,空间结构为三
角锥形; , 键电子对数为4,孤电子对数为0,空间结构为正四面体形;
, 键电子对数为3,孤电子对数为0,空间结构为平面三角形; , 键
电子对数为2,孤电子对数为1,空间结构为 形。
型分子或离子的空间结构判断方法
1.根据价层电子对互斥理论判断
孤电子对数 0 0 1 0 1 2
成键电子对数 2 3 2 4 3 2
空间结构 直线形 平面三角形 形 正四面体形 三角锥形 形
2.根据中心原子的杂化方式判断
杂化方式 空间结构 直线 形 孤电子对数 0 1 0 1 2
平面三角形 形 正四面体 三角锥形 形
【针对训练4】 下列各组分子的空间结构相同的是 。( )
C
A. 、 B. 、 C. 、 D. 、
[解析] 通过中心原子上的价层电子对数、孤电子对数确定分子的空间结构,其中A、D两项中分子的具体情况如下表:
键电子对数 中心原子上的孤电子对数 价层电子对数 空间结构
2 3 形
2 2 直线形
2 2 直线形
2 4 形
B项中 、 的空间结构分别为平面三角形、三角锥形;C项中, 与
的空间结构均为正四面体形。
【针对训练5】 根据杂化轨道理论可以判断分子的空间结构。试根据相关知识填空:
(1) 分子的空间结构为__________,其中 的杂化轨道类型为_ ___。
三角锥形
[解析] 中 原子价层电子对数为4,有1个孤电子对, 采用 杂化,
分子的空间结构为三角锥形。
(2) 中C原子轨道杂化类型为_ _________。
[解析] 的结构式为 ,分子中甲基上的碳原子采用 杂化,
羧基中碳原子采用 杂化。
①该分子中有___个 杂化的碳原子;___个 杂化的碳原子。
2
6
[解析] 有机物中饱和碳原子采取 杂化,双键上的碳原子采取 杂化,三键上的
碳原子采取 杂化。该分子中有2个 杂化碳原子,6个 杂化碳原子。
(3)一种有机化合物的结构简式为&10& 。
②该分子中有___个 键;___个 键。
3
3
[解析] 该分子中有3个 键,3个 键。
(4) 与 的结构相同,空间结构为______形,中心原子都采取_ __杂化。
直线
[解析] 与 的中心原子均采取 杂化,形成直线形结构。
主题四 分子间作用力对物质性质的影响
【例4】 完成下列各小题。
(1)常温下,在水中的溶解度乙醇大于氯乙烷,原因是__________________________
_____________。
乙醇与水之间形成氢键而氯乙烷不能形成
[解析] 乙醇和氯乙烷都属于极性分子,但乙醇与水分子之间形成氢键,而氯乙烷不能与水分子形成氢键,故常温下在水中的溶解度乙醇大于氯乙烷。
(2) 、 、 的沸点由高到低的顺序为_ _________________(填化学式)。
[解析] 、 、 的结构相似,结构相似的物质,相对分子质量越大,范德
华力越强,物质的沸点越高,但是 分子间能形成氢键,故这三种物质的沸点排
序: 。
(3)气态氢化物热稳定性 大于 的主要原因是_____________________________
_______。
原子半径
[解析] 由于原子半径 ,故键长: ,键能: ,所
以 比 稳定。
(4)氧元素有两种同素异形体,其中沸点高的是____(填化学式),原因是________
_____________________________。
[解析] 相对分子质量: ,故沸点: 。
(5)苯胺与甲苯的相对分子质量相近,但苯胺的熔点 、沸点 分别
高于甲苯的熔点 、沸点 ,原因是______________________。
苯胺分子之间存在氢键
[解析] 苯胺中有 ,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢
键可明显地提高苯胺的熔、沸点。
(6)已知邻羟基苯胺的结构为 ,邻羟基苯胺的沸点______(填“低于” 、“高
于”或“不确定”)对羟基苯胺的沸点;其原因是__________________________________
___________________________________________________________________________
_______________。
低于
邻羟基苯胺容易形成分子内氢键,沸点降低,对羟基苯胺容易形成分子间氢键,沸点升高,因此邻羟基苯胺的沸点低于对羟基苯胺的沸点
1.分子结构与性质“原因解释”型试题解题模型
2.三种作用力及对物质性质的影响
范德华力 氢键 共价键
作用微粒 分子 与 、 、 原子
强度比较 共价键 氢键 范德华力 影响因素 组成和结构相似的物质,相对分 子质量越大,范德华力越大 形成氢键元素的电负 性 原子半径
对性质的 影响 影响物质的熔、沸点、溶解度等 物理性质 分子间氢键使熔、沸 点升高,溶解度增大 键能越大,稳
定性越强
【针对训练6】 下列说法正确的是 。
的熔、沸点比第ⅤA族其他元素的气态氢化物的都高
②碳原子数相同的多元醇和一元醇,在水中溶解度前者更大
③同温同压下,冰的密度比液态水的密度小
④尿素 的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子稳定是因为水分子间存在氢键( )
A.①②③④⑤⑥ B.②③④⑤ C.①②③④⑤ D.①②③
B
[解析] 熔沸点: ,①错误;羟基可与水形成氢键,碳原子
数相同的多元醇和一元醇,在水中溶解度前者更大,②正确;相同条件下,同质量的
冰中水分子间形成的氢键比液态水多,同温同压下,冰的密度比液态水的密度小,③
正确;尿素分子间形成的氢键比醋酸多,所以尿素的熔、沸点比醋酸的高,④正确;
邻羟基苯甲酸易形成分子内氢键,对羟基苯甲酸易形成分子间氢键,所以邻羟基苯甲
酸的熔、沸点比对羟基苯甲酸的低,⑤正确;水分子的稳定性与化学键有关,与氢键
无关,⑥错误。
【针对训练7】 完成下列各小题。
(1)乙醇 与二甲醚 的分子式均为 ,但 的
沸点高于 的沸点,其原因是__________________________________________
_____________________________。
乙醇中分子间能形成氢键,二甲醚不能形成氢键,导致乙醇的沸点高于二甲醚
(2)尿素 易溶于水,其原因除尿素和水都是极性分子外,还有_________
_____________________。
尿素与水分子之间可以形成氢键
(3)钛与卤素形成的化合物熔、沸点如下表所示:
熔点/ 38.3 155
沸点/ 136.5 233.5 377
分析 、 、 的熔点和沸点呈现一定变化规律的原因是________________
___________________________________________________________。
三者组成与结构相似,随着相对分子质量增大,分子间作用力增大,熔、沸点升高
(4)常温下, 氧化 生成 、 、 等。 、
的沸点较高的是_ _______(写化学式)。
[解析] 形成的分子间氢键数目比 更多,所以 沸点更高。
(5)铁氧体也可使用沉淀法制备,制备时常加入氨 、联氨 等弱碱,已
知氨 熔点: 、沸点: ,联氨 熔点: 、沸点:
,解释其熔、沸点高低的主要原因:__________________________________
_______________。
联氨分子间形成氢键的数目多于氨分子间形成的氢键
人教版化学选择性必修二
第二章 分子结构与性质
章末复习
主题一 共价键类型的判断
【例1】 下列模型分别表示 、 、 的结构,下列说法正确的是( ) 。
C
A. 分子中含有 键
B. 是由非极性键构成的分子
C. 分子中有 键和 键
D. 分子中不含非极性键
[解析] 分子中含有 键,因此 分子中所含 键为
,A项错误;根据 的结构模型可知, 是由 极性键
构成的,B项错误; 分子中所含的碳碳三键是非极性键,D项错误。
1.共价键的分类
2.共价键类型的判断
(1)根据成键元素判断:同种元素的原子之间形成的是非极性键,不同种元素的原子之间形成的是极性键。
(2)根据原子间共用电子对数目判断单键、双键或三键。
(3)根据共价键规律判断 键、 键及其个数;原子间形成单键,则为 键;形
成双键,则含有一个 键和一个 键;形成三键,则含有一个 键和两个 键。
【针对训练1】 下列物质的分子中既有 键又有 键的是( ) 。
D
A.①②③ B.③④⑤⑥ C.①③⑥ D.③⑤⑥
[解析] 当两个原子间能形成多个共用电子对时,先形成一个 键,另外的原子轨道只
能形成 键。 中只有一个 键; 含有两个 键; 含有两
个 键和一个 键; 中含有三键:一个为 键,两个为 键;
中碳原子与碳原子之间有双键,一个为 键,一个为 键,另外有四个
键; 中碳原子与碳原子之间有三键,一个为 键,两个为 键,另外
有两个 键。
【针对训练2】 根据要求回答下列问题:
(1)甲、乙、丙三种有机物的结构如下:
甲:&1& 乙:&2& (光气)
丙:
①甲分子中有___个 键,___个 键,____(填“有”或“没有”)非极性键。
8
2
有
[解析] 甲分子中有3个 键,2个 键,2个 键,1个
键; 和 中分别有1个 键;一般来说,同种元素的原子之间形成的共价键
是非极性键,甲分子中有 、 非极性键。
②乙分子中碳原子形成___个 键,___个 键。
3
1
[解析] 乙分子中,C与 原子之间形成1个 键和1个 键,C与两个 原子之间分别
形成1个 键。
③丙分子中 键与 键的数目之比为______。
2∶1
[解析] 丙分子的结构简式为 ,其中含有1个 、1个 、3
个 和1个 ,故丙分子中共有6个 键和3个 键。
(2) 中 与 的结构相似, 的电子式可表示为__________;
中含有的 键数目为_ ____( 表示阿伏加德罗常数的值)。
[解析] 中,两个C原子之间以三键结合, 与其结构相似,则 中也存在三
键, 中有 键,数目为 。
主题二 杂化轨道类型的判断
【例2】 完成下列各小题。
(1) 中C原子的杂化轨道类型为_ _________。
[解析] 分子中, 和 上的碳原子的杂化轨道类型分别是
和 。
(2)甲醛 在 催化作用下加氢可得甲醇 。甲醛、甲醇分子内C原子
的杂化方式分别为_ ___、____。
[解析] 甲醛分子内C原子的杂化方式为 杂化,甲醇分子内C原子的价层电子对数为
4,所以C原子的杂化方式为 杂化。
(3) 中 原子的杂化方式为_ ___。
(4) 的结构简式为 , 分子中碳原子轨道的杂化类型
分别为_ ___和___。
(5)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别为
____、_ ___。
[解析] 乙二胺中 形成3个单键,含有1个孤电子对,属于 杂化;C形成4个单键,
不存在孤电子对,也是 杂化。
(6)抗坏血酸的分子结构如图所示,分子中碳原子的杂化轨道类型
为_ _________。
[解析] 形成四个单键的碳原子为 杂化,形成双键的碳原子为
杂化。
(7)甘氨酸 是最简单的氨基酸,甘氨酸中 原子的杂化轨道类型为
____,C原子的杂化轨道类型为_ _________。
[解析] 分子中羧基中的碳原子形成两个单键和一个双键,故其杂化类型
为 ;另一个C原子结合的原子数为4,无孤电子对,则其杂化轨道数为4,故采用的
杂化类型为 。
(8)铁能与三氮唑( ,结构如图所示)形成多种配合物。 中碳原子杂化方
式为_ ___。
[解析] 碳原子有3个 键,无孤电子对,碳原子杂化类型为 。
&5& 杂化轨道类型的判断
1.根据杂化轨道数目判断
杂化轨道数目 键电子对数目 中心原子的孤电子对数目。杂化轨道数目为2、3、
4对应的杂化类型分别为 、 、 。
2.根据杂化轨道的空间分布判断
空间分布 正四面体或三角锥形 平面三角形 直线形
杂化类型
3.有机物中碳原子杂化类型的判断
饱和碳原子采取 杂化,连接双键的碳原子采取 杂化,连接三键的碳原子采取
杂化。
【针对训练3】 根据题目要求,回答下列问题。
(1) 和 中心原子的杂化方式分别为_ ___和____。
[解析] 分子中心原子的价层电子对数为3,是平面三角形分子,B原子采用 杂
化; 分子中心原子的价层电子对数为4,是三角锥形分子, 原子采用 杂化。
(2) 分子中氧原子的杂化方式是_ ___; 分子中氮原子的杂化方式是____。
[解析] 的电子式为 , 原子最外层有2对成键电子和2对未成键电子,
原子采用 杂化。 可看作 分子中有1个 原子被氨基 取代,
其分子中 原子的杂化方式和 分子中的 原子一样,都是 杂化。
(3) 单质的常见形式为 ,其环状结构如图所示, 原子杂化方式
是_ ___。
[解析] 分子中,每个 原子与两个 原子形成单键, 原子的价层电子对数为4,采
用 杂化。
(4)甲醛( )在 催化作用下加氢可得甲醇 。甲醛分子内C原子
的杂化方式为____,甲醇分子内的 键角______(填“大于”、“等于”或“小于”)
甲醛分子内的 键角。
小于
[解析] 中,C原子与 原子形成一个双键,C原子采用 杂化,故甲醛分子
是平面三角形结构。 分子中,C原子的价层电子对数为4,没有未成键电子对,
C原子采用 杂化,是四面体结构。通过比较平面三角形和正四面体的键角,可知
分子内的 键角小于 分子内的 键角。
主题三 分子或离子空间结构的判断
【例3】 完成下列各小题。
(1) 的 模型为__________,分子的空间结构为__________。
四面体形
三角锥形
(2) 的空间结构是____________; 的空间结构是____________; 的
空间结构是____________。
平面三角形
平面三角形
正四面体形
[解析] 中心原子的价层电子对数为3,无孤电子对,为平面三角形; 的中心
原子 的成键电子对数为4,无孤电子对,为正四面体结构。
(3) 和过量 作用可生成 , 的空间构型为____________。
正四面体形
(4)麻醉剂的发现和使用是人类医学史上一项了不起的成就。“笑气” 是人类最
早应用于医疗的麻醉剂之一。已知 分子中氧原子只与一个氮原子相连,其分子空
间结构是______形。另一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气
,光气 分子的空间结构是__________形。
直线
平面三角
[解析] 中间氮原子价层电子对数为2,孤电子对数为0,故 为直线形; 的结
构式为 ,碳原子形成1个 键和3个 键,故碳原子采取 杂化, 为
平面三角形分子。
(5)分析下列分子或离子的空间结构,将序号填入表格中: , ,
, , , , , 。
直线形 形 平面三角形 三角锥形 正四面体形
____ ______ ______ ______ ____
①
③⑧
④⑦
②⑤
⑥
[解析] , 键电子对数为2,孤电子对数为0,空间结构为直线形; ,
键电子对数为3,孤电子对数为1,空间结构为三角锥形; , 键电子对数为2,
孤电子对数为2,空间结构为 形; , 键电子对数为3,孤电子对数为0,空
间结构为平面三角形; , 键电子对数为3,孤电子对数为1,空间结构为三
角锥形; , 键电子对数为4,孤电子对数为0,空间结构为正四面体形;
, 键电子对数为3,孤电子对数为0,空间结构为平面三角形; , 键
电子对数为2,孤电子对数为1,空间结构为 形。
型分子或离子的空间结构判断方法
1.根据价层电子对互斥理论判断
孤电子对数 0 0 1 0 1 2
成键电子对数 2 3 2 4 3 2
空间结构 直线形 平面三角形 形 正四面体形 三角锥形 形
2.根据中心原子的杂化方式判断
杂化方式 空间结构 直线 形 孤电子对数 0 1 0 1 2
平面三角形 形 正四面体 三角锥形 形
【针对训练4】 下列各组分子的空间结构相同的是 。( )
C
A. 、 B. 、 C. 、 D. 、
[解析] 通过中心原子上的价层电子对数、孤电子对数确定分子的空间结构,其中A、D两项中分子的具体情况如下表:
键电子对数 中心原子上的孤电子对数 价层电子对数 空间结构
2 3 形
2 2 直线形
2 2 直线形
2 4 形
B项中 、 的空间结构分别为平面三角形、三角锥形;C项中, 与
的空间结构均为正四面体形。
【针对训练5】 根据杂化轨道理论可以判断分子的空间结构。试根据相关知识填空:
(1) 分子的空间结构为__________,其中 的杂化轨道类型为_ ___。
三角锥形
[解析] 中 原子价层电子对数为4,有1个孤电子对, 采用 杂化,
分子的空间结构为三角锥形。
(2) 中C原子轨道杂化类型为_ _________。
[解析] 的结构式为 ,分子中甲基上的碳原子采用 杂化,
羧基中碳原子采用 杂化。
①该分子中有___个 杂化的碳原子;___个 杂化的碳原子。
2
6
[解析] 有机物中饱和碳原子采取 杂化,双键上的碳原子采取 杂化,三键上的
碳原子采取 杂化。该分子中有2个 杂化碳原子,6个 杂化碳原子。
(3)一种有机化合物的结构简式为&10& 。
②该分子中有___个 键;___个 键。
3
3
[解析] 该分子中有3个 键,3个 键。
(4) 与 的结构相同,空间结构为______形,中心原子都采取_ __杂化。
直线
[解析] 与 的中心原子均采取 杂化,形成直线形结构。
主题四 分子间作用力对物质性质的影响
【例4】 完成下列各小题。
(1)常温下,在水中的溶解度乙醇大于氯乙烷,原因是__________________________
_____________。
乙醇与水之间形成氢键而氯乙烷不能形成
[解析] 乙醇和氯乙烷都属于极性分子,但乙醇与水分子之间形成氢键,而氯乙烷不能与水分子形成氢键,故常温下在水中的溶解度乙醇大于氯乙烷。
(2) 、 、 的沸点由高到低的顺序为_ _________________(填化学式)。
[解析] 、 、 的结构相似,结构相似的物质,相对分子质量越大,范德
华力越强,物质的沸点越高,但是 分子间能形成氢键,故这三种物质的沸点排
序: 。
(3)气态氢化物热稳定性 大于 的主要原因是_____________________________
_______。
原子半径
[解析] 由于原子半径 ,故键长: ,键能: ,所
以 比 稳定。
(4)氧元素有两种同素异形体,其中沸点高的是____(填化学式),原因是________
_____________________________。
[解析] 相对分子质量: ,故沸点: 。
(5)苯胺与甲苯的相对分子质量相近,但苯胺的熔点 、沸点 分别
高于甲苯的熔点 、沸点 ,原因是______________________。
苯胺分子之间存在氢键
[解析] 苯胺中有 ,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢
键可明显地提高苯胺的熔、沸点。
(6)已知邻羟基苯胺的结构为 ,邻羟基苯胺的沸点______(填“低于” 、“高
于”或“不确定”)对羟基苯胺的沸点;其原因是__________________________________
___________________________________________________________________________
_______________。
低于
邻羟基苯胺容易形成分子内氢键,沸点降低,对羟基苯胺容易形成分子间氢键,沸点升高,因此邻羟基苯胺的沸点低于对羟基苯胺的沸点
1.分子结构与性质“原因解释”型试题解题模型
2.三种作用力及对物质性质的影响
范德华力 氢键 共价键
作用微粒 分子 与 、 、 原子
强度比较 共价键 氢键 范德华力 影响因素 组成和结构相似的物质,相对分 子质量越大,范德华力越大 形成氢键元素的电负 性 原子半径
对性质的 影响 影响物质的熔、沸点、溶解度等 物理性质 分子间氢键使熔、沸 点升高,溶解度增大 键能越大,稳
定性越强
【针对训练6】 下列说法正确的是 。
的熔、沸点比第ⅤA族其他元素的气态氢化物的都高
②碳原子数相同的多元醇和一元醇,在水中溶解度前者更大
③同温同压下,冰的密度比液态水的密度小
④尿素 的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子稳定是因为水分子间存在氢键( )
A.①②③④⑤⑥ B.②③④⑤ C.①②③④⑤ D.①②③
B
[解析] 熔沸点: ,①错误;羟基可与水形成氢键,碳原子
数相同的多元醇和一元醇,在水中溶解度前者更大,②正确;相同条件下,同质量的
冰中水分子间形成的氢键比液态水多,同温同压下,冰的密度比液态水的密度小,③
正确;尿素分子间形成的氢键比醋酸多,所以尿素的熔、沸点比醋酸的高,④正确;
邻羟基苯甲酸易形成分子内氢键,对羟基苯甲酸易形成分子间氢键,所以邻羟基苯甲
酸的熔、沸点比对羟基苯甲酸的低,⑤正确;水分子的稳定性与化学键有关,与氢键
无关,⑥错误。
【针对训练7】 完成下列各小题。
(1)乙醇 与二甲醚 的分子式均为 ,但 的
沸点高于 的沸点,其原因是__________________________________________
_____________________________。
乙醇中分子间能形成氢键,二甲醚不能形成氢键,导致乙醇的沸点高于二甲醚
(2)尿素 易溶于水,其原因除尿素和水都是极性分子外,还有_________
_____________________。
尿素与水分子之间可以形成氢键
(3)钛与卤素形成的化合物熔、沸点如下表所示:
熔点/ 38.3 155
沸点/ 136.5 233.5 377
分析 、 、 的熔点和沸点呈现一定变化规律的原因是________________
___________________________________________________________。
三者组成与结构相似,随着相对分子质量增大,分子间作用力增大,熔、沸点升高
(4)常温下, 氧化 生成 、 、 等。 、
的沸点较高的是_ _______(写化学式)。
[解析] 形成的分子间氢键数目比 更多,所以 沸点更高。
(5)铁氧体也可使用沉淀法制备,制备时常加入氨 、联氨 等弱碱,已
知氨 熔点: 、沸点: ,联氨 熔点: 、沸点:
,解释其熔、沸点高低的主要原因:__________________________________
_______________。
联氨分子间形成氢键的数目多于氨分子间形成的氢键
