第八单元金属和金属材料复习题(含解析) 2023-2024学年人教版九年级化学下册
文档属性
| 名称 | 第八单元金属和金属材料复习题(含解析) 2023-2024学年人教版九年级化学下册 |  | |
| 格式 | docx | ||
| 文件大小 | 426.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 07:56:04 | ||
图片预览




文档简介
第八单元金属和金属材料 复习题
一、选择题
1.生活中处处可以用到大量金属材料。下列有关金属材料的说法正确的是
A.合金通常比组分金属的熔点更高、硬度更小
B.生锈的铁制品回收成本高,属于不可回收垃圾
C.生铁和钢都是铁合金,两者含碳量不同
D.铝的金属活动性比铁强,所以在空气中铝比铁更易腐蚀
2.下列关于工业炼铁的叙述中错误的是
A.主要原料为铁矿石、焦炭和石灰石等
B.主要设备为电炉
C.主要原理为:3CO+Fe2O33CO2+2Fe
D.主要产物为生铁
3.归纳和推理是化学学习常用的思维方法。下列说法中正确的有( )
①化学变化中常伴随着发光、放热现象,所以有发光、放热现象产生的一定是化学变化
②合金是由一种金属跟其他金属(或非金属)熔合而成的具有金属特性的物质
③某气体可能由氢气、一氧化碳、甲烷中的一种或几种组成,将气体点燃后,用干燥的冷烧杯罩在火焰上方,有无色液滴出现,向烧杯中注入澄清石灰水振荡,石灰水变浑浊,则该气体的组合最多有四种情况
④煤、石油直接使用对环境污染较重,应该进行综合利用,而两者综合利用的过程都属于化学变化
⑤某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如下图所示:
若a表示氯酸钾、b表示高锰酸钾,则c可以表示氧气。
⑥将一定量的锌放入硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤;若向滤渣中加入稀硫酸有气泡产生,则溶液一定为无色。
A.1条 B.2条 C.3条 D.4条
4.收藏家收藏清末铝制品,至今保存完好,该艺术品不易腐蚀的主要原因是
A.铝的化学性质不活泼,不易发生化学反应 B.铝的氧化物容易发生还原反应
C.常温下,铝不参与氧气反应 D.铝易氧化,但铝表面的氧化铝具有保护内部铝的作用
5.假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )
A.硫酸亚铁溶液 B.稀盐酸 C.浓硝酸和浓盐酸的混合物 D.稀硫酸
6.生活处处有化学。从化学的角度看,下列做法不合理的是
A.进入久未开启的枯井或地窖,先做灯火实验
B.用钢丝球擦洗铝制品表面的污渍
C.铁锁锈蚀无法用钥匙打开,向锁眼处涂铅笔芯粉末,能很快开启
D.使用乙醇汽油能减少空气污染
7.2020年世界环境 日中国的主题是“美丽中国,我是行动者”。下列做法不可取的是
A.洗手后及时关闭水龙头 B.生活垃圾分类放置处理
C.用自备的布袋取代塑料袋购物 D.短途出行乘坐私家汽车取代自行车
8.推理是一种化学思维方法,以下推理合理的是
A.因为铝和盐酸反应生成AlCl3和H2,则金属铁与盐酸反应生成FeCl3和H2
B.铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀
C.单质中只含一种元素,只含有一种元素的纯净物一定是单质
D.化学变化一定会伴随着能量的变化,所以有能量变化的一定是化学变化
9.下列化学方程式书写正确且和描述相符的是
A.电解水实验:
B.王业上使用高锰酸钾制取氧气:
C.红磷燃烧测定空气中氧气的含量:
D.有铜生成的置换反应:
10.现有甲、乙、丙三种金属,将乙放入甲的硫酸盐溶液中,无明显变化;将乙、丙分别放入硝酸银溶液中,丙表面有固体析出,乙无明显变化。下列说法正确的是( )
A.甲在空气中一定易被腐蚀
B.将丙放入稀硫酸中一定会产生气泡
C.乙在自然界中可以单质形式存在
D.三种金属的活动性顺序为甲>乙>丙
11.下列反应中属于置换反应的是( )
A.2Mg+O22MgO B.2H2O2H2↑+O2↑
C.Fe+CuSO4=FeSO4+Cu D.NaOH+HCl=NaCl+H2O
12.根据物质性质决定用途的化学观念,下列对应关系不正确的是
A.石墨质软-用于制铅笔芯 B.干冰升华吸热-用于人工降雨
C.铝具有良好的抗腐蚀性-用于食品包装袋 D.铜具有导电性-用于作电线
二、填空与简答
13.(1)金刚石和石墨物理性质不同的原因是 ;
(2)一氧化碳和二氧化碳化学性质不同的原因 ;
(3)生铁和钢中 不同,使它们性能上有很大差别。
14.科学方法对化学学习起着事半功倍的作用。分类归纳是研究化学物质的重要方法。
(1)铁丝燃烧生成Fe3O4的过程中 (填“放出”或“吸收”)热量。
(2)铁制品的锈蚀过程,实际上是铁与空气中的 等发生化学反应的过程。
(3)与FeSO4,中铁元素化合价相同的铁的氧化物的化学式是 。
15.“低碳生活,绿色出行”。下图为公共自行车。请回答下列问题:
(1)车架表面喷漆不仅美观,而且可有效防止铁与 接触而生锈。
(2)防止公共自行车链条生锈的有效措施是 。
(3)废旧自行车回收利用的意义是 。
16.图一为探究金属化学性质的实验,图二是金属化学性质网络图.
(1)通过图一中的四个实验能得出三种金属活动性和氢的关系是 (用元素符号表示).
(2)依据图二完成金属性质网络,图二中的A属于 (填物质类别).
(3)镁带在空气中燃烧的现象是剧烈燃烧, ,生成白色固体.
(4)工业上常采用电解法、热还原法、直接加热法冶炼金属,请写出用一氧化碳还原赤铁矿冶铁的化学方程式 .
17.铁是一种重要的金属材料,我国春秋时期就掌握了人工冶铁。但由于铁生锈原因,古代的铁器很少能较好保留下来。
(1)①下面是一个关于铁生锈原因的探究实验:将铁钉放入三个试管中,一个里面是干燥的空气(封口)一个试管里装半试管的水,但要使铁钉有一部分留在空气中,第三个试管里装水且淹没铁钉,上面再用一层油密封,过几天后会发现只有第二个试管里的铁钉生锈了,这个实验证明铁生锈必须满足的条件是 。根据铁生锈原理请你写出一条防铁生锈的方法 。
②向AgNO3和Zn(NO3)2的混合溶液中加入过量Fe粉,充分反应后过滤,滤渣中一定含有 。
(2)铝在工业和生活中应用广泛。
常温下铝与氧气反应生成致密的氧化铝薄膜,所以铝制品具有很好的抗腐蚀性能,铝可制成电线,主要是利用其有良好的延展性和 性。将打磨过的铝片放入FeSO4溶液中,铝表而有明显变化。发生反应的化学方程式为 。
18.A~H都是初中化学中常见的物质,已知A、B都是黑色固体,D、F为红色固体,它们之间的转化关系如图所示。请回答下列问题:
(1)F的化学式为 。
(2)反应③中表现出还原性的物质是 (用化学式表示)。
(3)上述4个反应中,属于置换反应的是 (用反应的序号填空)。
(4)写出反应①的化学方程式: 。
19.“沉睡三千年,一醒惊天下”,三星堆出土的大量文物中,有青铜纵目面具、青铜神树。
【查阅资料】
(1)古代青铜器中含有铜、锡、铅等元素。
(2)测定碳14含量可估算古物的年代,计算公式:
(3)几种离子生成氢氧化物沉淀的pH,如表:
待沉淀的离子 Fe2+ Fe3+ Cu2+ Zn2+ Cd2+ pb2+
开始沉淀时的pH 6.34 1.48 5.2 6.2 7.2 8.0
完全沉淀时的pH 9.7 3.2 6.4 8.0 9.5 8.8
探究一:青铜器的性质
(1)青铜器属于 (选填“金属”或“合成”)材料。
(2)出土的青铜器保存较好,而更晚出土的铁器腐蚀严重,原因是 。
(3)若三星堆某文物测得的n=-0.42,则该文物距今约 年。
探究二:模拟青铜降锌
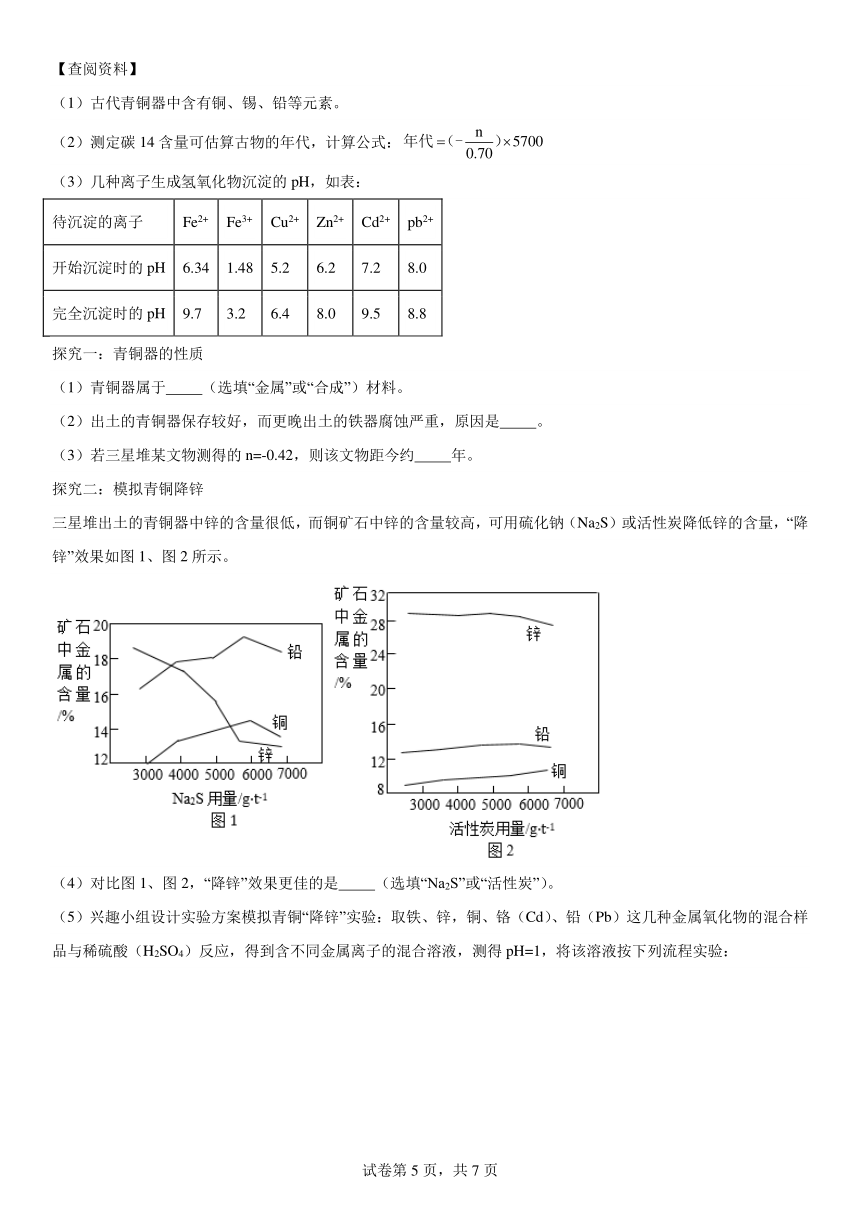
三星堆出土的青铜器中锌的含量很低,而铜矿石中锌的含量较高,可用硫化钠(Na2S)或活性炭降低锌的含量,“降锌”效果如图1、图2所示。
(4)对比图1、图2,“降锌”效果更佳的是 (选填“Na2S”或“活性炭”)。
(5)兴趣小组设计实验方案模拟青铜“降锌”实验:取铁、锌,铜、铬(Cd)、铅(Pb)这几种金属氧化物的混合样品与稀硫酸(H2SO4)反应,得到含不同金属离子的混合溶液,测得pH=1,将该溶液按下列流程实验:
①步骤Ⅰ中加H2O2的目的是 。
②步骤Ⅱ中加ZnO的作用是将溶液的pH调至 (填序号)之间。
A1.48~3.0 B3.2~5.2 C5.2~9.7
③由步骤Ⅲ可判断金属活动性:Zn Cd(选填“大于”或“小于”)
④写出步骤Ⅳ反应的化学方程式 。
三、科学探究题
20.外语校初三化学兴趣小组的同学想为铬(Cr)和锰(Mn)在金属活动性顺序表中找个“家”。已知两种金属可能在下列①~④的位置中。请设计实验确定它们的位置。
K Ca Na Mg ① Al ② Zn ③ Fe Sn Pb (H) Cu ④ Hg Ag Pt Au
【查阅资料】
a.铬是银白色金属,常温下在空气中表面能形成致密的氧化膜。
b.锰是灰白色的金属。
c.CrSO4溶液呈绿色:MnSO4溶液呈淡粉红色。
d.Cr和Mn在下列反应形成的化合物中都显+2价。
(1)通过阅读分析资料,我们知道铬的位置肯定不在 (填“①”“②”“③”“④”)。
【设计实验】
(2)为了实验成功,小明同学先将形状大小相同的几种金属分别进行 (填操作),再进行下述实验:
操作 现象 分析及结论
在锰片中滴加适量的稀硫酸 。 锰是氢(H)前的金属。
在铬片和锰片中分别滴加硫酸铝溶液 铬片表面有固体析出,溶液变绿色,锰片表面没有明显变化 反应的化学方程式是 ,铬、锰、铝的金属活动性由强到弱的顺序是 。
在锰片中滴加硫酸锌溶液 锰片表面没有明显变化 锰的位置在 。
通过以上探究,同学们成功确定铬和锰在金属活动性顺序表中的位置。
四、计算题
21.镁铜合金常用作飞机天线等导电材料,学校化学兴趣小组要测定10g某镁铜合金样品中镁的质量进行如图所示实验。
请计算:
(1)生成气体的质量为_____g。
(2)计算该镁铜合金样品中镁的质量。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A、合金通常比组分金属的熔点更高、硬度更大,该选项不正确;
B、生锈的铁制品属于可回收垃圾,该选项不正确;
C、生铁和钢都是铁合金,两者含碳量不同,该选项正确;
D、铝能和氧气反应生成致密的氧化铝保护膜,不容易生锈,该选项不正确。
故选C。
2.B
【详解】A.工业炼铁的主要原料是铁矿石、焦炭、石灰石等,故正确;
B.工业炼铁的设备是高炉不是电炉,故错误;
C.工业炼铁就是在高温的条件下,用一氧化碳来还原氧化铁,生成铁和二氧化碳,故正确;
D.工业炼的铁中含有杂质,属于生铁,故正确。故选B。
3.A
【详解】①化学变化中常伴随着发光、放热现象,有发光、放热现象产生的不一定是化学变化,例如白炽灯发光,错误;
②合金是由一种金属跟其他金属(或非金属)熔合而成的具有金属特性的物质,正确;
③某气体可能由氢气、一氧化碳、甲烷中的一种或几种组成,将气体点燃后,用干燥的冷烧杯罩在火焰上方,有无色液滴出现说明生成水,原气体中含有氢元素;向烧杯中注入澄清石灰水振荡,石灰水变浑浊说明生成了二氧化碳,原气体中含有碳元素;则该气体的组合有氢气一氧化碳、氢气甲烷、氢气一氧化碳甲烷、甲烷、甲烷一氧化碳,五种情况,错误;
④煤、石油直接使用对环境污染较重,应该进行综合利用,煤的综合利用是对煤进行干馏,在过程中生成了焦炭、煤焦油和焦炉煤气,属于化学变化,石油分馏过程中只是物质的分离,没有生成新物质,属于物理变化,错误;
⑤观察图像可知,少量高锰酸钾首先分解生成锰酸钾和二氧化锰和氧气,故b为高锰酸钾;生成的二氧化锰催化氯酸钾分解生成氧气和氯化钾,故a为氯酸钾、c为氯化钾,错误;
⑥活动性顺序锌大于铁大于铜;将一定量的锌放入硫酸亚铁和硫酸铜的混合溶液中,锌首先和硫酸铜反应生成铜和硫酸锌,锌如果过量再和硫酸亚铁反应生成铁和硫酸锌,锌仍过量的话会有剩余;充分反应后过滤,若向滤渣中加入稀硫酸有气泡产生,则滤渣中一定有铁,但是不确定硫酸亚铁是否反应完全,溶液可能为浅绿色,错误;
故选A。
4.D
【分析】铝能与空气中氧气反应在其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,故收藏家收藏清末铝制品,至今保存完好。
【详解】A、铝的化学性质比较活泼,铝能与空气中氧气反应,故选项说法错误。
B、该艺术品不易腐蚀的主要原因,不是铝的氧化物容易发生还原反应,故选项说法错误。
C、常温下,铝能与氧气反应,故选项说法错误。
D、该艺术品不易腐蚀的主要原因是铝易氧化,但铝表面的氧化铝具有保护内部铝的作用,故选项说法正确。
故选:D。
5.C
【详解】金、银、铜、铅不能与硫酸亚铁溶液反应;金、银、铜不与稀盐酸和稀硫酸反应;最可能是“强水”的是浓硝酸和浓盐酸的混合物可以与金、银、铜、铅、铁反应。故选C。
6.B
【详解】A、久未开启的枯井或地窖中容易积聚大量的二氧化碳,二氧化碳不支持燃烧,进入久未开启的枯井或地窖前可以先做灯火实验,以检验二氧化碳含量是否过高,故选项做法合理;
B、铝锅表面有一层致密的氧化铝薄膜,对铝锅起到保护作用,如果用钢丝球擦洗,可能把氧化铝薄膜擦去,故选项做法不合理;
C、由于铅笔芯的主要成分是石墨,具有滑腻感,所以,长期未用难以开启的铁锁可以在锁孔中加入少量铅笔芯来做润滑剂,故选项做法合理;
D、乙醇是清洁燃料,所以使用乙醇汽油能减少空气污染,故选项做法合理。
故选B。
7.D
【详解】A、洗手后及时关闭水龙头节约水资源,正确;
B、生活垃圾分类放置处理,保护环境,正确;
C、用自备的布袋取代塑料袋购物,减少白色污染,正确;
D、短途出行乘坐私家汽车取代自行车会增加空气污染物,错误;
故选:D。
8.C
【详解】A、金属铁与盐酸反应生成氯化亚铁和氢气,错误;
B、铝的金属活动性比铁强,但铝容易和空气中氧气生成一层致密氧化膜保护了内部金属,故比铁制品更不容易锈蚀,错误;
C、单质中只含一种元素,只含有一种元素的纯净物一定是单质,正确;
D、化学变化一定会伴随着能量的变化,有能量变化的不一定是化学变化,例如氢氧化钠溶于水放热,错误。
故选C。
9.C
【详解】A、水在通电的条件下反应生成氢气和氧气,该反应的化学方程式为:,不符合题意;
B、工业上是分离液态空气制取氧气,不是使用高锰酸钾制取氧气,不符合题意;
C、红磷燃烧生成五氧化二磷,该反应的化学方程式为:,生成物是固体,反应后,能形成压强差,可用于测定空气中氧气含量,符合题意;
D、该反应的反应物都是化合物,不属于置换反应,不符合题意。
故选C。
10.C
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢;位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此根据能否发生反应,可确定三种金属活动性由强到弱的顺序。
【详解】将乙放入甲的硫酸盐溶液中,无明显变化,说明甲比乙活泼;将乙、丙分别放入酸银溶液中,丙表面有固体析出,乙无明显变化,说明丙比银活泼,乙不如银活泼。
A、根据甲比乙活泼,无法确定甲的活泼性是否很强,说法错误;故不符合题意;
B、根据丙比银活泼,不能确定丙是否能与稀硫酸反应,说法错误;故不符合题意;
C、根据乙不如银活泼,银在自然界中可以单质形式存在,乙也在自然界中可以单质形式存在,说法正确;故符合题意;
D、根据甲比乙活泼,丙比银活泼,乙不如银活泼,无法确定三种金属的活动性顺序,说法错误;故不符合题意;
故选C
【点睛】考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
11.C
【详解】A、2Mg+O22MgO,符合“多变一”属于化合反应;故选项错误;
B、2H2O2H2↑+O2↑,符合“一变多”属于分解反应;故选项错误;
C、Fe+CuSO4=FeSO4+Cu,符合“单质+化合物=新单质+新化合物”属于置换反应;故选项正确;
D、NaOH+HCl=NaCl+H2O,符合“两交换、价不变”属于复分解反应;故选项错误;
故选:C。
12.C
【详解】
A、石墨质软,能在纸上留下灰褐色痕迹,所以可用来制铅笔芯,选项正确;
B、干冰升华吸热,使温度降低,用于人工降雨,选项正确;
C、铝具有良好的延展性,用于食品包装袋,选项错误;
D、铜具有导电性,用于作电线,选项正确。
故选:C。
13. 碳原子排列方式不同 分子构成不同 含碳量不同
【详解】(1)金刚石和石墨物理性质不同的原因是:碳原子的排列方式不同;
(2)一氧化碳由一氧化碳分子构成,二氧化碳由二氧化碳分子构成,分子构成不同,故化学性质不同;
(3)生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,生铁和钢中含碳量不同,故性能上有很大差异。
14. 放出 氧气和水 FeO
【详解】(1)铁丝燃烧生成Fe3O4的过程中火星四射,产生黑固体,放出热量。
(2)铁在潮湿的空气中容易生锈,铁制品的锈蚀过程,实际上是铁与空气中的氧气和水等发生化学反应的过程。
(3)FeSO4中铁元素化合价为+2价,+2价铁元素的氧化物是氧化亚铁,化学式是:FeO。
15. 氧气、水 涂油 节约金属资源
【详解】(1)铁生锈的条件是铁与氧气和水接触,车架表面喷漆可有效防止铁与氧气和水接触而生锈;
(2)防止公共自行车链条生锈的有效措施是:涂油,隔绝氧气和水;
(3)废旧自行车含金属材料,回收利用,可以节约金属资源。
16. Al>Fe>H>Cu 盐 发出耀眼的白光,放出热量
【详解】(1)甲实验铜片表面无现象,说明H>Cu;乙实验铁片表面附着一层红色固体,说明Fe>Cu;丙实验,铁片表面有气泡产生,说明Fe>H;丁实验铝片表面附着一层白色固体,说明Al>Fe,通过图一中的四个实验能得出三种金属活动性和氢的关系是:Al>Fe>H >Cu;
(2)金属能与氧气、酸、盐反应,故图二中的A属于盐。
(3)镁带在空气中燃烧的现象是剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体。
(4)赤铁矿主要成分是氧化铁,一氧化碳还原赤铁矿冶铁的化学方程式为:
17.(1) 有氧气(空气)和水 涂油、电镀 喷漆等 铁和银
(2) 导电 2Al+3FeSO4= Al2(SO4)3+3Fe
【详解】(1)第一个试管中只有空气没有水,最后铁钉没有生锈;第二个试管中既有水又有空气,最后铁钉生锈;第三个试管中只有水没有空气,最后铁钉没有生锈;三个试管说明铁生锈必须与空气中的氧气和水同时接触。防止生锈的方法包括:电镀、涂油、喷漆、搪瓷等。向硝酸银和硝酸锌溶液中加入过量铁粉,由于金属活动性An>Fe>Ag,故加入过量铁粉后,铁只与硝酸银反应生成硝酸亚铁和银,且过量铁粉反应后有剩余,故滤渣中一定含有生成的银和没有反应完的铁。
(2)铝可制成电线,说明铝的延展性好,且具有导电性。铝和硫酸亚铁生成硫酸铝和铁,化学方程式为2Al+3FeSO4= Al2(SO4)3+3Fe。
18.(1)Fe2O3
(2)CO
(3)①④
(4)
【分析】A、B都是黑色固体,在高温的条件下反应生成红色固体D,可推断A、B是单质碳或氧化铜,红色固体D应为铜,C自然为二氧化碳,C能与A在高温下反应,说明A为单质碳,E则为一氧化碳,F为红色固体,可推断为氧化铁,应为G要转化为单质铜,故G为单质铁,则H为可溶性铜盐;代入验证,推断正确。
【详解】(1)F为红色固体,为氧化铁,化学式为:Fe2O3;
(2)反应③是CO还原氧化铁,CO在反应中得到氧,表现出还原性,故化学式:CO;
(3)置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应,上述4个反应中属于置换反应的是:氧化铜和碳在高温的条件下生成铜和二氧化碳,铁和硫酸铜反应生成硫酸亚铁和铜,即①④;
(4)反应①是碳和氧化铜在高温下反应,化学方程式:。
19. 金属 合金的抗腐蚀性优于纯金属 3420 Na2S 将亚铁离子转变为三价铁离子 B 大于
【详解】(1)青铜属于合金材料;
(2)合金材料的抗腐蚀性优于铁,因此铁器腐蚀会严重;
(3)根据题意,代入题中所给公式可求年代为3420年;
(4)根据图像可知,使用Na2S会让锌的含量减小明显,故填:Na2S;
(5)①加入过氧化氢后,溶液中亚铁离子变成了三价铁离子,因此作用是将亚铁离子转变为三价铁离子;
②根据题意,为了使三价铁圈变成沉淀,溶液的pH应控制在大于3.2,为了使其他离子不产生沉淀,只需要保证铜离子不产生沉淀即可,因此pH要小于5.2,所以溶液的pH可以调至3.2~5.2,故选B;
③加入锌后,镉元素被置换,说明金属活动性锌大于镉,故填:大于;
④最后滤液为硫酸锌,可以和硫化钠反应:。
【点睛】
20.(1)④
(2) 打磨 锰片表面产生气泡 Cr>Al>Mn ③
【详解】(1)根据题干资料显示铬常温下在空气中表面能形成致密的氧化膜,说明铬常温下能与氧气反应,则铬化学性质活泼,铜常温下不与氧气反应,则Cr金属活动性大于Cu,位置在Cu之前,故Cr肯定不在位置④;
(2)为了实验成功,先将形状大小相同的几种金属分别进行打磨,去除表面的杂质和氧化膜,再进行下述实验:
根据分析及结论可知,锰是氢(H)前的金属,则Mn能与稀硫酸反应生成氢气,故在锰片中滴加稀硫酸能观察到锰表面有气泡产生;
CrSO4溶液呈绿色,在铬片和锰片中分别滴加硫酸铝溶液,铬片表面有固体析出,溶液变绿色,锰片表面没有明显变化,说明铬能置换出硫酸铝中的铝同时生成硫酸铬,化学方程式为:,说明铬的金属活动性大于铝,锰片不能与硫酸铝反应,说明锰的金属活动性小于铝,综上得出金属活动性Cr>Al>Mn;
在锰片中滴加ZnSO4溶液,锰片表面没有明显变化,说明锰不能置换出硫酸锌中的锌,则金属活动性Zn>Mn,锰是氢(H)前的金属,综上分析得出Mn的位置应该在③处。
21.(1)0.3
(2)解:设镁铜合金样品中镁的质量为x
答:镁铜合金样品中镁的质量为3.6g。
【详解】(1)铜的活动性较弱,不和稀硫酸反应;镁和稀硫酸反应生产氢气逸出,烧杯中物质总质量的减少就是生成气体的质量为100g+10g-109.7g=0.3g;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.生活中处处可以用到大量金属材料。下列有关金属材料的说法正确的是
A.合金通常比组分金属的熔点更高、硬度更小
B.生锈的铁制品回收成本高,属于不可回收垃圾
C.生铁和钢都是铁合金,两者含碳量不同
D.铝的金属活动性比铁强,所以在空气中铝比铁更易腐蚀
2.下列关于工业炼铁的叙述中错误的是
A.主要原料为铁矿石、焦炭和石灰石等
B.主要设备为电炉
C.主要原理为:3CO+Fe2O33CO2+2Fe
D.主要产物为生铁
3.归纳和推理是化学学习常用的思维方法。下列说法中正确的有( )
①化学变化中常伴随着发光、放热现象,所以有发光、放热现象产生的一定是化学变化
②合金是由一种金属跟其他金属(或非金属)熔合而成的具有金属特性的物质
③某气体可能由氢气、一氧化碳、甲烷中的一种或几种组成,将气体点燃后,用干燥的冷烧杯罩在火焰上方,有无色液滴出现,向烧杯中注入澄清石灰水振荡,石灰水变浑浊,则该气体的组合最多有四种情况
④煤、石油直接使用对环境污染较重,应该进行综合利用,而两者综合利用的过程都属于化学变化
⑤某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如下图所示:
若a表示氯酸钾、b表示高锰酸钾,则c可以表示氧气。
⑥将一定量的锌放入硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤;若向滤渣中加入稀硫酸有气泡产生,则溶液一定为无色。
A.1条 B.2条 C.3条 D.4条
4.收藏家收藏清末铝制品,至今保存完好,该艺术品不易腐蚀的主要原因是
A.铝的化学性质不活泼,不易发生化学反应 B.铝的氧化物容易发生还原反应
C.常温下,铝不参与氧气反应 D.铝易氧化,但铝表面的氧化铝具有保护内部铝的作用
5.假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )
A.硫酸亚铁溶液 B.稀盐酸 C.浓硝酸和浓盐酸的混合物 D.稀硫酸
6.生活处处有化学。从化学的角度看,下列做法不合理的是
A.进入久未开启的枯井或地窖,先做灯火实验
B.用钢丝球擦洗铝制品表面的污渍
C.铁锁锈蚀无法用钥匙打开,向锁眼处涂铅笔芯粉末,能很快开启
D.使用乙醇汽油能减少空气污染
7.2020年世界环境 日中国的主题是“美丽中国,我是行动者”。下列做法不可取的是
A.洗手后及时关闭水龙头 B.生活垃圾分类放置处理
C.用自备的布袋取代塑料袋购物 D.短途出行乘坐私家汽车取代自行车
8.推理是一种化学思维方法,以下推理合理的是
A.因为铝和盐酸反应生成AlCl3和H2,则金属铁与盐酸反应生成FeCl3和H2
B.铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀
C.单质中只含一种元素,只含有一种元素的纯净物一定是单质
D.化学变化一定会伴随着能量的变化,所以有能量变化的一定是化学变化
9.下列化学方程式书写正确且和描述相符的是
A.电解水实验:
B.王业上使用高锰酸钾制取氧气:
C.红磷燃烧测定空气中氧气的含量:
D.有铜生成的置换反应:
10.现有甲、乙、丙三种金属,将乙放入甲的硫酸盐溶液中,无明显变化;将乙、丙分别放入硝酸银溶液中,丙表面有固体析出,乙无明显变化。下列说法正确的是( )
A.甲在空气中一定易被腐蚀
B.将丙放入稀硫酸中一定会产生气泡
C.乙在自然界中可以单质形式存在
D.三种金属的活动性顺序为甲>乙>丙
11.下列反应中属于置换反应的是( )
A.2Mg+O22MgO B.2H2O2H2↑+O2↑
C.Fe+CuSO4=FeSO4+Cu D.NaOH+HCl=NaCl+H2O
12.根据物质性质决定用途的化学观念,下列对应关系不正确的是
A.石墨质软-用于制铅笔芯 B.干冰升华吸热-用于人工降雨
C.铝具有良好的抗腐蚀性-用于食品包装袋 D.铜具有导电性-用于作电线
二、填空与简答
13.(1)金刚石和石墨物理性质不同的原因是 ;
(2)一氧化碳和二氧化碳化学性质不同的原因 ;
(3)生铁和钢中 不同,使它们性能上有很大差别。
14.科学方法对化学学习起着事半功倍的作用。分类归纳是研究化学物质的重要方法。
(1)铁丝燃烧生成Fe3O4的过程中 (填“放出”或“吸收”)热量。
(2)铁制品的锈蚀过程,实际上是铁与空气中的 等发生化学反应的过程。
(3)与FeSO4,中铁元素化合价相同的铁的氧化物的化学式是 。
15.“低碳生活,绿色出行”。下图为公共自行车。请回答下列问题:
(1)车架表面喷漆不仅美观,而且可有效防止铁与 接触而生锈。
(2)防止公共自行车链条生锈的有效措施是 。
(3)废旧自行车回收利用的意义是 。
16.图一为探究金属化学性质的实验,图二是金属化学性质网络图.
(1)通过图一中的四个实验能得出三种金属活动性和氢的关系是 (用元素符号表示).
(2)依据图二完成金属性质网络,图二中的A属于 (填物质类别).
(3)镁带在空气中燃烧的现象是剧烈燃烧, ,生成白色固体.
(4)工业上常采用电解法、热还原法、直接加热法冶炼金属,请写出用一氧化碳还原赤铁矿冶铁的化学方程式 .
17.铁是一种重要的金属材料,我国春秋时期就掌握了人工冶铁。但由于铁生锈原因,古代的铁器很少能较好保留下来。
(1)①下面是一个关于铁生锈原因的探究实验:将铁钉放入三个试管中,一个里面是干燥的空气(封口)一个试管里装半试管的水,但要使铁钉有一部分留在空气中,第三个试管里装水且淹没铁钉,上面再用一层油密封,过几天后会发现只有第二个试管里的铁钉生锈了,这个实验证明铁生锈必须满足的条件是 。根据铁生锈原理请你写出一条防铁生锈的方法 。
②向AgNO3和Zn(NO3)2的混合溶液中加入过量Fe粉,充分反应后过滤,滤渣中一定含有 。
(2)铝在工业和生活中应用广泛。
常温下铝与氧气反应生成致密的氧化铝薄膜,所以铝制品具有很好的抗腐蚀性能,铝可制成电线,主要是利用其有良好的延展性和 性。将打磨过的铝片放入FeSO4溶液中,铝表而有明显变化。发生反应的化学方程式为 。
18.A~H都是初中化学中常见的物质,已知A、B都是黑色固体,D、F为红色固体,它们之间的转化关系如图所示。请回答下列问题:
(1)F的化学式为 。
(2)反应③中表现出还原性的物质是 (用化学式表示)。
(3)上述4个反应中,属于置换反应的是 (用反应的序号填空)。
(4)写出反应①的化学方程式: 。
19.“沉睡三千年,一醒惊天下”,三星堆出土的大量文物中,有青铜纵目面具、青铜神树。
【查阅资料】
(1)古代青铜器中含有铜、锡、铅等元素。
(2)测定碳14含量可估算古物的年代,计算公式:
(3)几种离子生成氢氧化物沉淀的pH,如表:
待沉淀的离子 Fe2+ Fe3+ Cu2+ Zn2+ Cd2+ pb2+
开始沉淀时的pH 6.34 1.48 5.2 6.2 7.2 8.0
完全沉淀时的pH 9.7 3.2 6.4 8.0 9.5 8.8
探究一:青铜器的性质
(1)青铜器属于 (选填“金属”或“合成”)材料。
(2)出土的青铜器保存较好,而更晚出土的铁器腐蚀严重,原因是 。
(3)若三星堆某文物测得的n=-0.42,则该文物距今约 年。
探究二:模拟青铜降锌
三星堆出土的青铜器中锌的含量很低,而铜矿石中锌的含量较高,可用硫化钠(Na2S)或活性炭降低锌的含量,“降锌”效果如图1、图2所示。
(4)对比图1、图2,“降锌”效果更佳的是 (选填“Na2S”或“活性炭”)。
(5)兴趣小组设计实验方案模拟青铜“降锌”实验:取铁、锌,铜、铬(Cd)、铅(Pb)这几种金属氧化物的混合样品与稀硫酸(H2SO4)反应,得到含不同金属离子的混合溶液,测得pH=1,将该溶液按下列流程实验:
①步骤Ⅰ中加H2O2的目的是 。
②步骤Ⅱ中加ZnO的作用是将溶液的pH调至 (填序号)之间。
A1.48~3.0 B3.2~5.2 C5.2~9.7
③由步骤Ⅲ可判断金属活动性:Zn Cd(选填“大于”或“小于”)
④写出步骤Ⅳ反应的化学方程式 。
三、科学探究题
20.外语校初三化学兴趣小组的同学想为铬(Cr)和锰(Mn)在金属活动性顺序表中找个“家”。已知两种金属可能在下列①~④的位置中。请设计实验确定它们的位置。
K Ca Na Mg ① Al ② Zn ③ Fe Sn Pb (H) Cu ④ Hg Ag Pt Au
【查阅资料】
a.铬是银白色金属,常温下在空气中表面能形成致密的氧化膜。
b.锰是灰白色的金属。
c.CrSO4溶液呈绿色:MnSO4溶液呈淡粉红色。
d.Cr和Mn在下列反应形成的化合物中都显+2价。
(1)通过阅读分析资料,我们知道铬的位置肯定不在 (填“①”“②”“③”“④”)。
【设计实验】
(2)为了实验成功,小明同学先将形状大小相同的几种金属分别进行 (填操作),再进行下述实验:
操作 现象 分析及结论
在锰片中滴加适量的稀硫酸 。 锰是氢(H)前的金属。
在铬片和锰片中分别滴加硫酸铝溶液 铬片表面有固体析出,溶液变绿色,锰片表面没有明显变化 反应的化学方程式是 ,铬、锰、铝的金属活动性由强到弱的顺序是 。
在锰片中滴加硫酸锌溶液 锰片表面没有明显变化 锰的位置在 。
通过以上探究,同学们成功确定铬和锰在金属活动性顺序表中的位置。
四、计算题
21.镁铜合金常用作飞机天线等导电材料,学校化学兴趣小组要测定10g某镁铜合金样品中镁的质量进行如图所示实验。
请计算:
(1)生成气体的质量为_____g。
(2)计算该镁铜合金样品中镁的质量。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A、合金通常比组分金属的熔点更高、硬度更大,该选项不正确;
B、生锈的铁制品属于可回收垃圾,该选项不正确;
C、生铁和钢都是铁合金,两者含碳量不同,该选项正确;
D、铝能和氧气反应生成致密的氧化铝保护膜,不容易生锈,该选项不正确。
故选C。
2.B
【详解】A.工业炼铁的主要原料是铁矿石、焦炭、石灰石等,故正确;
B.工业炼铁的设备是高炉不是电炉,故错误;
C.工业炼铁就是在高温的条件下,用一氧化碳来还原氧化铁,生成铁和二氧化碳,故正确;
D.工业炼的铁中含有杂质,属于生铁,故正确。故选B。
3.A
【详解】①化学变化中常伴随着发光、放热现象,有发光、放热现象产生的不一定是化学变化,例如白炽灯发光,错误;
②合金是由一种金属跟其他金属(或非金属)熔合而成的具有金属特性的物质,正确;
③某气体可能由氢气、一氧化碳、甲烷中的一种或几种组成,将气体点燃后,用干燥的冷烧杯罩在火焰上方,有无色液滴出现说明生成水,原气体中含有氢元素;向烧杯中注入澄清石灰水振荡,石灰水变浑浊说明生成了二氧化碳,原气体中含有碳元素;则该气体的组合有氢气一氧化碳、氢气甲烷、氢气一氧化碳甲烷、甲烷、甲烷一氧化碳,五种情况,错误;
④煤、石油直接使用对环境污染较重,应该进行综合利用,煤的综合利用是对煤进行干馏,在过程中生成了焦炭、煤焦油和焦炉煤气,属于化学变化,石油分馏过程中只是物质的分离,没有生成新物质,属于物理变化,错误;
⑤观察图像可知,少量高锰酸钾首先分解生成锰酸钾和二氧化锰和氧气,故b为高锰酸钾;生成的二氧化锰催化氯酸钾分解生成氧气和氯化钾,故a为氯酸钾、c为氯化钾,错误;
⑥活动性顺序锌大于铁大于铜;将一定量的锌放入硫酸亚铁和硫酸铜的混合溶液中,锌首先和硫酸铜反应生成铜和硫酸锌,锌如果过量再和硫酸亚铁反应生成铁和硫酸锌,锌仍过量的话会有剩余;充分反应后过滤,若向滤渣中加入稀硫酸有气泡产生,则滤渣中一定有铁,但是不确定硫酸亚铁是否反应完全,溶液可能为浅绿色,错误;
故选A。
4.D
【分析】铝能与空气中氧气反应在其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,故收藏家收藏清末铝制品,至今保存完好。
【详解】A、铝的化学性质比较活泼,铝能与空气中氧气反应,故选项说法错误。
B、该艺术品不易腐蚀的主要原因,不是铝的氧化物容易发生还原反应,故选项说法错误。
C、常温下,铝能与氧气反应,故选项说法错误。
D、该艺术品不易腐蚀的主要原因是铝易氧化,但铝表面的氧化铝具有保护内部铝的作用,故选项说法正确。
故选:D。
5.C
【详解】金、银、铜、铅不能与硫酸亚铁溶液反应;金、银、铜不与稀盐酸和稀硫酸反应;最可能是“强水”的是浓硝酸和浓盐酸的混合物可以与金、银、铜、铅、铁反应。故选C。
6.B
【详解】A、久未开启的枯井或地窖中容易积聚大量的二氧化碳,二氧化碳不支持燃烧,进入久未开启的枯井或地窖前可以先做灯火实验,以检验二氧化碳含量是否过高,故选项做法合理;
B、铝锅表面有一层致密的氧化铝薄膜,对铝锅起到保护作用,如果用钢丝球擦洗,可能把氧化铝薄膜擦去,故选项做法不合理;
C、由于铅笔芯的主要成分是石墨,具有滑腻感,所以,长期未用难以开启的铁锁可以在锁孔中加入少量铅笔芯来做润滑剂,故选项做法合理;
D、乙醇是清洁燃料,所以使用乙醇汽油能减少空气污染,故选项做法合理。
故选B。
7.D
【详解】A、洗手后及时关闭水龙头节约水资源,正确;
B、生活垃圾分类放置处理,保护环境,正确;
C、用自备的布袋取代塑料袋购物,减少白色污染,正确;
D、短途出行乘坐私家汽车取代自行车会增加空气污染物,错误;
故选:D。
8.C
【详解】A、金属铁与盐酸反应生成氯化亚铁和氢气,错误;
B、铝的金属活动性比铁强,但铝容易和空气中氧气生成一层致密氧化膜保护了内部金属,故比铁制品更不容易锈蚀,错误;
C、单质中只含一种元素,只含有一种元素的纯净物一定是单质,正确;
D、化学变化一定会伴随着能量的变化,有能量变化的不一定是化学变化,例如氢氧化钠溶于水放热,错误。
故选C。
9.C
【详解】A、水在通电的条件下反应生成氢气和氧气,该反应的化学方程式为:,不符合题意;
B、工业上是分离液态空气制取氧气,不是使用高锰酸钾制取氧气,不符合题意;
C、红磷燃烧生成五氧化二磷,该反应的化学方程式为:,生成物是固体,反应后,能形成压强差,可用于测定空气中氧气含量,符合题意;
D、该反应的反应物都是化合物,不属于置换反应,不符合题意。
故选C。
10.C
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢;位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此根据能否发生反应,可确定三种金属活动性由强到弱的顺序。
【详解】将乙放入甲的硫酸盐溶液中,无明显变化,说明甲比乙活泼;将乙、丙分别放入酸银溶液中,丙表面有固体析出,乙无明显变化,说明丙比银活泼,乙不如银活泼。
A、根据甲比乙活泼,无法确定甲的活泼性是否很强,说法错误;故不符合题意;
B、根据丙比银活泼,不能确定丙是否能与稀硫酸反应,说法错误;故不符合题意;
C、根据乙不如银活泼,银在自然界中可以单质形式存在,乙也在自然界中可以单质形式存在,说法正确;故符合题意;
D、根据甲比乙活泼,丙比银活泼,乙不如银活泼,无法确定三种金属的活动性顺序,说法错误;故不符合题意;
故选C
【点睛】考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
11.C
【详解】A、2Mg+O22MgO,符合“多变一”属于化合反应;故选项错误;
B、2H2O2H2↑+O2↑,符合“一变多”属于分解反应;故选项错误;
C、Fe+CuSO4=FeSO4+Cu,符合“单质+化合物=新单质+新化合物”属于置换反应;故选项正确;
D、NaOH+HCl=NaCl+H2O,符合“两交换、价不变”属于复分解反应;故选项错误;
故选:C。
12.C
【详解】
A、石墨质软,能在纸上留下灰褐色痕迹,所以可用来制铅笔芯,选项正确;
B、干冰升华吸热,使温度降低,用于人工降雨,选项正确;
C、铝具有良好的延展性,用于食品包装袋,选项错误;
D、铜具有导电性,用于作电线,选项正确。
故选:C。
13. 碳原子排列方式不同 分子构成不同 含碳量不同
【详解】(1)金刚石和石墨物理性质不同的原因是:碳原子的排列方式不同;
(2)一氧化碳由一氧化碳分子构成,二氧化碳由二氧化碳分子构成,分子构成不同,故化学性质不同;
(3)生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,生铁和钢中含碳量不同,故性能上有很大差异。
14. 放出 氧气和水 FeO
【详解】(1)铁丝燃烧生成Fe3O4的过程中火星四射,产生黑固体,放出热量。
(2)铁在潮湿的空气中容易生锈,铁制品的锈蚀过程,实际上是铁与空气中的氧气和水等发生化学反应的过程。
(3)FeSO4中铁元素化合价为+2价,+2价铁元素的氧化物是氧化亚铁,化学式是:FeO。
15. 氧气、水 涂油 节约金属资源
【详解】(1)铁生锈的条件是铁与氧气和水接触,车架表面喷漆可有效防止铁与氧气和水接触而生锈;
(2)防止公共自行车链条生锈的有效措施是:涂油,隔绝氧气和水;
(3)废旧自行车含金属材料,回收利用,可以节约金属资源。
16. Al>Fe>H>Cu 盐 发出耀眼的白光,放出热量
【详解】(1)甲实验铜片表面无现象,说明H>Cu;乙实验铁片表面附着一层红色固体,说明Fe>Cu;丙实验,铁片表面有气泡产生,说明Fe>H;丁实验铝片表面附着一层白色固体,说明Al>Fe,通过图一中的四个实验能得出三种金属活动性和氢的关系是:Al>Fe>H >Cu;
(2)金属能与氧气、酸、盐反应,故图二中的A属于盐。
(3)镁带在空气中燃烧的现象是剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体。
(4)赤铁矿主要成分是氧化铁,一氧化碳还原赤铁矿冶铁的化学方程式为:
17.(1) 有氧气(空气)和水 涂油、电镀 喷漆等 铁和银
(2) 导电 2Al+3FeSO4= Al2(SO4)3+3Fe
【详解】(1)第一个试管中只有空气没有水,最后铁钉没有生锈;第二个试管中既有水又有空气,最后铁钉生锈;第三个试管中只有水没有空气,最后铁钉没有生锈;三个试管说明铁生锈必须与空气中的氧气和水同时接触。防止生锈的方法包括:电镀、涂油、喷漆、搪瓷等。向硝酸银和硝酸锌溶液中加入过量铁粉,由于金属活动性An>Fe>Ag,故加入过量铁粉后,铁只与硝酸银反应生成硝酸亚铁和银,且过量铁粉反应后有剩余,故滤渣中一定含有生成的银和没有反应完的铁。
(2)铝可制成电线,说明铝的延展性好,且具有导电性。铝和硫酸亚铁生成硫酸铝和铁,化学方程式为2Al+3FeSO4= Al2(SO4)3+3Fe。
18.(1)Fe2O3
(2)CO
(3)①④
(4)
【分析】A、B都是黑色固体,在高温的条件下反应生成红色固体D,可推断A、B是单质碳或氧化铜,红色固体D应为铜,C自然为二氧化碳,C能与A在高温下反应,说明A为单质碳,E则为一氧化碳,F为红色固体,可推断为氧化铁,应为G要转化为单质铜,故G为单质铁,则H为可溶性铜盐;代入验证,推断正确。
【详解】(1)F为红色固体,为氧化铁,化学式为:Fe2O3;
(2)反应③是CO还原氧化铁,CO在反应中得到氧,表现出还原性,故化学式:CO;
(3)置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应,上述4个反应中属于置换反应的是:氧化铜和碳在高温的条件下生成铜和二氧化碳,铁和硫酸铜反应生成硫酸亚铁和铜,即①④;
(4)反应①是碳和氧化铜在高温下反应,化学方程式:。
19. 金属 合金的抗腐蚀性优于纯金属 3420 Na2S 将亚铁离子转变为三价铁离子 B 大于
【详解】(1)青铜属于合金材料;
(2)合金材料的抗腐蚀性优于铁,因此铁器腐蚀会严重;
(3)根据题意,代入题中所给公式可求年代为3420年;
(4)根据图像可知,使用Na2S会让锌的含量减小明显,故填:Na2S;
(5)①加入过氧化氢后,溶液中亚铁离子变成了三价铁离子,因此作用是将亚铁离子转变为三价铁离子;
②根据题意,为了使三价铁圈变成沉淀,溶液的pH应控制在大于3.2,为了使其他离子不产生沉淀,只需要保证铜离子不产生沉淀即可,因此pH要小于5.2,所以溶液的pH可以调至3.2~5.2,故选B;
③加入锌后,镉元素被置换,说明金属活动性锌大于镉,故填:大于;
④最后滤液为硫酸锌,可以和硫化钠反应:。
【点睛】
20.(1)④
(2) 打磨 锰片表面产生气泡 Cr>Al>Mn ③
【详解】(1)根据题干资料显示铬常温下在空气中表面能形成致密的氧化膜,说明铬常温下能与氧气反应,则铬化学性质活泼,铜常温下不与氧气反应,则Cr金属活动性大于Cu,位置在Cu之前,故Cr肯定不在位置④;
(2)为了实验成功,先将形状大小相同的几种金属分别进行打磨,去除表面的杂质和氧化膜,再进行下述实验:
根据分析及结论可知,锰是氢(H)前的金属,则Mn能与稀硫酸反应生成氢气,故在锰片中滴加稀硫酸能观察到锰表面有气泡产生;
CrSO4溶液呈绿色,在铬片和锰片中分别滴加硫酸铝溶液,铬片表面有固体析出,溶液变绿色,锰片表面没有明显变化,说明铬能置换出硫酸铝中的铝同时生成硫酸铬,化学方程式为:,说明铬的金属活动性大于铝,锰片不能与硫酸铝反应,说明锰的金属活动性小于铝,综上得出金属活动性Cr>Al>Mn;
在锰片中滴加ZnSO4溶液,锰片表面没有明显变化,说明锰不能置换出硫酸锌中的锌,则金属活动性Zn>Mn,锰是氢(H)前的金属,综上分析得出Mn的位置应该在③处。
21.(1)0.3
(2)解:设镁铜合金样品中镁的质量为x
答:镁铜合金样品中镁的质量为3.6g。
【详解】(1)铜的活动性较弱,不和稀硫酸反应;镁和稀硫酸反应生产氢气逸出,烧杯中物质总质量的减少就是生成气体的质量为100g+10g-109.7g=0.3g;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
同课章节目录
