2.2 课时1 化学反应中能量变化的本质及转化形式 课件 (共24张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.2 课时1 化学反应中能量变化的本质及转化形式 课件 (共24张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 17:37:09 | ||
图片预览







文档简介
(共24张PPT)
第2章 化学键 化学反应规律
第2节 化学反应与能量转化 课时1
1.知道物质具有能量,了解化学能与热能的相互转化,建立吸热反应、放热反应的概念。
2.能够从化学键的断裂与形成角度理解化学反应的实质及化学反应中能量变化的实质。
化学反应的利用
物质变化
能量变化
应用
应用
制
备
物
质
提
供
能
量
问题:
化学反应中通常伴随着怎样的能量变化?
联想·质疑
一、化学反应中的能量转化形式
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
化学能
热能、光能
化学能
电能
化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
活动·探究
感受化学反应中的能量变化
观看下列两个实验视频并记录实验现象
【实验1-1】
【实验1-2】
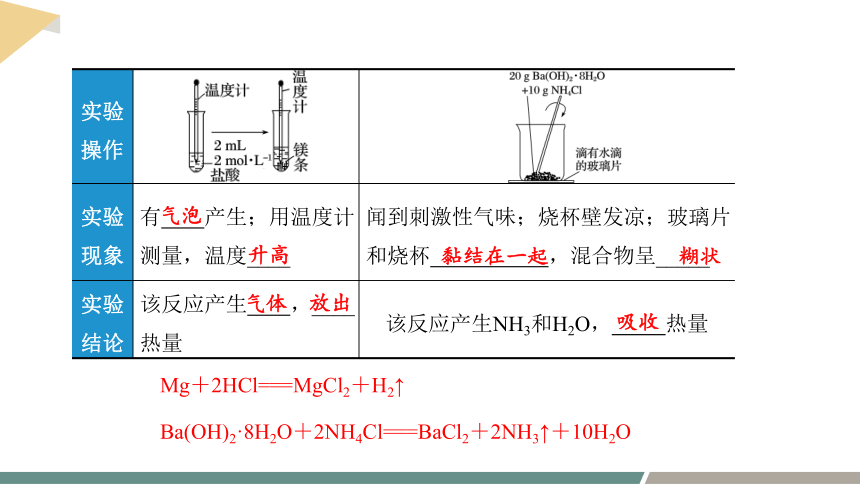
实验 操作
实验 现象 有 产生;用温度计测量,温度____ 闻到刺激性气味;烧杯壁发凉;玻璃片和烧杯 ,混合物呈_____
实验 结论 该反应产生 ,____ 热量 该反应产生NH3和H2O, 热量
气泡
升高
黏结在一起
糊状
气体
放出
吸收
Mg+2HCl===MgCl2+H2↑
Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
【结论】
化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的 热量,有的 热量。
放出
吸收
1.放热反应与吸热反应
①放热反应:释放热量的化学反应。
②吸热反应:吸收热量的化学反应。
你还知道哪些反应是放热反应,哪些反应是吸热反应,请举例说明。
?
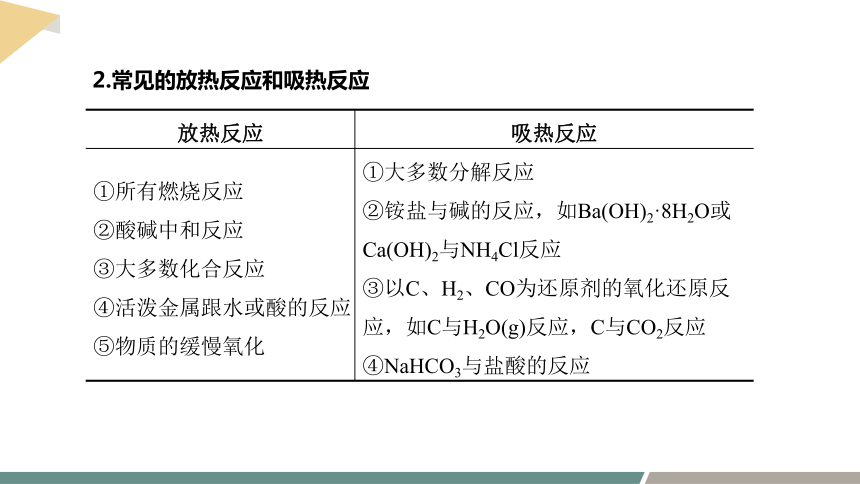
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
2.常见的放热反应和吸热反应
有关吸热反应和放热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如Ba(OH)2·8H2O与NH4Cl的反应在常温下能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
归纳总结
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)化学反应既有物质变化,又有能量变化( )
(4)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(5)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
×
×
√
×
×
[练一练]
判断正误
化学反应中为什么会有能量的变化?
反应吸热还是放热是由什么决定的呢?
断裂:氢氧键
形成:氢氢键
形成:氧氧键
2H2O 2H2 + O2
通电
二、化学反应中的能量变化的本质
宏观
微观
生成了新的物质,能量变化
旧化学键断裂、新化学键形成
吸收能量
放出能量
1.从化学键的角度分析化学反应中能量变化(微观角度)
交流·研讨
请根据下列信息判断氢气燃烧生成水蒸气时是吸收能量还是释放能量。
断键吸收的能量=436kj+249kj=685kj
成键释放的能量=930kj
生成1 molH20释放能量=930kj-685kj=245kj
释放能量>吸收能量,反应过程释放能量
E1<E2
e1>e2
释放能量
吸收能量
反应物
新键形成释放能量E2
放热反应
吸热反应
旧键断裂吸收能量E1
生成物
化学反应的实质
一个化学反应是否为放热还是吸热取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
反
应
物
旧化学 键断裂
新化学 键形成
吸收能量
释放能量
生
成
物
决定
能
量
变
化
释放能量大于吸收能量:放热反应
吸收能量大于释放能量:吸热反应
不同的物质不仅组成不同、结构不同,其内部所储存的能量(化学能)也不同,是否可以从物质自身储存的化学能的变化来分析化学反应能量变化的原因呢?
2.从物质内部能量的角度分析化学反应中能量变化(宏观角度)
反应物
生成物
能量E(生)
能量E(反)
E(反) >E(生)
释放能量
E(反) < E(生)
吸收能量
热能、光能、电能
热能、光能、电能
放热反应 吸热反应
化学能转化为热能
热能转化为化学能被生成物“储存”
放热反应
吸热反应
反应物的总能量>生成物的总能量
反应物的总能量<生成物的总能量
化
学
能
热能
电能
热能
光能
电能
光能
铝热反应焊接钢轨
三、化学能与其他形式的能量相互转化的应用
最具发展潜力的清洁能源——氢能
氢能被视为 21 世纪最具发展潜力的清洁能源,世界上许多国家和地区已经广泛开展了氢能研究。
20 世纪 50 年代,科学家利用液氢作为超音速和亚音速飞机的燃料,成功地使氢能飞机上天。
氢氧燃料电池被认为是利用氢能解决未来人类能源危机的途径之一。氢氧燃料电池可将化学能直接转换为电能,能量转换效率通常为 60% ~ 80%,而且污染少、噪音小、装置可大可小、使用方便。
[练一练]
1.判断正误。
(1)对于一个化学反应来说,当化学键断裂时吸收的能量大于化学键形成时放出的能量,则反应放热( )
(2)相同条件下形成1 mol H—Cl键放出的能量与断开1 mol H—Cl键吸收的能量相等( )
(3)任何化学反应,都有物质变化,同时伴随着能量变化( )
(4)放热反应为“贮存”能量的过程,吸热反应为“释放”能量的过程( )
(5)已知Fe与稀盐酸的反应为放热反应,即Fe的能量大于H2的能量( )
×
√
√
×
×
2.如图是某化学反应过程中能量变化的曲线图。下列叙述正确的是( )
A.该反应为吸热反应
B.该图可以表示Zn与HCl溶液反应的能量变化
C.该反应先发生物质变化后发生能量变化
D.断开反应物中化学键吸收的能量大于形成生成物中化学键放出的能量
B
3.已知2H→H2的能量变化如图所示。下列说法不正确的是( )
A.2H→H2过程中形成的化学键是共价键
B.相同质量的氢气分子的能量比氢原子的能量低
C.2H→H2过程中形成1 mol新化学键放出437.6 kJ的能量
D.1 mol H2离解成2 mol H要放出437.6 kJ热量
D
4.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收
180 kJ能量,反应过程中能量变化如图所示。
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量_____(填“高于”或“低于”)生成物的总能量。
(2)1 mol NO(g)分子中的化学键断裂时要吸收____ kJ能量。
(3)断裂1 mol N≡N吸收的能量x值为____。
低于
632
946
【解析】根据图示,断裂旧化学键所吸收能量为(x+498)kJ,形成新化学键所释放能量为2×632 kJ=1 264 kJ,每生成2 mol NO(g)所吸收能量为180 kJ,因此有180 kJ=(x+498)kJ-1 264 kJ,故x为946。
化学反应
实质
特征
旧化学键断裂和新化学键形成
能量变化
物质变化
形式
本质
能量形式
反应类型
化学能转化为热能、电能等
吸热反应
放热反应
化学键
物质能量
断键吸收能量和成键释放能量的相对大小
反应物总能量和生成物总能量相对大小
第2章 化学键 化学反应规律
第2节 化学反应与能量转化 课时1
1.知道物质具有能量,了解化学能与热能的相互转化,建立吸热反应、放热反应的概念。
2.能够从化学键的断裂与形成角度理解化学反应的实质及化学反应中能量变化的实质。
化学反应的利用
物质变化
能量变化
应用
应用
制
备
物
质
提
供
能
量
问题:
化学反应中通常伴随着怎样的能量变化?
联想·质疑
一、化学反应中的能量转化形式
在以下两个你熟悉的化学反应中,除了物质的变化外是否还有能量的变化?如果有,是什么样的能量变化?
化学能
热能、光能
化学能
电能
化学能
化学能是指储存在物质当中的能量。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。
活动·探究
感受化学反应中的能量变化
观看下列两个实验视频并记录实验现象
【实验1-1】
【实验1-2】
实验 操作
实验 现象 有 产生;用温度计测量,温度____ 闻到刺激性气味;烧杯壁发凉;玻璃片和烧杯 ,混合物呈_____
实验 结论 该反应产生 ,____ 热量 该反应产生NH3和H2O, 热量
气泡
升高
黏结在一起
糊状
气体
放出
吸收
Mg+2HCl===MgCl2+H2↑
Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
【结论】
化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的 热量,有的 热量。
放出
吸收
1.放热反应与吸热反应
①放热反应:释放热量的化学反应。
②吸热反应:吸收热量的化学反应。
你还知道哪些反应是放热反应,哪些反应是吸热反应,请举例说明。
?
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
2.常见的放热反应和吸热反应
有关吸热反应和放热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如Ba(OH)2·8H2O与NH4Cl的反应在常温下能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
归纳总结
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)化学反应既有物质变化,又有能量变化( )
(4)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(5)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
×
×
√
×
×
[练一练]
判断正误
化学反应中为什么会有能量的变化?
反应吸热还是放热是由什么决定的呢?
断裂:氢氧键
形成:氢氢键
形成:氧氧键
2H2O 2H2 + O2
通电
二、化学反应中的能量变化的本质
宏观
微观
生成了新的物质,能量变化
旧化学键断裂、新化学键形成
吸收能量
放出能量
1.从化学键的角度分析化学反应中能量变化(微观角度)
交流·研讨
请根据下列信息判断氢气燃烧生成水蒸气时是吸收能量还是释放能量。
断键吸收的能量=436kj+249kj=685kj
成键释放的能量=930kj
生成1 molH20释放能量=930kj-685kj=245kj
释放能量>吸收能量,反应过程释放能量
E1<E2
e1>e2
释放能量
吸收能量
反应物
新键形成释放能量E2
放热反应
吸热反应
旧键断裂吸收能量E1
生成物
化学反应的实质
一个化学反应是否为放热还是吸热取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
反
应
物
旧化学 键断裂
新化学 键形成
吸收能量
释放能量
生
成
物
决定
能
量
变
化
释放能量大于吸收能量:放热反应
吸收能量大于释放能量:吸热反应
不同的物质不仅组成不同、结构不同,其内部所储存的能量(化学能)也不同,是否可以从物质自身储存的化学能的变化来分析化学反应能量变化的原因呢?
2.从物质内部能量的角度分析化学反应中能量变化(宏观角度)
反应物
生成物
能量E(生)
能量E(反)
E(反) >E(生)
释放能量
E(反) < E(生)
吸收能量
热能、光能、电能
热能、光能、电能
放热反应 吸热反应
化学能转化为热能
热能转化为化学能被生成物“储存”
放热反应
吸热反应
反应物的总能量>生成物的总能量
反应物的总能量<生成物的总能量
化
学
能
热能
电能
热能
光能
电能
光能
铝热反应焊接钢轨
三、化学能与其他形式的能量相互转化的应用
最具发展潜力的清洁能源——氢能
氢能被视为 21 世纪最具发展潜力的清洁能源,世界上许多国家和地区已经广泛开展了氢能研究。
20 世纪 50 年代,科学家利用液氢作为超音速和亚音速飞机的燃料,成功地使氢能飞机上天。
氢氧燃料电池被认为是利用氢能解决未来人类能源危机的途径之一。氢氧燃料电池可将化学能直接转换为电能,能量转换效率通常为 60% ~ 80%,而且污染少、噪音小、装置可大可小、使用方便。
[练一练]
1.判断正误。
(1)对于一个化学反应来说,当化学键断裂时吸收的能量大于化学键形成时放出的能量,则反应放热( )
(2)相同条件下形成1 mol H—Cl键放出的能量与断开1 mol H—Cl键吸收的能量相等( )
(3)任何化学反应,都有物质变化,同时伴随着能量变化( )
(4)放热反应为“贮存”能量的过程,吸热反应为“释放”能量的过程( )
(5)已知Fe与稀盐酸的反应为放热反应,即Fe的能量大于H2的能量( )
×
√
√
×
×
2.如图是某化学反应过程中能量变化的曲线图。下列叙述正确的是( )
A.该反应为吸热反应
B.该图可以表示Zn与HCl溶液反应的能量变化
C.该反应先发生物质变化后发生能量变化
D.断开反应物中化学键吸收的能量大于形成生成物中化学键放出的能量
B
3.已知2H→H2的能量变化如图所示。下列说法不正确的是( )
A.2H→H2过程中形成的化学键是共价键
B.相同质量的氢气分子的能量比氢原子的能量低
C.2H→H2过程中形成1 mol新化学键放出437.6 kJ的能量
D.1 mol H2离解成2 mol H要放出437.6 kJ热量
D
4.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收
180 kJ能量,反应过程中能量变化如图所示。
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量_____(填“高于”或“低于”)生成物的总能量。
(2)1 mol NO(g)分子中的化学键断裂时要吸收____ kJ能量。
(3)断裂1 mol N≡N吸收的能量x值为____。
低于
632
946
【解析】根据图示,断裂旧化学键所吸收能量为(x+498)kJ,形成新化学键所释放能量为2×632 kJ=1 264 kJ,每生成2 mol NO(g)所吸收能量为180 kJ,因此有180 kJ=(x+498)kJ-1 264 kJ,故x为946。
化学反应
实质
特征
旧化学键断裂和新化学键形成
能量变化
物质变化
形式
本质
能量形式
反应类型
化学能转化为热能、电能等
吸热反应
放热反应
化学键
物质能量
断键吸收能量和成键释放能量的相对大小
反应物总能量和生成物总能量相对大小
