2.3.2 化学反应的限度 课件(共24张PPT) 2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.3.2 化学反应的限度 课件(共24张PPT) 2023-2024学年高一化学鲁科版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 19:33:13 | ||
图片预览







文档简介
(共24张PPT)
德国化学家哈伯对合成氨进行全面系统的研究,两年间进行了6500多次的实验,终于在1909年取得了鼓舞人心的成果,就是在550℃、20MPa和锇为催化剂的条件下合成了氨,氨的产率约为6.25%。现代合成氨工艺的反应条件是铁触媒作催化剂,400-500℃,10-30MPa,氨的产率大约为10-15%。
【思考】
①氮气和氢气在550℃、20MPa和锇为催化剂的条件下,氨的产率约为6.25%,此条件下的该反应是否达到了最大的限度(产率)?
②现代合成氨的产率大于哈伯合成氨的
产率,说明化学反应的限度是否能够发
生改变?
③实际的化工生产中,是不是只要化学
反应的速率快就可以提高产品的产量?
要提高产品的产量还要考虑哪些问题?
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度 课时2
1.了解化学反应的可逆性,理解可逆反应的特征。
2.认识化学反应的进行是有一定限度的,理解化学平衡的概念及化学平衡的特征。
一、认识化学反应存在限度
观察·思考
预测实验现象 观察到的实验现象 结论
溶液呈棕黄色
溶液显红色
KI溶液过量,FeCl3也不会全部转化成FeCl2,即FeCl3与KI的反应不能进行完全
思考:上述实验,你对化学反应的认识有什么新的启示?
2Fe3+ + 2I- 2Fe2+ + I2
向相同浓度足量的KI溶液中加入少量的FeCl3溶液,充分反应后,再加入几滴 KSCN 溶液,你认为反应原理是什么?能观察到什么现象?为什么?
=
视频
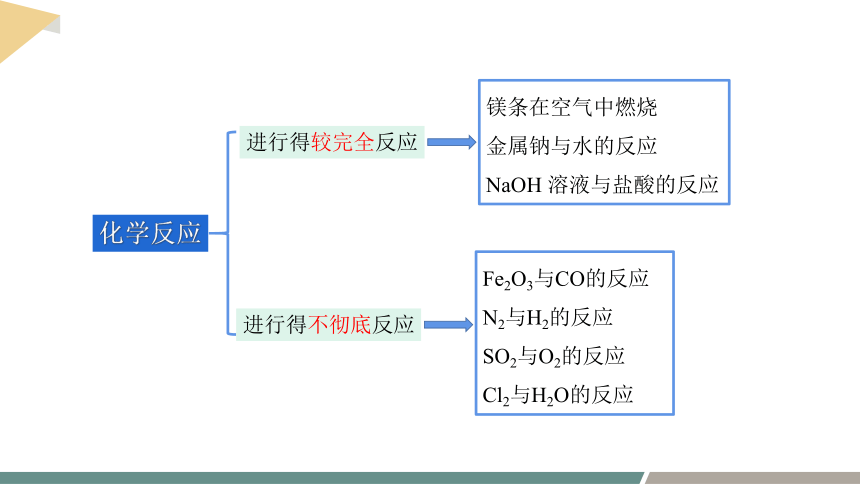
化学反应
进行得较完全反应
进行得不彻底反应
镁条在空气中燃烧
金属钠与水的反应
NaOH 溶液与盐酸的反应
Fe2O3与CO的反应
N2与H2的反应
SO2与O2的反应
Cl2与H2O的反应
1.可逆反应
(1)概念:
在相同条件下,向正、反两个方向同时进行的反应。
正向反应:反应物→生成物
逆向反应:生成物→反应物
可逆反应的化学方程式中,用 代替
正反应
逆反应
(2)表示方法:
对于可逆反应来说,在一定条件下反应物不可能全部转化为产物,反应只能进行到一定的程度,这就是该化学反应在这个条件下所能达到的限度。即无论进行多长时间,反应物都不可能100%地全部转化为生成物。
S
32
O
16
O
18
一段时间
Δ
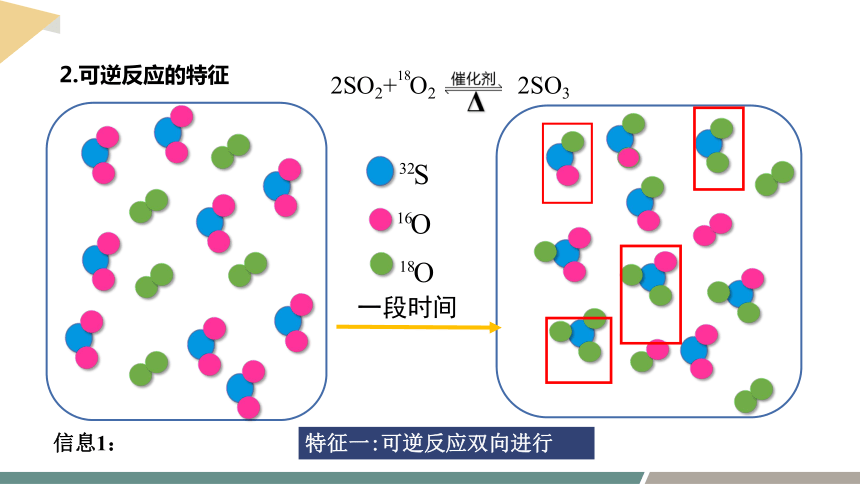
2SO2+ O2 2SO3
18
2.可逆反应的特征
特征一:可逆反应双向进行
信息1:
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
特征二:正反应和逆反应在相同的条件下同时发生
14CO2、14C、14CO
不是,两者的反应条件不同,故不是可逆反应。
1.反应2H2+O2===2H2O和2H2O===2H2↑+O2↑,是否为可逆反应?为什么?
点燃
电解
2. 14CO2 + 12C 2CO,达到最大限度后,混合物中含14C的粒子有哪些?
【思考】
二、认识化学平衡状态
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某密闭容器中发生反应:
此条件下进行到什么时候达到了这个反应的限度
此时的反应是否停止了?
此时为何3种物质的浓度保持不变
2SO2 + O2 2SO3
催化剂
观察·思考
各物质的浓度保持不变
【开始阶段】
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)开始时c(SO2) 、c(O2)大, c(SO3)=0
2SO2 + O2 2SO3
只有正反应,v(逆)=0
正逆反应都进行,v(逆)≠0,v(正)>v(逆)
【瞬间过后】
反应速率
v(正)
v(逆)
t1
时间(t)
0
(2)瞬间后c(SO2) 、c(O2 )变小,c(SO3)≠0
2SO2 + O2 2SO3
【一定时间段内】
(3)c(SO2) 、c(O2)逐渐变小,c(SO3)逐渐增大,三种物质的浓度达到一个特定值。
2SO2 + O2 2SO3
v(正)
v(逆)
反应速率
t1
时间(t)
0
v(正)=v(逆) ≠0
时间(t)
反应速率
0
t1
v(正)=v(逆)
化学平衡状态
(1)0~t1:v(正)>v(逆)
(2)t1:v(正)=v(逆)
1.化学平衡建立的过程
v(正)
v(逆)
非化学平衡状态
2SO2 + O2 2SO3
催化剂
由于v(正)= v(逆) ≠ 0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
2.化学平衡状态
平衡特征
逆:可逆反应(或可逆过程)
等: v正 = v逆 (不等于零)
动:正逆反应均未停止,只是速率相等,是动态平衡
定:平衡时,各组分的浓度或含量保持不变
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡移动
D
【思考】还有哪些特征可以判断可逆反应已达到了平衡状态?
1.可逆反应达到平衡的重要特征( )
A.反应停止了 B.正、逆反应速率都为零
C.反应物和生成物的浓度相等 D.正、逆反应的速率相等
2.下列说法中不正确的是( )
A.当可逆反应达到平衡时,就是此反应在该条件下能达到的限度
B.当可逆反应达到平衡时,此反应的正反应速率和逆反应速率相等
C.延长反应时间,不能使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应达到其限度后,反应就停止了
D
[练一练]
【常用于判断反应达到平衡的依据】
达到平衡的标志:
v正=v逆
浓度不再改变
(一定条件下)
(1)直接标志
(2)间接标志
以xA + yB zC为例:
vA耗 = vA生
vA耗 : vC耗 = x : z
vB生 : vC生 = y : z
vA耗 : vB生 = x : y
a.能说明v正=v逆的标志
①各组分的物质的量或物质的量分数保持不变
②各气体的体积或体积分数保持不变
③各组分的质量或质量分数保持不变
④体系的颜色和温度不变
b.各组分的浓度保持不变
不是相等,也不是成一定比例
c.方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
类型 判断依据以mA(g)+nB(g) pC(g)+qD(g)为例 平衡状态
混合物体系中各成分的含量 ①各物质的物质的量或各物质的物质的量分数一定 平衡
②各物质的质量或各物质的质量分数一定 平衡
正、逆反应速率的关系 ①在单位时间内消耗了m mol A同时生成m mol A,即v正=v逆 平衡
②在单位时间内消耗了n mol B同时生成p mol C,则v正不一定等于v逆 不一定
③在单位时间内生成n mol B,同时消耗q mol D,因二者变化均表示v逆,所以v正不一定等于v逆 不一定
温度 体系温度一定(其他不变) 平衡
颜色 反应体系内有色物质的颜色一定 平衡
可逆反应达到平衡状态后,平衡状态能否改变呢?
观察·思考
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
2NO2 (g) N2O4(g)
红棕色
无色
实验 现象 浸到冰水中时混合物颜色_____,浸到热水中时混合物颜色_____
变浅
变深
降低温度
升高温度
平衡正向移动
平衡逆向移动
颜色变浅
颜色变深
3.化学平衡状态的改变
视频
结论:
化学平衡是在一定条件下建立起来的,当条件改变时,原平衡状态被破坏,并在新的条件下建立起新的平衡状态。
原平衡
(v正=v逆)
条件改变
一定时间后
平衡破坏
(v正′≠v逆′)
新平衡
(v正"=v逆")
化学平衡的移动
说明:浓度、温度、压强等因素均会影响化学平衡状态,具体 内容会在选修中学习。
[练一练]
1.可逆反应 2NO2(红棕色) 2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
ADEH
2.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
③④⑤⑥
化学反应限度
与条件的控制
化学反应的限度
化学反应条件的控制
可逆反应
化学平衡状态
在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。反应存在限度
逆:可逆反应(或可逆过程)
等: v正 = v逆 (不等于零)
动:正逆反应均未停止,只是速率相等,是动态平衡
定:平衡时,各组分的浓度或含量保持不变
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡移动
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
目的
促进有利的化学反应,抑制有害的化学反应
方法
改变化学反应的速率
改变可逆反应进行的程度
德国化学家哈伯对合成氨进行全面系统的研究,两年间进行了6500多次的实验,终于在1909年取得了鼓舞人心的成果,就是在550℃、20MPa和锇为催化剂的条件下合成了氨,氨的产率约为6.25%。现代合成氨工艺的反应条件是铁触媒作催化剂,400-500℃,10-30MPa,氨的产率大约为10-15%。
【思考】
①氮气和氢气在550℃、20MPa和锇为催化剂的条件下,氨的产率约为6.25%,此条件下的该反应是否达到了最大的限度(产率)?
②现代合成氨的产率大于哈伯合成氨的
产率,说明化学反应的限度是否能够发
生改变?
③实际的化工生产中,是不是只要化学
反应的速率快就可以提高产品的产量?
要提高产品的产量还要考虑哪些问题?
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度 课时2
1.了解化学反应的可逆性,理解可逆反应的特征。
2.认识化学反应的进行是有一定限度的,理解化学平衡的概念及化学平衡的特征。
一、认识化学反应存在限度
观察·思考
预测实验现象 观察到的实验现象 结论
溶液呈棕黄色
溶液显红色
KI溶液过量,FeCl3也不会全部转化成FeCl2,即FeCl3与KI的反应不能进行完全
思考:上述实验,你对化学反应的认识有什么新的启示?
2Fe3+ + 2I- 2Fe2+ + I2
向相同浓度足量的KI溶液中加入少量的FeCl3溶液,充分反应后,再加入几滴 KSCN 溶液,你认为反应原理是什么?能观察到什么现象?为什么?
=
视频
化学反应
进行得较完全反应
进行得不彻底反应
镁条在空气中燃烧
金属钠与水的反应
NaOH 溶液与盐酸的反应
Fe2O3与CO的反应
N2与H2的反应
SO2与O2的反应
Cl2与H2O的反应
1.可逆反应
(1)概念:
在相同条件下,向正、反两个方向同时进行的反应。
正向反应:反应物→生成物
逆向反应:生成物→反应物
可逆反应的化学方程式中,用 代替
正反应
逆反应
(2)表示方法:
对于可逆反应来说,在一定条件下反应物不可能全部转化为产物,反应只能进行到一定的程度,这就是该化学反应在这个条件下所能达到的限度。即无论进行多长时间,反应物都不可能100%地全部转化为生成物。
S
32
O
16
O
18
一段时间
Δ
2SO2+ O2 2SO3
18
2.可逆反应的特征
特征一:可逆反应双向进行
信息1:
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
特征二:正反应和逆反应在相同的条件下同时发生
14CO2、14C、14CO
不是,两者的反应条件不同,故不是可逆反应。
1.反应2H2+O2===2H2O和2H2O===2H2↑+O2↑,是否为可逆反应?为什么?
点燃
电解
2. 14CO2 + 12C 2CO,达到最大限度后,混合物中含14C的粒子有哪些?
【思考】
二、认识化学平衡状态
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某密闭容器中发生反应:
此条件下进行到什么时候达到了这个反应的限度
此时的反应是否停止了?
此时为何3种物质的浓度保持不变
2SO2 + O2 2SO3
催化剂
观察·思考
各物质的浓度保持不变
【开始阶段】
反应速率
v(正)
v(逆)
t1
时间(t)
0
(1)开始时c(SO2) 、c(O2)大, c(SO3)=0
2SO2 + O2 2SO3
只有正反应,v(逆)=0
正逆反应都进行,v(逆)≠0,v(正)>v(逆)
【瞬间过后】
反应速率
v(正)
v(逆)
t1
时间(t)
0
(2)瞬间后c(SO2) 、c(O2 )变小,c(SO3)≠0
2SO2 + O2 2SO3
【一定时间段内】
(3)c(SO2) 、c(O2)逐渐变小,c(SO3)逐渐增大,三种物质的浓度达到一个特定值。
2SO2 + O2 2SO3
v(正)
v(逆)
反应速率
t1
时间(t)
0
v(正)=v(逆) ≠0
时间(t)
反应速率
0
t1
v(正)=v(逆)
化学平衡状态
(1)0~t1:v(正)>v(逆)
(2)t1:v(正)=v(逆)
1.化学平衡建立的过程
v(正)
v(逆)
非化学平衡状态
2SO2 + O2 2SO3
催化剂
由于v(正)= v(逆) ≠ 0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
2.化学平衡状态
平衡特征
逆:可逆反应(或可逆过程)
等: v正 = v逆 (不等于零)
动:正逆反应均未停止,只是速率相等,是动态平衡
定:平衡时,各组分的浓度或含量保持不变
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡移动
D
【思考】还有哪些特征可以判断可逆反应已达到了平衡状态?
1.可逆反应达到平衡的重要特征( )
A.反应停止了 B.正、逆反应速率都为零
C.反应物和生成物的浓度相等 D.正、逆反应的速率相等
2.下列说法中不正确的是( )
A.当可逆反应达到平衡时,就是此反应在该条件下能达到的限度
B.当可逆反应达到平衡时,此反应的正反应速率和逆反应速率相等
C.延长反应时间,不能使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应达到其限度后,反应就停止了
D
[练一练]
【常用于判断反应达到平衡的依据】
达到平衡的标志:
v正=v逆
浓度不再改变
(一定条件下)
(1)直接标志
(2)间接标志
以xA + yB zC为例:
vA耗 = vA生
vA耗 : vC耗 = x : z
vB生 : vC生 = y : z
vA耗 : vB生 = x : y
a.能说明v正=v逆的标志
①各组分的物质的量或物质的量分数保持不变
②各气体的体积或体积分数保持不变
③各组分的质量或质量分数保持不变
④体系的颜色和温度不变
b.各组分的浓度保持不变
不是相等,也不是成一定比例
c.方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
类型 判断依据以mA(g)+nB(g) pC(g)+qD(g)为例 平衡状态
混合物体系中各成分的含量 ①各物质的物质的量或各物质的物质的量分数一定 平衡
②各物质的质量或各物质的质量分数一定 平衡
正、逆反应速率的关系 ①在单位时间内消耗了m mol A同时生成m mol A,即v正=v逆 平衡
②在单位时间内消耗了n mol B同时生成p mol C,则v正不一定等于v逆 不一定
③在单位时间内生成n mol B,同时消耗q mol D,因二者变化均表示v逆,所以v正不一定等于v逆 不一定
温度 体系温度一定(其他不变) 平衡
颜色 反应体系内有色物质的颜色一定 平衡
可逆反应达到平衡状态后,平衡状态能否改变呢?
观察·思考
将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
2NO2 (g) N2O4(g)
红棕色
无色
实验 现象 浸到冰水中时混合物颜色_____,浸到热水中时混合物颜色_____
变浅
变深
降低温度
升高温度
平衡正向移动
平衡逆向移动
颜色变浅
颜色变深
3.化学平衡状态的改变
视频
结论:
化学平衡是在一定条件下建立起来的,当条件改变时,原平衡状态被破坏,并在新的条件下建立起新的平衡状态。
原平衡
(v正=v逆)
条件改变
一定时间后
平衡破坏
(v正′≠v逆′)
新平衡
(v正"=v逆")
化学平衡的移动
说明:浓度、温度、压强等因素均会影响化学平衡状态,具体 内容会在选修中学习。
[练一练]
1.可逆反应 2NO2(红棕色) 2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
ADEH
2.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
③④⑤⑥
化学反应限度
与条件的控制
化学反应的限度
化学反应条件的控制
可逆反应
化学平衡状态
在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。反应存在限度
逆:可逆反应(或可逆过程)
等: v正 = v逆 (不等于零)
动:正逆反应均未停止,只是速率相等,是动态平衡
定:平衡时,各组分的浓度或含量保持不变
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡移动
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
目的
促进有利的化学反应,抑制有害的化学反应
方法
改变化学反应的速率
改变可逆反应进行的程度
