2.3.1 化学反应的快慢 课件(共26张PPT) 2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.3.1 化学反应的快慢 课件(共26张PPT) 2023-2024学年高一化学鲁科版(2019)必修第二册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 37.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 19:37:25 | ||
图片预览









文档简介
(共26张PPT)
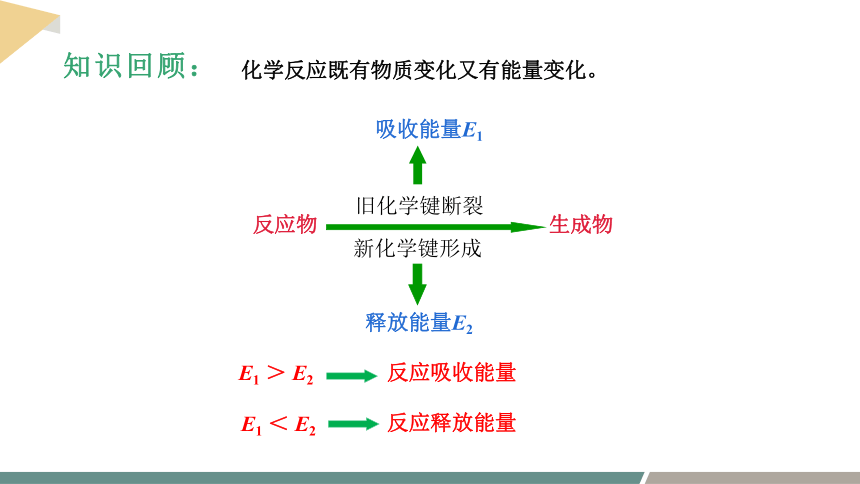
新化学键形成
反应物 生成物
旧化学键断裂
反应吸收能量
反应释放能量
释放能量E2
吸收能量E1
E1 < E2
E1 > E2
化学反应既有物质变化又有能量变化。
知识回顾:
在利用化学反应时,我们除了关注化学反应的物质变化和能量变化外,还应关注那些方面的问题?
硫酸是一种重要的化工产品。早在公元 7 世纪人们就开始寻找制取硫酸的方法,但是直到 1875 年德国化学家麦塞尔(R.Messel)以铂为催化剂才使硫酸生产有了较大的发展。尔后,硫酸工业生产的每次突破性进展都是因为使用了新型、高效的催化剂而取得的。那么,在硫酸的工业生产中,催化剂发挥了什么作用?在生产过程中,二氧化硫转化为三氧化硫需要氧气,但即使氧气再过量,二氧化硫也不能全部转化为三氧化硫,这是为什么?
反应快慢问题
反应程度问题
联想·质疑
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度 课时1
1.知道化学反应速率的概念和常用表示方法,并能进行简单计算。
2.通过实验认识浓度、温度、催化剂等条件对化学反应速率的影响,了解调控化学反应速率的方法。
焰火反应 金属铜的锈蚀 塑料降解
上述三个情境中,谁反应最快?谁反应较慢?谁反应最慢?
焰火反应最快,铜的锈蚀较慢,塑料降解最慢
一、化学反应的快慢
【思考与讨论】
例如:我们学过物理都知道:
(1) 光的传播速度是很快的;
(2) 光在空气中的传播速度3×108m/s。
定量描述
定性描述
快与慢是相对的是一种定性的比较
初中我们通过观察对比实验现象来定性描述化学反应的快慢
定性描述
如何定量描述化学反应的快慢呢
①冒气泡快慢
②颜色变化快慢
③固体物质的减少快慢
④出现浑浊的快慢
⑤温度变化快慢
1.化学反应速率
用来衡量化学反应过程进行快慢的物理量。
单位:
mol/(L min) 或mol/(L s)
mol L-1 min-1或mol L-1 S-1
通常用单位时间内反应物浓度的减少量(绝对值)或生成物浓度的增加量来表示。
2.表达式
aA+bB===cC+dD
v (A) =
Δc(A)
Δt
v (D) =
Δc(D)
Δt
【例1】在某一化学反应中,已知反应物A的浓度在10 s内从4 mol/L变成1 mol/L。则在这10 s内用A表示的化学反应速率为多少?
问:第10s的化学反应速率为多少?
无法确定
【注意】化学反应速率指一段时间内的平均速率。
=
4 mol·L-1–1 mol·L-1
10 s
v(A)
c(A)
t
=
3 mol·L-1
10 s
0.3 mol·L-1·s-1
=
=
①在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0mol/L,在这5s内B的化学反应速率为_ ________。
②一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余6.8mol,这种反应物的化学反应速率为___ ________。
0.3mol/(L·S)
0.048mol/(L·min)
【例2】
【注意】
1.反应速率要指明具体物质并取正值;
2.表示气体或溶液反应速率,不能用于表示固体和纯液体;
3.指平均速率。
同一反应中,用不同物质的浓度变化来表示的反应速率是否相同呢?它们之间有什么关系呢?
一个化学反应的反应速率
反应物浓度的减少量
生成物浓度的增加量
【例3 】反应4NH3+5O2 4NO+6H2O 在5L的密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,此反应的平均反应速率为多少?
分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示。
v(NO)=0.002 mol/(L·s)
v(NH3)=0.002 mol/(L·s)
v(O2)=0.0025 mol/(L·s)
NH3 O2 NO H2O
△n物质的量(mol) 0.3 0.375 0.3
速率(mol/(L·s)) 0.002 0.0025 0.002
比例
4 : 5 : 4
【化学反应速率之比等于化学方程式中的化学计量数之比】
4NH3+5O2 4NO+6H2O
固体或纯液体,其浓度可视为常数,因此不用固体或纯液体表示化学反应速率。
易错警示
则该反应速率的快慢顺序为:_____________________
【例4】反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1)>(4)>(2)>(3)
归一法:
①看单位是否统一,若不统一,换算成相同的单位。
②换算成同一物质表示的反应速率,再比较数值的大小。
化学反应速率大小的比较方法
(1)化学反应速率指平均速率,不是瞬时速率。
(2)同一反应用不同的物质来表示速率,
需要指明具体物质,如V(CO)。
(4)不用固体或纯液体表示化学反应速率。
(3)同一化学反应: aA+bB = cC+dD,
有V(A)︰V(B)︰V(C)︰V(D)=a︰b︰c︰d
H2O2
分解缓慢
二氧化锰
刚买时
3天后
化学事实:通过控制,加快有利反应;抑制/减慢不利反应。
调控化学反应速率是决定化学实验成败或化工成本的关键
哪些因素?
影 响
二、化学反应速率的影响因素
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是:A 镁 B 铝 C 钠 D 铁
1.内因:反应物本身的性质(决定因素)
2.外因:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
√
浓度?
温度?
压强?
催化剂?
物质的形状?
“探究化学反应速率的影响因素”属于探究反应规律类型的任务。计此类任务实验方
案的关键是变量控制,可按以下步骤进行思考。
1. 确定研究对象,如选定符合实验要求的化学反应。
2. 确定自变量和因变量。在本实验中,自变量为浓度、温度、接触面积、催化剂等外界条件,因变量为化学反应速率。
3. 设计实验操作,改变单一自变量。在此过程中,要明确通过实验操作应控制哪个自变量改变、哪些自变量不变。
4. 确定因变量的观测指标。在本实验中,应确定通过观察哪些现象来判断化学反应的快慢。
变量控制方法
方法导引
活动·探究
探究化学反应速率的影响因素
实验目的
实验用品
实验方案设计
探究哪些因素能影响化学反应速率
表面积大致相同的镁条、铁片,块状碳酸钙、碳酸钙粉末,二氧化锰粉末,盐酸(0.5mol L—1,3mol L—1),H2O2溶液(3%);
试管,药匙,镊子,胶头滴管,酒精灯,试管夹,火柴。
1.选择化学反应
2.确定待研究的影响因素
3.设计改变影响因素的操作
4.确定观测反应快慢的指标
【实验方案实施】
实验内容 实验现象 实验结论
0.5 mol·L-1盐酸与铁反应产生气泡的速率较慢,
3 mol·L-1盐酸与铁反应产生气泡的速率较快
其他条件相同时,反应物浓度越大,化学反应速率越快
视频:浓度影响
视频:温度影响
加热的试管中产生气泡的速率较快,不加热的试管中产生气泡的速率较慢
其他条件相同时,体系的温度越高,化学反应速率越快
【实验方案实施】
视频:形状影响
视频:催化剂影响
实验内容 实验现象 实验结论
加碳酸钙粉末的试管内产生气泡的速率较快,
加块状碳酸钙的试管内产生气泡的速率较慢
其他条件相同时,固体反应物表面积越大、化学反应速率越快
不加MnO2粉末的试管内无明显变化,加MnO2粉末的试管内有大量气体产生
MnO2是H2O2分解反应的催化剂,可明显加快化学反应速率
(2)影响反应速率的外界因素:
②温度:其他条件不变时,升高温度,反应速率增大
(1)决定因素:
反应物本身的性质。
影响化学反应速率的因素
外因
内因
适合所有反应,不论反应吸热还是放热,升高温度,反应速率都加快。
①浓度: 其他条件不变时,增大浓度,反应速率增大
对于固体或纯液体反应物,一般情况下其浓度是常数,因此改变其量的多少,并不影响其浓度,其化学反应速率不会改变。
③催化剂:其他条件不变时,加入催化剂能加快反应速率。
④接触面积:其他条件不变时,增大反应物的接触面积可以增大反应速率
固体反应物颗粒越小,表面积越大
【思考交流】
气
体
一定量的气体,体积变小,压强变大
1.压强对化学反应速率有什么影响
增大压强
增大反应物的浓度
减小压强
减小反应物的浓度
2.如果反应物是固体、液体或溶液时,改变压强对反应速率有什么影响?
无影响,仅适用于有气体参加或生成的反应。
[练一练]
1.下列关于化学反应速率的说法正确的是( )
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.对于任何化学反应来说,反应速率越快,反应现象就越明显
C.化学反应速率为0.8mol (L s)-1是指1s时某物质的浓度为0.8mol L-1
D.化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
A
2.一定条件下,在2L密闭容器中发生反应:A(g)+2B(g)═2C(g)+3D(g),测得5min内,A的物质的量减小了10mol,则5min内该反应的化学反应速率是( )
A.v(A)=2mol/(L min) B.v(B)=1mol/(L min)
C.v(C)=2mol/(L min) D.v(D)=1.5mol/(L min)
C
3.反应4A(s)+2B(g) 2C(g)+D(g)从正向开始,经过2s后B的浓度减少了0.04mol L-1。下列说法正确的是( )
A.用A表示的反应速率是0.04mol L-1 s-1
B.在这2s内用B和C表示的反应速率的值是相同的
C.在2s末时的反应速率,用反应物B来表示是0.02mol L-1 s-1
D.2s后,D的物质的量为0.02mol
B
4.下列事实中,什么因素影响了化学反应速率。
(1)黄铁矿煅烧时要粉碎成细小的矿粒: ;
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2后很快产生大量气体: ;
(3)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢: ;
(4)同样大小的大理石分别在0.1mol L-1的盐酸和1mol L-1的盐酸中反应速率不同: ;
反应物的接触面积
催化剂
反应物本身的性质
反应物的浓度
化学反应的速率
化学反应速率
用来衡量化学反应过程进行快慢的物理量
△v=△c/△t
mol/(L min) 或mol/(L s)
影响化学反应速率的因素
反应物自身的性质
催化剂
压强
温度
接触面积等
新化学键形成
反应物 生成物
旧化学键断裂
反应吸收能量
反应释放能量
释放能量E2
吸收能量E1
E1 < E2
E1 > E2
化学反应既有物质变化又有能量变化。
知识回顾:
在利用化学反应时,我们除了关注化学反应的物质变化和能量变化外,还应关注那些方面的问题?
硫酸是一种重要的化工产品。早在公元 7 世纪人们就开始寻找制取硫酸的方法,但是直到 1875 年德国化学家麦塞尔(R.Messel)以铂为催化剂才使硫酸生产有了较大的发展。尔后,硫酸工业生产的每次突破性进展都是因为使用了新型、高效的催化剂而取得的。那么,在硫酸的工业生产中,催化剂发挥了什么作用?在生产过程中,二氧化硫转化为三氧化硫需要氧气,但即使氧气再过量,二氧化硫也不能全部转化为三氧化硫,这是为什么?
反应快慢问题
反应程度问题
联想·质疑
第2章 化学键 化学反应规律
第3节 化学反应的快慢和限度 课时1
1.知道化学反应速率的概念和常用表示方法,并能进行简单计算。
2.通过实验认识浓度、温度、催化剂等条件对化学反应速率的影响,了解调控化学反应速率的方法。
焰火反应 金属铜的锈蚀 塑料降解
上述三个情境中,谁反应最快?谁反应较慢?谁反应最慢?
焰火反应最快,铜的锈蚀较慢,塑料降解最慢
一、化学反应的快慢
【思考与讨论】
例如:我们学过物理都知道:
(1) 光的传播速度是很快的;
(2) 光在空气中的传播速度3×108m/s。
定量描述
定性描述
快与慢是相对的是一种定性的比较
初中我们通过观察对比实验现象来定性描述化学反应的快慢
定性描述
如何定量描述化学反应的快慢呢
①冒气泡快慢
②颜色变化快慢
③固体物质的减少快慢
④出现浑浊的快慢
⑤温度变化快慢
1.化学反应速率
用来衡量化学反应过程进行快慢的物理量。
单位:
mol/(L min) 或mol/(L s)
mol L-1 min-1或mol L-1 S-1
通常用单位时间内反应物浓度的减少量(绝对值)或生成物浓度的增加量来表示。
2.表达式
aA+bB===cC+dD
v (A) =
Δc(A)
Δt
v (D) =
Δc(D)
Δt
【例1】在某一化学反应中,已知反应物A的浓度在10 s内从4 mol/L变成1 mol/L。则在这10 s内用A表示的化学反应速率为多少?
问:第10s的化学反应速率为多少?
无法确定
【注意】化学反应速率指一段时间内的平均速率。
=
4 mol·L-1–1 mol·L-1
10 s
v(A)
c(A)
t
=
3 mol·L-1
10 s
0.3 mol·L-1·s-1
=
=
①在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0mol/L,在这5s内B的化学反应速率为_ ________。
②一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余6.8mol,这种反应物的化学反应速率为___ ________。
0.3mol/(L·S)
0.048mol/(L·min)
【例2】
【注意】
1.反应速率要指明具体物质并取正值;
2.表示气体或溶液反应速率,不能用于表示固体和纯液体;
3.指平均速率。
同一反应中,用不同物质的浓度变化来表示的反应速率是否相同呢?它们之间有什么关系呢?
一个化学反应的反应速率
反应物浓度的减少量
生成物浓度的增加量
【例3 】反应4NH3+5O2 4NO+6H2O 在5L的密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,此反应的平均反应速率为多少?
分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示。
v(NO)=0.002 mol/(L·s)
v(NH3)=0.002 mol/(L·s)
v(O2)=0.0025 mol/(L·s)
NH3 O2 NO H2O
△n物质的量(mol) 0.3 0.375 0.3
速率(mol/(L·s)) 0.002 0.0025 0.002
比例
4 : 5 : 4
【化学反应速率之比等于化学方程式中的化学计量数之比】
4NH3+5O2 4NO+6H2O
固体或纯液体,其浓度可视为常数,因此不用固体或纯液体表示化学反应速率。
易错警示
则该反应速率的快慢顺序为:_____________________
【例4】反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1)>(4)>(2)>(3)
归一法:
①看单位是否统一,若不统一,换算成相同的单位。
②换算成同一物质表示的反应速率,再比较数值的大小。
化学反应速率大小的比较方法
(1)化学反应速率指平均速率,不是瞬时速率。
(2)同一反应用不同的物质来表示速率,
需要指明具体物质,如V(CO)。
(4)不用固体或纯液体表示化学反应速率。
(3)同一化学反应: aA+bB = cC+dD,
有V(A)︰V(B)︰V(C)︰V(D)=a︰b︰c︰d
H2O2
分解缓慢
二氧化锰
刚买时
3天后
化学事实:通过控制,加快有利反应;抑制/减慢不利反应。
调控化学反应速率是决定化学实验成败或化工成本的关键
哪些因素?
影 响
二、化学反应速率的影响因素
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是:A 镁 B 铝 C 钠 D 铁
1.内因:反应物本身的性质(决定因素)
2.外因:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
√
浓度?
温度?
压强?
催化剂?
物质的形状?
“探究化学反应速率的影响因素”属于探究反应规律类型的任务。计此类任务实验方
案的关键是变量控制,可按以下步骤进行思考。
1. 确定研究对象,如选定符合实验要求的化学反应。
2. 确定自变量和因变量。在本实验中,自变量为浓度、温度、接触面积、催化剂等外界条件,因变量为化学反应速率。
3. 设计实验操作,改变单一自变量。在此过程中,要明确通过实验操作应控制哪个自变量改变、哪些自变量不变。
4. 确定因变量的观测指标。在本实验中,应确定通过观察哪些现象来判断化学反应的快慢。
变量控制方法
方法导引
活动·探究
探究化学反应速率的影响因素
实验目的
实验用品
实验方案设计
探究哪些因素能影响化学反应速率
表面积大致相同的镁条、铁片,块状碳酸钙、碳酸钙粉末,二氧化锰粉末,盐酸(0.5mol L—1,3mol L—1),H2O2溶液(3%);
试管,药匙,镊子,胶头滴管,酒精灯,试管夹,火柴。
1.选择化学反应
2.确定待研究的影响因素
3.设计改变影响因素的操作
4.确定观测反应快慢的指标
【实验方案实施】
实验内容 实验现象 实验结论
0.5 mol·L-1盐酸与铁反应产生气泡的速率较慢,
3 mol·L-1盐酸与铁反应产生气泡的速率较快
其他条件相同时,反应物浓度越大,化学反应速率越快
视频:浓度影响
视频:温度影响
加热的试管中产生气泡的速率较快,不加热的试管中产生气泡的速率较慢
其他条件相同时,体系的温度越高,化学反应速率越快
【实验方案实施】
视频:形状影响
视频:催化剂影响
实验内容 实验现象 实验结论
加碳酸钙粉末的试管内产生气泡的速率较快,
加块状碳酸钙的试管内产生气泡的速率较慢
其他条件相同时,固体反应物表面积越大、化学反应速率越快
不加MnO2粉末的试管内无明显变化,加MnO2粉末的试管内有大量气体产生
MnO2是H2O2分解反应的催化剂,可明显加快化学反应速率
(2)影响反应速率的外界因素:
②温度:其他条件不变时,升高温度,反应速率增大
(1)决定因素:
反应物本身的性质。
影响化学反应速率的因素
外因
内因
适合所有反应,不论反应吸热还是放热,升高温度,反应速率都加快。
①浓度: 其他条件不变时,增大浓度,反应速率增大
对于固体或纯液体反应物,一般情况下其浓度是常数,因此改变其量的多少,并不影响其浓度,其化学反应速率不会改变。
③催化剂:其他条件不变时,加入催化剂能加快反应速率。
④接触面积:其他条件不变时,增大反应物的接触面积可以增大反应速率
固体反应物颗粒越小,表面积越大
【思考交流】
气
体
一定量的气体,体积变小,压强变大
1.压强对化学反应速率有什么影响
增大压强
增大反应物的浓度
减小压强
减小反应物的浓度
2.如果反应物是固体、液体或溶液时,改变压强对反应速率有什么影响?
无影响,仅适用于有气体参加或生成的反应。
[练一练]
1.下列关于化学反应速率的说法正确的是( )
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.对于任何化学反应来说,反应速率越快,反应现象就越明显
C.化学反应速率为0.8mol (L s)-1是指1s时某物质的浓度为0.8mol L-1
D.化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
A
2.一定条件下,在2L密闭容器中发生反应:A(g)+2B(g)═2C(g)+3D(g),测得5min内,A的物质的量减小了10mol,则5min内该反应的化学反应速率是( )
A.v(A)=2mol/(L min) B.v(B)=1mol/(L min)
C.v(C)=2mol/(L min) D.v(D)=1.5mol/(L min)
C
3.反应4A(s)+2B(g) 2C(g)+D(g)从正向开始,经过2s后B的浓度减少了0.04mol L-1。下列说法正确的是( )
A.用A表示的反应速率是0.04mol L-1 s-1
B.在这2s内用B和C表示的反应速率的值是相同的
C.在2s末时的反应速率,用反应物B来表示是0.02mol L-1 s-1
D.2s后,D的物质的量为0.02mol
B
4.下列事实中,什么因素影响了化学反应速率。
(1)黄铁矿煅烧时要粉碎成细小的矿粒: ;
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2后很快产生大量气体: ;
(3)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢: ;
(4)同样大小的大理石分别在0.1mol L-1的盐酸和1mol L-1的盐酸中反应速率不同: ;
反应物的接触面积
催化剂
反应物本身的性质
反应物的浓度
化学反应的速率
化学反应速率
用来衡量化学反应过程进行快慢的物理量
△v=△c/△t
mol/(L min) 或mol/(L s)
影响化学反应速率的因素
反应物自身的性质
催化剂
压强
温度
接触面积等
