3.3.1 乙醇 课件 (共23张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.3.1 乙醇 课件 (共23张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 19:38:21 | ||
图片预览







文档简介
(共23张PPT)
第3章 简单的有机化合物
第3节 饮食中的有机化合物 课时1
早在几千年前,人类就掌握了发酵法酿酒的技术。各种酒类都含有浓度不等的乙醇。故乙醇俗称酒精。
1.了解乙醇的结构和物理性质。
2.掌握乙醇的主要化学性质及相应性质实验的现象,能书写相关的反应式。
一、乙醇的物理性质与结构
①病人发烧通常用酒精擦拭全身,用此法降温。
②衣服上沾上少许汽油用酒精可以去除。
③酒香不怕巷子深
④白酒的主要成分是乙醇和水
⑤酒精灯用完后为什么要盖上灯帽
⑥用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
观察乙醇并联系生活归纳乙醇的物理性质
1.乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
无色
特殊香味
液体
比水小
与水以任意比互溶,能溶解多种有机物和无机物
酒精
78.5℃易挥发
【思考】如何由工业酒精制备无水乙醇 怎样检验无水乙醇中有水
用工业酒精与新制生石灰后蒸馏,可得无水酒精。
取少量酒精,加入无水硫酸铜,若出现蓝色,则证明酒精含水。
2.乙醇的结构
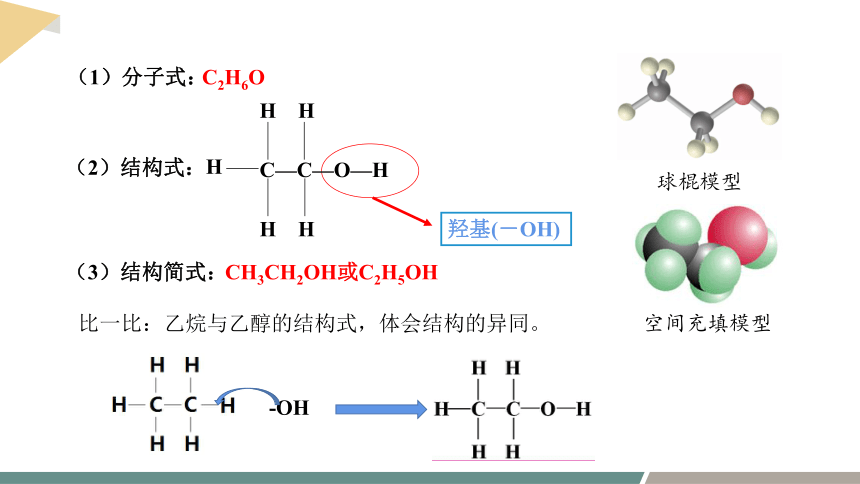
乙醇的分子式为C2H6O,请根据其分子式,结合C、H和O原子的成键原则,推测乙醇的结构式。
A:
B:
根据工业上利用乙烯与水加成制乙醇,推测出乙醇的结构式为A
CH2=CH2 + H—OH
催化剂
△,加压
CH3CH2—OH(乙醇)
羟基(-OH)
C—C—O—H
H
H
H
H
H
CH3CH2OH或C2H5OH
C2H6O
(2)结构式:
(1)分子式:
(3)结构简式:
比一比:乙烷与乙醇的结构式,体会结构的异同。
-OH
球棍模型
空间充填模型
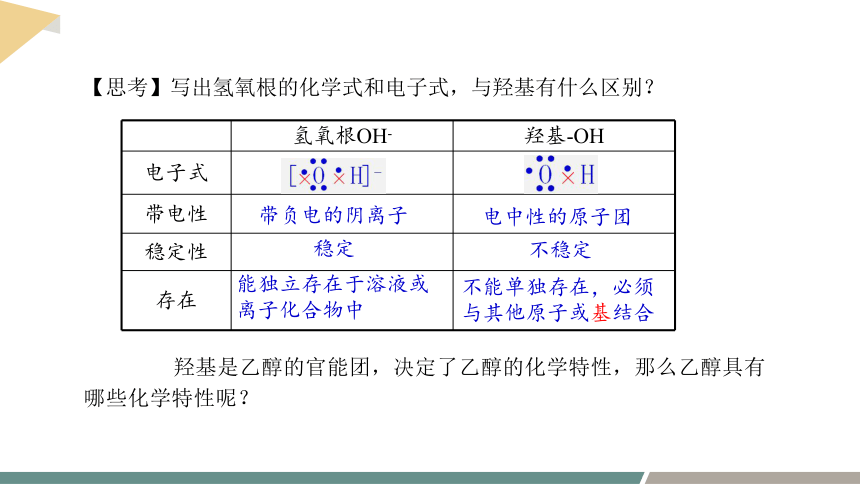
【思考】写出氢氧根的化学式和电子式,与羟基有什么区别?
氢氧根OH- 羟基-OH
电子式
带电性
稳定性
存在
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
羟基是乙醇的官能团,决定了乙醇的化学特性,那么乙醇具有哪些化学特性呢?
二、乙醇的化学性质
活动·探究
探究乙醇的化学性质
【探究实验 1】向烧杯中加入约 2 mL 无水乙醇,点燃,观察现象并得出结论。
现象:
产生淡蓝色火焰,放出大量热。
结论:
乙醇易和空气中氧气发生氧化反应。
视频1
2CO2 +3H2O
C2H5OH + 3O2
点燃
【探究实验 2】
向试管中加入约 2 mL 无水乙醇,取一根光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
视频2
现象:
铜丝在空气中加热由红变黑,插入乙醇溶液中,溶液沸腾,铜丝表面有黑变红,试管中的液体有刺激性气味。
红
黑
红
Cu
CuO
Cu
反应整个过程铜的作用是什么?
结论:
铜做催化剂,乙醇可以被氧化为有刺激性气味的液体。
铜丝红
Δ
变黑
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
分析:①发生反应 2Cu+O2==2CuO
分析:②生成新的物质——乙醛 CuO+CH3CH2OH Cu +CH3CHO+H2O
中间产物
现象及原因探究
总反应:2C2H5OH + O2
Cu
2CH3CHO + 2 H2O
①
②
①
②
Cu作催化剂
有刺激性气味
Cu
Cu
反应历程
【探究实验 3】
试管中加入约 2 mL 酸性 KMnO 4 溶液,滴入数滴无水乙醇,振荡,观察现象。
视频3
现象:
紫色酸性高锰酸钾溶液褪色
结论:
乙醇能被酸性高锰酸钾强氧化剂氧化
CH3COOH
CH3CH2OH
酸性高锰酸钾溶液
世界卫生组织的事故调查显示,大约 50%~60% 交通事故与酒后驾车有关。
你知道吗
如何检查司机是否酒后驾车?
K2Cr2O7
CH3CH2OH
Cr2(SO4 )3
【探究实验 4】
向试管中加入约 2 mL 无水乙醇,再放入一小块金属钠,观察现象,检验生成的气体。
思考:如预测产生的气体可能是什么气体 如何检验?
物质 金属钠的变化 气体燃烧现象 检验产物
乙醇
观看实验,并完成下表
钠沉在液面下,不熔化,反应缓慢
产生淡蓝色火焰
烧杯壁上出现液滴,石灰水不浑浊
钠的密度比乙醇的大
有氢气生成
反应方程式:
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
结论:
乙醇能和活泼金属反应,生成氢气
视频4
联想钠和水反应的现象,对比乙醇和钠反应的现象,分析二者有何异同,从中你能得出什么结论?
与水反应 与乙醇反应
反应方程式
反应实质
现 象 声现象
钠变化
结 论 羟基氢的活泼性
密度大小
2Na+2H2O==2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
水中氢原子被置换
有“嘶嘶”声响
浮、熔、游、响
ρ(Na)<ρ(H2O)
羟基氢原子被置换
无声响
沉于底部、不熔化
ρ(Na)>ρ(CH3CH2OH)
H2O>CH3CH2OH
1.乙醇氧化反应
①燃烧
②催化氧化
③被强氧化剂(酸性高锰酸钾溶液)氧化
2.乙醇和钠反应
2CH3CH2OH+O2 2CH3CHO+2H2O
C2H5OH+O2 2CO2+3H2O
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
二、乙醇的化学性质
三、乙醇的用途
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
你知道生活中所说酒的度数是什么含义吗?你知道常见酒的度数是多少吗?饮酒对人体有何利弊?说说你知道的过度饮酒所带来的危害有那些?
常见酒的度数
酒的度数:
乙醇的体积分数
乙醇在人体内的代谢过程
酒精(乙醇)
乙醛
乙酸
CO2+H2O
乙醇脱氢酶
乙醇脱氢酶
未成年人不应饮酒
[练一练]
1.关于乙醇结构与性质方面的说法中正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇、水分别与钠,乙醇的反应比水更平缓
D
C
2.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制酒精饮料
C.1 mol乙醇与足量的Na作用得到0.5 mol H2
D.乙醇与钠反应的产物为C2H5ONa
3.下列化合物结构中有两种官能团的是( )
A.CH2=CHCl B.CH3CH2OH
C.CH3COOH D.
4.乙醇分子中的各种化学键如图所示,对乙醇在各种反应中断键的说明不正确的是( )
A.与金属钠反应时,断裂①
B.与乙酸、浓硫酸共热时,断裂①
C.在Cu的催化作用下与O2反应,只断裂②
D.与浓硫酸共热到170℃时,断裂②⑤
C—C—O—H
H
H
H
H
H
⑤
④
②
③
①
A
C
乙醇
结构
分子式
结构式
官能团
性质
物理性质
化学性质
易挥发、无色有特殊香味的液体
与活泼金属反应
氧化反应
C2H6O
-OH羟基
第3章 简单的有机化合物
第3节 饮食中的有机化合物 课时1
早在几千年前,人类就掌握了发酵法酿酒的技术。各种酒类都含有浓度不等的乙醇。故乙醇俗称酒精。
1.了解乙醇的结构和物理性质。
2.掌握乙醇的主要化学性质及相应性质实验的现象,能书写相关的反应式。
一、乙醇的物理性质与结构
①病人发烧通常用酒精擦拭全身,用此法降温。
②衣服上沾上少许汽油用酒精可以去除。
③酒香不怕巷子深
④白酒的主要成分是乙醇和水
⑤酒精灯用完后为什么要盖上灯帽
⑥用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
观察乙醇并联系生活归纳乙醇的物理性质
1.乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
无色
特殊香味
液体
比水小
与水以任意比互溶,能溶解多种有机物和无机物
酒精
78.5℃易挥发
【思考】如何由工业酒精制备无水乙醇 怎样检验无水乙醇中有水
用工业酒精与新制生石灰后蒸馏,可得无水酒精。
取少量酒精,加入无水硫酸铜,若出现蓝色,则证明酒精含水。
2.乙醇的结构
乙醇的分子式为C2H6O,请根据其分子式,结合C、H和O原子的成键原则,推测乙醇的结构式。
A:
B:
根据工业上利用乙烯与水加成制乙醇,推测出乙醇的结构式为A
CH2=CH2 + H—OH
催化剂
△,加压
CH3CH2—OH(乙醇)
羟基(-OH)
C—C—O—H
H
H
H
H
H
CH3CH2OH或C2H5OH
C2H6O
(2)结构式:
(1)分子式:
(3)结构简式:
比一比:乙烷与乙醇的结构式,体会结构的异同。
-OH
球棍模型
空间充填模型
【思考】写出氢氧根的化学式和电子式,与羟基有什么区别?
氢氧根OH- 羟基-OH
电子式
带电性
稳定性
存在
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
羟基是乙醇的官能团,决定了乙醇的化学特性,那么乙醇具有哪些化学特性呢?
二、乙醇的化学性质
活动·探究
探究乙醇的化学性质
【探究实验 1】向烧杯中加入约 2 mL 无水乙醇,点燃,观察现象并得出结论。
现象:
产生淡蓝色火焰,放出大量热。
结论:
乙醇易和空气中氧气发生氧化反应。
视频1
2CO2 +3H2O
C2H5OH + 3O2
点燃
【探究实验 2】
向试管中加入约 2 mL 无水乙醇,取一根光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
视频2
现象:
铜丝在空气中加热由红变黑,插入乙醇溶液中,溶液沸腾,铜丝表面有黑变红,试管中的液体有刺激性气味。
红
黑
红
Cu
CuO
Cu
反应整个过程铜的作用是什么?
结论:
铜做催化剂,乙醇可以被氧化为有刺激性气味的液体。
铜丝红
Δ
变黑
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
分析:①发生反应 2Cu+O2==2CuO
分析:②生成新的物质——乙醛 CuO+CH3CH2OH Cu +CH3CHO+H2O
中间产物
现象及原因探究
总反应:2C2H5OH + O2
Cu
2CH3CHO + 2 H2O
①
②
①
②
Cu作催化剂
有刺激性气味
Cu
Cu
反应历程
【探究实验 3】
试管中加入约 2 mL 酸性 KMnO 4 溶液,滴入数滴无水乙醇,振荡,观察现象。
视频3
现象:
紫色酸性高锰酸钾溶液褪色
结论:
乙醇能被酸性高锰酸钾强氧化剂氧化
CH3COOH
CH3CH2OH
酸性高锰酸钾溶液
世界卫生组织的事故调查显示,大约 50%~60% 交通事故与酒后驾车有关。
你知道吗
如何检查司机是否酒后驾车?
K2Cr2O7
CH3CH2OH
Cr2(SO4 )3
【探究实验 4】
向试管中加入约 2 mL 无水乙醇,再放入一小块金属钠,观察现象,检验生成的气体。
思考:如预测产生的气体可能是什么气体 如何检验?
物质 金属钠的变化 气体燃烧现象 检验产物
乙醇
观看实验,并完成下表
钠沉在液面下,不熔化,反应缓慢
产生淡蓝色火焰
烧杯壁上出现液滴,石灰水不浑浊
钠的密度比乙醇的大
有氢气生成
反应方程式:
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
结论:
乙醇能和活泼金属反应,生成氢气
视频4
联想钠和水反应的现象,对比乙醇和钠反应的现象,分析二者有何异同,从中你能得出什么结论?
与水反应 与乙醇反应
反应方程式
反应实质
现 象 声现象
钠变化
结 论 羟基氢的活泼性
密度大小
2Na+2H2O==2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
水中氢原子被置换
有“嘶嘶”声响
浮、熔、游、响
ρ(Na)<ρ(H2O)
羟基氢原子被置换
无声响
沉于底部、不熔化
ρ(Na)>ρ(CH3CH2OH)
H2O>CH3CH2OH
1.乙醇氧化反应
①燃烧
②催化氧化
③被强氧化剂(酸性高锰酸钾溶液)氧化
2.乙醇和钠反应
2CH3CH2OH+O2 2CH3CHO+2H2O
C2H5OH+O2 2CO2+3H2O
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
二、乙醇的化学性质
三、乙醇的用途
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
你知道生活中所说酒的度数是什么含义吗?你知道常见酒的度数是多少吗?饮酒对人体有何利弊?说说你知道的过度饮酒所带来的危害有那些?
常见酒的度数
酒的度数:
乙醇的体积分数
乙醇在人体内的代谢过程
酒精(乙醇)
乙醛
乙酸
CO2+H2O
乙醇脱氢酶
乙醇脱氢酶
未成年人不应饮酒
[练一练]
1.关于乙醇结构与性质方面的说法中正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇、水分别与钠,乙醇的反应比水更平缓
D
C
2.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制酒精饮料
C.1 mol乙醇与足量的Na作用得到0.5 mol H2
D.乙醇与钠反应的产物为C2H5ONa
3.下列化合物结构中有两种官能团的是( )
A.CH2=CHCl B.CH3CH2OH
C.CH3COOH D.
4.乙醇分子中的各种化学键如图所示,对乙醇在各种反应中断键的说明不正确的是( )
A.与金属钠反应时,断裂①
B.与乙酸、浓硫酸共热时,断裂①
C.在Cu的催化作用下与O2反应,只断裂②
D.与浓硫酸共热到170℃时,断裂②⑤
C—C—O—H
H
H
H
H
H
⑤
④
②
③
①
A
C
乙醇
结构
分子式
结构式
官能团
性质
物理性质
化学性质
易挥发、无色有特殊香味的液体
与活泼金属反应
氧化反应
C2H6O
-OH羟基
