1.3.3 预测硅及其化合物的性质 课件 (共23张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 1.3.3 预测硅及其化合物的性质 课件 (共23张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 19:44:50 | ||
图片预览







文档简介
(共23张PPT)
第1章 原子结构 元素周期律
第3节 元素周期表的应用 课时3
1.掌握硅元素及其化合物的性质。
2.了解元素周期表与元素周期律的应用,建立“位—构—性”关系应用的思维模型。
从山川大河到珠宝玉器,
从世界上第一台计算机到笔记本再到智能手机,
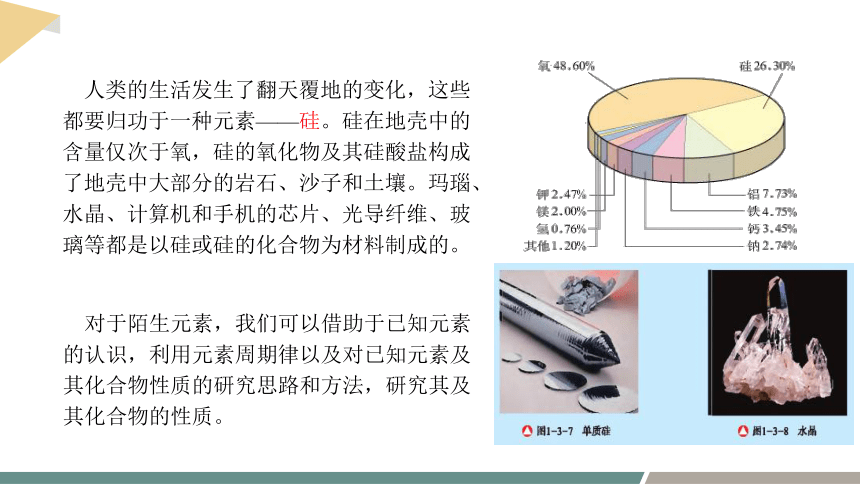
人类的生活发生了翻天覆地的变化,这些都要归功于一种元素——硅。硅在地壳中的含量仅次于氧,硅的氧化物及其硅酸盐构成了地壳中大部分的岩石、沙子和土壤。玛瑙、水晶、计算机和手机的芯片、光导纤维、玻璃等都是以硅或硅的化合物为材料制成的。
对于陌生元素,我们可以借助于已知元素的认识,利用元素周期律以及对已知元素及其化合物性质的研究思路和方法,研究其及其化合物的性质。
一、预测硅及其化合物的性质
交流·研讨
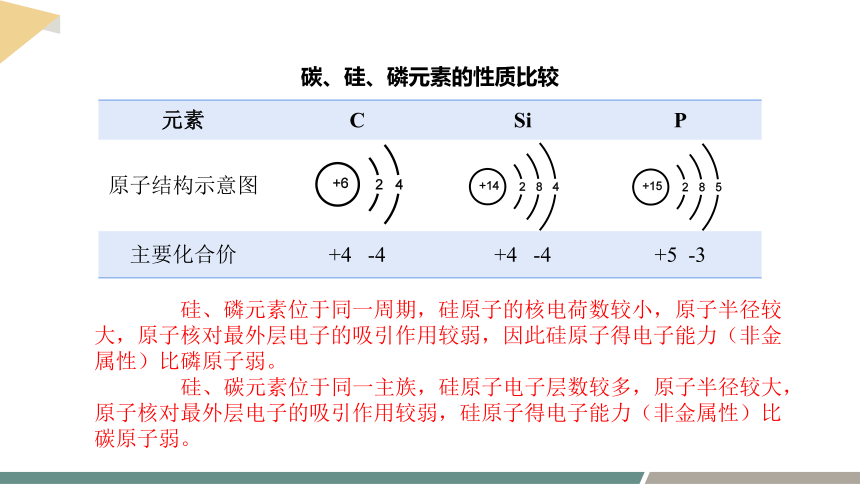
1.比较碳、硅、磷元素的性质。
2.硅及其化合物有哪些?尝试写出他们的化学式。
3.请预测硅及其化合物的化学性质,并说明预测依据。
硅及其化合物的化学式 化学性质预测 预测依据
元素 C Si P
原子结构示意图
主要化合价 +4 -4 +4 -4 +5 -3
碳、硅、磷元素的性质比较
硅、磷元素位于同一周期,硅原子的核电荷数较小,原子半径较大,原子核对最外层电子的吸引作用较弱,因此硅原子得电子能力(非金属性)比磷原子弱。
硅、碳元素位于同一主族,硅原子电子层数较多,原子半径较大,原子核对最外层电子的吸引作用较弱,硅原子得电子能力(非金属性)比碳原子弱。
硅及其化合物的化学式 化学性质预测 预测依据
Si
SiO2
H2SiO3
Na2SiO3
硅及其化合物的化学性质预测及依据
化学性质不活泼,但是在一定条件下能与氧气等发生化学反应,由于其性质的特殊性,可能还具有独特的性质
具有酸性氧化物的通性,能与碱、碱性氧化物等发生反应,可能也具有一定的特性
具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸
与碳同主族,与碳单质具有相似的化学性质
与碳同主族,与二氧化碳具有相似的化学性质
与碳同主族,与磷同周期,非金属性弱于碳和磷
白色固体,易溶于水,与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸
属于弱酸的正盐,可与强酸反应生成硅酸
二、硅及其化合物与非金属材料
1.硅与半导体材料
硅是常温下化学性质稳定的半导体材料。
工业制硅
SiO2 +2C ==== Si(粗硅)+ 2CO↑
高温
Si(粗硅)+2Cl2 ==== SiCl4
高温
SiCl4+2H2 ==== Si(高纯硅)+4HCl
SiO2
粗硅
CO
高温
SiCl4
①焦炭
②Cl2
高温
H2
HCl
纯硅
高温
③
2.二氧化硅与光导纤维
二氧化硅广泛存在于自然界中,沙子、石英和水晶的成分都是二氧化硅。
二氧化硅制成的光导纤维克服了声音信号和图像信号在铜丝或铝丝中传播损耗大的缺点,节约了大量金属资源。此外还可以应用于能量传输、信息处理,遥测遥控和医疗器械。
①与烧碱溶液反应
SiO2+2NaOH == Na2SiO3+H2O
SiO2+CaO ==== CaSiO3
高温
二氧化硅化学性质——酸性氧化物
②与氧化钙反应
唯一不溶于水、也不与水反应的酸性氧化物
③弱氧化性
SiO2+2C ==== Si+2CO↑
高温
④特性(与氢氟酸反应,用于雕刻玻璃)
SiO2 + 4HF == SiF4↑+ 2H2O
3.硅酸盐与无机非金属材料
材料
有机高分子材料
金属材料
无机非金属材料
传统无机非
金属材料
新型无机非
金属材料
玻璃
水泥
陶瓷
高温结构陶瓷
生物陶瓷
2HCl + Na2SiO3 == H2SiO3↓+ 2NaCl
硅酸可以由较强酸(碳酸、盐酸、硫酸等)和可溶性硅酸盐反应制硅酸的制备:
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
2H2SO4 + Na2SiO3 == H2SiO3↓+ Na2SO4
三、元素周期表的应用
1930年美国化学家托马斯·米奇利成功
地获得了一种新型的致冷剂——CCl2F2(即
氟里昂,简称F12)。这完全得益于元素周期
表的指导。在1930年前,一些气体如氨,二
氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。
在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。
米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。
在金属和非金属分界线处,寻找半导体材料。
寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等
寻找用于制农药的材料(非金属F、Cl、S、P等)
练一练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)自然界中硅元素都存在于石英中。 ( )
(2)晶体硅的结构和金刚石类似,熔点高。 ( )
(3)硅是制造太阳能电池的常用材料。 ( )
(4)石英、水晶、沙子的主要成分都是二氧化硅。 ( )
(5)SiO2是一种空间立体网状结构的晶体,熔点高、硬度大。 ( )
(6)SiO2是制作半导体的材料,Si是制作光纤的材料。 ( )
(7)氢氟酸不能存放在玻璃瓶中,要用塑料瓶存放。 ( )
(8)SiO2既能和NaOH反应,又能和HF反应,所以二氧化硅属于两性氧化物。 ( )
(9)水玻璃可用作木材防火剂。 ( )
(10)Na2SiO3的水溶液俗称水玻璃,往其中通入CO2有沉淀产生。 ( )
(11)水泥、玻璃、陶瓷都是传统无机非金属材料。 ( )
×
√
√
√
√
×
×
√
√
√
√
2.下列关于硅和二氧化硅的说法不正确的是( )。
A.晶体硅呈灰黑色,是具有金属光泽、硬而脆的固体
B.硅的化学性质很稳定,但自然界里无游离态的硅存在,常温下可与其他物质发生反应
C.硅和二氧化硅都能与NaOH溶液反应
D.工业上用焦炭在高温条件下还原二氧化硅来制备硅,说明通常情况下还原性C>Si
D
3.下列关于硅酸的说法正确的是( )。
A.硅酸可以通过SiO2和水的化合反应直接制得
B.可用反应Na2SiO3+2HCl 2NaCl+H2SiO3↓制取硅酸
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.干燥剂“硅胶”的主要化学成分是硅酸
B
4.元素周期表中某区域的一些元素通常用来制造农药,它们是( )
A.左下方区域的金属元素
B.金属元素和非金属元素分界线附近的元素
C.右上方区域的非金属元素
D.稀有气体元素
C
5. W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法正确的是( )
A.原子半径:X>Y>W>Z
B.W和X组成的化合物一定是碱性氧化物
C.Z对应的气态氢化物中所有原子均达到8电子稳定结构
D.向氢元素与W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
D
预测元素及其化合物的性质
硅及其化合物
元素周期表的应用
硅及其化合性质
硅及其化合物的应用
发现新元素、预测元素性质
寻找半导体材料
寻找制造新品种农药元素
寻找催化剂元素
寻找耐高温、耐腐蚀的合金元素
第1章 原子结构 元素周期律
第3节 元素周期表的应用 课时3
1.掌握硅元素及其化合物的性质。
2.了解元素周期表与元素周期律的应用,建立“位—构—性”关系应用的思维模型。
从山川大河到珠宝玉器,
从世界上第一台计算机到笔记本再到智能手机,
人类的生活发生了翻天覆地的变化,这些都要归功于一种元素——硅。硅在地壳中的含量仅次于氧,硅的氧化物及其硅酸盐构成了地壳中大部分的岩石、沙子和土壤。玛瑙、水晶、计算机和手机的芯片、光导纤维、玻璃等都是以硅或硅的化合物为材料制成的。
对于陌生元素,我们可以借助于已知元素的认识,利用元素周期律以及对已知元素及其化合物性质的研究思路和方法,研究其及其化合物的性质。
一、预测硅及其化合物的性质
交流·研讨
1.比较碳、硅、磷元素的性质。
2.硅及其化合物有哪些?尝试写出他们的化学式。
3.请预测硅及其化合物的化学性质,并说明预测依据。
硅及其化合物的化学式 化学性质预测 预测依据
元素 C Si P
原子结构示意图
主要化合价 +4 -4 +4 -4 +5 -3
碳、硅、磷元素的性质比较
硅、磷元素位于同一周期,硅原子的核电荷数较小,原子半径较大,原子核对最外层电子的吸引作用较弱,因此硅原子得电子能力(非金属性)比磷原子弱。
硅、碳元素位于同一主族,硅原子电子层数较多,原子半径较大,原子核对最外层电子的吸引作用较弱,硅原子得电子能力(非金属性)比碳原子弱。
硅及其化合物的化学式 化学性质预测 预测依据
Si
SiO2
H2SiO3
Na2SiO3
硅及其化合物的化学性质预测及依据
化学性质不活泼,但是在一定条件下能与氧气等发生化学反应,由于其性质的特殊性,可能还具有独特的性质
具有酸性氧化物的通性,能与碱、碱性氧化物等发生反应,可能也具有一定的特性
具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸
与碳同主族,与碳单质具有相似的化学性质
与碳同主族,与二氧化碳具有相似的化学性质
与碳同主族,与磷同周期,非金属性弱于碳和磷
白色固体,易溶于水,与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸
属于弱酸的正盐,可与强酸反应生成硅酸
二、硅及其化合物与非金属材料
1.硅与半导体材料
硅是常温下化学性质稳定的半导体材料。
工业制硅
SiO2 +2C ==== Si(粗硅)+ 2CO↑
高温
Si(粗硅)+2Cl2 ==== SiCl4
高温
SiCl4+2H2 ==== Si(高纯硅)+4HCl
SiO2
粗硅
CO
高温
SiCl4
①焦炭
②Cl2
高温
H2
HCl
纯硅
高温
③
2.二氧化硅与光导纤维
二氧化硅广泛存在于自然界中,沙子、石英和水晶的成分都是二氧化硅。
二氧化硅制成的光导纤维克服了声音信号和图像信号在铜丝或铝丝中传播损耗大的缺点,节约了大量金属资源。此外还可以应用于能量传输、信息处理,遥测遥控和医疗器械。
①与烧碱溶液反应
SiO2+2NaOH == Na2SiO3+H2O
SiO2+CaO ==== CaSiO3
高温
二氧化硅化学性质——酸性氧化物
②与氧化钙反应
唯一不溶于水、也不与水反应的酸性氧化物
③弱氧化性
SiO2+2C ==== Si+2CO↑
高温
④特性(与氢氟酸反应,用于雕刻玻璃)
SiO2 + 4HF == SiF4↑+ 2H2O
3.硅酸盐与无机非金属材料
材料
有机高分子材料
金属材料
无机非金属材料
传统无机非
金属材料
新型无机非
金属材料
玻璃
水泥
陶瓷
高温结构陶瓷
生物陶瓷
2HCl + Na2SiO3 == H2SiO3↓+ 2NaCl
硅酸可以由较强酸(碳酸、盐酸、硫酸等)和可溶性硅酸盐反应制硅酸的制备:
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
2H2SO4 + Na2SiO3 == H2SiO3↓+ Na2SO4
三、元素周期表的应用
1930年美国化学家托马斯·米奇利成功
地获得了一种新型的致冷剂——CCl2F2(即
氟里昂,简称F12)。这完全得益于元素周期
表的指导。在1930年前,一些气体如氨,二
氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。
在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。
米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。
在金属和非金属分界线处,寻找半导体材料。
寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等
寻找用于制农药的材料(非金属F、Cl、S、P等)
练一练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)自然界中硅元素都存在于石英中。 ( )
(2)晶体硅的结构和金刚石类似,熔点高。 ( )
(3)硅是制造太阳能电池的常用材料。 ( )
(4)石英、水晶、沙子的主要成分都是二氧化硅。 ( )
(5)SiO2是一种空间立体网状结构的晶体,熔点高、硬度大。 ( )
(6)SiO2是制作半导体的材料,Si是制作光纤的材料。 ( )
(7)氢氟酸不能存放在玻璃瓶中,要用塑料瓶存放。 ( )
(8)SiO2既能和NaOH反应,又能和HF反应,所以二氧化硅属于两性氧化物。 ( )
(9)水玻璃可用作木材防火剂。 ( )
(10)Na2SiO3的水溶液俗称水玻璃,往其中通入CO2有沉淀产生。 ( )
(11)水泥、玻璃、陶瓷都是传统无机非金属材料。 ( )
×
√
√
√
√
×
×
√
√
√
√
2.下列关于硅和二氧化硅的说法不正确的是( )。
A.晶体硅呈灰黑色,是具有金属光泽、硬而脆的固体
B.硅的化学性质很稳定,但自然界里无游离态的硅存在,常温下可与其他物质发生反应
C.硅和二氧化硅都能与NaOH溶液反应
D.工业上用焦炭在高温条件下还原二氧化硅来制备硅,说明通常情况下还原性C>Si
D
3.下列关于硅酸的说法正确的是( )。
A.硅酸可以通过SiO2和水的化合反应直接制得
B.可用反应Na2SiO3+2HCl 2NaCl+H2SiO3↓制取硅酸
C.因为硅酸难溶于水,所以它不能与NaOH溶液反应
D.干燥剂“硅胶”的主要化学成分是硅酸
B
4.元素周期表中某区域的一些元素通常用来制造农药,它们是( )
A.左下方区域的金属元素
B.金属元素和非金属元素分界线附近的元素
C.右上方区域的非金属元素
D.稀有气体元素
C
5. W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法正确的是( )
A.原子半径:X>Y>W>Z
B.W和X组成的化合物一定是碱性氧化物
C.Z对应的气态氢化物中所有原子均达到8电子稳定结构
D.向氢元素与W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
D
预测元素及其化合物的性质
硅及其化合物
元素周期表的应用
硅及其化合性质
硅及其化合物的应用
发现新元素、预测元素性质
寻找半导体材料
寻找制造新品种农药元素
寻找催化剂元素
寻找耐高温、耐腐蚀的合金元素
